氯氟醚菌唑在香蕉和芒果果实中的残留分布
王思威, 王潇楠, 常 虹, 刘艳萍
(广东省农业科学院 植物保护研究所,农业农村部华南果蔬绿色防控重点实验室,广东省植物保护新技术重点实验室,广州 510640)
香蕉和芒果是重要的热带亚热带经济作物,但香蕉叶斑病和芒果炭疽病发生严重,是影响香蕉和芒果产量和质量的重要病害,实际生产上多用三唑类杀菌剂进行防治,传统的三唑类杀菌剂因为抗性问题导致防治效果显著下降。氯氟醚菌唑 (结构式见图式1) 是巴斯夫公司开发的第一个新型异丙醇三唑类杀菌剂,与现有三唑类菌剂相比,其作用机制独特,具有保护、治疗、铲除作用,以及良好的环境相容性,不会对哺乳动物造成致畸性、神经毒性、生殖毒性、致癌性或内分泌干扰等影响,属于低风险的三唑类杀菌剂。先后获得欧盟、美国、澳洲等绿色、安全等级认证,适用于大田作物、经济作物等 60 余种作物[1-3]。

图式 1 氯氟醚菌唑结构式Scheme 1 The structural formula of mefentrifluconazole
农药残留联席会议 (JMPR) 规定其残留物为氯氟醚菌唑,每日允许摄入量 (ADI) 为0.04 mg/(kg bw),急性参考剂量 (ARfD) 为0.3 mg/(kg bw)。国际食品法典委员会(CAC)制定氯氟醚菌唑在香蕉、芒果上的最大残留限量 (MRL) 分别为1.5 和0.6 mg/kg[4]。欧盟的评估结果为:氯氟醚菌唑的ADI为 0.035 mg/(kg bw),ARfD 为0.15 mg/(kg bw),制定其在香蕉、芒果上的MRL 值均为0.01 mg/kg[5]。目前氯氟醚菌唑在我国登记作物有苹果、柑橘、芒果、香蕉、马铃薯、黄瓜和葡萄等[6],但尚未制定氯氟醚菌唑在我国作物上的MRL 值[7]。
目前,关于氯氟醚菌唑残留的研究相关报道较少,Zhang 等[8]开展了氯氟醚菌唑在稻米中的残留消解动态和最终残留量研究,并开展了急性和慢性风险评估;Liu 等[9]阐明了S-氯氟醚菌唑和R-氯氟醚菌唑在西瓜中的选择性降解、最终残留量和储藏稳定性,并应用概率模型进行了膳食风险评估;李艳红[10]进行了斑马鱼对氯氟醚菌唑对映体选择性毒性效应研究;Zhang[11]采用超高效液相色谱-质谱联用仪,多壁碳纳米管净化,对6 种植物源样品和5 种动物源样品中的氯氟醚菌唑残留进行了检测方法研究,并用该方法测定了田间黄瓜和番茄样品;另有利用高效液相色谱分析氯氟醚菌唑制剂的报道[12]。目前尚未见采用超高效液相色谱-串联质谱法 (UPLC-MS/MS) 研究香蕉、芒果果实中氯氟醚菌唑残留的报道。鉴于此,本研究拟建立氯氟醚菌唑在香蕉、芒果果实中残留量的UPLC-MS/MS 检测方法,并开展400 g/L 氯氟醚菌唑悬浮剂在香蕉、芒果中的消解动态、残留分布特征研究,旨在为该药在香蕉、芒果上的科学合理使用以及制定其MRL 值提供科学依据。
1 材料与方法
1.1 药剂及主要仪器
98.7%氯氟醚菌唑 (mefentrifluconazole) 标准品,Chem Service 公司;400 g/L 氯氟醚菌唑悬浮剂 (mefentrifluconazole 400 g/L SC),巴斯夫 (中国)有限公司;乙腈、甲醇 (色谱纯,美国 Thermo Fisher Scientific 公司);氯化钠 (分析纯,上海阿拉丁试剂有限公司);纯净水 (杭州娃哈哈集团有限公司);N-丙基乙二胺吸附剂 (PSA,Agela Technology)、十八烷基键合硅胶吸附剂 (C18,Agela Technology);石墨化碳黑 (GCB,CNW Technology)。
LCMS-8045 超高效液相色谱-串联三重四极杆质谱仪 (日本岛津企业管理 (中国) 有限公司);GTR22-1 离心机 (北京时代北利离心机有限公司);XW-80A 涡旋仪 (上海精科有限公司);ULTRATURRAXT 25 匀浆机 (德国IKA 公司);HY-5 回旋式振荡器 (天津市津腾实验设备有限公司);FA2004分析天平、TXB622L 电子天平 (日本岛津公司)。
1.2 试验方法
1.2.1 田间试验 按照NY/T 788—2018《农作物中农药残留试验准则》[13]于2018 年8—12 月分别在广东广州及茂名、广西南宁、云南红河、海南澄迈和福建漳州6 地开展了400 g/L 氯氟醚菌唑悬浮剂在香蕉上的残留试验;在广东肇庆及茂名、广西南宁、云南玉溪、海南三亚和福建漳州6 地开展了在芒果上的残留试验。其中残留消解试验在最终残留试验小区中开展,且不少于一半的点数开展消解试验。每处理小区为4 棵树,均重复1 次。另设对照小区。田间试验设计详见表1。施药方式为电动喷雾器喷雾施药。
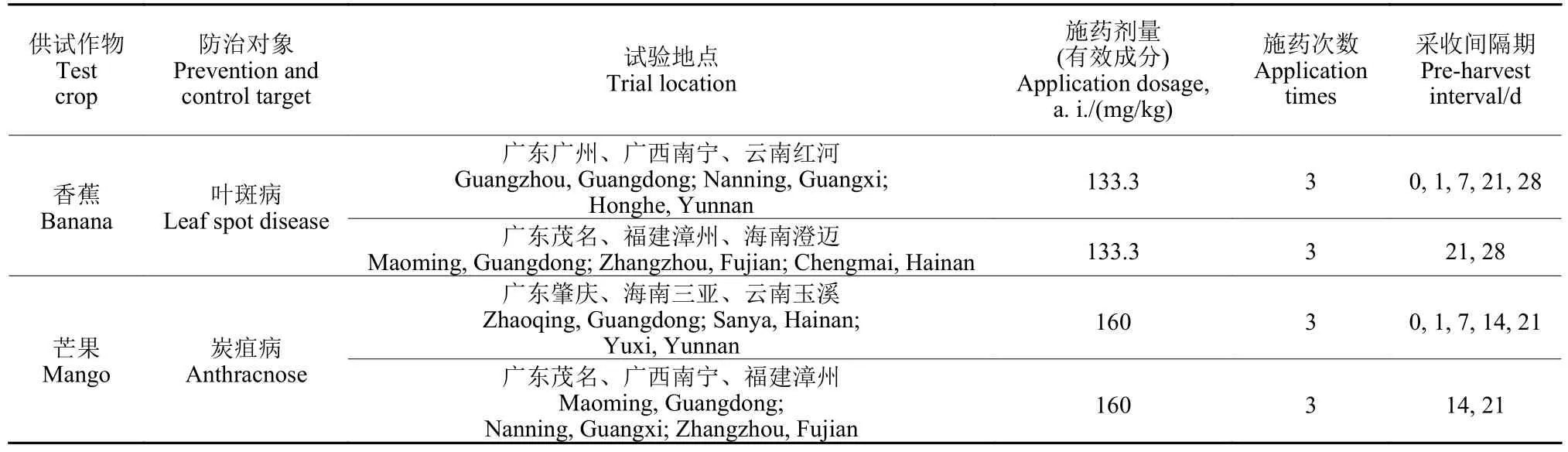
表1 田间残留试验设计Table 1 Design of field trials for residue test
1.2.2 样品采集与运输 根据田间试验的采样时间要求,随机在试验小区从4 株树的不同方向及不同部位采集生长正常、无病害的个体,不少于12 个果实 (至少2 kg),处理小区分别采集2 个独立样品。采集后8 h 立即制备成实验室样品,于-20 ℃保存,备用。
1.2.3 样品制备 香蕉检测全果、果肉样品;芒果检测去除果核后的整个果实和果肉,但全果的残留量计算包括果核。
香蕉全果样品:将香蕉果实表面上附着的杂质与尾丝用干毛刷除去,剪去果柄。取1/2 计个数和称量后,切碎,混匀,四分法缩分,分取150 g样品两份,于 -20 ℃贮存,待分析。
香蕉果肉样品:取田间香蕉残留样本的另1/2 计个数和称量后,剥去香蕉皮,取出果肉,切碎,混匀,四分法缩分,分取150 g 样品两份,于-20 ℃贮存,待分析。
芒果全果样品:将芒果果实表面上附着的杂质用干毛刷除去,剪去果柄。1/2 计个数和称量后,取出果核,并称重后,切碎,混匀,四分法缩分,分取150 g 样品两份,于 -20 ℃贮存,待分析。
芒果果肉样品:取田间香蕉残留样本的另1/2 计个数和称量后,剥去芒果皮,取出果肉,切碎,混匀,四分法缩分,分取150 g 样品两份,于-20 ℃贮存,待分析。
1.3 分析方法
1.3.1 样品前处理 称取切碎样品10 g (精确至0.1 g) 于100 mL 离心管中,加入20.0 mL 乙腈进行提取,剧烈振荡10 min,静置30 min;加入1.0 g氯化钠和4.0 g 无水硫酸镁,涡旋1 min,于3000 r/min 下离心5 min;取1.5 mL 上清液,置于加有50 mg C18和10 mg GCB 的2 mL 离心管中,涡旋1 min,于10000 r/min 下离心5 min;取上清液,过0.22 µm 滤膜,待UPLC-MS/MS 测定。
1.3.2 液相色谱-质谱检测条件 色谱条件:Shimpack GIST-HP C18色谱柱(2.1 mm × 100 mm,3 µm);柱箱温度45 ℃;流动相为V(乙腈) :V(水) = 80 : 20;流速0.4 mL/ min;进样量1 µL。
质谱条件:电喷雾离子源正离子扫描模式(ESI+);雾化气流量2 L/min;加热气流量10 L/min;接口温度350 ℃;DL 温度100 ℃;加热块温度400 ℃;干燥气流量10 L/min;其他质谱参数见表2。在此条件下,氯氟醚菌唑的保留时间为1.02 min。

表2 氯氟醚菌唑质谱测定参数Table 2 MS parameters for the detection of mefentrifuconazole
1.3.3 标准溶液配制及标准曲线绘制 准确称取10 mg(精确至0.1 mg)氯氟醚菌唑标准品,用甲醇溶解并定容于10 mL 容量瓶中,配成质量浓度为1000 mg/L 标准母液,再用乙腈逐级稀释,配制成质量浓度为0.5、0.1、0.05、0.01 和0.005 mg/L 的标准工作溶液,按1.3.2 节条件测定,外标法定量,以进样质量浓度(x) 为横坐标,相应的峰面积(y)为纵坐标,绘制标准曲线。
分别用芒果全果、芒果果肉、香蕉全果、香蕉果肉空白基质对照液逐级稀释上述氯氟醚菌唑标准母液,配制成0.005、0.01、0.05、0.1、0.5、1 mg/L 的系列基质匹配标准溶液。按1.3.2 节的条件测定,以氯氟醚菌唑的溶剂标准溶液和基质标准溶液质量浓度与检测离子峰面积作标准曲线。
1.3.4 添加回收试验 准确称取空白香蕉全果、果肉样品及芒果全果、果肉样品,分别进行0.001、0.01、0.1 和1.0 mg/kg 4 个水平氯氟醚菌唑的添加回收试验,重复5 次。按1.3.1 节和1.3.2 节方法及条件进行提取、净化和测定,计算平均回收率和相对标准偏差(RSD)。
2 结果与分析
2.1 前处理条件的优化
2.1.1 提取溶剂的选择 分别考察了乙腈、甲醇为提取溶剂对氯氟醚菌唑在香蕉和芒果中回收率的影响。结果 (图1) 表明:以乙腈为提取溶剂时回收率为87%~96%,而以甲醇为提取溶剂时回收率低于70% (41%~67%)。按农药残留回收率要求[13],选择乙腈作为提取溶剂。
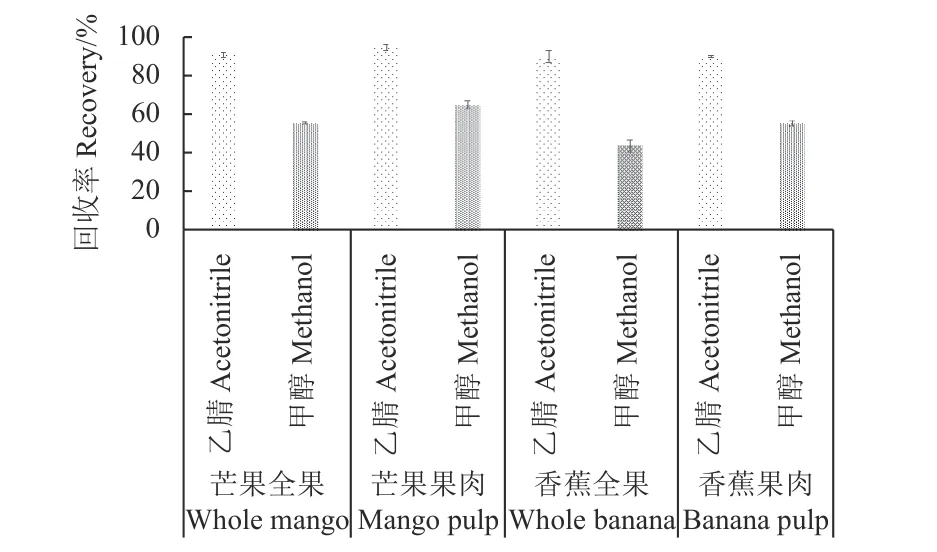
图1 提取溶剂对氯氟醚菌唑提取效率的影响 (n = 3)Fig.1 Effect on extraction efficiency of extraction solvents for mefentrifuconazole (n = 3)
2.1.2 固相吸附剂种类及用量的选择 分别比较了60 mg C18、60 mg GCB、50 mg C18+ 10 mg GCB、60 mg PSA 和50 mg PSA + 10 mg GCB 对芒果、香蕉基质中氯氟醚菌唑残留的净化效果(n= 5)。结果 (图2) 表明:60 mg GCB 净化后的样品中氯氟醚菌唑的回收率偏低 (64%~80%),其他4 种净化剂处理的样品中氯氟醚菌唑的回收率均达到残留试验要求[13],但60 mg C18和60 mg PSA 对样品色素的吸附效果较差,50 mg C18+ 10 mg GCB 处理样品的回收率又比50 mg PSA + 10mg GCB 的高,故最终选择50 mg C18+ 10 mg GCB作为样品前处理的净化剂。

图2 吸附剂对氯氟醚菌唑回收率的影响Fig.2 Effects of adsorbent combinations on the recoveries of mefentrifuconazole
2.2 色谱参数的选择
在流速为0.4 mL/min 条件下,分别考察了以乙腈-水、乙腈-1%甲酸水溶液、甲醇-水和甲醇-1%甲酸水溶液作为流动相体系时对氯氟醚菌唑的响应。结果 (图3) 表明:以乙腈-水作为流动相时,氯氟醚菌唑的峰型最好,且响应峰面积最大,故选择乙腈-水为氯氟醚菌唑的流动相。然后,又考察了乙腈-水的不同体积配比对氯氟醚菌唑的响应,结果表明:乙腈体积比例在65%~90%范围内,氯氟醚菌唑的响应随着乙腈体积比的增大而增大,综合考虑保留时间和经济环保因素,最终选择V(乙腈) :V(水) = 80 : 20。
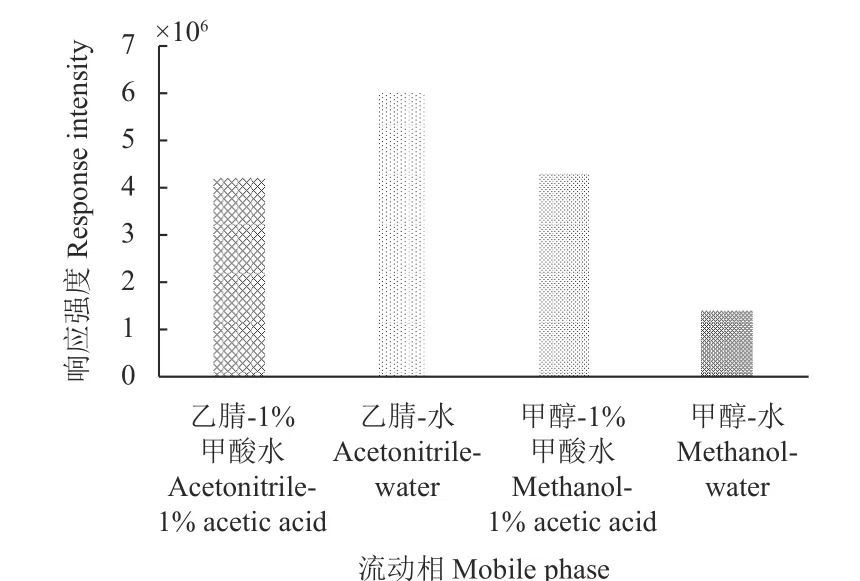
图3 流动相体系中氯氟醚菌唑的响应强度 (体积比7 : 3)Fig.3 Response intensity of mefentrifuconazole in mobile phase system (V/V=7 : 3)
2.3 方法的线性方程、定量限及基质效应
如表3 所示,氯氟醚菌唑的峰面积与质量浓度间呈良好的线性关系。基质效应在-0.07%~5.86%,大于 -20%且小于20%,故基质效应可忽略,用溶剂标准曲线进行校正[14]。氯氟醚菌唑在芒果和香蕉中的定量限 (LOQ) 均为0.001 mg/kg。
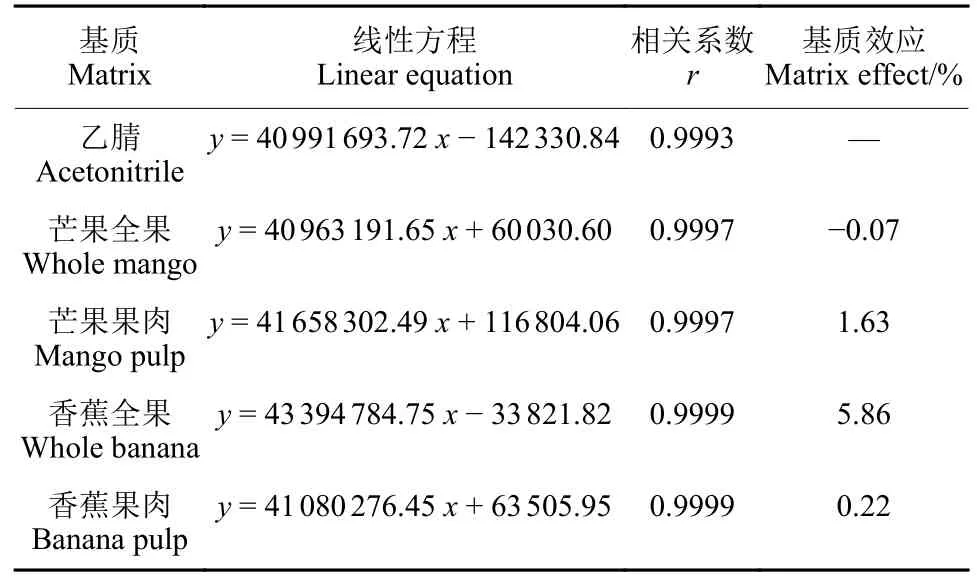
表3 氯氟醚菌唑线性方程及基质效应Table 3 Linear equation and matrix effects of mefentrifuconazole
2.4 方法的正确度和精密度
从表4 中可看出:在0.001~1 mg/kg 4 个添加水平下,氯氟醚菌唑在香蕉果肉中的平均回收率和RSD 分别为84%~93%和2.3%~4.4%,在香蕉全果中的平均回收率和RSD 分别为83%~92%和3.4%~5.9%,在芒果果肉中的平均回收率和RSD分别为82%~89%和2.9%~5.1%,在芒果全果中的中的平均回收率和RSD 分别为85%~91%和3.1%~6.0%。方法的正确度和精密度均符合农药残留分析[13]的要求。典型色谱图见图4。
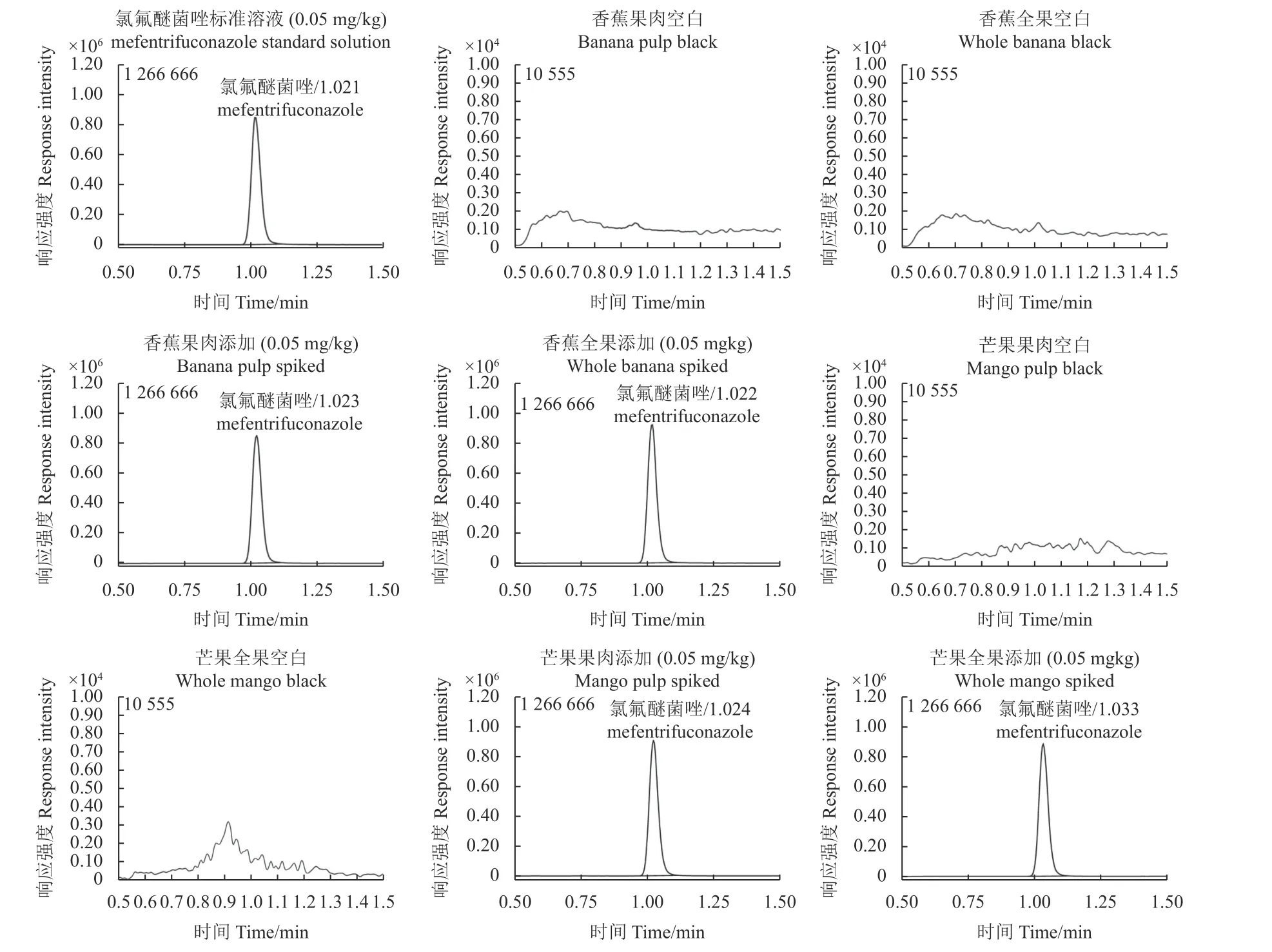
图4 氯氟醚菌唑在香蕉和芒果果实中的典型图谱Fig.4 Typical chromatograms of mefentrifuconazole spiked in banana and mango fruits

表4 氯氟醚菌唑在香蕉、芒果果实中的添加回收率及相对标准偏差(n = 5)Table 4 Average recovery, relative standard deviation of mefentrifuconazole in banana and mango fruits (n = 5)
2.5 氯氟醚菌唑在香蕉、芒果果实中的消解动态
400 g/L 氯氟醚菌唑SC 按有效成分133.3 mg/kg在香蕉施上喷雾施用3 次,在香蕉果实中的原始沉积量为0.19~0.51 mg/kg,施用7 d 后的消解速率为35.5%~74.5%;400 g/L 氯氟醚菌唑SC 按有效成分160 mg/kg 在芒果上喷雾施用3 次,在芒果果实中的原始沉积量为0.38~0.70 mg/kg,施用7 d 后的消解速率为35.9%~55.7%。
2.6 氯氟醚菌唑在香蕉、芒果果实中的最终残留
结果(表5)表明:400 g/L 氯氟醚菌唑SC 按有效成分133.3 mg/kg 在香蕉上喷雾施用3 次,距末次施药后21 和28 d,氯氟醚菌唑在香蕉全果中的残留量分别为0.05~0.09 mg/kg 和0.03~0.06 mg/kg,而在香蕉果肉中分别为0.001~0.004 mg/k 和 <0.001~0.002 mg/kg。400 g/L 氯氟醚菌唑SC 按有效成分160 mg/kg 在芒果上喷雾施用3 次,距末次施药后14 和21 d,氯氟醚菌唑在芒果全果中的残留量分别为0.12~0.28 mg/kg 和0.04~0.16 mg/kg,在芒果果肉中分别为0.001~0.003 mg/kg 和0.001~0.002 mg/kg。
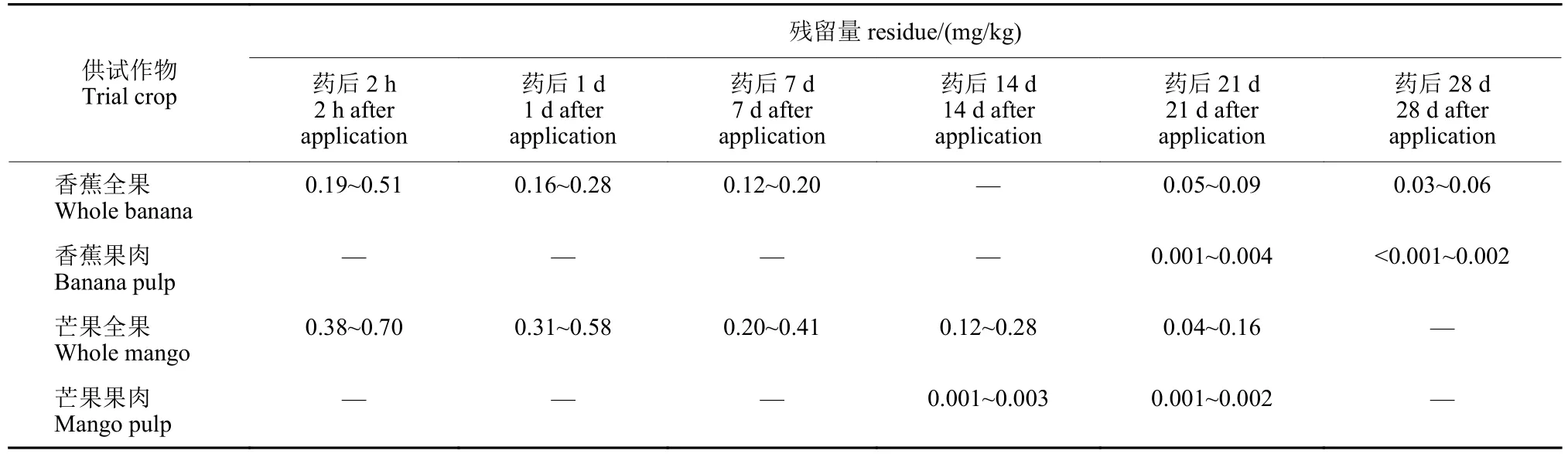
表5 氯氟醚菌唑在香蕉、芒果中的最终残留量Table 5 The terminal residues of mefentrifuconazole in banana and mango fruits
氯氟醚菌唑在香蕉、芒果中的残留量伴随施药时间的延长呈现明显下降趋势。香蕉果肉的质量占全果比例约为60%,芒果果肉质量占全果60%~80%,氯氟醚菌唑的辛醇-水分配系数(Kow)分为3.4,属于中等强度移动性的亲脂性农药[15],易于附着在含腊质的果皮上。以上因素决定了氯氟醚菌唑主要残存在香蕉和芒果果皮中。
3 结论与讨论
本研究对香蕉、芒果样品中氯氟醚菌唑的前处理条件和仪器分析条件进行了优化,建立了以乙腈为提取溶剂,以C18和GCB 为净化剂,采用UPLC-MS/MS 检测香蕉和芒果中氯氟醚菌唑的消解动态和残留的分析方法。结果表明,氯氟醚菌唑在香蕉和芒果中的残留量与作物种类、田间气候条件等因素相关;随施药间隔天数增加,残留量降低。氯氟醚菌唑在果肉中的残留量低于全果,这与氯氟醚菌唑的辛醇水分配系数、水溶性等因素相关。马晨等[16-17]研究芒果、香蕉果实中农药残留分布结果表明,农药在全果中的残留量高于在果肉中的,对于内吸性较强的农药,少部分样品中果肉中的残留量高于全果或只在果肉中有检出。
农药最大残留限量标准制定事关保障消费者身体健康、农产品质量安全、促进食品和农产品公平贸易,各个国家及组织均对其非常重视。JMPR依据来自厄瓜多尔良好农业规范 (Good Agricultural Practices,GAP),基础数据来自巴西、哥伦比亚和厄瓜多尔,按有效成分140 g/hm2,间隔14 d,施用5 次,一季总用量700 g/hm2,采收间隔期0 d,具体的残留试验数据为:全果0.04、0.12、0.16、0.24、0.35、0.47、0.54、0.57、0.65、0.74 mg/kg,果肉 < 0.01、0.01、0.04、0.05(2)、0.06、0.09、0.14、0.21(2) mg/kg,制定其在香蕉 (全果) 中的MRL 值为1.5 mg/kg[18]。JMPR 制定氯氟醚菌唑在芒果中的MRL 值时,其GAP 来自中国,按0.016 kg a.i/hL,间隔10 d,安全间隔期 (pre-harvest interval, PHI) 14 d,施用3 次,全果上残留数据为0.12、0.16 (2)、0.20、0.22、0.28 mg/kg[18],制定芒果上的MRL 值为0.6 mg/kg[18]。本研究中采用的GAP 及结果与之一致。
比较本试验数据与JMPR 制定香蕉MRL 值的数据,GAP 不同,存在较大差异,具体在用药量、次数、间隔期等方面均不同,与戊唑醇、丙环唑的研究结果一致[19]。导致我国部分农药在香蕉中的MRL 值与CAC 限量存在差异的另外一个原因,可能与喷雾器械、施用方式有关,例如JMPR 制定香蕉中吡唑醚菌酯MRL 值的GAP 来自中、南美州[20],喷液量为21~28 L/hm2,推测可能用飞防方式进行试验,而我国通常的喷液量为900 L/hm2,以背负式喷雾器、大体积喷淋为主。第3 个原因是国际上对于香蕉上MRL 值制定的适用部位不同:CXG41—1993《关于适用MRLs 并分析的商品部位指南》和CXA-4—1989《食品和饲料分类》,有基于果肉的,也有基于全果的,造成混乱。例如,吡唑醚菌酯在JMPR 报告中的测定部位是全蕉[20],丙环唑在报告[21]中的测定部位是果肉、果皮,然后按果皮占全果的30%折算得到全果的残留量,而腈苯唑在报告[22]中的测定部位是果肉、果皮、全果。
目前我国尚未制定氯氟醚菌唑在任何食品上的MRL 值,本研究明确了氯氟醚菌唑在香蕉和芒果上的消解动态和最终残留量水平,可为该农药在我国相关作物上登记使用提供基础评价数据。

