降解菌Pseudomonas sp.AT2 对莠去津胁迫下水稻生长的影响机制
马丽雅, 王 亚, 葛 静, 生弘杰, 冯发运,李 勇, 李 梅, 余向阳*,
(1.江苏省农业科学院 省部共建国家重点实验室培育基地——江苏省食品质量安全重点实验室,南京 210014;2.江苏省农业科学院 农产品质量安全与营养研究所,南京 210014)
莠去津 (atrazine,ATZ) 属于三嗪类芽前、芽后除草剂,在玉米、高粱、甘蔗等作物上广泛使用,主要防除多种一年生禾本科和阔叶杂草[1],具有防治效率高、成本低廉、杀草谱广等优点,在70 多个国家及地区应用广泛[2]。与此同时,由于莠去津迁移性较强且消解半衰期长,导致其在农田土壤、毗邻农田的地下水及地表水中频频被检出,在种植玉米后的土壤中莠去津的检出量可达0.9 mg/kg[3]。环境中残留的莠去津易被植物吸收,对后茬敏感作物 (水稻[3]、小麦[4]、甘薯[5]等) 造成药害,严重影响后茬作物的生长及安全生产。据报道,按照通常用量 (38%莠去津悬浮剂1.5 L/hm2)施用,莠去津对小麦的生长影响较大,可造成小麦旗叶干枯、籽粒偏小等现象[4];采用低浓度莠去津 (0.2~0.8 mg/L) 处理水稻幼苗后,水稻生长受到抑制,细胞膜通透性增强,叶绿素含量下降,同时莠去津可在水稻籽粒中积累[6]。另外,莠去津还能通过食物链 (如谷物等) 进入人体,对动物及人类的神经系统、生殖系统及内分泌系统具有潜在的威胁[7-8]。因此,降低生态环境及农作物中莠去津的残留,对农业生产及人类健康具有重要意义。
土壤中微生物无处不在,其对土壤物质循环和农药残留修复起着重要作用[9],但残留农药反过来也会影响土壤微生物的多样性[10-11]及功能基因的丰度[12]。同时,根际微生物也会影响植物对农药的降解代谢[13]。研究表明,根际微生物可以联合植物提高根际土壤中农药的降解效率,缓解残留农药对植物的毒害作用。Ahmad 等[14]发现,将根际降解菌群接种于双草醚 (2 和5 mg/L) 污染土壤,可以增强小麦对双草醚的降解作用,降解率可高达100%;Salam 等[15]发现,在种植前将甘蔗茎秆浸泡在含假丝酵母菌酵母CandidaVITJzN04(3 × 105CFU/mL) 的YEPD 培养基中,处理5 d 后种植在林丹 (100 mg/kg) 污染土壤中,可以显著增强甘蔗根际林丹的降解,使其降解半衰期从43.3 d减至7.1 d。近年来,关于莠去津降解菌的筛选及应用有较多报道[1,16-18],同时降解菌的降解基因也已明确,包括atzA~atzF,其中模式菌株Pseudomonassp.ADP 包含了所有降解基因,能将莠去津完全矿化[19]。然而,目前关于莠去津降解菌的研究主要集中于离体条件下菌株对莠去津的降解功能探究,以及菌株在修复莠去津污染土壤中的应用,但关于莠去津降解菌在“土壤-植物”系统的修复应用报道较少,菌株对植物耐受莠去津胁迫的影响机制也尚不清楚。
本研究采用盆栽试验模拟水稻的大田生长环境,研究了莠去津对水稻根际微生物菌群结构及降解基因丰度的影响,并从水稻根际土壤中分离纯化出一株莠去津降解菌Pseudomonassp.AT2,将其应用于莠去津污染土壤,探究了AT2 对“土壤-水稻”系统中莠去津降解的影响及机制,以期为保障水稻的安全生产提供一定的理论基础。
1 材料与方法
1.1 供试材料
1.1.1 药剂及试剂 98%莠去津 (atrazine) 原药购于先正达南通作物保护有限公司,称取0.02 g (精确到0.0001 g) 莠去津原药,用50 mL 乙腈完全溶解,配制成400 mg/L 的莠去津母液,于4 ℃保存,待用;乙腈为色谱纯。无机盐 (MSM) 培养基:MgSO4·7H2O 0.40 g,FeSO4·7H2O 0.20 g,K2HPO40.20 g,(NH4)2SO40.20 g,CaSO40.08 g,去离子水 1 L,pH 7.0~7.2,并于121 ℃灭菌20 min,备用。植物总RNA 提取试剂盒购于北京庄盟国际生物基因科技有限公司;反转录试剂盒、Green qPCR SuperMix 购于北京全式金生物技术股份有限公司;引物由通用生物 (安徽) 股份有限公司合成。
1.1.2 供试土壤 采自江苏省南京市农田 (0~20 cm),土壤类型为黄棕壤 (N 35.03°;E 118.87°),其基本理化性质为:pH 7.24,黏粒含量27%,有机质含量为24.61 g/kg,有机碳含量为7.44 g/kg。土样去除植物根系后过2 mm 不锈钢筛网,备用。
1.2 根际土壤微生物群落多样性分析
莠去津污染土壤的制备参照程金金等[20]的方法。取1 mL 400 mg/L 的莠去津母液,采用100 mL丙酮稀释后,均匀添加至500 g 供试土壤中并混合均匀,通风放置24 h 至丙酮挥发完全,获得土壤中莠去津终浓度为0.8 mg/kg 的污染土壤,该浓度在已报道的土壤中莠去津的残留浓度范围内[3]。均匀喷洒去离子水至田间最大持水量的60%,以不添加莠去津的土壤作为空白对照。将消毒后的水稻种子置于育苗盘中,当生长至三叶一心期时,选取5 株长势一致的水稻苗移栽至装有500 g 土壤的烧杯中,每个处理重复4 次。每个烧杯中添加30 mL 无菌水,每天补充水至初始水平,置于水稻温室中培养。培养条件:200 μmol/(m2·s),14 h光照/10 h 黑暗;昼/夜温度为30/25 ℃。培养6 d后,参照冯发运等[10]的方法收集每个烧杯中水稻的根际土壤,得到4 个平行的待测土壤样品。利用FastDNA® Spin Kit (MP Biomedical,Solon,OH,美国) 提取土壤DNA,并通过NanoDrop 2000超微量核酸测定仪和琼脂糖凝胶电泳法评估所提取DNA 的样品质量。以合格的土壤DNA 样品为模板,利用特异性引物338F (ACTCCTACGGGA GGCAGCAG) 和806R (GGACTACHVGGGT WTCTAAT) 对16S rRNA 基因的V3-V4 区进行扩增。采用AxyPrepDNA 凝胶回收试剂盒 (AXYGEN公司) 进行切胶回收,回收的产物送至上海美吉生物医药科技有限公司,基于Illumina Miseq 平台进行高通量测序,并通过云平台 (http://cloud.majorbio.com/) 进行数据分析。
1.3 根际土壤中莠去津降解基因丰度测定
根据已报道的莠去津降解基因引物[21],采用定量PCR 仪Bio-Rad CFX96 对土壤中莠去津降解基因进行扩增,测定其丰度。将降解基因的PCR产物连接至pEASY-T3 载体,并验证基因序列。选择序列正确的质粒以10 倍梯度稀释,测定不同浓度质粒的CT 值,并换算成拷贝数,建立莠去津降解基因质粒的标准曲线。将1.2 节中提取得到的不同土壤DNA 进行荧光定量PCR 扩增,并结合标准曲线计算各处理样品中莠去津降解基因的拷贝数。采用Green qPCR SuperMix 进行荧光定量PCR 扩增,反应体系为:10 μL 2 × Mix,0.4 μL上游引物,0.4 μL 下游引物,1 μL DNA 模板,8.2 μL 无菌水。反应程序为:94 ℃ 30 s,1 个循环;94 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s,40 个循环。
1.4 莠去津降解菌的筛选及鉴定
取1.2 节中制备的土壤样品5 g,置于LB 液体培养基中富集培养24 h 后,依次转移至含莠去津 (2、10 和 50 mg/L) 的MSM 液体培养基中梯度驯化3 次。取驯化培养后的菌液涂布于莠去津终浓度为10 mg/L 的MSM 固体培养基上,培养24 h后,挑取不同形态的菌落进行多代划线培养,得到纯化菌株[22]。将纯化后的单一菌株接种于含10 mg/L 莠去津并以其为唯一碳源的MSM 液体培养基中进行复筛,同时以不接菌的处理组为对照,30 ℃、180 r/min 振荡培养4 d 后,通过高效液相色谱仪测定莠去津含量并计算降解率。MSM 液体培养基中莠去津的提取与检测参考李阳阳等[1]的方法。提取其中具有降解功能菌株的DNA,用16S rRNA 基因通用引物进行PCR 扩增,并将扩增后的产物送至南京擎科生物科技有限公司测序,利用NCBI 比对测序结果并构建系统进化树,结合菌株的形态及生理生化特征,确定降解菌的菌属。
1.5 降解菌对莠去津胁迫下水稻的影响
试验共设置4 组处理:1) 对照土壤 + 对照水稻;2) 对照土壤 + 接菌水稻;3) 含莠去津土壤 +对照水稻;4) 含莠去津土壤 + 接菌水稻,其中莠去津含量均为0.8 mg/kg。选择降解能力最强的菌株AT2 为目标菌株,用灭菌后的生理盐水配制菌悬液至OD600约为1.0。将2 份长势一致的三叶一心期水稻苗置于上述菌悬液中浸根处理12 h,得到2 份接菌水稻;2 份对照水稻采用等量的无菌生理盐水进行相同处理。将处理后的4 份水稻分别种植于对照土壤和莠去津污染土壤中,培养6 d 后测定水稻的相关生理指标、土壤和水稻中莠去津的含量以及水稻中莠去津降解基因的表达量。土壤和水稻中莠去津的提取与检测方法采用Ma 等[23]的方法,回收率为89.6%~102.3%,满足残留农药检测要求。
水稻中莠去津降解基因表达量的测定:通过液氮将植物样品研磨至粉末,利用植物总RNA 提取试剂盒提取RNA,并通过1%琼脂糖凝胶电泳和超微量紫外分光光度计检测RNA 的完整性和纯度,取上述合格的RNA 样品 (1.0 μg),经gDNA Eraser 消除DNA 后合成cDNA,并作为模板进行荧光定量PCR 扩增。根据已报道的水稻中莠去津降解基因[6,23-27]设计特异性引物,并以OsActin为内参基因。荧光定量PCR 体系与反应程序同1.3 节。
1.6 数据分析
通过Excel 2016 和Origin 2021 软件制图。试验结果采用SPSS 22.0 软件进行单因素方差分析(ANOVA),并用Tukey 检验进行多重比较;或采用Student’st-test (t检验) 进行分析。
2 结果与分析
2.1 莠去津对水稻根际土壤微生物多样性的影响
对莠去津胁迫下水稻根际土壤的微生物多样性进行分析,α多样性结果如表1 所示。各处理样本覆盖度均在98%以上,能较好地覆盖样本微生物群落的多数物种。另外,莠去津胁迫显著降低了Sobs 指数、Chao 指数和Simpson 指数,但对Shannon 指数无显著影响,表明莠去津胁迫可降低水稻根际土壤中细菌的丰富度和多样性。
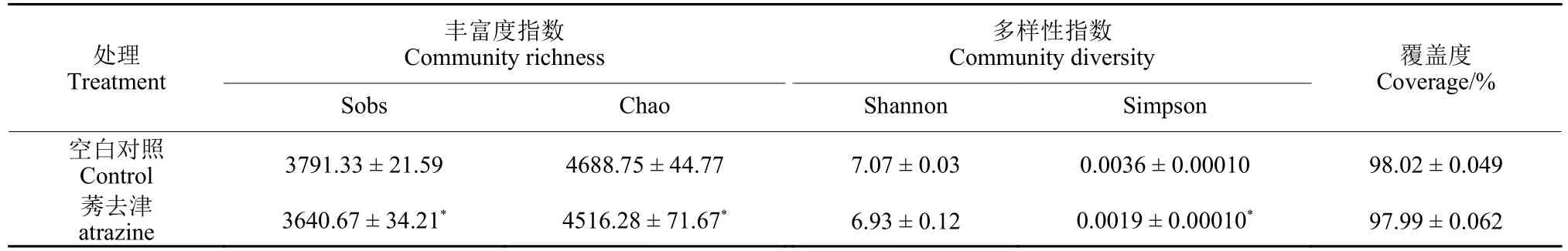
表1 不同处理土壤中细菌α 多样性指标Table 1 Alpha diversity indexes of rhizosphere soil samples under different treatment
为了分析莠去津对根际土壤细菌群落β多样性的影响,在属水平上进行了主坐标分析 (PCoA)。结果表明:第一组分 (PC1) 和第二组分 (PC2) 的方差贡献率分别为64.31%和17.7%,累计贡献率为82.01% (图1A)。另外,莠去津处理组样品点和对照组样品点在二维平面上能完全分开,说明莠去津可影响土壤细菌的群落结构。进一步筛选得到不同处理下存在显著差异的优势菌属,结果如图1B 所示:莠去津处理显著降低了戴沃斯菌属(Devosia)、氢孢菌属 (Hydrogenispora)、代尔夫特菌属 (Delftia) 的相对丰度,而噬氢菌属 (Hydrogenophaga)、瘤胃梭菌属 (Ruminiclostridium)、鞘氨醇杆菌属 (Sphingobacterium)、假单胞菌属 (Pseudomonas)、金黄杆菌属 (Chryseobacterium)、芽孢杆菌属 (Bacillus) 和窄食单胞菌属 (Stenotrophomonas)的相对丰度则显著增加。
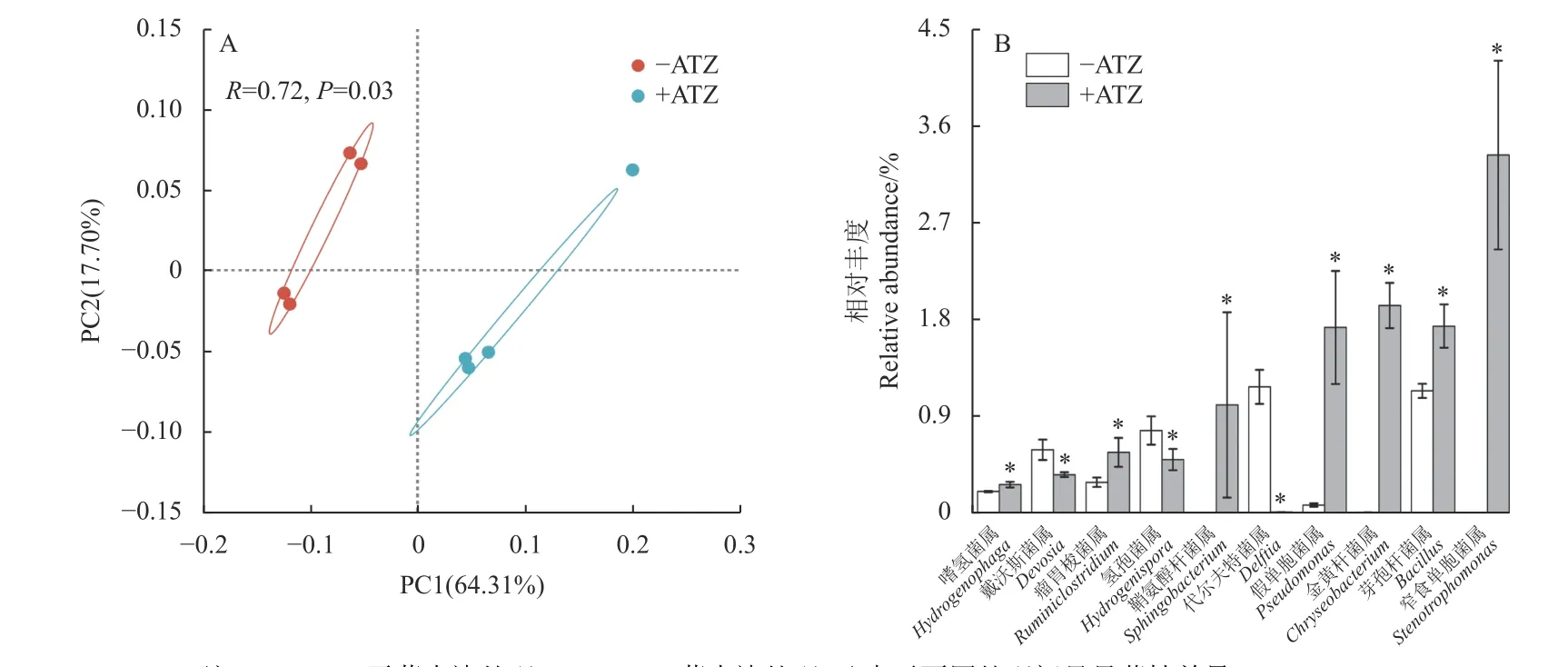
图1 不同处理下水稻根际细菌在属水平上的主坐标分析 (PCoA) (A) 和组间差异明显的优势菌属 (B)Fig.1 PCoA analysis of rice rhizosphere bacteria at genus level (A) and dominant bacterial genera with significant differences between groups (B) under different treatments
2.2 根际土壤中莠去津降解基因丰度的变化特征
土壤中莠去津降解基因 (TrzN、AtzB、AtzC、AtzD、AtzE) 丰度检测结果如图2 所示,莠去津对不同降解基因丰度的影响存在差异。首先,相较于对照组,参与水解反应的基因TrzN、AtzB、AtzC在莠去津处理的根际土壤中丰度更高,其中TrzN基因的丰度为对照组的46 倍,而基因AtzD和AtzE在不同处理之间无显著差异。以上结果表明,莠去津处理会改变土壤中降解基因的丰度,影响根际土壤中降解功能菌菌群。
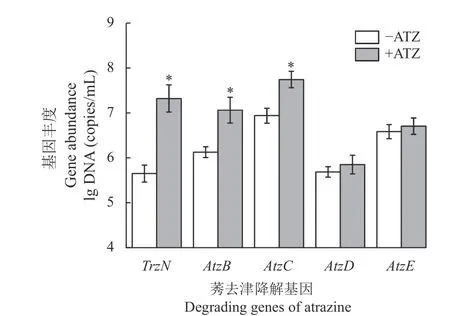
图2 莠去津处理对根际土壤中莠去津降解基因丰度的影响Fig.2 Effect of atrazine on the abundance of atrazine degrading genes in rhizosphere soil
2.3 菌株AT2 对莠去津胁迫下水稻生长的影响
通过分离筛选纯化,获得8 株对莠去津具有降解功能的菌株,分别命名为AT1~AT8,对莠去津的体外降解率在40.8%~88.9%之间 (表2)。根据16S rRNA 基因序列同源性比对,发现8 株菌株分别隶属于假单胞菌属 (Pseudomonassp.)、芽孢杆菌属 (Bacillussp.)、类芽孢杆菌属 (Paenibacillussp.)、金黄杆菌属 (Chryseobacteriumsp.) 和肠杆菌属 (Enterobactersp.)。以其中降解能力最强的Pseudomonassp.AT2 为目标菌株,通过对水稻株高、根长、干重、叶绿素和MDA 含量进行测定,评估了接菌和未接菌水稻耐受莠去津胁迫的能力。结果如表3 所示:在莠去津胁迫下,水稻生长明显受到了抑制,叶绿素含量下降,同时伴随着MDA 含量增加,说明氧化胁迫增强。接种降解菌株AT2 后,水稻中MDA 含量与单独莠去津处理组相比显著下降,表明菌株AT2 可缓解莠去津对水稻的氧化胁迫损伤。另外,在莠去津胁迫下,接菌处理组水稻的株高、根长、干重和叶绿素含量相较于未接菌组分别增加了34.6%、27.6%、28.6%和76.3%,进一步证明降解菌AT2 对莠去津胁迫具有缓解作用。
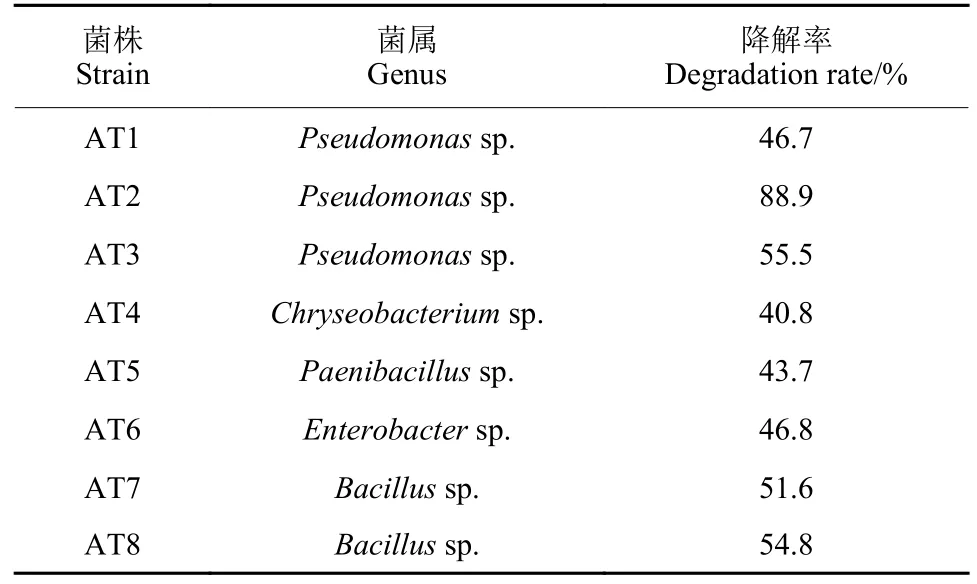
表2 8 株莠去津降解菌的筛选鉴定Table 2 Identification of 8 atrazine-degrading strains
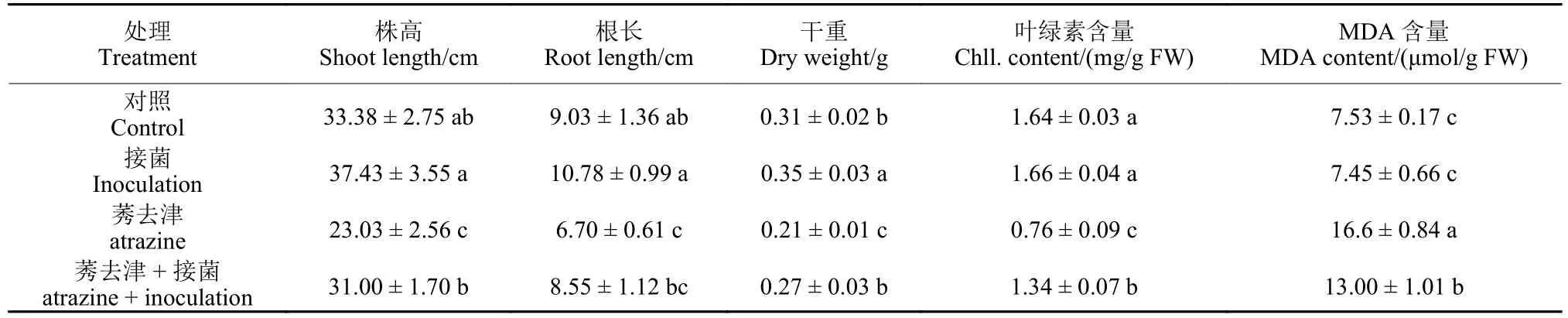
表3 莠去津胁迫下菌株Pseudomonas sp.AT2 对水稻生长的影响Table 3 Effect of Pseudomonas sp.AT2 on the growth of rice plants under atrazine stress
2.4 菌株AT2 对水稻和土壤中莠去津降解的影响
为明确降解菌AT2 对土壤-水稻系统中莠去津降解的影响,测定了接菌和未接菌处理下水稻及土壤中莠去津的含量。结果显示:接菌组水稻地上组织和根中莠去津的含量分别比未接菌组水稻低57.5%和47.1%,且茎叶中含量明显高于根中含量;土壤中莠去津含量变化趋势与水稻相似,接菌组土壤中莠去津含量显著低于未接菌组,其含量仅为未接菌组土壤的85.1% (图3)。研究表明,降解菌AT2 可显著促进土壤-水稻系统中莠去津的降解。为进一步评估AT2 对水稻吸收和运输莠去津能力的影响,分析了莠去津的富集系数 (BCF) 和转运系数 (TF)。由表4 中结果可知,接种AT2 后根和叶的富集系数均显著下降,同时转运系数也从3.34 下降至2.68,表明接种菌株AT2 减少了莠去津向水稻地上部分的转运。
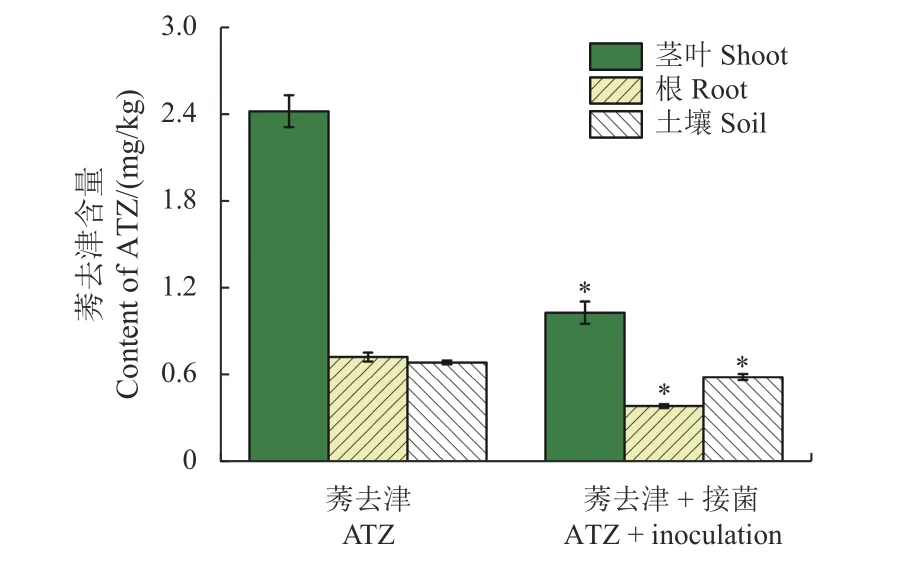
图3 接种Pseudomonas sp.AT2 菌株对水稻和土壤中莠去津含量的影响Fig.3 Effect of Pseudomonas sp.AT2 inoculation on atrazine (ATZ) content in rice and soil
2.5 菌株AT2 对水稻中莠去津降解基因的影响
农药在植物中的代谢主要通过三相代谢完成。为评估AT2 对水稻中莠去津降解基因表达的影响,从已报道的莠去津降解基因中选择6 个参与I 相和II 相代谢的关键基因,测定了不同处理下降解基因的表达量。结果如图4 所示:在无莠去津胁迫情况下,接菌组水稻和未接菌对照组水稻中降解基因的表达量无显著差异;莠去津胁迫下,水稻的防御系统被激活,莠去津降解基因的表达量显著增加,其中P450 基因的表达量是无莠去津胁迫对照组的10.7 倍。另外,莠去津胁迫下,接菌组水稻中莠去津降解基因的表达量明显高于未接菌组水稻,与未接菌组相比,接菌组水稻中编码漆酶、甲基转移酶、糖基转移酶、P450、谷胱甘肽S-转移酶和硫氧还蛋白的基因表达量分别提高了1.5、1.3、2.7、1.7、2.5 和1.3倍。研究表明,接种降解菌AT2 激活了水稻中莠去津的降解基因,从而可促进水稻中莠去津的降解代谢。
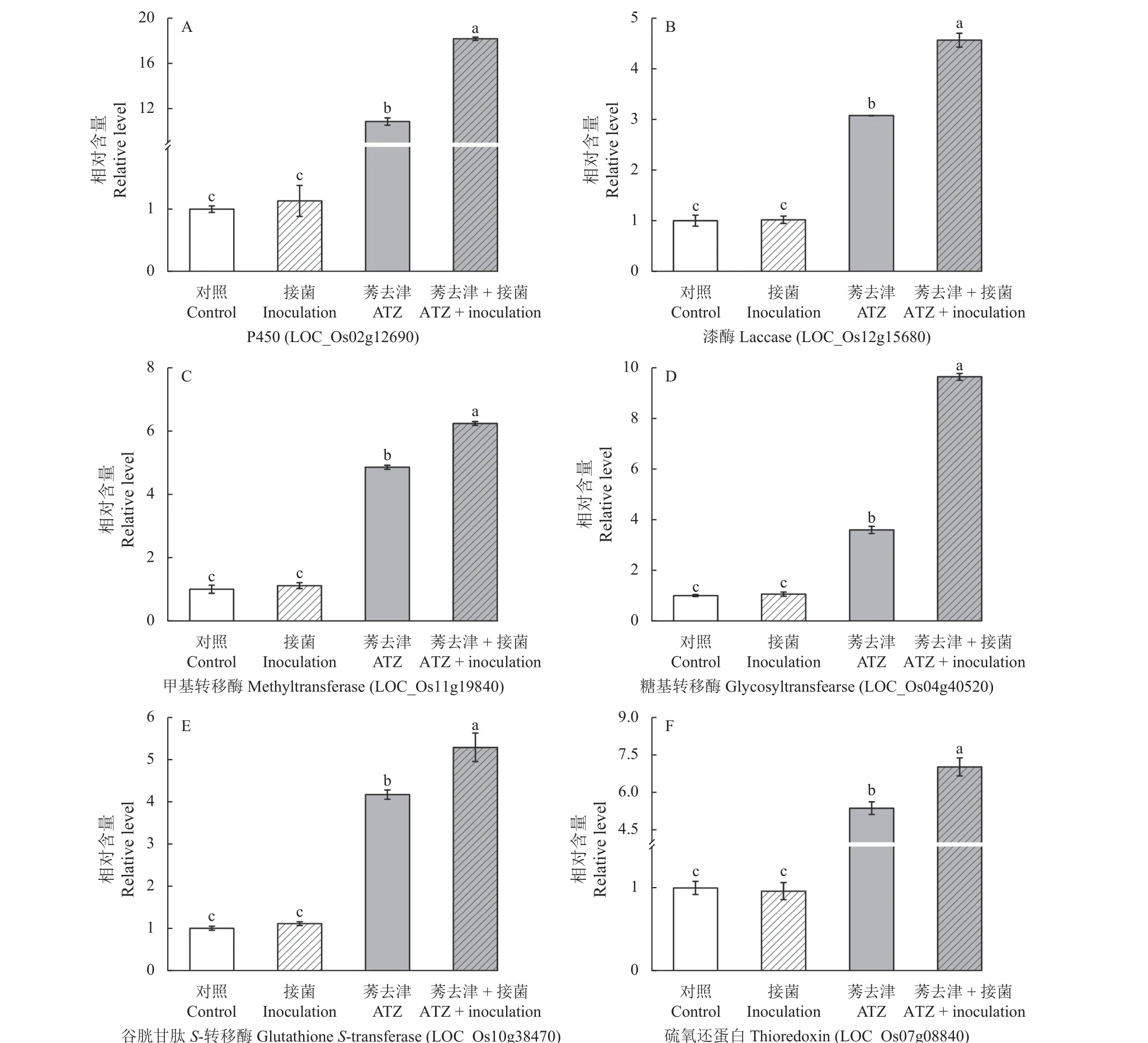
图4 不同处理下水稻中莠去津降解基因的表达量Fig.4 Transcriptional expression of defense genes involved in atrazine (ATZ) degradation in rice under different treatments
3 讨论与结论
根际微生物是植物根际微域的重要组成部分,是衡量根际活力和质量的重要指标之一[28]。农药一方面可被植物直接吸收或残留在土壤中,对植物根际微生物造成直接影响,另一方面还可通过改变植物的根系分泌物,从而间接影响根际微生物的结构[13]。本研究发现,莠去津处理下,Sobs、Chao 和Simpson 指数均显著下降,可能是莠去津进入土壤后抑制了根际微生物的活性,从而降低了水稻根际微生物的多样性指数和丰富度指数。已有研究表明,当有机污染物进入土壤后,土壤中部分微生物能以有机污染物为碳源进行生长,并导致该部分微生物丰度增加[29-30]。在本研究的细菌丰度分析中,发现莠去津处理显著增加了水稻根际土壤中鞘氨醇杆菌属、假单胞菌属、金黄杆菌属及芽孢杆菌属的丰度,而这些菌属均与有机污染物的降解密切相关[31-33]。另外,在水稻根际土壤莠去津降解基因丰度变化的研究中,发现参与水解反应的降解基因TrzN、AtzB和AtzC的丰度受莠去津胁迫影响而显著增加,推测可能在莠去津处理下,部分具有特定功能的菌株(如降解菌) 丰度增加并协同植物促进对莠去津的降解,从而发挥抵御药剂胁迫的作用。
目前已有研究表明,降解菌可有效缓解莠去津对后茬敏感作物的药害[34-35]。本研究在莠去津污染的根际土壤中分离筛选获得8 株莠去津降解菌,其中Pseudomonassp.AT2 的降解能力最强。将菌株AT2 接种于水稻根际,可有效缓解莠去津对水稻生长的抑制,接菌组水稻株高、根长、干重和叶绿素含量均显著增加。MDA 作为细胞膜脂质过氧化的产物,常用于评价植物的氧化胁迫程度[36]。本研究发现,莠去津胁迫下,根际接种菌株AT2 后,水稻体内MDA 含量显著下降,这可能是由于接种AT2 增强了水稻对活性氧的清除能力,从而减轻莠去津对水稻的氧化胁迫损伤。
在农药降解研究领域,目前已明确根际微生物可以联合植物在农药降解过程中发挥功效[14-15]。Rani 等[37]研究发现,向日葵接种根际细菌菌株Paenibacillussp.ITISM08、Bacillussp.PRB77和Bacillussp.PRB101 后,植物体内硫丹的积累量明显减少,土壤中硫丹 (初始质量浓度为5 mg/L)的降解率可达到92%。本研究发现,水稻根际接种菌株AT2 不仅可显著降低水稻根和叶中莠去津的积累量,同时还可促进土壤中残留莠去津的降解,与Rani 等的研究结果类似。据报道,农药在植物中的代谢解毒主要通过植物酶系的诱导转化实现。农药进入植物后首先在细胞色素P450 酶系(CYPs)、漆酶等酶系的作用下进行氧化、还原和水解等反应,进一步通过糖基转移酶、谷胱甘肽S-转移酶等酶系与植物体内的亲水型分子结合形成II 相代谢产物,同时降低对植物的毒性,该II 相代谢产物随后能被Ⅲ相代谢转运子识别,将结合物沉积在液泡中或通过主动运输排出至细胞间隙[38-39]。本研究发现,莠去津胁迫下,参与水稻中I 相 (P450、漆酶) 和II 相代谢 (甲基转移酶、糖基转移酶、谷胱甘肽S-转移酶、硫氧还蛋白) 的关键降解基因在菌株AT2 作用下显著上调表达,推测这可能是菌株AT2 能够促进水稻中莠去津降解,修复莠去津对水稻毒害的内在原因。
综上,本研究揭示了莠去津胁迫可降低水稻根际细菌α多样性,导致微生物群落结构发生改变,同时还可增加根际土壤中莠去津降解基因的丰度。另外,接种莠去津降解菌Pseudomonassp.AT2 则能缓解莠去津对水稻的胁迫损伤,激活水稻中莠去津降解基因的表达,进而促进“土壤-水稻”系统中莠去津的降解代谢,阻控残留莠去津向水稻地上部转移富集。研究结果可为利用功能微生物定向修复残留农药污染,保障作物的安全生产提供理论基础。

