环氧虫啶与人血清白蛋白的相互作用
刘晓娟, 邓培渊, 范春丽, 田云芳
(郑州师范学院 郑州市植物景观多样性与生态修复重点实验室,郑州 450044)
环氧虫啶(cycloxaprid)是华东理工大学开发的一个具有自主知识产权的新烟碱类杀虫剂[1]。在商品化新烟碱类杀虫剂的结构中,吡虫啉等常见杀虫剂的硝基均为反式构型,而环氧虫啶是独特的顺式硝基构型并含有七元氧桥杂环结构 (结构式见图式1),因此环氧虫啶的作用机制与其他新烟碱类不同,其对抗性害虫的杀虫活性优于吡虫啉,具有广阔的应用前景[2]。

图式 1 环氧虫啶结构式Scheme 1 The structural formula of cycloxaprid
由于新烟碱类杀虫剂对昆虫烟碱乙酰胆碱受体具有较高选择性,所以被认为其对非靶标生物低毒[3]。但有研究表明,新烟碱类杀虫剂对非靶标生物也具有危害性,主要表现为氧化应激、抑制活动能力、损伤DNA 和生育功能受损等[3-4]。此外,由于该类杀虫剂的大量使用,导致土壤、水体、空气等被污染,而人体通过饮食、饮水、呼吸等多种途径会暴露于该类农药中[5],因此其对人类的生育、生殖、神经以及脏器功能也带来风险[6-7]。
目前,有关环氧虫啶的研究,在毒理学、作用方式、代谢与残留等方面取得了一定的进展[8],但其对人体的影响、毒性机理以及在人体内的运输机制尚缺乏进一步研究。人血清白蛋白 (human serum albumin, HSA) 是人血浆中含量最丰富的非特异性载体蛋白质,具有多种生理功能[9]。药物进入人体血液系统后,大部分先与HSA 进行可逆结合,然后进行存储、转运、发挥药效或毒副作用。药物与HSA 可逆结合的亲和性,直接影响了药物分子在血液中的生物利用率、分布、自由态浓度和代谢[10]。此外,HSA 还是研究药物与蛋白质结合机制的经典模型蛋白,常被用于药物与蛋白质相互作用的研究中[11-12]。因此,在分子水平研究环氧虫啶与HSA 的相互作用,对环氧虫啶的毒理学及其安全风险评估具有较大的借鉴意义。
当药物与蛋白质结合时,蛋白质的二维和三维结构均会发生改变,进而影响蛋白质的生理功能[13]。荧光光谱法是研究蛋白质分子构象的一种有效方法,可以推断蛋白质分子在各种环境下的构象变化,进而阐释蛋白质结构与功能间的关系[14]。分子对接是通过计算机建立小分子配体与蛋白质的受体结构,模拟二者结合中发生的分子行为与结构变化[15],是研究分子间相互作用的重要方法之一。分子动力学可以从分子水平来研究药物靶点蛋白的结构[16],为研究蛋白质的力学行为、蛋白质动态的相互作用和生物网络分析提供了新视角和新途径[17]。荧光光谱法、分子对接技术及分子动力学模拟三者常常结合使用,用于对实验结果的进一步验证[18-21]。鉴于此,本研究运用荧光光谱法、分子对接技术及分子动力学模拟相结合来研究环氧虫啶与HSA 结合的特性和机理。
1 材料和方法
1.1 仪器和试剂
F-380 型荧光分光光度计 (天津港东科技发展有限公司),YASARA 分子模拟工作站 (奥地利格拉兹大学)。环氧虫啶(cycloxaprid,99.5%标准品,德国Dr.Ehrenstorfer GmbH 公司),人血清白蛋白(HSA)、华法林 (warfarin) 和布洛芬 (ibuprofen)(北京索莱宝科技有限公司)。其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 荧光猝灭实验 添加1.0 × 10-4mol/L 的环氧虫啶甲醇溶液于1.0 × 10-6mol/L 的HSA 溶液中(HSA 溶于PBS 缓冲液,pH = 7.4,含质量分数为0.9%的NaCl),使环氧虫啶的终浓度分别为HSA浓度的0、1、2、4、6、8、10 倍;激发波长λex=280 nm,狭缝宽度为10/5 nm,发射波长在290~450 nm,分别设置温度为293、302 和310 K,扫描HSA 与环氧虫啶作用的荧光光谱。
1.2.2 位点竞争实验 位点标记物华法林和布洛芬分别代表HSA 结构的siteI 和siteⅡ位点,环氧虫啶和HSA 浓度比为4 : 1,向其中加入位点标记物进行滴定实验。其他实验方法与1.2.1 节相同,计算在310 K 时HSA 和环氧虫啶的结合常数和结合位点数。
1.2.3 分子对接 通过分子对接可以将配体与受体迅速结合,从而获取配体和受体之间相互作用信息,实现对分子间结合位点和结合作用力的预测[22]。从Protein Data Bank 中下载HSA 晶体结构(2BX8),运用YASARA 程序完成原始结构的加H、除H2O 和添加缺失原子[23];参考1.2.2 节中确定的环氧虫啶结合位点,运用AutoDock4.0 进行刚性对接,设置环氧虫啶为全柔性结构,其他参数均为默认值。
1.2.4 分子动力学模拟 分子动力学模拟在YASARA 平台完成。体系置于TIP3P 显性立方体H2O 分子模型中,原子与边界之间的距离为0.9 nm,采用Amber14 力场,添加钠离子保持体系电中性。模拟设置pH = 7.4 和温度310 K,采用NVT正则系宗和郎格万方法控制体系温度,积分步长为2.5 fs,采样间隔为50 ps。程序在Centos 系统下运行。
1.2.5 结合自由能计算 运用Amber12 程序包MMPBSA.py 模块中的MM-PBSA[24]方法计算环氧虫啶和HSA 的结合自由能,对模拟平衡后5 ns动力学轨迹的100 个构象进行采样分析,结合自由能 (ΔG) 和范德华力 (ΔEvdw)、静电作用力 (ΔEele)、非极性溶剂化能 (ΔGnopolar) 和极性溶剂化能 (ΔGpb)间的关系如公式 (1) 所示:
1.2.6 能量分解和丙氨酸突变扫描 运用Amber14软件包,分解对接复合物中HSA 单个氨基酸能量贡献。为评估单个氨基酸能量贡献值的分布特征,对贡献值较高 (大于2.09 kJ/mol) 的氨基酸进行丙氨酸突变扫描计算[25],比较突变前结合自由能(ΔGwild)和突变后结合自由能(ΔGmutant)的差值(ΔΔG)。
2 结果与分析
2.1 荧光猝灭机制
在模拟人体生理的条件下,测试了不同浓度的环氧虫啶加入HSA 混合液的荧光光谱。结果(图1) 表明,HSA 的内源荧光发射峰位于334 nm处,随着环氧虫啶的加入,HSA 的荧光强度逐渐降低,峰值有微弱蓝移,表明环氧虫啶使HSA 的色氨酸残基的微环境发生了变化[25],环氧虫啶能有效地猝灭HSA。
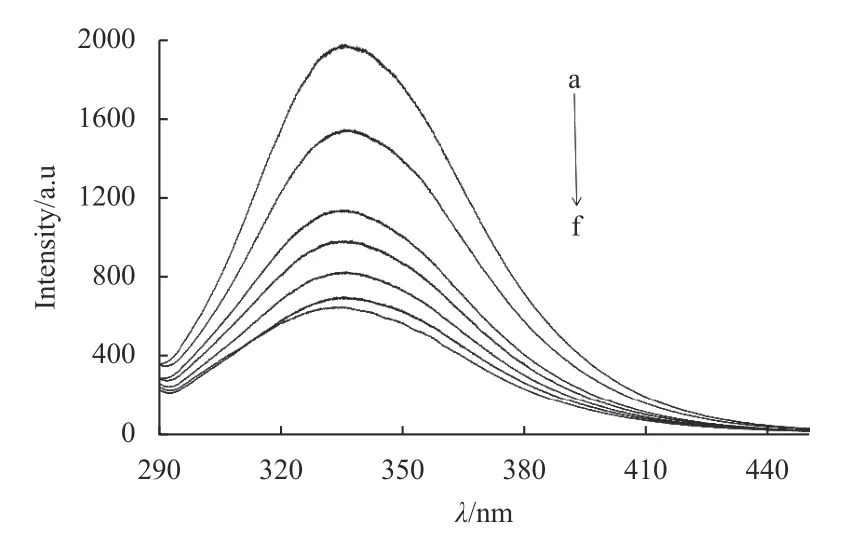
图1 不同浓度环氧虫啶时HSA 的荧光发射光谱Fig.1 Emission spectra of human serum albumin in the presence of various concentrations of cycloxaprid
判断体系的荧光猝灭机制时,可按照Stern-Volmer 方程 (2)[26]进行分析。
式中:F0和F分别表示没有和有环氧虫啶时HSA 的荧光强度;Ksv为动态猝灭常数;[Q]为环氧虫啶浓度;Kq为猝灭速率常数;τ0为HSA 的分子平均寿命10-8s。计算的猝灭常数 (表1) 显示,HSA 和环氧虫啶的Ksv的值随着温度的升高而减小,说明HSA 和环氧虫啶的作用为静态猝灭,Kq值远大于生物大分子的最大碰撞碎灭常数(2.0 ×1010L/(mol·s))[26],说明HSA 与环氧虫啶有较强的亲和力,环氧虫啶与HSA 结合利于其到达特定组织和持续发挥作用。

表1 不同温度下环氧虫啶和HSA 相互作用的猝灭常数(Ksv)、猝灭速率常数(Kq)Table 1 The quenching constants (Ksv), quenching rate constants (Kq) of the interaction of cycloxapyrid with HSA at different temperatures
2.2 结合常数和结合位点数
HSA 和环氧虫啶的结合为静态猝灭过程,KA为结合常数,n为结合位点数,按照公式(3)计算得到不同温度下HSA 和环氧虫啶结合常数在0.76 × 105~1.57 × 105L/mol 之间,表明两者有较强的结合能力;结合位点数位于0.89~0.98 之间,说明两者有1 个结合位点 (表2) 。
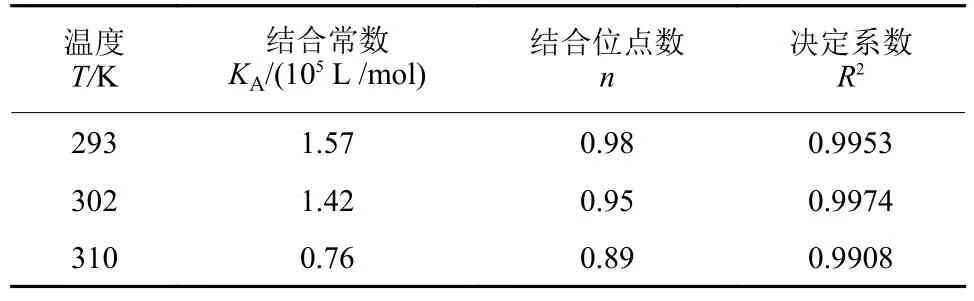
表2 不同温度下环氧虫啶与HSA 作用的结合常数 (KA) 和结合位点数 (n)Table 2 The binding constants (KA) and binding sites (n)of the cycloxapyrid with HSA at different temperatures
2.3 环氧虫啶结合位点的确定
药物与蛋白之间的相互作用通常是多种作用力的协同作用,这种相互作用的量化参数就是药物与蛋白的结合常数KA。结合常数越小,表明外源物对位点探针的替代性越强,即竞争性越强。
HSA 的两个主要结合位点siteI 和siteII,分别位于HSAIIA 和IIIA 的疏水腔内。研究表明,华法林与HSA 结合在siteI 位点,布洛芬结合在siteII 位点[27]。本研究结果 (表3) 显示,与空白对照比对,添加华法林后环氧虫啶与HSA 的结合常数发生了明显的变化,说明环氧虫啶法与华法林竞争同一结合位点,即环氧虫啶结合在了HSA IIA 疏水腔内的siteI 位点。

表3 位点标记物对结合体系结合常数的影响Table 3 Effect of site maker probes on binding constants of binding system
2.4 热力学参数和作用力类型
蛋白质与小分子借助氢键、静电作用力、范德华力和疏水作用力等非共价结合形成复合物,其作用力类型可以根据热力学常数大小判断,通过Van't Hoff 方程[28](公式4 和5) 计算自由能变(ΔG)、焓变 (ΔH) 和熵变 (ΔS)。
不同温度条件下环氧虫啶与HSA 相互作用的热力学参数测定结果 (表4) 表明:不同温度下,ΔG均小于0,表明两者的结合是自发反应;ΔH和ΔS均小于0,根据Ross 等[29]提出的理论分析,环氧虫啶和HSA 结合过程的主要作用力是范德华力和氢键作用。
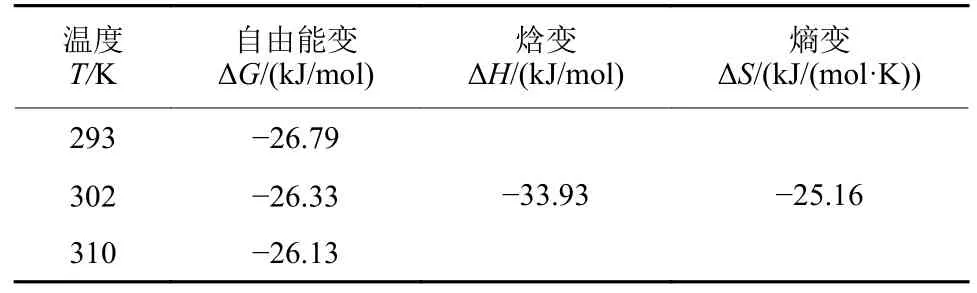
表4 不同温度下环氧虫啶和HSA 相互作用的热力学参数Table 4 Thermodynamic parameters for the interaction of the cycloxapyrid with HSA at different temperatures
2.5 分子对接结果
参考2.3 节中预测的环氧虫啶与HSA 的结合位点,将其固定于HSA 的siteI 位点,设置Grid Box 涵盖整个模型,对接体系格点为110 × 98 × 105,间距为0.375 Å (1 Å = 0.1 nm),最优结合模式如图2 所示,环氧虫啶与His416 和Gln459 形成了两个键长分别为4.13 Å和5.89 Å的氢键,说明氢键是两者结合的分子基础,这与热力学参数显示的结果是一致的。
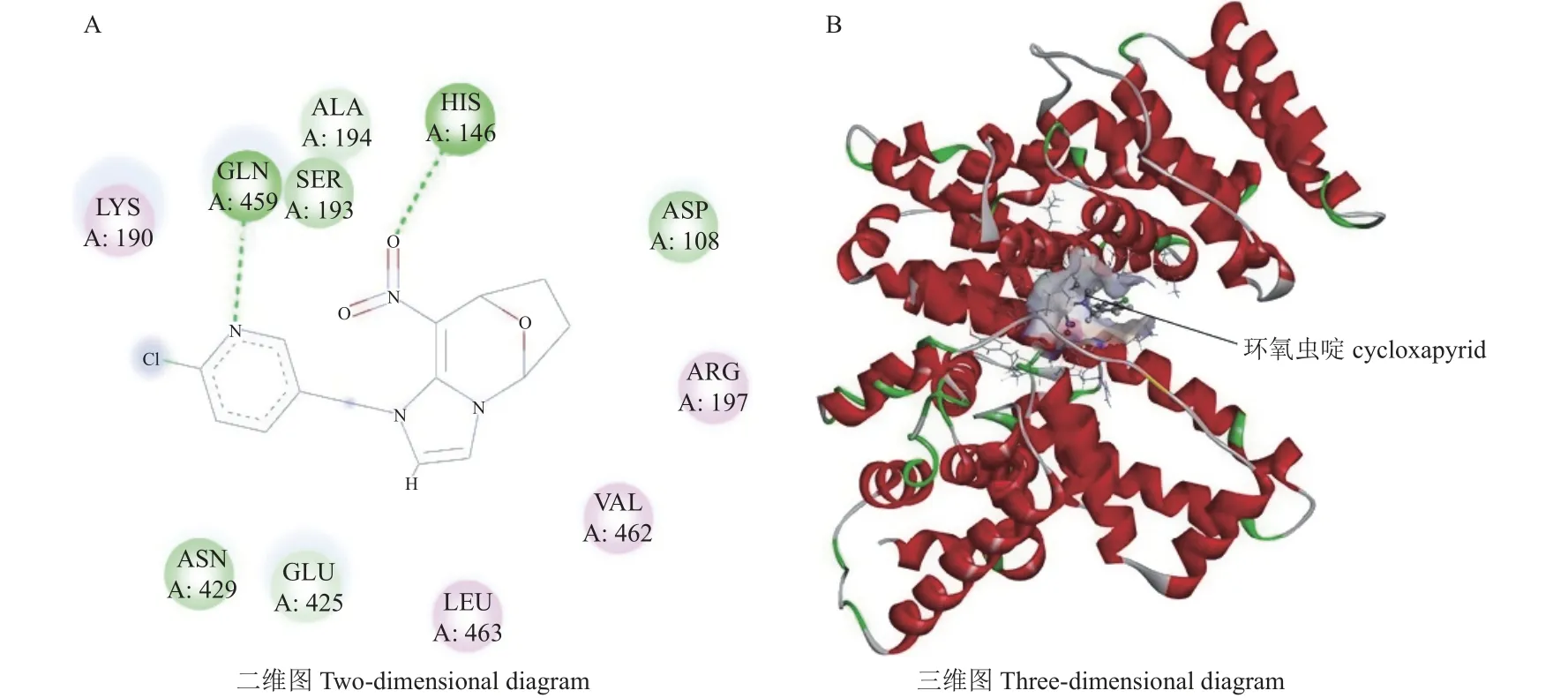
图2 环氧虫啶与HSA 的结合方式Fig.2 Binding mode of cycloxapyrid and HSA
2.6 分子动力学模拟结果
本研究采用分子动力学对分子对接的结果进行验证。均方根偏差 (root mean square deviation,RMSD) 是判断体系是否达到平衡状态的重要指标之一。由图3、图4 可知,HSA 和环氧虫啶复合物体系中,在约25 ns 达到收敛平衡状态,主链原子的RMSD 在2.0 Å左右波动,说明两者可以形成稳定复合物;与HSA 单体的分子动力学模拟结果相比,复合物体系更容易达到平衡态,且RMSD值更低,说明HSA 中加入环氧虫啶后,体系更加稳定,进一步证明了两者的结合可以自发进行。
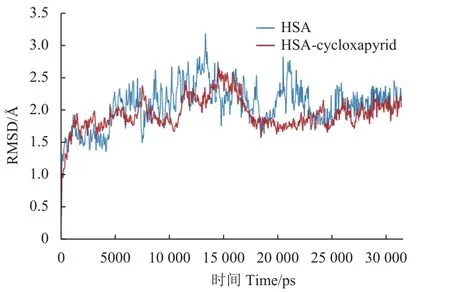
图3 分子动力学模拟中主链原子均方根偏差的变化Fig.3 The change of RMSD of backbone atoms in molecular dynamics simulation

图4 分子动力学模拟体系能量变化Fig.4 The change of system energy in molecular dynamics simulation
2.7 结合自由能的计算结果
运用Amber12 程序包MMPBSA.py 模块中的MM-PBSA 方法,计算得到环氧虫啶与HSA 自由能为 -25.90 kJ/mol (表5),两者形成了相对稳定的复合物。对结合自由能进行分析发现,范德华力、静电作用力和非极性溶剂化能可促进两者的结合,能量贡献值分别为 -77.95、-23.81 和 -12.30 kJ/mol,其中范德华力是主要驱动力;极性溶剂化能是主要的抑制力,能量贡献值为85.81 kJ/mol。

表5 环氧虫啶和HSA 复合物结合自由能和组分Table 5 The binding free energy and components of cycloxapyrid and HSA complex (kJ/mol)
2.8 氨基酸残基能量分解结果
为研究HSA 单个氨基酸残基在结合过程中的能量贡献及分布,运用Amber12 程序分析了单个氨基酸的总能量和侧链能量,结果见表6。共有6 个氨基酸的能量贡献值超过6 kJ/mol,包括Ala194、Leu198、Val455、Asn458、Gln459 和Val462,氨基酸Gln459 贡献值差最大,为11.22 kJ/mol。这些氨基酸残基集中在Gln459 附近,表明该区域是环氧虫啶和HSA 结合的关键区域。

表6 环氧虫啶和HSA 复合物残基能量分解能量分项值Table 6 The energy decomposition on a per-residue of cycloxapyrid and HSA complex (kJ/mol)
2.9 丙氨酸突变扫描结果
单个氨基酸残基的能量贡献值,包括残基之间的相互作用和残基与外源分子的作用[30]。为了探究氨基酸残基对外源分子结合的影响,假设受体和配体的结合模式不受局部构象变化的影响,选取Ala194、Leu198、Val455、Asn458、Gln459 和Val462 氨基酸突变体进行扫描。
丙氨酸突变扫描是为了进一步分辨出氨基酸残基能量分解后自由能较高的氨基酸。扫描结果显示,只有Asn458 和Gln459两个氨基酸突变体具有较明显的结合自由能 (表7),结合自由能差分别为 -7.40 和 -10.42 kJ/mol,表明Gln459 是与外源分子环氧虫啶结合的关键氨基酸,这也是对氨基酸残基能量分解结果的进一步验证。
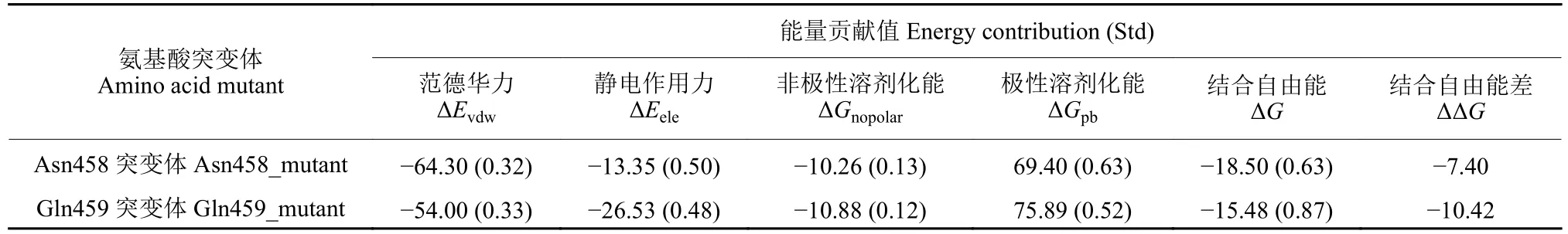
表7 环氧虫啶和HSA 结合突变体的结合自由能Table 7 The binding free energies of mutant complex of cycloxapyrid and HSA (kJ/mol)
3 结论与讨论
本研究探讨了环氧虫啶与人血清蛋白的相互作用。分别采用荧光猝灭法、分子对接和分子动力学等方法进行了多方面的实验与验证。荧光猝灭是指荧光分子与溶剂分子之间发生猝灭,多用于生物大分子和小分子药物或者金属离子之间的相互作用[31]。借助于荧光猝灭法,获得环氧虫啶与HSA 的结合常数在0.76 × 105~1.57 × 105L/mol之间,二者结合在HSA IIA 疏水腔内的siteI 位点。分子对接时,以结构生物学为基础进行环氧虫啶与HSA 相互作用的动力学模拟研究,确定环氧虫啶与HSA 的作用靶点,得到HSA 与环氧虫啶的结合自由能为 -25.90 kJ/mol,表明二者可以形成稳定的复合物。农药与蛋白质的有效结合,可以直接影响药物在人体内的扩散[32]。本研究表明,环氧虫啶在人体内可能具有较强的扩散能力。
HSA 含有3 个晶体结构域[33],每个结构域都有A、B 两个亚结构。大多数化学合成物与HSA结合在IIA 和IIIA 部位,其中IIIA 的活性最强[34]。本研究结果表明,HSA 与环氧虫啶结合的主要能量贡献残基集中位于IIA 区域,不在活性最高的IIIA 区,这与华法林与HSA 的结合模式一致[35]。这可能是由于IIA 位于α-螺旋形成的通道底部,更有利于环氧虫啶的结合与释放,也表明HSA 与外源小分子的结合模式可能是多因素共同作用的结果。
Moreira 等[36]将突变体扫描中氨基酸ΔΔG能量的不同分为:“hot spots (热点)”“warm spots (暖点)”和“null spots (非点)”。本研究中,Gln459为近似暖点,是环氧虫啶与HSA 结合的关键氨基酸,对环氧虫啶在人体内的吸收、转运和降解过程中起重要作用。本研究为环氧虫啶在人体内的运转机理提供了一定的依据,也可为开发新型更加环保、低毒的杀虫剂提供借鉴。

