重组CRM197-4GnRH去势疫苗抗原分子的原核表达及免疫效果评价
高华义,刘堃,张璐,王永芳,任东兴,郭钰洁,武毅,申雁冰,付旭彬*,王敏*
(1. 天津科技大学 生物工程学院,天津 300457;2. 天津瑞普生物技术股份有限公司,天津 300308;3. 天津海关动植物与食品检测中心,天津 300461;4. 南京农业大学动物医学院,江苏 南京 210095)
公猪生长过程中,体内会积聚大量雄性激素,使猪肉产生膻味,不仅影响口感、风味,还影响生猪饲喂效率,因此公猪往往需要阉割去势。该过程耗费大量人力、物力,还容易导致阉割应激及外伤感染。自欧盟发布自愿中止公猪手术阉割宣言,免疫去势替代家畜、宠物的手术阉割已成必然。
促性腺激素释放激素(gonadotropin releasing hormone,GnRH)也被称为黄体生成素释放激素,由下丘脑神经细胞分泌[1]。该激素形式多种多样,目前至少已经发现24种,主要源自哺乳动物、鱼、鸟等动物的神经组织,GnRH可以通过刺激垂体合成和分泌促性腺激素,对动物的生长和生殖有重要的作用[2-3]。通过对GnRH进行改造修饰,不仅可以解决免疫系统不能识别自身激素的问题,还可以提高GnRH的免疫原性,从而可以起到免疫去势作用。在此过程中,还要特别注意其应用场景的需求,公猪免疫去势需要维持一定的免疫有效期,以便可以通过调控体系发挥其免疫去势作用[4-5]。
Ladd等[6]为了提升GnRH免疫去势疫苗的免疫原性,分别将GnRH的第1、6、10位氨基酸与破伤风类毒素进行偶联结合,通过免疫犬、兔子和大鼠,测定其血清中的抗体效价,与第6、10位氨基酸链接点疫苗相比,GnRH通过第1位氨基酸与破伤风类毒素进行的偶联免疫效果最佳。Oonk等[7]通过用D型氨基酸Lys取代GnRH第6位氨基酸,并将经过修饰后的GnRH进行连接形成二聚体,与载体蛋白OVA相连,免疫公猪后,其免疫有效率达到100%;同时,通过用Ala依次替换GnRH的每个氨基酸,并与载体蛋白偶联后免疫公猪,发现不同位置的氨基酸被取代后,其免疫原性受到的影响不同。作为全球唯一一个用于公猪免疫去势的商业化产品,美国硕腾生产的异普克去势疫苗是在GnRH的基础上去掉了第1位的氨基酸,具有一定的免疫活性[8]。除了上述提到的通过进行氨基酸的替代以提升免疫去势疫苗的效果,还可以通过增加抗原分子量,使其抗原表位增多,以多聚体的形式提升其刺激机体产生免疫反应的能力[9]。Oonk等[7]通过用BSA载体与单个GnRH连接,之后通过测定动物血清中睾酮浓度以验证免疫有效率;并且通过同样的方式将BSA与串联的GnRH进行偶联结合,进行睾酮浓度的测定;最后结果表明,串联的GnRH与载体蛋白偶联之后形成的新分子免疫有效率可以达到100%,显著高于单个GnRH发挥的效用。Xu等[10]通过使用-hinge-MVP作为载体蛋白与单个GnRH和3个串联的GnRH进行连接,通过测试其对大鼠免疫应答反应,发现3个串联的GnRH与载体蛋白偶联后所发挥的免疫应答反应显著强于单个GnRH。
基于化学合成疫苗存在合成工艺复杂、生产成本高、批次间质控难度高等难题,国内外学者尝试使用基因工程方法制备GnRH免疫去势疫苗,其自身作为10个氨基酸的半抗原,半衰期较短,且无免疫原性,往往需要使用载体蛋白偶联修饰。而载体蛋白与单个GnRH分子的结合,其结构不稳定,免疫动物后,动物机体往往难以有效识别并将之通过抗原递呈细胞开展免疫应答,而GnRH多聚体偶联载体蛋白后可以很好的产生免疫去势作用。目前通过基因工程获取的免疫去势疫苗抗原因其表达量、免疫效果、纯化工艺和生产成本等因素,难以大规模的商业化应用。因此,开发一种适合公猪免疫去势、生产工艺简单的免疫去势基因工程疫苗,对我国生猪养殖行业意义重大。本研究采用白喉毒素无毒突变体(CRM197)与4拷贝GnRH串联,制备重组CRM197-GnRH,并分析了其免疫去势效果。
1 材料与方法
1.1 试剂
TaqDNA聚合酶、T4 DNA连接酶、限制性核酸内切酶、dNTPs、DNA Marker、异丙基硫代半乳糖苷(IPTG)、DNA纯化试剂盒,购自于TaKaRa公司;SDS-PAGE Marker,购于北京全式金生物技术股份有限公司;His Band Purification Kit,购于Novagen公司;BCG购于上海瑞楚生物科技有限公司;多肽抗原G1(GnRH+Th抗原表位)、GnRH阳性血清来源于天津瑞普生物技术股份有限公司;Montanide ISA 61 VG(油包水佐剂)、Montanide ISA 206 VG(水包油包水佐剂)、Montanide ISA 02 VG(水溶性佐剂)、Montanide IMS 1313 VG(纳米水溶性佐剂),购自于法国SEPPIC 公司;A8佐剂由南京农业大学提供;Sim-01佐剂和Bis-01佐剂由清华大学提供;酵母提取物、蛋白胨,购于OXOID 公司(英国);饱和平衡酚(pH=8.0)购于生工生物工程(上海)股份有限公司;DAB显色试剂盒购于南京生兴生物技术有限公司;睾酮放免试剂盒购于北京北方生物技术研究所有限公司。
1.2 菌株、质粒和试验动物
菌株:大肠杆菌BL21-DE3、大肠杆菌DH5α来源于天津瑞普生物技术股份有限公司。
质粒:pET22b(+)(氨苄青霉素抗性,Ampr),pMD18-T(卡那霉素抗性,Kanr)来源于天津瑞普生物技术股份有限公司。
动物:未去势的12周龄健康雄性大鼠100只,体重在240~260 g之间,由天津瑞普生物技术股份有限公司提供,经检查不存在隐睾和睾丸发育问题。将大鼠随机分成10组,每组10只,试验在天津瑞普生物技术股份有限公司空港经济区分公司动物房开展,常规适应性饲养1周,自由饮水和采食,饲料为不含任何抗生素和抗菌药的全价鼠粮,至第13周龄开始做试验。
1.3 重组CRM197-4GnRH的表达载体构建
1.3.1 构建表达系统
CRM197-4GnRH基因由深圳华大基因股份有限公司合成,在合成过程中与pMD18-T载体进行了连接,从而得到重组质粒pMD18-T-CRM197-4GnRH。用EcoRⅠ和XhoⅠ对pMD18-T-CRM197-4GnRH质粒和pET22b(+)载体进行双酶切。采用大肠杆菌BL21按照感受态细胞的制备方法予以制备,24 h内使用。按照《分子克隆实验指南》进行质粒的提取:在LB平板中挑取5个单菌落,在LB液体培养基(Amp)中37 ℃培养。取菌液离心,分别加入溶液Ⅰ和溶液Ⅱ,用等体积碱性饱和平衡酚/氯仿混合,将上清液与等体积氯仿混匀,将沉淀用2倍体积无水乙醇轻轻混匀沉淀烘干,用20 μL含有RNA酶的TE (TER)溶解质粒,37 ℃温育0.5 h,仅余DNA片段。对质粒进行EcoRⅠ、XhoⅠ双酶切鉴定,送深圳华大基因股份有限公司测序。将所测序的质粒以BL(pET22b-CRM197-4GnRH)命名。
将重组菌BL(pET22b-CRM197-4GnRH)置于4 mL含Amp的LB液体培养基内,37 ℃过夜培养。用超声破碎仪将所重悬的菌液处理,取上述所得的上清液80 μL,进行SDS-PAGE分析其是否有所需目的蛋白。
1.3.2 优化表达系统条件
挑取重组菌BL单菌落于含有Amp的LB液体培养基中,37 ℃培养8 h。将所取得的菌液按1%接种量接种到含Amp的LB液体培养基中,37 ℃,200 r/min培养2~3 h,当OD600值处于0.4~0.6时,加入终浓度为0.5 mmol/L的IPTG,37 ℃诱导培养,在第0、1、2、3、4、5、6、8、10 h分别吸取1 mL菌液,通过SDS-PAGE观察蛋白表达量,确定最佳诱导时间。
将所取得的菌液按1%接种量分别接种到含Amp的LB、TB、SOB、TSB液体培养基内,37 ℃,200 r/min培养2~3 h,当OD600值处于0.4~0.6之间时,以终浓度为0.5 mmol/L的IPTG诱导5 h,吸取1 mL培养的菌液。通过SDS-PAGE观察蛋白表达量,从而确定表达所用的最佳培养基。
将重组菌BL按上述方法培养后,将其分装到5个试管内,分别用终浓度0、0.1、0.25、0.5、0.75 mmol/L IPTG进行诱导表达,37 ℃作用5 h,吸取1 mL培养的菌液。通过SDS-PAGE观察蛋白表达量,从而确定最佳IPTG诱导浓度。
1.4 疫苗的配比与免疫
CRM197-4GnRH+Bis-01组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,取50 mL抗原溶液加入至50 mL高压灭菌的Bis-01佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+02 VG组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,取50 mL抗原溶液加入至50 mL 高压灭菌的Montanide ISA 02 VG佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+Sim-01组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,取50 mL抗原溶液加入至50 mL 高压灭菌的Sim-01佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+206 VG组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,取50 mL抗原溶液加入至50 mL 高压灭菌的Montanide ISA 206 VG佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+A8+02 VG组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,将A8和Montanide ISA 02 VG按1∶1比例配制组合佐剂,取50 mL抗原溶液加入至50 mL 高压灭菌的组合佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+BCG+02 VG组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,将BCG和Montanide ISA 02 VG按1∶1比例配制组合佐剂,取50 mL抗原溶液加入至50 mL 高压灭菌的组合佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+BCG+1313 VG组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,将BCG和Montanide IMS 1313 VG按1∶1比例配制组合佐剂,取50 mL抗原溶液加入至50 mL 高压灭菌的组合佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
CRM197-4GnRH+61 VG组疫苗的制备:称取10.0 mg CRM197-4GnRH,溶于90 mL的PBS中,除菌过滤,取50 mL抗原溶液加入至50 mL 高压灭菌的Montanide ISA 61 VG佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
G1+61 VG组疫苗的制备:称取10.0 mg多肽抗原G1,溶于90 mL的PBS中,除菌过滤,取50 mL抗原溶液加入至50 mL 高压灭菌的Montanide ISA 61 VG佐剂中,充分乳化,疫苗检验合格后分装于西林瓶中,浓度为50 μg/mL。
1.5 抗体有效性的效果分析
将动物分为空白对照(A组)、CRM197-4GnRH+Bis-01(B组)、CRM197-4GnRH+02 VG(C组)、CRM197-4GnRH+Sim-01(D组)、CRM197-4GnRH+206 VG(E组)、CRM197-4GnRH+A8+02 VG(F组)、CRM197-4GnRH+BCG+02 VG(G组)、CRM197-4GnRH+BCG+1313 VG(H组)、CRM197-4GnRH+61 VG(I组)和G1+61 VG(J组)共10组。在大鼠第13周龄之时进行首免,间隔两周后加强注射1次,每次免疫剂量为50 μg/只,注射体积为1 mL/只;其中空白对照用等体积的PBS进行注射。于第13周龄首免前,眼眶取血法采血0.75 mL,从首免开始每隔两周采血1次直至第31周龄试验结束。将采集的血样首先置于室温条件下0.5 h,之后放置于4 ℃保存过夜,3 500 r/min离心10 min后,将所得血清置于-20 ℃保存。所有组的免疫注射方式均为背部皮下注射,每组10只。
1.6 统计学分析
把数据输入IBM SPSS Statistics 21统计学软件进行处理,通过方差检验、多重比较分析其显著性与否。
2 结果
2.1 重组CRM197-4GnRH蛋白的纯化
为了构建CRM197-4GnRH重组表达载体,通过将CRM197-4GnRH基因连接到了pMD18-T载体,得到了质粒pMD18-T-CRM197-4GnRH;用EcoRⅠ、XhoⅠ将pMD18-T-CRM197-4GnRH和pET22b(+)载体进行了双酶切,然后通过使用Agarose Gel DNA Purification Kit将目的片段CRM197-4GnRH与酶切后pET22b(+)载体的回收;以片段∶载体=5∶1(摩尔比)将目的片段CRM197-4GnRH与pET22b(+)载体的连接;然后将连接载体通过转化进入了感受态细胞DH5α中,并通过碱裂解法提取了质粒pET22b-CRM197-4GnRH。经过EcoRⅠ和XhoⅠ的双酶切鉴定,结果表明双酶切有一个1 827 bp左右的片段(图1),与目的片段预期大小一致,经过测序表明确为所需目的片段。
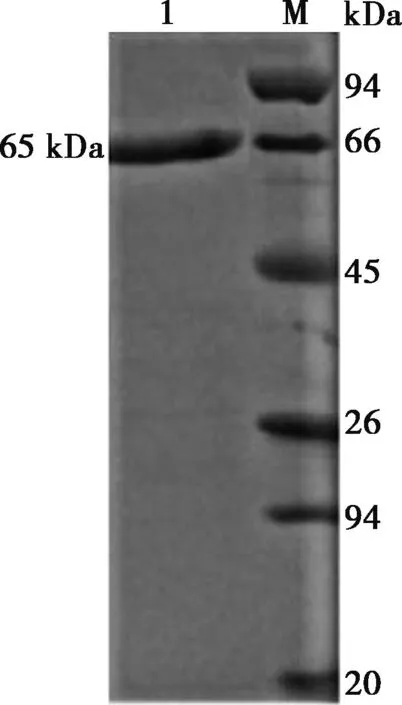
通过挑取重组菌BL及宿主菌BL pET-22b(+)单菌落,加入IPTG诱导其蛋白表达。经表达条件的优化,确定最优的表达条件为:诱导表达时间5 h,培养基为LB液体培养基,IPTG诱导浓度为0.5 mmol/L。经过最优表达条件的诱导,将沉淀物用原培养基1/10体积的无菌PBS重悬,将其进行了超声破碎,经SDS-PAGE分析,发现重组菌表达产物在65 kDa左右有1条明显的条带,与预期结果相符合(图2)。

1. 重组菌菌体蛋白;M. 蛋白Marker;2. 原始菌菌体蛋白对照。
将诱导表达重组菌进行超声裂解,用0.5% TritonX-100洗涤后,用8 mol/L的尿素进行溶解,将溶解后的融合蛋白CRM197-4GnRH过His镍柱,将之前和之后的洗脱液分别用离心管收集,中间5 mL洗脱液所进行的洗脱作为所需目的蛋白。将经洗脱后的样品经SDS-PAGE分析,发现在65 kDa处有明显条带(图3),与预期一致,说明成功表达了融合蛋白。
1. 纯化后的蛋白;M. 蛋白Marker。

M. 蛋白Marker;1. 纯化后的表达蛋白。
Westem blot分析发现,所表达的蛋白可以与大鼠GnRH特异性抗血清发生反应,经显色后发现仅有1条清晰条带(图4),表明所获得的融合蛋白免疫学活性较好。
2.2 CRM197-4GnRH的免疫原性
通过间接ELISA 法测定大鼠免疫后不同时期血清中GnRH抗体水平,发现所有的试验组都有较高的、不同水平的抗体滴度值,免疫组抗体滴度与空白对照组相比较,免疫组大鼠血清抗体滴度均显著升高(P<0.05),说明各疫苗组均产生了免疫应答,与预期一致(图5)。同时,发现不同佐剂免疫组在二免后4周左右达到稳定峰值,大概持续10周维持较高水平,然后呈现缓慢下降趋势。其中水包油包水佐剂组(E组)、油包水佐剂组(I组)、抗原G1油包水佐剂组(J组)免疫去势大鼠GnRH抗体滴度显著高于其他组,但3者内部之间差异不大(P>0.05);此3组自17周龄至27周龄,抗体维持在较高的水平,说明水包油包水佐剂和油包水佐剂可以作为免疫去势疫苗佐剂。

图5 大鼠血清GnRH抗体滴度测定
2.3 免疫大鼠睾酮浓度的测定
通过采用放射免疫法测定大鼠血清中睾酮浓度,以免疫后血清中睾酮浓度<0.1 ng/mL作为疫苗有效与否的判定指标(表1和图6)。结果发现,在第19~31周龄时,免疫组血清睾酮浓度显著低于空白对照组(P<0.05),这说明各免疫组均对免疫去势疫苗产生了免疫应答;其中,水包油包水佐剂组(E组)、油包水佐剂组(I组)、抗原G1油包水佐剂组(J组)在第17~27周龄时血清睾酮浓度低于0.1 ng/mL,其有效率均可达到100%,维持时间持续10周时间,显著低于其他组(P<0.05),但3组之间相比差异不显著(P>0.05)(图6)。

表1 免疫后不同时期有效率统计 %
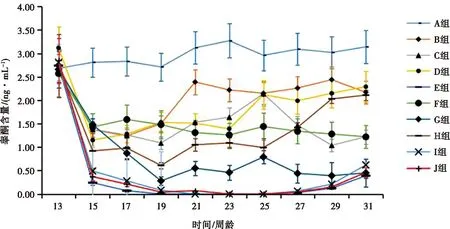
图6 免疫后不同时期对照组和免疫组血清中睾酮浓度
3 讨论
本文通过大肠杆菌表达系统对CRM197-4GnRH抗原进行了表达,采用不同种类佐剂制备疫苗进行大鼠的免疫,研究了其对大鼠的免疫去势作用。自从Stewar发现GnRH之后,朱杰青[11]和Jung等[12]都曾利用大肠杆菌表达系统进行GnRH及其类似物的研究,其中Jung等[12]分别把犬瘟热病毒的p35蛋白作为载体蛋白与GnRH六聚体基因相连接,同时将轮状病毒VP6蛋白作为载体蛋白,将其与6个串联的GnRH基因连接,表达后的产物对犬的免疫去势作用显著,与研究预期一致。本研究中,在预试验阶段尝试了将CRM197蛋白与抗原G1基因进行连接表达,但表达量较低,分析有可能是该质粒的稳定性差或者新型融合蛋白结构受到了空间影响,难以有效表达[13]。这需要在蛋白的空间结构方面进行进一步的研究。
为了降低免疫去势疫苗批次间质控难度,获得生产工艺简单的疫苗产品,对免疫去势抗原分子进行了精确设计,采用白喉毒素突变体CRM197与4拷贝GnRH串联,以基因工程方法进行免疫去势抗原的制备;将CRM197-4GnRH基因与表达载体连接,酶切鉴定得到了1条1 827 bp的片段,与预期一致;优化了大肠杆菌表达条件,优选表达条件为:诱导时间表达5 h、培养基为LB液体培养基、IPTG诱导浓度为0.5 mmol/L;将纯化后的融合蛋白进行SDS-PAGE,发现在65 kDa处有明显条带,与预期一致;融合蛋白经过Western blot鉴定,在65 kDa处出现1条较为清晰的目的条带,表明融合蛋白具有良好的免疫学活性。
根据报道,血清中睾酮浓度<0.1 ng/mL可能是判定疫苗有效与否的指标[14]。本试验中,B组所用佐剂为清华大学所供,为针对新型通路的新型亲油性疫苗佐剂,试验中有效率偏低,不能判定为对雄性大鼠去势免疫增效作用,在该疫苗中其未能达到免疫增效作用,分析其原因可能是该佐剂特异性针对新型特定通路,其免疫机制、激活方式等存在一定的特异性,比如其仅对特定结构或相应受体与之结合,影响抗原产生免疫应答反应。C组为重组疫苗水溶性佐剂组,未能对雄性大鼠去势有免疫增效作用,分析可能是水包油佐剂一般在注射后缓慢形成油包水乳液,可以提供良好的水溶性,便于制备和稳定抗原,免疫应答反应相对温和,其一般针对脂溶性好的抗原或需要更温和的免疫刺激抗原更加适用,这也是常规动物疫苗往往采取油包水佐剂的原因。D组所用佐剂为清华大学所供,是针对于新型通路的新型疫苗佐剂,为亲水性佐剂,其未能对雄性大鼠去势有免疫增效作用,可能是由于新型特定通路的免疫机制、激活方式在不同动物个体中存在差异,或者是其作为水溶性佐剂,在机体内发挥免疫应答反应更加温和,需要更高浓度抗原参与。E组为重组疫苗水包油包水佐剂,该种佐剂有利于疫苗在体内的吸收,不易造成溃烂、鼓包等副作用,17~27周龄期间免疫有效率达到100%,免疫有效期10周以上,在试验过程中发现其更易于乳化,制成的疫苗黏度小,且水包油包水更易于吸收,可以作为备选佐剂配比重组疫苗应用于公猪免疫去势。为了得到更好、更优良的佐剂,通过设计了水包油佐剂、纳米水溶性佐剂,并从清华大学、南京农业大学等取得最新实验室研究的针对于新型通路佐剂,并分别尝试与BCG、A8佐剂等共用,旨在寻找免疫效果好、安全性好、副作用少的市场化佐剂,F、G和H组分别为重组疫苗水溶性佐剂与A8佐剂共用组、重组疫苗水溶性佐剂与BCG共用组和重组疫苗纳米水溶性佐剂与BCG共用组,设计原则旨在既发挥免疫增效功能,又能发挥其亲水特性,降低油性物质对动物产生的鼓包、溃烂等问题,在本研究中,3种配比佐剂结果均不理想,未能对雄性大鼠产生免疫去势增效功能。分析可能是水包油佐剂、油包水佐剂共用在乳化过程中发生相互作用或不相容现象,导致佐剂的结构或功能发生改变,影响其在疫苗中的性能,使得乳化后的疫苗无法提供充分的免疫刺激或抗原的稳定性受损。I组为重组疫苗油包水组,其在17~27周龄期间时对雄性大鼠免疫有效率达100%,有效期可以持续10周以上,可以满足公猪免疫去势有效期时长要求,其原因是油包水佐剂作为常规使用最为广泛的佐剂,在提供强免疫刺激、促进抗原递呈和处理、诱导免疫记忆以及稳定疫苗等方面具有优势。J组作为阳性对照组,为G1多肽抗原(GnRH+Th抗原表位)油包水组,17~27周龄期间免疫有效率达到100%,至29周龄时降至90%,是目前针对公猪免疫去势研究最多的疫苗制备方法,但其往往容易对动物接种区域造成鼓包、溃烂等副作用,甚至引起动物死亡。总体来说,E组、I组作为重组GnRH疫苗,可以有效对雄性大鼠进行去势,可以作为潜在的公猪用免疫去势基因工程疫苗。
综上,本研究在大鼠体内考察了重组去势疫苗CRM197-4GnRH的免疫去势效果,将融合蛋白分别与不同佐剂乳化,制备了CRM197-4GnRH+Bis-01疫苗、CRM197-4GnRH+02 VG疫苗、CRM197-4GnRH+Sim-01疫苗、CRM197-4GnRH+206 VG疫苗、CRM197-4GnRH+A8+02 VG疫苗、CRM197-4GnRH+BCG+02 VG疫苗、CRM197-4GnRH+BCG+1313 VG疫苗、CRM197-4GnRH+61 VG疫苗和G1+61 VG疫苗,测定了免疫后大鼠体内GnRH抗体滴度和睾酮水平,发现水包油包水佐剂组CRM197-4GnRH+206 VG、油包水佐剂组CRM197-4GnRH+61 VG疫苗和油包水佐剂组G1+61 VG疫苗可以显著提升大鼠体内GnRH抗体滴度,并抑制大鼠体内睾酮水平,显著优于其他组。通过重组去势疫苗对大鼠免疫作用的研究,为GnRH免疫去势基因工程疫苗的进一步开发奠定了基础。

