细胞糖酵解对猪流行性腹泻病毒复制的影响
吴冰,季霖,徐雅雯,唐泰山,杨龙圣,何召庆,范红结,蔺辉星*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 南京海关动植物与食品检测中心,江苏 南京 210019;3. 兆丰华生物科技(南京)有限公司,江苏 南京 211102)
猪流行性腹泻(PED)是一种急性肠道传染病,主要表现为急性水样腹泻、呕吐和死亡,对新生仔猪的致死率较高[1-3]。其病原猪流行性腹泻病毒(PEDV)是单股正链RNA病毒,属于套式病毒目冠状病毒科α冠状病毒属[4]。病毒属胞内寄生物,依靠宿主细胞代谢来完成其复制。病毒感染可诱导宿主细胞代谢途径发生显著的变化,主要包括中心碳代谢、脂肪酸合成和谷氨酰胺分解代谢等[5]。尽管病毒诱导的细胞代谢变化在某种程度上存在相似之处,但每种病毒可能需要其独特的代谢变化才能完成其生命周期[5]。例如,甲型流感病毒H1N1、登革热病毒(DENV)、诺如病毒(NV)和卡波西肉瘤疱疹病毒(KSHV)主要诱导糖酵解变化[6-9];而丙型肝炎病毒(HCV)和痘苗病毒(VACV)主要激活谷氨酰胺分解代谢变化[8,10]。据报道,某些冠状病毒如新型冠状病毒(SARS-CoV-2)可通过增强宿主细胞的糖酵解来促进自身复制[11-12],但PEDV感染对细胞代谢的影响则报道较少。本研究拟检测PEDV感染对细胞糖酵解的影响,并验证糖酵解变化对PEDV复制的影响,研究结果将有助于阐明PEDV的感染机制,并为冠状病毒病的综合防控提供参考。
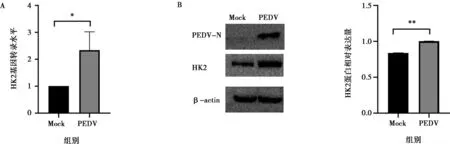
A. HK2基因转录水平;B. HK2蛋白表达水平;Mock为未感染IPEC-J2细胞样品;* P<0.05,** P<0.01,下同。
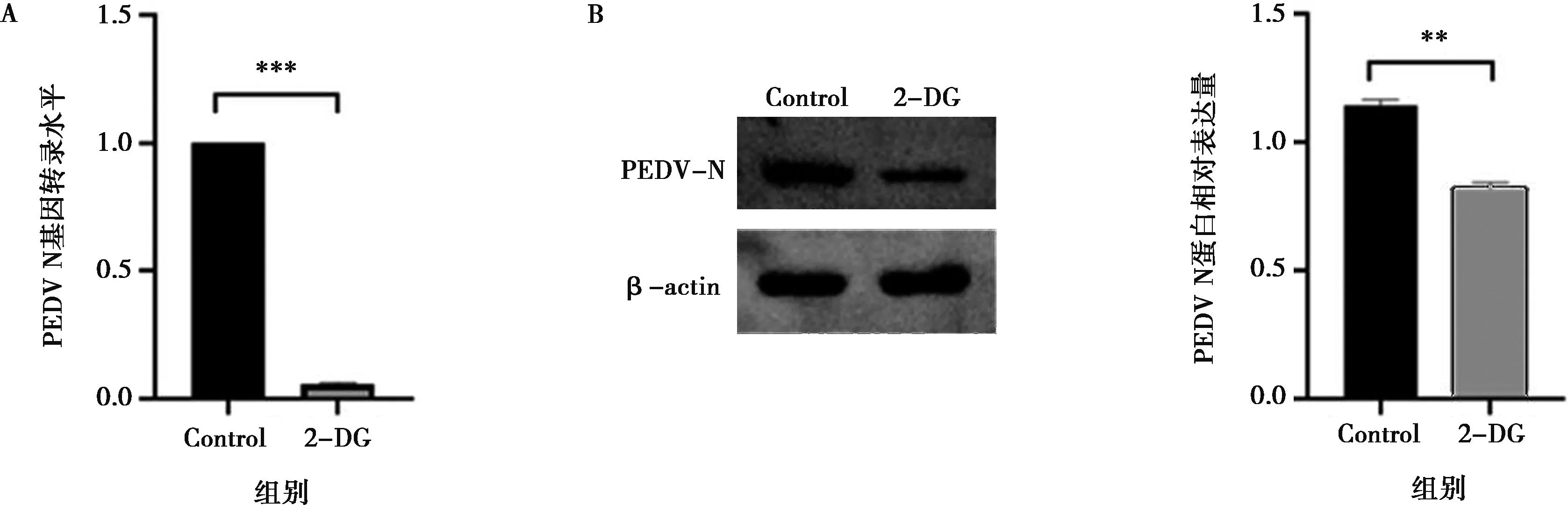
A.PEDV N基因转录水平;B.PEDV N蛋白表达水平;Control为PEDV感染IPEC-J2细胞36 h后收取的细胞样品;***P<0.001。
1 材料与方法
1.1 材料
猪小肠上皮细胞IPEC-J2和PEDV流行毒株YC2014[13](GenBank:KU252649.1)均由本实验室保存。PEDV N蛋白单克隆抗体由本实验室制备并保存,糖酵解抑制剂2-脱氧-D-葡萄糖(2-DG)购自美国MCE公司,DMEM/F-12培养基及胎牛血清购自美国Gibco公司,RIPA裂解液、蛋白酶抑制剂PMSF购自上海碧云天生物技术有限公司,己糖激酶2(HK2)抗体购自武汉爱博泰克生物科技有限公司,鼠抗β-actin单克隆抗体购自北京全式金生物技术有限公司。
1.2 PEDV感染后细胞糖酵解的变化
1.2.1 病毒的细胞感染
IPEC-J2细胞在12孔板中培养约24 h长成单层细胞,以感染复数(MOI)为1将PEDV YC2014毒株感染细胞,孵育1 h后弃去病毒液并加入维持液。
1.2.2 实时荧光定量PCR(qPCR)
PEDV感染IPEC-J2细胞后36 h将细胞板置于超低温冰箱,反复冻融3次,收取细胞裂解液。用TRIzol法提取细胞裂解液总RNA,然后用试剂盒将其反转录为cDNA。将cDNA稀释至合适浓度后作为模板,qPCR检测糖酵解关键酶HK2基因的mRNA量,以β-actin为内参基因。qPCR反应条件:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火延伸30 s,共计40个循环。每个样本设3个重复。qPCR所用引物见表1。
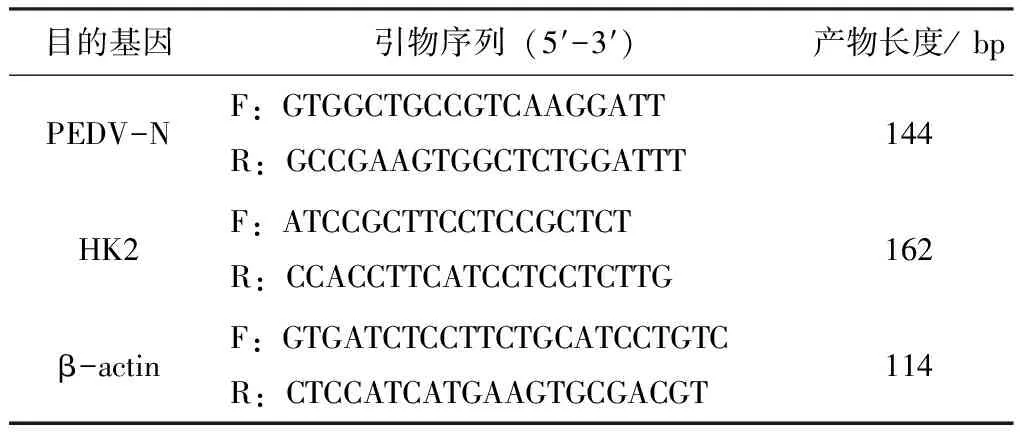
表1 引物信息
1.2.3 Western blot分析
PEDV感染IPEC-J2细胞后36 h,细胞用PBS清洗3次,每孔加入100 μL蛋白裂解液,冰上作用15 min充分裂解细胞。将细胞样品刮下并收集到1.5 mL离心管中,在4 ℃ 12 000 r/min 离心后吸取上清液,使用BCA法测定蛋白浓度。蛋白经SDS-PAGE后转印至PVDF膜。转印后,用5%脱脂乳封闭2 h,PBST清洗3次。将PVDF膜分别置于脱脂乳稀释的PEDV N抗体、HK2抗体中4 ℃过夜进行孵育。然后PBST清洗3次,将PVDF膜分别置于羊抗鼠IgG-HRP或羊抗兔IgG-HRP中,室温孵育1 h,PBST清洗3次后加入ECL显色液,用化学发光成像仪进行拍照。
1.3 糖酵解抑制剂对病毒复制的影响
为了研究糖酵解对PEDV复制的影响,本试验检测了糖酵解抑制剂2-DG对PEDV复制的影响。IPEC-J2细胞在12孔板中培养24 h,加入含有10 μmol/L 2-DG的培养基,预处理2 h后弃去培养基,以MOI为1将PEDV YC2014毒株感染细胞,孵育1 h后弃去病毒液,然后加入含有10 μmol/L 2-DG的维持液。在感染后36 h收取样品,通过qPCR以及Western blot检测病毒复制的变化。
1.4 不同葡萄糖浓度对病毒复制的影响
为探究葡萄糖浓度适度升高是否有利于PEDV的复制,本试验检测了正常浓度(5.5 mmol/L)和高浓度(11.1 mmol/L和22.2 mmol/L)葡萄糖条件下PEDV复制的情况。IPEC-J2细胞在12孔板中培养24 h,以MOI为1将PEDV YC2014毒株感染细胞,孵育1 h后弃去病毒液并加入含有正常浓度和高浓度葡萄糖的维持液进行培养。于感染后36 h收取样品,通过qPCR以及Western blot检测病毒复制变化。
1.5 统计分析
使用GraphPad Prism 8.0分析所有数据。组间的差异如下所示:P<0.05表示差异显著,P<0.01和P<0.001表示差异极显著。
2 结果
2.1 PEDV感染增强IPEC-J2细胞糖酵解
实验室前期的非靶向代谢组学数据显示,与对照组IPEC-J2细胞样品相比,PEDV感染的IPEC-J2细胞中糖酵解产物乳酸的含量显著增加,并且通过乳酸含量检测试剂盒验证了该结果。为了确定PEDV感染后IPEC-J2细胞中糖酵解的变化,收取PEDV感染后36 h的IPEC-J2细胞样品,通过qPCR检测了HK2的转录水平。结果如图1A显示,与对照组IPEC-J2细胞样品相比,PEDV感染显著增强了HK2的转录(P<0.05)。通过Western blot分析PEDV感染组和对照组的糖酵解限速酶HK2的表达,结果如图1B所示,与对照组IPEC-J2细胞样品相比,PEDV感染显著增加HK2的表达(P<0.01),表明PEDV感染增强了IPEC-J2细胞的糖酵解。
2.2 糖酵解抑制剂对PEDV复制的影响
本研究进一步检测了使用糖酵解抑制剂来抑制糖酵解是否会对PEDV的复制产生影响。己糖激酶是糖酵解途径中的关键酶,2-DG是一种葡萄糖类似物,可竞争性抑制己糖激酶以抑制糖酵解。使用qPCR检测对照组与2-DG处理组PEDV N基因的转录水平,结果如图2A所示,与对照组PEDV感染的IPEC-J2细胞相比,2-DG处理显著抑制了PEDV N基因的转录(P<0.001)。使用Western blot检测对照组和2-DG处理组的PEDV N蛋白表达水平,结果如图2B所示,与对照组PEDV感染的IPEC-J2细胞相比,2-DG处理显著降低了PEDV N蛋白的表达水平(P<0.01),即PEDV复制受到了抑制。上述结果表明,糖酵解是PEDV复制过程中所需的关键代谢途径之一。
2.3 不同葡萄糖浓度对PEDV复制的影响
由于前期研究发现PEDV感染会导致培养基中葡萄糖消耗增加,本试验探究了在细胞维持液中适度增加葡萄糖浓度是否可促进PEDV的复制。在病毒感染后使用含有正常浓度(5.5 mmol/L)和高浓度(11.1 mmol/L和22.2 mmol/L)葡萄糖的维持液进行培养,36 h后提取细胞蛋白进行Western blot检测,结果如图3所示,高浓度葡萄糖条件下病毒复制显著增加。
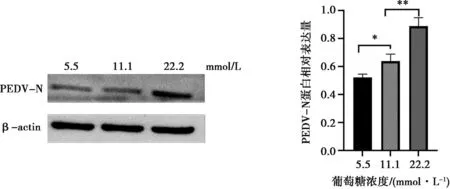
图3 不同葡萄糖浓度对PEDV复制的影响
3 讨论
病毒需要依赖细胞代谢来为病毒复制提供能量和生物大分子。许多病毒可增强细胞糖酵解,如人巨细胞病毒(HCMV)和SARS-CoV-2感染可激活细胞糖酵解,而抑制细胞糖酵解可抑制HCMV和SARS-CoV-2的复制[11,14-16]。糖酵解可促进细胞脂质的生物合成,从而促进病毒的复制[17]。DENV感染可激活糖酵解促进脂质的生物合成[18]。HCMV通过糖酵解为脂肪酸合酶(FAS)的生物合成提供原料[19-20]。本实验室在前期的代谢组学研究中发现,PEDV感染IPEC-J2细胞后36 h,细胞中乳酸的量显著升高。由于乳酸是细胞糖酵解的产物,乳酸浓度的升高可反映细胞糖酵解的增强。HK2是糖酵解过程中的第一个限速酶,是糖酵解的关键代谢酶之一[21-22]。本研究结果表明,PEDV感染导致HK2表达水平的升高,而抑制细胞糖酵解后,PEDV的复制也受到了抑制。可见,适度抑制细胞糖酵解有利于防控PEDV感染。
病毒感染对细胞糖酵解的调控机制各不相同。腺病毒通过其E4ORF1蛋白与上皮细胞中的转录因子Myc结合,激活糖酵解相关基因,使糖酵解相关酶的表达量升高,最终使糖酵解增强[23]。甲病毒可通过其非结构蛋白3(Nsp3)中的YXXM基序激活PI3K/AKT信号通路,从而增强细胞糖酵解[24]。SARS-CoV-2的非结构蛋白6(Nsp6)与宿主细胞中的MGA/MAX复合物相互作用从而介导糖酵解的增强[25]。PEDV感染通过何种途径来增强宿主细胞的糖酵解有待进一步研究。

