猪源和犬源ELF4蛋白的亚细胞定位比较研究
高翠翠,喻娇,唐青海*,侯鑫军,刘婷,全飞杨,刘建行,赵婷芳,赵铖,朱钰英,危艳武*
(1. 衡阳师范学院生命科学学院/南岳山区生物资源保护与利用湖南省重点实验室,湖南 衡阳 421008;2. 中国农业科学院哈尔滨兽医研究所/兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
E26转录因子(E26 transformation specific,ETS)家族分子是多细胞生物的一类转录因子,参与发育和分化等多个关键生物学过程[1]。E74 样因子4(E74-like factor 4,ELF4)是ETS家族的重要一员,该蛋白由N端激活区域、与DNA共识序列结合的ETS区域和富含丝氨酸、苏氨酸和脯氨酸的区域组成。人ELF4(hELF4)参与细胞多种生理或病理的过程,如肿瘤发生[2]、DNA损伤修复[3]、天然免疫[4]、细胞周期调控[5]和成骨分化[6]等。研究表明,hELF4高表达可促进人胰岛素瘤细胞增殖[7],然而在急性髓性白血病中,hELF4则是作为一个抑癌基因起作用[8]。hELF4对胃癌细胞的增殖和侵袭有正向调节作用[9],肿瘤来源的外泌体通过传递LINC01091调控microRNA-128-3p/ELF4/CDX2轴促进胃癌的生长和转移[10]。此外,hELF4在免疫调节中起着重要作用。You等[11]首次发现hELF4是一种Ⅰ型干扰素(IFNs)转录因子,并通过直接调节Ⅰ型IFNs反应来抑制病毒的复制。hELF4功能突变缺失导致人类自身炎症和免疫缺陷疾病[12]。肠道hELF4是维持肠道内稳态、减轻酒精诱导的肝脏脂肪变性和损伤的重要宿主保护因子[13]。hELF4蛋白功能区研究比较透彻,定位在细胞核中,与其作为转录因子的功能关联密切[14]。

A. cELF4基因截短示意图;B. sELF4基因截短示意图。图中数字表示片段长度,单位为bp。
目前尚无猪E74样因子4(sELF4)和犬E74样因子4(cELF4)的亚细胞定位比较研究的报道。本课题组成员前期成功克隆了sELF4基因,并制备了免疫活性和特异性良好的鸡抗sELF4多克隆抗体[15],克隆cELF4基因,体外表达重组cELF4蛋白并制备了相应的抗体[16]。为揭示sELF4和cELF4蛋白的亚细胞定位特征,阐明二者亚细胞定位的异同,本研究采用PCR截短扩增基因片段、以绿色荧光蛋白(GFP)为报告基因,构建真核表达载体,转染细胞,观察细胞定位,研究结果将为进一步探究sELF4 和cELF4功能奠定基础。
1 材料与方法
1.1 材料
感受态细胞Top 10购自天根生化科技(北京)有限公司;KOD FX Neo高保真酶购自东洋纺(上海)生物科技有限公司;Ligation Mix、内切酶以及XfectTM转染试剂均购自宝日医生物技术(北京)有限公司;Hoechst 33342购于Abbkine Scientific公司;DMEM和胎牛血清培养基购自Gibico公司;含sELF4基因全长质粒pMD19T-sELF4、含cELF4基因全长质粒pMD19T-cELF4 以及宫颈癌细胞HeLa由南岳山区生物资源保护与利用湖南省重点实验室构建或保存。
1.2 方法
1.2.1 引物的设计
根据本课题组前期已经测定的cELF4基因序列(GenBank No. MZ198105)、sELF4基因序列(GenBank No. KU097322),用Primer Premier 5.0软件分别设计cELF4和sELF4基因全长PCR扩增引物和截短扩增引物,各片段相对位置如图1所示,引物由深圳华大基因股份有限公司合成,引物序列信息见表1和表2。

表1 cELF4引物信息

表2 sELF4引物信息
1.2.2 sELF4和cELF4基因的PCR扩增与重组真核表达载体的构建
以pMD19T-cELF4 或pMD19T-sELF4载体为模板,利用KOD FX Neo高保真酶进行cELF4和sELF4截短序列的PCR扩增。PCR反应体系为:DNA模板2 μL、KOD FX Neo 1 μL、2× PCR Buffer for KOD FX Neo 25 μL,2 mmol/L dNTPs 10 μL,上下游引物各1 μL,灭菌去离子水10 μL。PCR反应程序为:95 ℃ 5 min;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 2 min,35个循环;69 ℃ 7 min;4 ℃保存。PCR产物经1.2%琼脂糖凝胶电泳检测后,进行双酶切,与荧光蛋白报告载体pEGFP-C1连接、转化Top 10感受态细胞,阳性克隆采用双酶切和序列测定进行鉴定。
1.2.3 重组质粒的转染、染色与亚细胞定位的观察
将长满单层的HeLa细胞经胰蛋白酶消化、以适当密度接种96 孔板内,采用含10%胎牛血清的DMEM培养基在37 ℃、5% CO2条件下培养24 h;采用XfectTM转染试剂将重组真核表达质粒转染HeLa细胞。转染后48 h,弃培养基,0.85%的生理盐水洗涤1次,加入Hoechst 33342染液、室温孵育15 min,弃染液、用0.85%的生理盐水洗涤3次,荧光倒置显微镜下观察荧光蛋白细胞定位,绿色荧光显示为目的蛋白,蓝色荧光为细胞核。
1.2.4 sELF4和cELF4基因的序列比较分析
利用DNAStar 7.0 对cELF4和sELF4蛋白的氨基酸序列进行对比分析。
2 结果
2.1 sELF4和cELF4基因截短片段的真核表达载体的构建
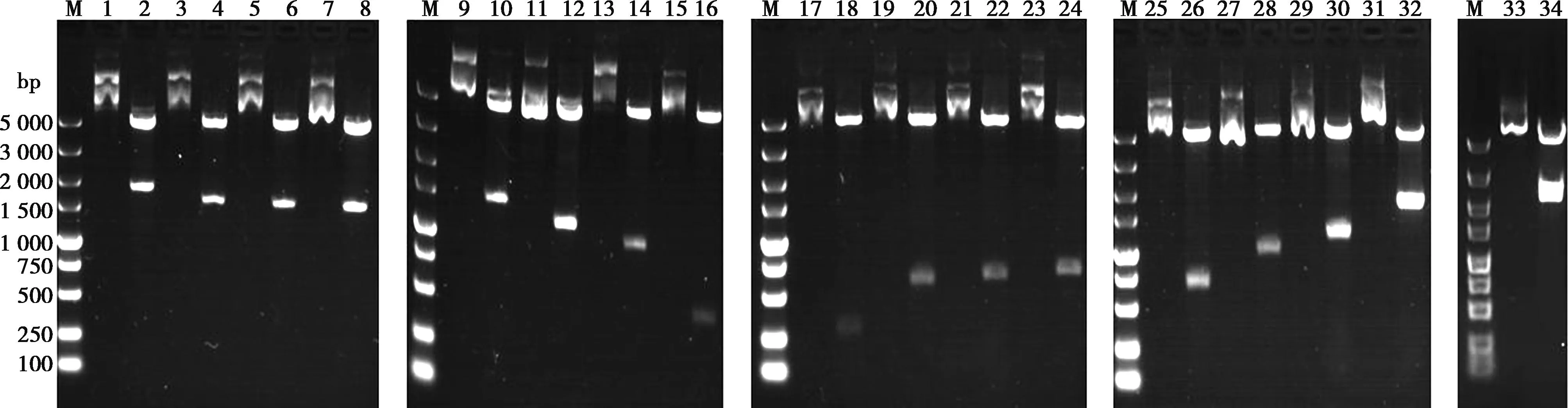
经PCR扩增,得到cELF4基因的13个分子量分别为1 992、1 734、1 476、1 443、1 386、1 119、441、258、516、549、606、873和1 551 bp的核酸片段(图2);克隆至pEGFP-C1载体中构建13个重组真核表达质粒,双酶切鉴定结果显示,13个真核质粒均为阳性(图3)。经PCR扩增得到sELF4基因的17个片段,分子量分别为1 989、1 731、1 473、1 440、1 404、1 383、1 116、948、438、258、516、549、585、606、873、1 041和1 551 bp(图4);克隆至pEGFP-C1载体中构建17个重组真核表达质粒,经双酶切鉴定均为阳性(图5)。

M. DL2000 Marker;1~13. 分别为cELF4-1-1992、cELF4-259-1992、cELF4-517-1992、cELF4-550-1992、cELF4-607-1992、cELF4-874-1992、cELF4-1552-1992、cELF4-1-258、cELF4-1-516、cELF4-1-549、cELF4-1-606、cELF4-1-873和cELF4-1-1551的PCR产物。

M. DL5000 Marker;1. 重组质粒pEGFP-C1-cELF4-1-1992的双酶切产物;2. 重组质粒pEGFP-C1-cELF4-1-1992;3. 重组质粒pEGFP-C1-cELF4-259-1992的双酶切产物;4. 重组质粒pEGFP-C1-cELF4-259-1992;5. 重组质粒pEGFP-C1-cELF4-517-1992的双酶切产物;6. 重组质粒pEGFP-C1-cELF4-517-1992;7. 重组质粒pEGFP-C1-cELF4-550-1992的双酶切产物;8. 重组质粒pEGFP-C1-cELF4-550-1992;9. 重组质粒pEGFP-C1-cELF4-607-1992的双酶切产物;10. 重组质粒pEGFP-C1-cELF4-607-1992;11. 重组质粒pEGFP-C1-cELF4-874-1992的双酶切产物;12. 重组质粒pEGFP-C1-cELF4-874-1992;13. 重组质粒pEGFP-C1-cELF4-1552-1992的双酶切产物;14. 重组质粒pEGFP-C1-cELF4-1552-1992;15. 重组质粒pEGFP-C1-cELF4-1-258的双酶切产物;16. 重组质粒pEGFP-C1-cELF4-1-258;17. 重组质粒pEGFP-C1-cELF4-1-516的双酶切产物;18. 重组质粒pEGFP-C1-cELF4-1-516;19. 重组质粒pEGFP-C1-cELF4-1-549的双酶切产物;20. 重组质粒pEGFP-C1-cELF4-1-549;21. 重组质粒pEGFP-C1-cELF4-1-606的双酶切产物;22. 重组质粒pEGFP-C1-cELF4-1-606;23. 重组质粒pEGFP-C1-cELF4-1-873的双酶切产物;24. 重组质粒pEGFP-C1-cELF4-1-873;25. 重组质粒pEGFP-C1-cELF4-1-1551的双酶切产物;26. 重组质粒pEGFP-C1-cELF4-1-1551。
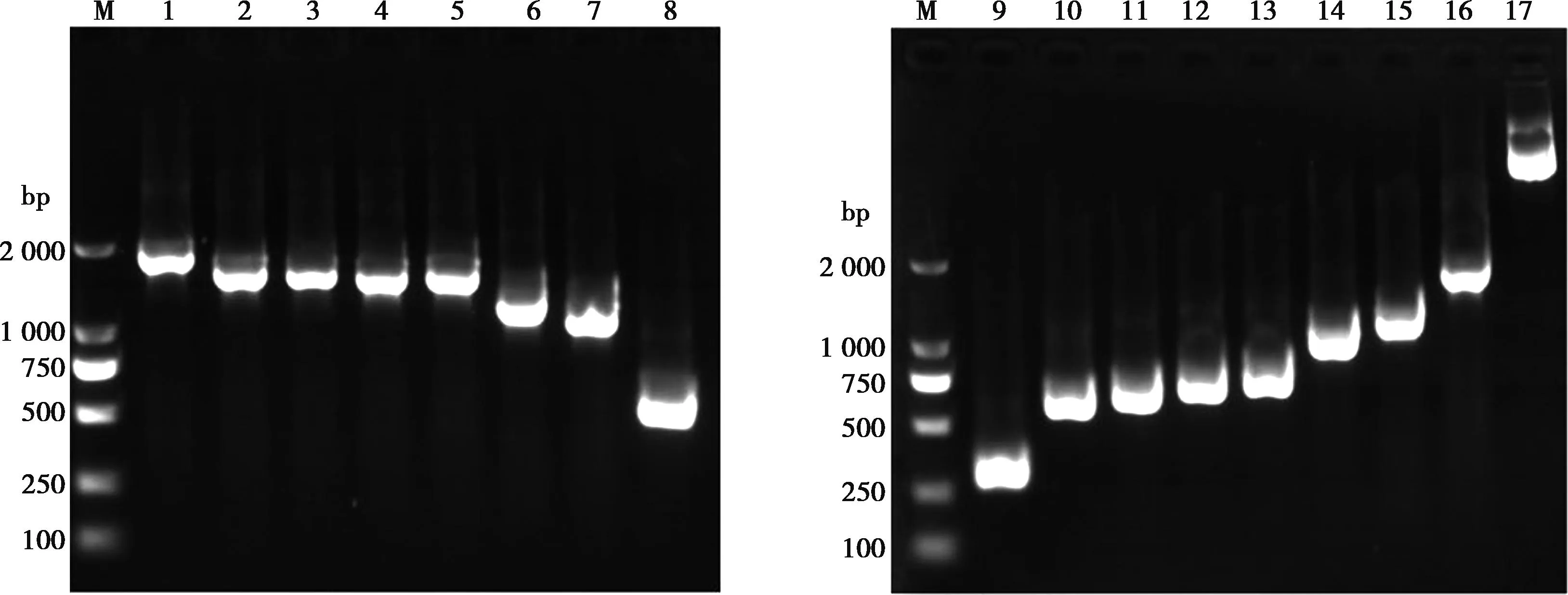
M. DL2000 Marker;1~16. 分别为sELF4-259-1989、sELF4-517-1989、sELF4-550-1989、sELF4-586-1989、sELF4-607-1989、sELF4-874-1989、sELF4-1042-1989、sELF4-1552-1989、sELF4-1-258、sELF4-1-516、sELF4-1-549、sELF4-1-585、sELF4-1-606、sELF4-1-873、sELF4-1-1041和sELF4-1-1551的PCR产物;17. pEGFP-C1-sELE4-1-1989质粒。
M. DL5000 Marker;1. 重组质粒pEGFP-C1-sELF4-259-1989;2. 重组质粒pEGFP-C1-sELF4-259-1989的双酶切产物;3. 重组质粒pEGFP-C1-sELF4-517-1989;4. 重组质粒pEGFP-C1-sELF4-517-1989的双酶切产物;5. 重组质粒pEGFP-C1-sELF4-550-1989;6. 重组质粒pEGFP-C1-sELF4-550-1989的双酶切产物;7. 重组质粒pEGFP-C1-sELF4-586-1989;8. 重组质粒pEGFP-C1-sELF4-586-1989的双酶切产物;9. 重组质粒pEGFP-C1-sELF4-607-1989;10. 重组质粒pEGFP-C1-sELF4-607-1989的双酶切产物;11. 重组质粒pEGFP-C1-sELF4-874-1989;12. 重组质粒pEGFP-C1-sELF4-874-1989的双酶切产物;13. 重组质粒pEGFP-C1-sELF4-1042-1989;14. 重组质粒pEGFP-C1-sELF4-1042-1989的双酶切产物;15. 重组质粒pEGFP-C1-sELF4-1552-1989;16. 重组质粒pEGFP-C1-sELF4-1552-1989的双酶切产物;17. 重组质粒pEGFP-C1-sELF4-1-258;18. 重组质粒pEGFP-C1-sELF4-1-258的双酶切产物;19. 重组质粒pEGFP-C1-sELF4-1-516;20. 重组质粒pEGFP-C1-sELF4-1-516的双酶切产物;21. 重组质粒pEGFP-C1-sELF4-1-549;22. 重组质粒pEGFP-C1-sELF4-1-549的双酶切产物;23. 重组质粒pEGFP-C1-sELF4-1-585;24. 重组质粒pEGFP-C1-sELF4-1-585的双酶切产物;25. 重组质粒pEGFP-C1-sELF4-1-606;26. 重组质粒pEGFP-C1-sELF4-1-606的双酶切产物;27. 重组质粒pEGFP-C1-sELF4-1-873;28. 重组质粒pEGFP-C1-sELF4-1-873的双酶切产物;29. 重组质粒pEGFP-C1-sELF4-1-1041;30. 重组质粒pEGFP-C1-sELF4-1-1041的双酶切产物;31. 重组质粒pEGFP-C1-sELF4-1-1551;32. 重组质粒pEGFP-C1-sELF4-1-1551的双酶切产物;33. 重组质粒pEGFP-C1-sELF4-1-1989;34. 重组质粒pEGFP-C1-sELF4-1-1989的双酶切产物。
2.2 sELF4和cELF4的亚细胞定位
亚细胞定位结果显示,cELF4的1~86 aa(1~258 bp)、292~663 aa(874~1 992 bp)、518~663 aa(1 552~1 992 bp)荧光分布在整个细胞;1~172 aa(1~516 bp)、1~183 aa(1~549 bp)、1~202 aa(1~606 bp)荧光分布在细胞质中;1~291 aa(1~873 bp)、1~517 aa(1~1 551 bp)、1~663 aa(1~1 992 bp)、87~663 aa(259~1 992 bp)、173~663 aa(517~1 992 bp)、184~663 aa(550~1 992 bp)、203~663 aa(607~1 992 bp)荧光分布在细胞核中,1~291 aa(1~873 bp)、203~663 aa(607~1 992 bp)均定位在细胞核,cELF4的核定位信号肽分布在203~291 aa,292~663 aa (874~1 992 bp)定位在细胞质和细胞核中均有分布,且荧光蛋白发生凝聚现象(如图6)。

图6 cELF4不同截短片段与EGFP融合表达的亚细胞定位观察(标尺=100 μm)
sELF4的1~86 aa(1~258 bp)、1~202 aa(1~606 bp)、292~662 aa(874~1 989 bp)、348~662 aa(1 042~1 989 bp)、518~662 aa(1 552~1 989 bp)荧光分布在整个细胞,1~172 aa(1~516 bp)、1~183 aa(1~549 bp)、1~195 aa(1~585 bp)荧光分布在细胞质中,1~291 aa(1~873 bp)、1~347 aa(1~1 041 bp)、1~517 aa(1~1 551 bp)、1~662 aa(1~1 989 bp)、87~662 aa(259~1 989 bp)、173~662 aa(517~1 989 bp)、184~662 aa(550~1 989 bp)、196~662 aa(586~1 989 bp)、203~662 aa(607~1 989 bp)荧光分布在细胞核中,1~291 aa(1~873 bp)、203~662 aa(607~1 989 bp)均定位在细胞核,sELF4的核定位信号肽分布也在203~291 aa(607~873 bp)(如图7)。

图7 sELF4不同截短片段与EGFP融合表达的亚细胞定位观察(标尺=100 μm)
通过对比发现,sELF4的1~202 aa(1~606 bp)分布在整个细胞中,在sELF4-585-606之间还存在一段不完全的定位信号肽,在sELF4 196~291 aa(586~873 bp)之间有可能存在两个核定位信号肽。cELF4 1~202 aa(1~606 bp)仅仅分布在细胞质中,在cELF4 516~606 aa之间还存在一段细胞质信号肽。 sELF4 292~662 aa和cELF4 292~663 aa在细胞质和细胞核中均有分布,且部分荧光蛋白发生凝聚现象。
2.3 sELF4和cELF4基因序列比较分析
氨基酸序列对比分析结果显示(图8),cELF4蛋白和sELF4蛋白的氨基酸序列中第169~303 aa序列完全一致,说明该区段十分保守。第 320~400 aa序列中差异位点相对较多,共有20个变异位点;cELF4在第357 aa缺失H,在第70~160 aa共有13个差异位点,sELF4在第116、117位缺失S和A。

红色背景区代表氨基酸差异区域;无背景色区表示氨基酸保守区域。
3 讨论
hELF4是近年来新发现的一个在肿瘤发生、发展及肿瘤免疫中至关重要的癌基因[2]。研究表明,hELF4参与细胞周期的调节[5],介导成脂成骨细胞的分化[6],参与DNA损伤修复[3]。DNA损伤会破坏代谢稳态并引发炎症反应,Shi等[17]研究发现,hELF4的敲低增加了4细胞胚胎的DNA损伤,这表明hELF4通过控制基因组完整性进而影响猪的早期胚胎发育。Kosti等[18]的研究结果表明hELF4是miRNA-转录因子网络的关键组成部分,是胶质母细胞瘤受体信号通路和脂质动态的桥梁调节因子。卫国红等[19]研究发现,hELF4能促进胰岛素瘤细胞增殖并抑制细胞凋亡,将其与其他类型肿瘤相比,发现ELF4的功能具有一定的多样性,在不同类型肿瘤中,由于hELF4定位在细胞质或细胞核中而发挥功能的差异性,可能激活不同的信号转导通路,而其原因可能是在细胞内相互结合的关键蛋白因子不同。HeLa细胞是一种宫颈癌细胞,具有无限增殖潜能,且繁殖速度快、可连续传代,被广泛应用于肿瘤研究、细胞培养以及生物学试验等。由于其稳定且增殖活性好、外源基因的蛋白表达量高、便于蛋白质的亚细胞定位观察,常用于各类蛋白质定位研究的模式细胞[19]。
本研究以GFP为报告基因,将重组质粒转染HeLa细胞,观察目的蛋白的亚细胞定位,确定了sELF4全长蛋白和cELF4全长蛋白均定位在细胞核中,这与人ELF4蛋白定位一致。cELF4和sELF4的核定位信号分布在203~291 aa(607~873 bp),而人ELF4包含两个核定位信号分别位于173~183 aa和196~202 aa[14],这说明不同种属来源的ELF4蛋白的核定位信号肽分布有差异。一般来说,信号肽大概为16~26个氨基酸,而本研究发现信号肽分布在203~291 aa,推测cELF4和sELF4可能存在多个核定位信号;cELF4和sELF4的亚细胞定位存在差异,在cELF4-516-606之间还存在1段细胞质信号肽,而sELF4-516-585之间存在1段细胞质信号肽。此外,发现去除了N端核定位信号肽的sELF4 292~662 aa和cELF4 292~663 aa在细胞质和细胞核中均有分布,且部分荧光蛋白发生凝聚现象,而这一现象在全长蛋白的表达中并未观察到,推测这种现象可能与蛋白质翻译后折叠、修饰或亲水性发生改变有关。Hamdan等[20]研究发现,内质网应激会导致胞质蛋白稳态缺陷和蛋白质聚集体的形成。蛋白质构象异常或折叠错误可导致其结合成更大的、不可溶的结构,蛋白质发生聚集[21],这与应激或衰老条件下的翻译错误、突变或缺乏寡聚组装伴侣有关[22]。Jamar等[23]研究结果发现,在缺乏无义介导的mRNA降解、翻译停滞降解和无终止降解的突变体中,mRNA监测途径的缺失会导致蛋白质聚集增加。喻娇等[16]研究发现cELF4基因(GenBank No. MZ198105)与sELF4基因(GenBank No.KU097322)的氨基酸相似性为91.8%。本研究利用DNAStar 7.0 软件对cELF4基因编码的氨基酸序列与sELF4基因编码的氨基酸序列进行对比分析,发现二者在某特定区域(169~303 aa)保守性极高,亚细胞定位试验显示cELF4和sELF4的核定位信号均分布在203~291 aa,表明来源于猪和犬的ELF4蛋白核定位信号肽高度保守。
综上所述,本研究明确了cELF4和sELF4基因的信号肽定位序列分布特征,为后续开展基因功能研究提供了依据。

