基于临床-病理-超声特征构建评估乳腺癌新辅助化疗疗效的列线图模型
陈露文,曾慧,雷敏(江西省赣州市肿瘤医院,江西 赣州 341000)
乳腺癌(BC)是发生于女性群体的常见恶性肿瘤疾病,据不完全统计,我国每年新发BC例数已超30万,严重危害我国女性的身体健康[1]。由于BC肿瘤类型和分期较多,且转移和侵袭能力强,导致了BC预后差和死亡率高[2]。临床研究[3]表明,早期乳腺癌临床治愈率高,且5年生存率高达99%,但晚期BC患者5年生存率不足30%。超声应用于乳腺癌诊断上具有安全、无创、无辐射、显像清晰和准确评估淋巴结状况等特点,也是初步评估肿块是否恶性的首选方法之一[4]。开展NAC可以在手术前对肿瘤进行降期,并获取肿瘤对特定药物的敏感性和抗药性信息,为后续治疗方案提供方向[5]。有关研究[6]表明,开展NAC对BC患者临床有效性可达60%-90%,而非NAC仅为58%。但是,NAC也会导致对化疗药物不敏感的患者无法准确评估,错失最佳救治窗口,从而降低后续临床疗效。国内有关超声特征结合临床病理评估乳腺癌NAC疗效,构建相应疗效风险预测列线图模型的文献较少,所以开展此研究,现报道如下。
1 资料和方法
1.1 一般资料和分组
1.1.1 诊断标准:符合《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》[7]相关标准且经乳腺超声检查。
1.1.2 纳入标准:①年龄>18岁;②相关资料齐全;③术前已接受乳腺超声检查;④未接受抗肿瘤治疗者;⑤在我院行NAC且治疗周期均为4-6周;⑥患者和家属知情并签署知情同意书。
1.1.3 排除标准:①合并其他恶性肿瘤、自身免疫缺陷性疾病等;②合并重要脏器(心、肝、肾等)功能不全者;③有免疫抑制剂使用史者;④男性乳腺癌患者。
1.1.4 分组:回顾性分析2021年6月-2023年3月我院100例行NAC的BC患者相关资料,按照7∶3比例分为建模集和验证集。并根据经过NAC治疗后患者疗效分为有效组(n=49)和无效组(n=21)。
1.2 资料收集和方法
1.2.1 相关资料收集 收集资料包括年龄、BMI、月经情况、NAC方案、淋巴结情况、TNM分期、分化程度、组织学分级、免疫组化检查,超声特征资料等[3]。
1.2.2 NAC疗效判定 参考《实体瘤临床疗效评价标准(RECIST1.1)》[8],完全缓解:患者病灶完全消失,部分缓解:患者病灶缩小30%以上,疾病稳定:患者病灶缩小<30%或者病灶长径增加<20%,疾病进展:出现新病灶或者病灶长径增加>20%。本研究评估患者NAC疗效为:有效=完全缓解+部分缓解;无效=疾病稳定+疾病进展。
1.3 统计学分析 采用SPSS23.0分析数据,计数资料以(n)表示,行χ2检验;正态性分布的计量资料用表示,行t检验;单因素和多因素回归分析BC患者NAC疗效的独立影响因素;采用R软件构建风险预测列线图模型;绘制ROC曲线评估模型的预测价值;使用H-L检验判断模型的拟合优度。结果均以P<0.05表示差异具有统计学意义。
2 结果
2.1 患者相关资料分析 单因素分析结果提示,患者病灶大小、侧方声影、血流分级、肿块形状、淋巴结转移、分化程度、ER、PR和HER-2在组间差异比较中具有统计学意义(P<0.05),见表1。
表1 有效组和无效组相关资料比较[n(%),]
?
2.2 影响患者NAC疗效的多因素Logistic分析 将表1中具有统计学意义的指标进行因素赋值,以患者疗效为二分类结局,见表2。将赋值因素代入二元Logistic回归分析中,其结果显示,患者病灶大小、侧方声影、血流分级、淋巴结转移、分化程度、ER、PR和HER-2均为BC患者NAC疗效的独立影响因素(P<0.05),见表3。

表2 因素赋值表
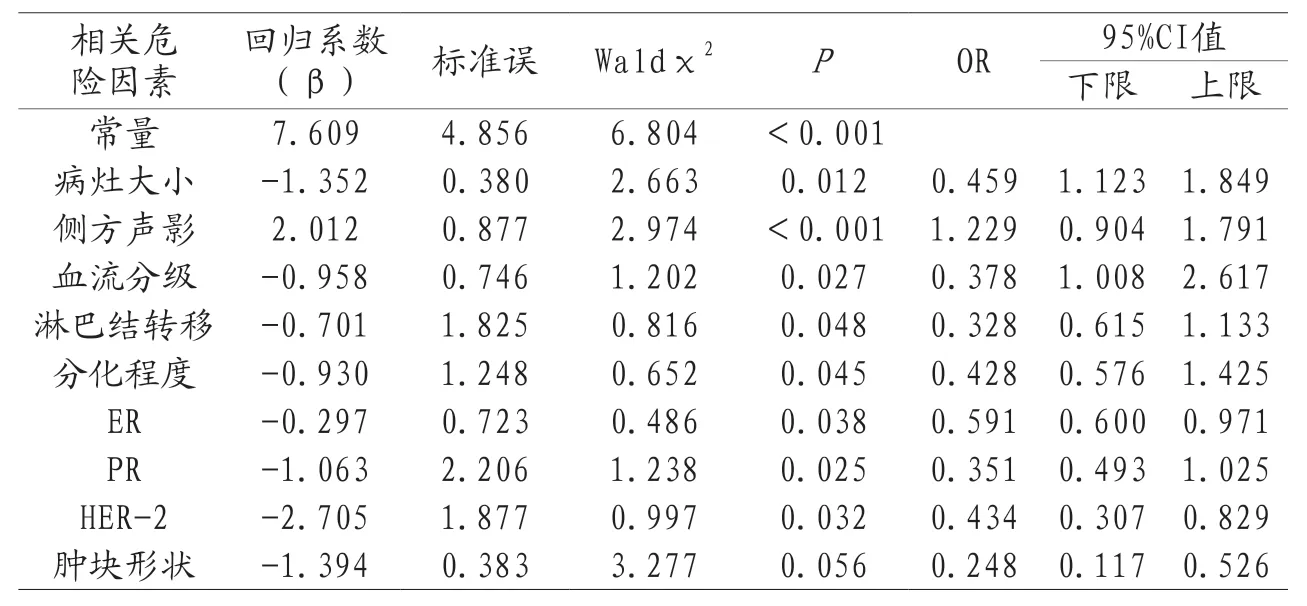
表3 影响BC患者NAC疗效的多因素Logistic分析
2.3 超声特征模型、临床-病理模型及联合模型构建 超声特征包含3个独立预测因子:病灶大小、侧方声影、血流分级(均P<0.05);临床-病理模型包含5个独立预测因子:淋巴结转移、分化程度、ER、PR和HER-2(均P<0.05)。基于临床-病理-超声特征的独立预测因子相结合,采用多因素Logistic回归分析,构建出联合模型。运用R软件生成列线图,见图1。
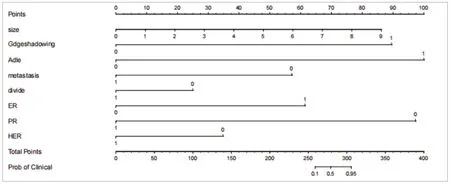
图1 BC患者NAC疗效风险预测列线图模型
2.4 风险预测模型构建 通过ROC曲线分析显示,联合模型相对于临床模型和超声特征模型具有更高的诊断价值,见图2和图3。建模集ROC联合模型的AUC为0.967(95%CI为0.930-1.000),其敏感度为95.2%,特异度为91.8%;验证集联合模型AUC为0.955(95%CI为0.913-0.997),其敏感度为92.2%,特异度为89.7%。

图2 建模集ROC曲线

图3 验证集ROC曲线
2.5 对联合模型的验证 建模集与验证集分别经H-L拟合优度检验,结果显示分别为χ2=5.042,P=0.655(建模集),χ2=4.392,P=0.355(验证集),提示该模型预测患者术后发生并发症的概率与实际概率比较,差异无统计学意义,拟合度较好,预测价值高。联合预测模型校准图中,校准曲线贴近标准曲线,提示该模型校准一致性较好,见图4和图5。
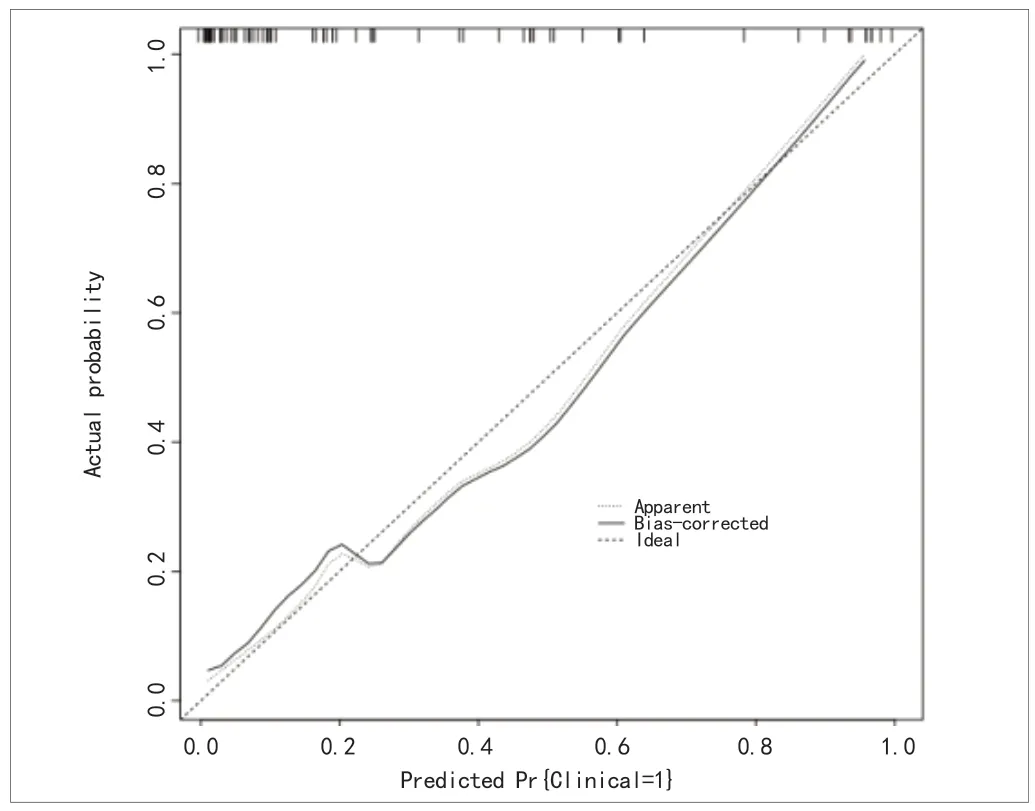
图4 建模集联合模型校准图
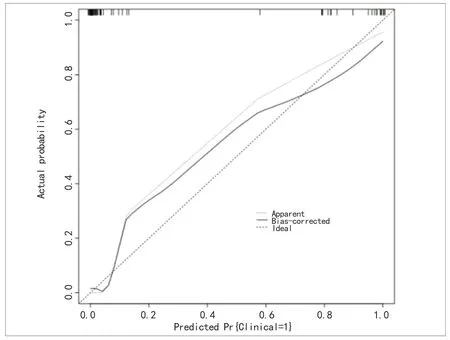
图5 验证集联合模型校准图
3 讨论
术前开展新辅助化疗可以帮助缩小乳腺肿瘤体积,有利于手术根除和提高预后效果[9]。但如果患者接受新辅助化疗效果不佳,不仅会延后手术时间,导致肿瘤进展和恶化,化疗药物带来的副作用和出现耐药性也会影响临床预后[10]。因此,若是能在开展NAC前便能准确地预测出NAC疗效,既避免了不应有的药物毒性反应,也能制定出临床个体化治疗方案[11]。
本研究结果提示,存在病灶大,无侧方声影,血流丰富,淋巴结转移,中低分化程度,以及ER、PR和HER-2为阳性的BC患者行NAC治疗难以取得较好疗效。笔者分析原因可能存在以下几点:①体积较大的乳腺肿瘤一般已进展至疾病晚期,癌细胞侵袭淋巴系统或转移其他部位风险更高,患者术前行NAC恐难以获益[12]。本研究中资料显示,无效组平均病灶大小显著大于有效组,与既往研究[13]相符。②有侧方声影,肿瘤边缘形成锐利的界限,提示肿瘤可能是非浸润性的,周围组织未被侵袭。李鑫焱[14]等学者的研究表明,侧方声影是NAC疗效的重要预测因素(OR=4.892,95%CI:1.306-18.329),与本研究结果一致。③肿瘤血流丰富说明肿瘤组织具有高度的血管密度和血管增生,不仅增加了肿瘤代谢活性和增殖速度,血液循环还为肿瘤细胞转移和逃逸提供通道[15]。④淋巴结之间具有连接和传导功能,乳腺癌细胞借助淋巴系统迅速扩散和转移,而中低分化程度的肿瘤增殖快,易转移且恶性程度高,因此肿瘤细胞难以完全清除并加大复发的可能性,影响患者疗效[16]。⑤ER和PR阳性表达提示癌细胞具有依赖激素生长的特征,应采取内分泌治疗(雌激素阻断剂或拮抗剂),行NAC疗效难以获益。HER-2阳性提示需采用抑制HER-2通路的靶向药(曲妥珠单抗)方案。且ER、PR和HER-2表达阳性的癌细胞更容易向周边结缔组织浸润,诱发周围纤维结缔组织增生及淋巴细胞反应[17]。
综上所述,基于患者病灶大小、侧方声影、血流分级、淋巴结转移、分化程度、ER、PR和HER-2构建出临床特征模型与临床-病理结合的联合模型具备更高的预测价值,可在开展NAC前便能较为准确地评估该方案的适应性和疗效。

