全基因组水平金银花TCP 基因家族的鉴定及表达模式分析
谭政委 ,郭水柱,苏小雨 ,孙 瑶 ,余永亮 ,李 磊,张利超,许兰杰 ,鲁丹丹 ,安素妨 ,李春明 ,梁慧珍 *,王子君
1.河南省农业科学院中药材研究所,河南 郑州 450002
2.河南省农业科学院 芝麻研究中心,河南 郑州 450002
3.仲景宛西制药股份有限公司,河南 南阳 474550
4.承德市中药材绿色生态种植技术服务中心,河北 承德 067000
5.驻马店市种子服务站,河南 驻马店 463000
TCP 转录因子是植物特有的转录因子[1],是以玉米中的Teosinte 分支1(Teosinte branched1,TB1)、金鱼草中的CYC(Cycloidea)和水稻中的增殖细胞因子1(proliferating cell factors 1,PCF1)、增殖细胞因子2(proliferating cell factors 2,PCF2)4 个基因的首字母而得名[2-4]。TCP 蛋白家族都具有一个由59 个氨基酸组成的碱性螺旋-环-螺旋(basic Helix-Loop-Helix,bHLH)保守结构域,该结构域参与DNA 结合、蛋白互作和亚细胞定位。根据保守结构域序列特征,TCP 家族又分为Class Ⅰ和Class Ⅱ,Class Ⅰ又称PCF 类或TCP-P 类,Class Ⅱ又进一步分为CYC/TB1 和CIN 亚类,其中Ⅰ类TCP 的碱性区比Ⅱ类TCP 少4 个氨基酸残基[4-5]。TCP 蛋白可以直接或间接调控多个基因的表达,不同类型的TCP 蛋白因其结构域差异结合不同靶基因的顺式作用元件,大量研究表明,Class I 类TCP 蛋白特异性结合含有GGNCCCAC 元件的基因,Class II 类TCP 则倾向于结合含有G(T/C)GGNCCC 元件的基因[3]。
TCP基因家族广泛参与种子萌发及胚胎生长[6]、侧枝形成[7]、花器官形成[8]、生物和非生物胁迫[9]、次生代谢生物合成[10-11]、氮素利用[12]等植物生长发育的多个生物学过程。TCP 蛋白可以单独或通过与其他蛋白形成复合体的形式调控下游基因的表达,并且不同TCP 对同一个基因的调控机制也有所不同。在拟南芥的研究中,AtTCP20 和AtTCP4 都可以调控靶基因脂氧合酶2(Lipoxygenase2,LOX2)的表达,其中AtTCP20 抑制LOX2基因的表达,而AtTCP4 激活LOX2基因的表达[13-14]。另外,AtTCP4还能结合到GIS(Glabrousinflor-escencestems)、叶绿素合成相关基因原茶碱还原酶(Protoch lorophyllidereductase,PORB)、二乙烯基还原酶(Divinylreductase,DVR)和过表达抑制剂(SuppressorofoverexpressionofCO1,SOC1CO1)启动子区域,调控这些基因的表达[15-16]。在蝴蝶兰中,PePCF10 和PeCIN8 可各自形成同源二聚体,参与胚珠发育相关生理过程[17],在拟南芥中,AtTCP3 可以通过与R2R3-MYBs-TT8 互作,增强其稳定性,从而正调控类黄酮生物合成[11]。AtTCP20与转录因子AtNLP6、AtNLP7 在细胞核内形成异源二聚体,激活氮同化关键基因AtNIA1的转录表达,从而提高植株氮同化能力[18]。在水稻的最新研究中,OsTCP19 蛋白通过结合于水稻分蘖相关基因半矮化少分蘖突变体(dwarf and low-tillering,DLT)并抑制其必到从而决定水稻氮信号响应及分蘖[12]。在毛杨树的相关研究中发现 PtoTCP20 与PtoWOX4a 相互作用,激活PtoWND6的转录,从而影响次生维管组织发育[19]。此外,大量研究表明,TCP 蛋白参与植物次生代谢调控及生物、非生物胁迫响应过程,在草莓中FvTCP9 与FaMYC1 相互作用促进花青素的积累,促进果实成熟[20]。番茄CRN12_997 与SlTCP14-2 结合,会增加植株对辣椒灰霉病的易感性[21]。
金银花LoniceraJaponicaFlos是我国临床常用大宗中药材,金银花中含有丰富的挥发油、黄酮类、有机酸类、三萜类和环烯醚萜类等化学成分,因其具有抗菌消炎、抗病毒、抗肿瘤、抗衰老等功效而具有重要的临床药用价值[22-23]。不同种质金银花在株型、枝条和叶片形态及化学成分含量等方面均存在较大差异,目前关于金银的研究多集中于资源评价、花色形成及药理学方面,分子遗传学方面报道相对较少,目前国内外尚未见金银花TCP基因家族转录因子的相关研究报道。随着金银花基因组测序完成,其基因组数据为遗传育种和功能基因的鉴定提供了重要参考。本研究通过生物信息学方法,对金银花基因组中的TCP基因家族转录因子进行鉴定,并对序列特征、进化关系、表达模式等进行综合分析,以期为进一步探索研究金银花TCPs基因的功能奠定基础。
1 材料与仪器
1.1 材料
本研究所用金银花品种‘密银花1 号’为团队2020 年河南省省级审定品种,经河南省农业科学院中药材所梁慧珍研究鉴定为忍冬科忍冬属植物忍冬LonicerajaponicaThunb.。
1.2 仪器
QIAquant 96 荧光定量PCR 仪(德国QIAGEN公司);5424R 高速离心机(德国Eppendorf 公司);DYY-8C 型电泳仪(北京六一仪器厂);Tanon2500凝胶成像(上海天能生命科学有限公司)。
2 方法
2.1 样品的处理
将1 年生扦插苗盆栽,在自然条件下生长,将盆栽苗置于低温冰箱中做冷处理(4 ℃),在处理后6、12、24、36 和48 h 取样,0 h 作为对照,3~5 株叶片收集并混合作为一个生物学重复,每个时间点取3 个生物学重复,将样品在液氮中速冻,然后转移至超低温冰箱中保存备用。
2.2 金银花TCP 基因家族的鉴定
根参考金银花基因组相关文献,在国家基因组科学数据中心(https://bigd.big.ac.cn/gwh)下载金银花基因组序列、蛋白序列及基因组注释文件(项目编号:PRJCA001719)。从pfam 数据库下载TCP 转录因子的隐马尔科夫模型(hindden market model,HMM)文件(登陆号:PF03634),在国家超级计算郑州中心服务器上通过HMMER 软件检索金银花蛋白质序列数据库,E-value 设置为0.001,筛选出候选基因。利用 SMART ( http://smart.emblheidelberg.de/)、CD-Search Tool(https:// www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)检测候选蛋白质序列,剔除不含bHLH 基序的蛋白序列,最后得到金银花中编码LjTCP 蛋白的基因序列。
2.3 LjTCP 基因染色体定位、基因复制及共线性分析
根据基因注释文件,利用TBtools 软件将鉴定出的LjTCP基因锚定到染色体上,并根据LjTCP基因在染色上的位置进行命名编号。通过TBtools[23]软件中的One Step MCScanX 分析金银花基因组内LjTCP基因家族成员间复制关系,通过Advance Circos 模块对复制关系进行展示。
2.4 LjTCP 转录因子家族成员理化性状及结构特性分析
通过在线软件ProtParam(http://web.expasy.org /protparam/)分析蛋白理化性质,使用PlantmPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)预测LjTCPs 蛋白亚细胞定位,利用在线工具ExPASY(https://www.expasy.org/tools)预测LjTCPs 氨基酸数量、相对分子质量、理论等电点,通过Expasy(https://web.expasy.org/protscale/)软件分析蛋白的亲疏水性。通过TBtools 软件对LjTCP 基因家族成员的内含子和外显子结构信息进行分析展示。
2.5 LjTCP 基因蛋白质序列多重比对与系统发育树构建
采用MEGA 7.0 软件中ClusterW 对金银花、拟南芥和水稻中TCP基因进行多序列比对,并通过邻接法进行系统发育树构建,Bootstrap 设置为1 000,根据拟南芥和水稻中TCP基因对金银花TCP进行分组,通过Evolview 在线软件和Adobe Illustrator软件对进化树进行美化;通过ClusterW 对不同分组中LjTCP保守结构域进行多序列比对,并通过GeneDoc 软件对比对结果进行美化展示。
2.6 保守基序及启动子分析
通过本地MEME(v5.4.1)软件对LjTCP基因家族成员进行基序分析,参数:maximum number of Motifs=10,minimum width≥6,maximum width ≤50。为了解析LjTCPs启动子区域顺式作用元件,提取LjTCPs基因ATG 上游2 000 bp 序列,利用Plant CARE(https://bioinformatics.psb.ugent.be /webtools/plantcare/html/)软件进行启动子顺式作用元件分析,并通过TBtool 和R version 4.3.1 软件对启动子分析结果进行展示。
2.7 LjTCP 基因家族表达模式分析
在国家基因组科学数据中心(https://bigd.big.ac.cn/gwh)中下载金银花不同发育时期(S1~S8)转录组数据(项目编号:PRJCA001719)[23],从NCBI 的Short Read Arshive(SRA)数据库中下载‘封金1 号’(F_5,低花青素含量品种)和‘豫金2 号’(Y_5,高花青素含量品种)花期为S5 期转录组数据(项目编号:PRJNA861870)[24],在国家超级计算郑州中心服务器通过fastp 软件对原始数据进行过滤,去除接头,得到clean reads,利用HISAT2 将clean Reads 与金银花参考基因组进行序列比对,利用featuresCounts 软件,对reads 进行精确的计数,并计算FPKM 值,LjTCP基因家族成员的相对表达丰度用log2(FPKM+1)值表示,通过R软件中的Pheatmap 包对其表达量进行热图展示。
2.8 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)
通过qRT-PCR 技术检测LjTCP基因家族基因在冷胁迫处理后基因表达变化。利用RNA 提取试剂盒提取各组织样品的RNA。利用1.2%琼脂糖凝胶电泳检测提取的总RNA 的质量和完整性,测定RNA 的浓度及纯度,并将总RNA 反转录为第一链cDNA。使用PrimerPremier5 软件设计定量引物(表1),每个荧光定量PCR 反应重复3 次。数据通过2−ΔΔCt相对定量法对基因进行表达水平分析,结果以3 个生物重复的±s值表示,用Student’st-test 对处理后6、12、24、36、48 h 与0 h 样品表达量进行显著性分析,P<0.01 表示差异具有显著性,通过GraphPad Prism 8 软件进行绘图。

表1 qRT-PCR 分析所用引物序列信息Table 1 Primer sequences used for qRT-PCR
3 结果与分析
3.1 LjTCP 基因家族的鉴定及理化性质分析
利用pfam 数据库中TCP家族转录因子保守结构域bHLH(登陆号PF03634),通过检索金银花基因组,共鉴定出17 个LjTCPs,利用Pfam 和NCBI的Conserved Domain Search 在线分析软件对LjTCP蛋白进行结构域验证。结果表明,17 个LjTCPs 蛋白均含有非典型的bHLH 特征结构域,分别命名为LjTCP01~LjTCP17(表2)。使用ExPASy 工具对LjTCP 家族成员进行蛋白质理化性质分析,LjTCP01 蛋白最长,编码379 个氨基酸,LjTCP04蛋白最短,编码202 个氨基酸,相对分子质量分布区域为22 119.09~42 098.05,等电点范围是6.06(LjTCP14)~9.74(LjTCP04),大多数蛋白为碱性蛋白,且具有良好的亲水性。亚细胞定位预测结果显示,LjTCPs 均定位在细胞核中(表2)。
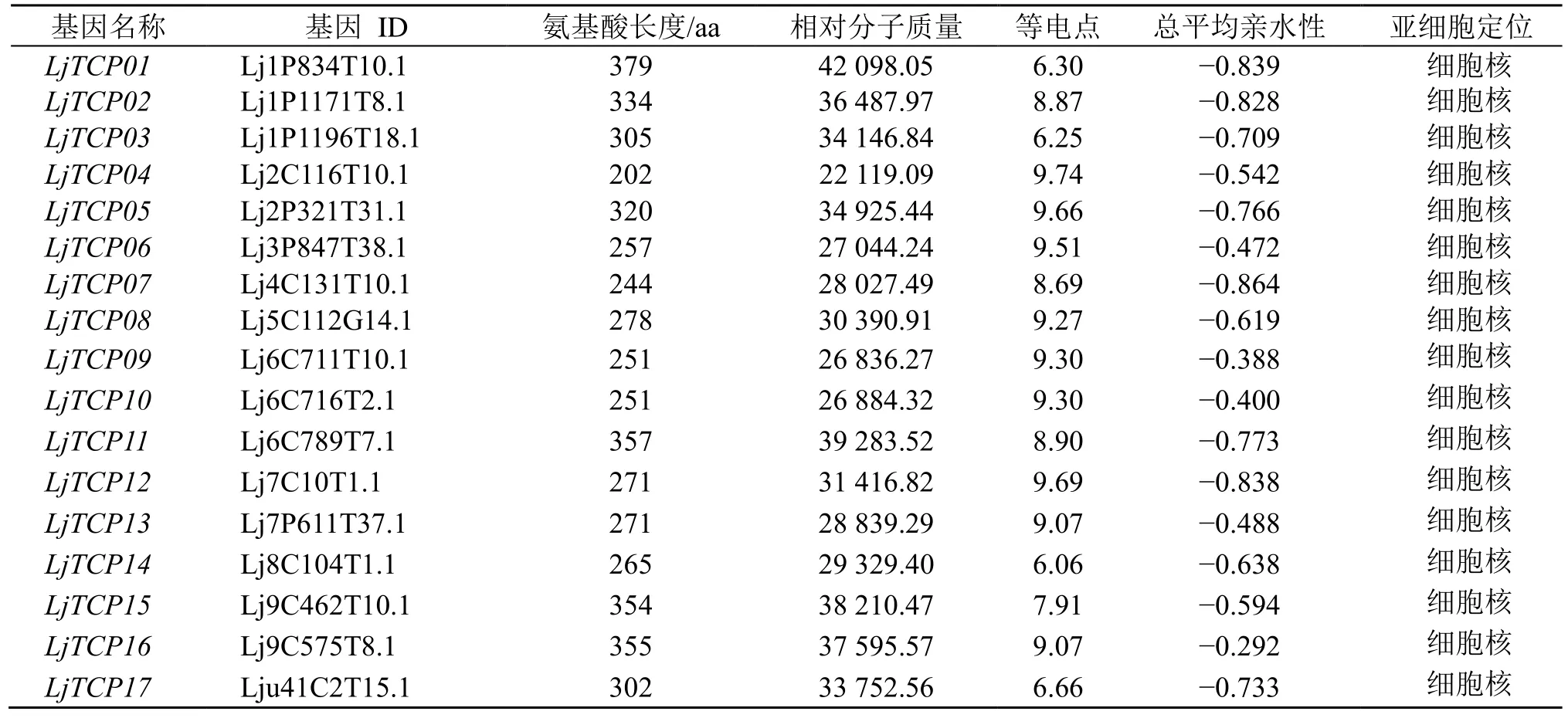
表2 金银花LjTCP 基因家族氨基酸序列特征分析Table 2 Analysis of amino acid sequence characteristics of LjTCP gene family in L.japonica
3.2 LjTCP 基因家族成员染色体定位及共线性分析
共有17 个金银花LjTCP基因被映射到9 条染色体上(图1),其中LjTCP17是唯一未组装在染色体上的基因。LjTCP基因在所有染色体上都有分布,但总体上呈现不均匀分布,其中第1 条(LjTCP01、LjTCP02、LjTCP03)和6 条染色体(LjTCP09、LjTCP10、LjTCP11)上有3 个LjTCP基因,第2 条(LjTCP04、LjTCP05)、第7 条(LjTCP12、LjTCP13)和9 条染色体(LjTCP15、LjTCP16)上有2 个LjTCP,其余染色体上只有一个LjTCP。

图1 LjTCP 基因家族的染色体定位Fig.1 Chromosomal location of LjTCP gene family
基因复制被认为是基因组和遗传系统进化的主要驱动力之一,重复基因为新基因的产生提供了原材料,而新基因则促进了新功能的产生。为了了解LjTCP基因家族的扩增机制,对金银花基因组的复制事件进行了全面分析,结果表明(图2),金银花LjTCP基因家族中没有发现串联重复事件,但有 11 个基因(LjTCP01/LjTCP14、LjTCP03/LjTCP14、LjTCP06/LjTCP09、LjTCP06/LjTCP10、LjTCP07/LjTCP12、LjTCP08/LjTCP11、LjTCP08/LjTCP15、LjTCP09/LjTCP10、LjTCP11/LjTCP15)共9 对基因间存在共线性关系,另外,通过基因复制事件分析显示,除LjTCP04和LjTCP17,其余15 个LjTCP基因中检测到了全基因组复制和片段性复制事件,其中LjTCP17未检测到复制事件可能主要是由于该基因未定位到染色体上。

图2 LjTCP 基因家族的共线性分析Fig.2 Collinearity analysis of TCP gene family from L.japonica
3.3 LjTCP 基因家族成员基因结构和蛋白保守基序分析
利用LjTCP 蛋白全长氨基酸序列构建系统发育树,结果显示,LjTCP 蛋白成员可以分成2 个亚群(图3-A)。为了深入了解LjTCP 家族成员蛋白保守基序组成,通过MEME 软件对其保守基序进行预测,如图3-B 显示,所有LjTCP 家族成员均具有保守的TCP 结构域(Motif1)。第Ⅰ亚群的9 个成员都含Motif2,并且该亚群中所含的保守基序种类较多,Motif4、Motif5只存在于第Ⅱ亚群中,并且同一亚群中具有相似的保守基序,而不同亚群中保存基序种类差异较大,这暗示同一亚群中成员可能具有相似的功能,而不同亚群中功能可能有所差异。另外,通过基因结构分析结果显示,LjTCP家族成员基因结构相对比较简单,其中LjTCP02和LjTCP05含有2 个内含子,LjTCP01、LjTCP07、LjTCP08、LjTCP09、LjTCP10、LjTCP12和LjTCP13只含有1 个内含子,其余LjTCP不含内含子(图3-C)。
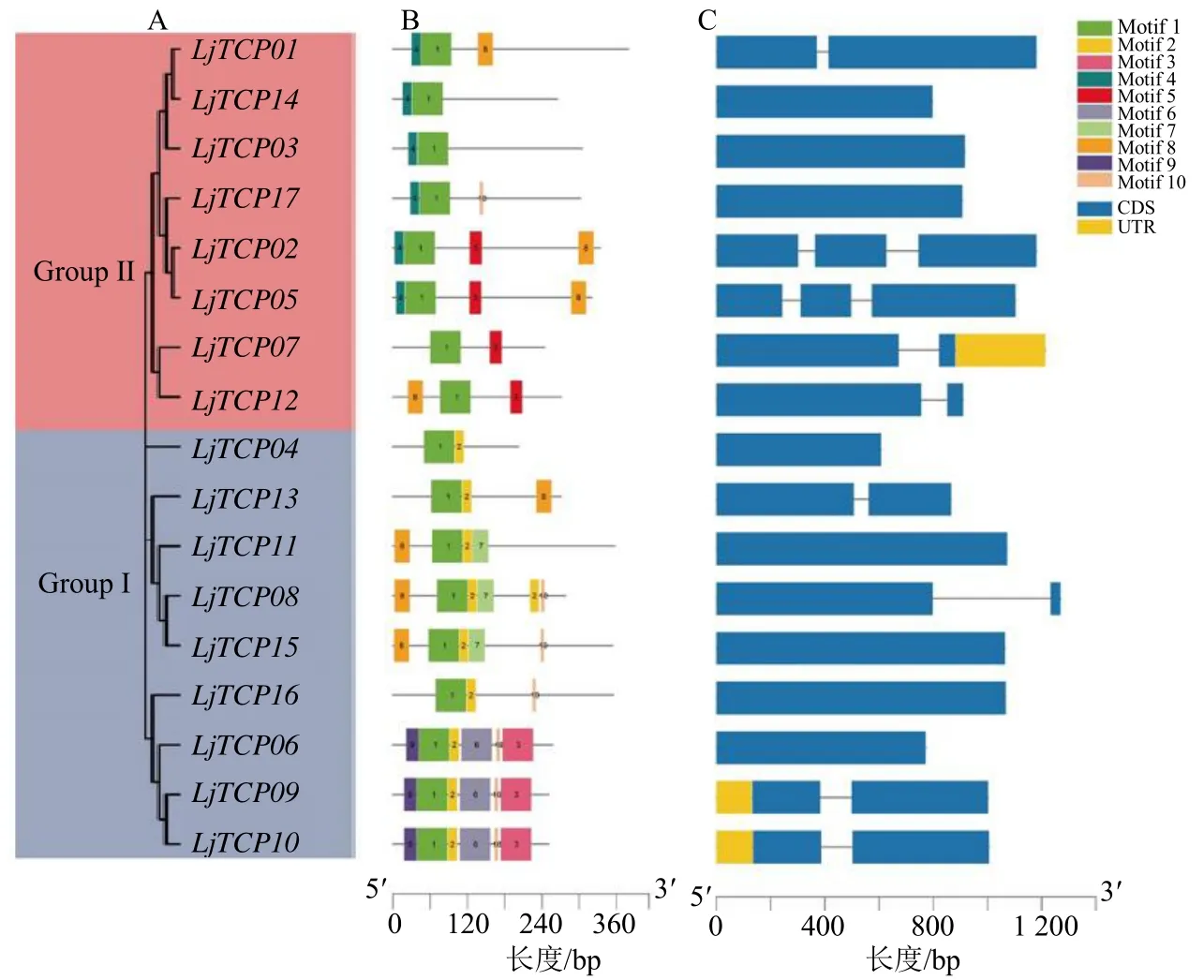
图3 LjTCP 基因家族进化树 (A)、保守结构域 (B) 和基因结构 (C) 分析Fig.3 Phylogenetic tree (A), conserve motif (B) and gene structure (C) analysis of LjTCP genes family
3.4 LjTCP 基因家族系统发育树构建及多重比对分析
为了阐明LjTCP 蛋白质的序列特征,对所有LjTCP 进行了多序列比对,结果表明在59 个残基的TCP 结构域中,BASIC 区域保守性最强,Helix区域保守性较差,Loop 区域变化较大。确定17 个bHLH 结构域中相同的19 个残基:10 个在Basic 区域(KDRHXKVXXRXRRXR),2 个螺旋中的7 个疏水性残基以及1 个断裂螺旋的甘氨酸(图4)。

图4 LjTCPs 结构域的多序列比对Fig.4 Multiple sequence alignment of LjTCPs domain
基于系统发育树和TCP 结构域的特征,LjTCP蛋白质被分为2 类(图5):第1 类为PCF 组,包含9 个LjTCP 蛋白质;第2 类包含2 个亚组,即CIN和CYC/TB1。CIN组有6个LjTCP蛋白质,CYC/TB1组有2 个LjTCP 蛋白质。每个组都具有独特的序列和结构特征。例如,在Basic 区域,PCF 组比CIN和CYC/TB1 组少了4 个氨基酸残基(图4),这使得这2 种类型的TCP 蛋白质具有不同但相似的DNA 结合位点(第1 类为GGNCCAC,第2 类为GTGGNCCC)。在Helix 和Loop 区域方面,每种类型TCP 都具有独特的氨基序列特征,如在Helix I区域的最后3 个残基中,PCF 组成员为TRE,CIN组为QDR,CYC/TB1 组为QDL 和QDM(图4)。

图5 金银花、拟南芥和水稻TCP 基因家族的系统发育分析。Fig.5 Phylogeny analysis of TCP gene family among L.japonica, Arabidopsis thaliana and Oryza sativa.
3.5 LjTCP 基因家族成员启动子顺式作用元件分析
为了进一步了解金银花中TCP转录因子的潜在功能和调控机制,使用PlantCARE 对翻译起始位点上游近2.0 kb 的序列区域进行顺式作用元件分析。结果几乎所有的LjTCP基因在启动子区域都有至少7 个以上顺式作用元件(图6)。这些顺式作用元件进一步被分为4 类:生理响应、光响应、植物激素响应和胁迫(图7)。第1 类是与植物生长和发育相关的生理响应元件,包括O2-site、CAT-box、circadian、MSA-like 等。第2 类是含光响应元件,包括GATA-motif、G-box、BoxII、GT1-motif、Sp1等。其中GT1-motif 元件是在LjTCP基因家族成员启动子中最丰富的顺式作用元件。第3 类是植物激素响应元件,由TGACG-motif、TCA-element、ABRE、P-box、GARE-motif 等组成。例如,LjTCP03的启动子区域具有CGTCA-motif、TGACG-motif、ABRE、P-box、GARE-motif 和TATC-box 顺式作用元件,这些顺式作用元件与茉莉酸甲酯(methyl jasmonate,MeJA)、脱落酸(abscisic acid,ABA)、生长素、赤霉素(gibberellic acid,GA)响应应有关,据推测LjTCP03可能参与多种激素响应。第4 类是非生物与生物胁迫相关的顺式作用元件,包括抗氧化应答元件(antioxidant response elements,ARE)、低温应答(low temperature resonsive Element,LTR)元件、干旱诱导元件(MYB binding site,MBS)、创伤应答元件(Wun-motif)和TC-rich repeats。LTR元件在6 个LjTCPs启动子中被发现,其中LjTCP16启动子区域含有2 个LTR 元件。值得注意的是,LjTCP10基因中不包含任何与非生物或生物胁迫相关的元件。总的来说,这些结果表明LjTCP基因家族可能与生长发育、激素和胁迫响应有关。
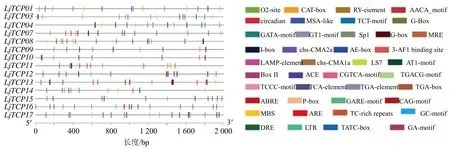
图6 LjTCP 基因家族启动子区域顺式作用元件分析Fig.6 Analysis of promoter cis-acting elements of LjTCP gene family

图7 LjTCP 基因家族启动子区域顺式作用元件数量统计分析Fig.7 Statistical analysis of number of cis-acting elements in promoter region of LjTCP gene family
3.6 LjTCP 基因家族成员表达模式分析
为了探究LjTCP基因家族在花发育不同时期的表达模式,利用金银花转录组数据对花发育的8 个时期(S1~S8)的表达模式进行分析,结果表明,大部分基因在S1~S3 期中表达量较高,随着发育进程表达量呈现下降的趋势(图8-A)。在其他植物的研究中发现,TCP基因调控花青素合成结构基因的表达,影响植物花青素和花色的形成,为了探究LjTCP基因是否可能参与金银花花青素合成调控过程,对2 个金银花花青素含量差异明显的品种的LjTCP基因表达量进行FPKM 分析,结果表明LjTCP05、LjTCP13、LjTCP14、LjTCP16和LjTCP17在 2 个品种中表达量具有明显的差异,其中LjTCP05、LjTCP13、LjTCP14和LjTCP17在花青素含量较少的品种封金1 号中表达量较高,LjTCP16在花青素含量较高的品种豫金2 号中表达量较高(图8-B)。
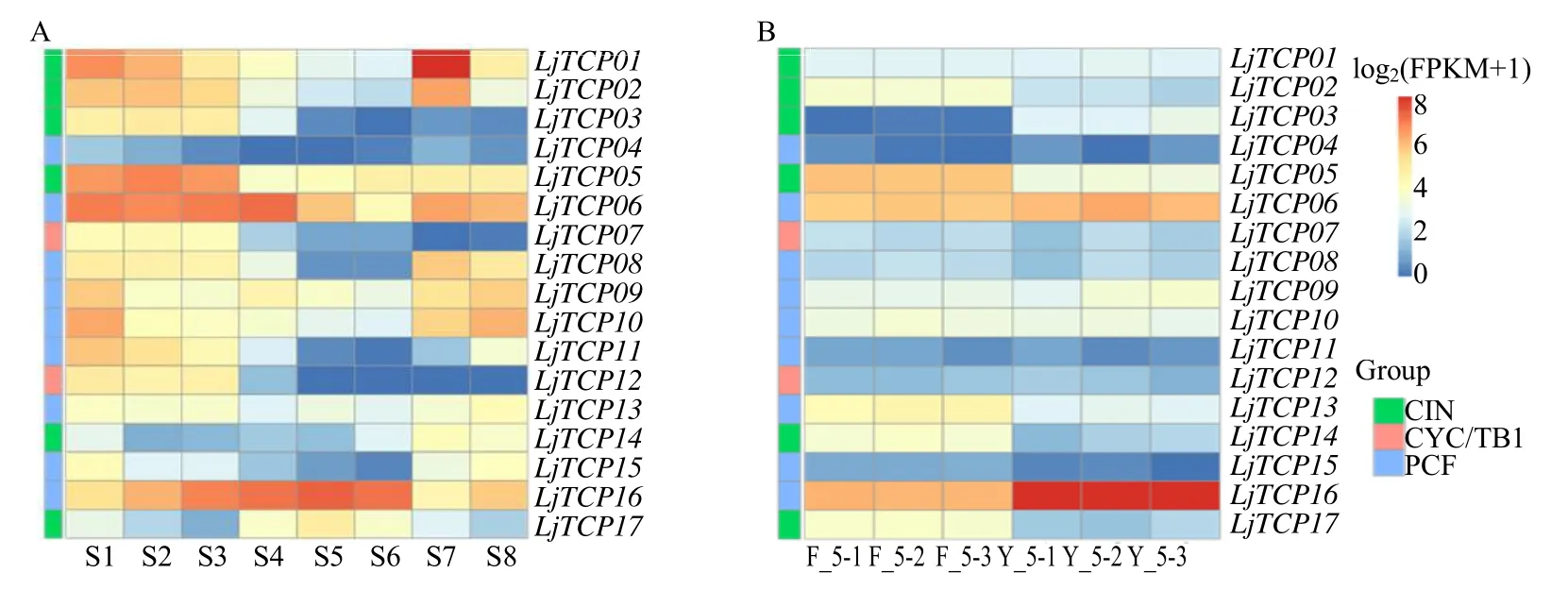
图8 LjTCP 基因家族在不同发育阶段 (A) 和2 个品种的金银花 (B) 中的表达模式Fig.8 Expression heatmap of LjTCP gene family in different developmental stages (A) and two varieties (B) of L.japonica
3.7 冷处理下LjTCP 基因家族成员表达模式分析
为了研究LjTCP基因家族在应对低温反应中的表达模式,选择了6 个含有LTR 顺式作用元件的LjTCP基因,并调查其在诱导低温胁迫(4 ℃)的不同阶段(0、6、12、24、48 h)的表达水平。结果如图9 所示,根据表达模式,可以将这6 个基因分为3 类,第1 类LjTCP8和LjTCP14随着冷处理的进行其表达量持续升高,在冷处理48 h 后,表达量达到最高;第2 类LjTCP13和LjTCP16在处理后表达量先降低,随后升高,但LjTCP13和LjTCP16表达模式略有不同,LjTCP13在处理后先降低随后升高,在冷处理36 h 后表达量达到最高,而LjTCP16则是表达量先降低,随后升高,在24 h 后达到表达量最高峰,随后表达量降低至处理前水平;第3 类LjTCP15和LjTCP17表达量先升高后降低至基础表达水平。
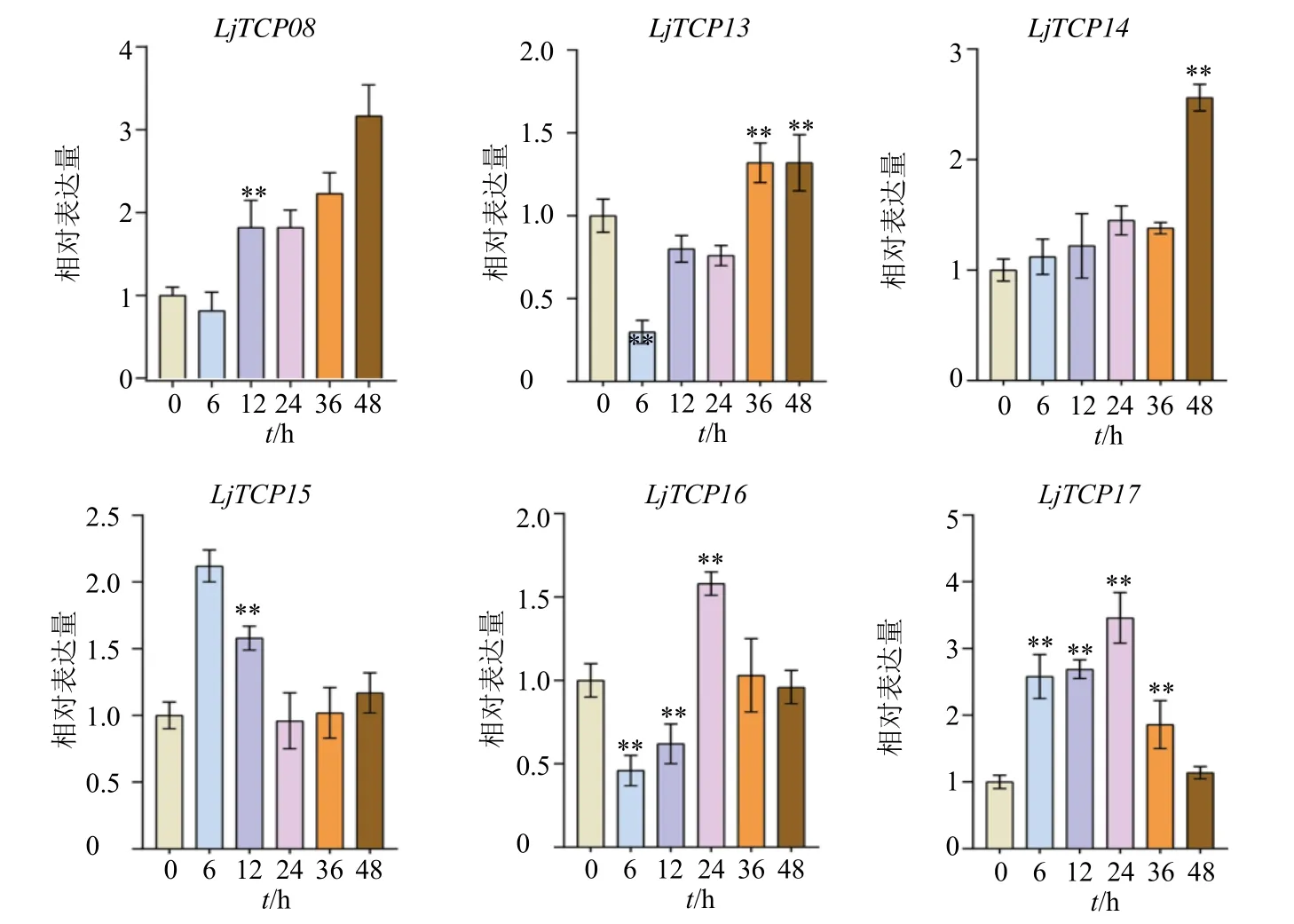
图9 LjTCP 基因家族冷处理后表达模式分析Fig.9 Expression profiles analysis of LjTCP gene family under cold stress
4 讨论
金银花是一种兼具药用、观赏作用的经济作物,但关于金银花发育的生物学机制相关研究较少,TCP 作为植物的特异转录因子家族,在植物生长发育、生物和非生物胁迫响应过程的多个方面起至关重要的作用。随着越来越多的植物基因组测序完成,大量植物中的TCP基因家族在全基因组范围内进行了鉴定,不同物种中鉴定的TCP 数目也不尽相同,如在拟南芥[25]、水稻[26]、茶树[27]中分别鉴定出24、22 和37 个TCP基因家族成员。本研究从全基因组水平,对金银花TCP基因家族进行了鉴定,共鉴定出17 个TCP基因,其基因总数与其他物种中TCP数目有所差异,说明不同物种间该家族的基因数量也存在一定差异,这可能与不同物种间基因组大小、基因扩张程度不同有关。其中LjTCP01~LjTCP16不均匀的分布于金银花基因组9 条染色体上,受限于金银花基因组测序质量问题,LjTCP17定位于contig 上,而未能定位到染色体上。在植物基因组中,基因复制和分化是基因家族扩张和新功能演化的必要步骤。为了评估复制对LjTCP基因家族的影响。基因组内共线性分结果表明LjTCP复制类型主要为全基因组复制和片段性复制,有15 个LjTCPs参与了片段复制事件,有9 对基因间存在共线性关系,但未发现串联重复,这与葡萄[28]、玉米[29]、棉花[30]的研究结果一致,这说明全基因组复制合片段性复制在LjTCP基因家族扩张中起了至关重要的作用。
序列同源分析表明,金银花TCP家族基因在分子特性和保守结构域等特征上与其他物种TCP家族基因相似,金银花TCP家族成员可以分为2 大类、3 个亚家族,PCF 亚家族包含9 个LjTCP 蛋白,CYC/TB1 亚家族含有2 个,6 个LjTCP 蛋白属于CIN 亚家族。保守结构域分析表明,所有金银花TCP家族成员的N 末端都具有非典型的Basic-Helixloop-Helix 结构域,根据Basic 区域氨基酸不同,又可以将TCP 分为2 大类,其中ClassⅠ亚家族比ClassⅡ亚家族TCP 结构域少4 个氨基酸,这与前人的研究结果一致。金银花TCP motif 种类在不同亚家族中的保守基序也具有一定的差异性,Class Ⅰ中多数成员保守基序要多于Class Ⅱ。在前人的研究中,Class Ⅰ和Class Ⅱ在调控植物不同方面生长发育过程。Class Ⅰ的蛋白成员可能与果实的发育、花色有关[31],而Clas sⅡ成员在植物花瓣发育[32]、分枝[7]等过程中发挥作用,如在玉米TB1 突变体中,TB1 的表达降低,导致顶端优势缺失,植株分枝数量增多[33]。在拟南芥中,AtTCP18(BRC1、TB1直系同源基因)主要在腋芽中表达,其活性缺失可诱导腋芽发育成侧枝[34]。在金鱼草中,CYC基因在花发育的整个过程中都有表达,与dish基因共同调控花的对称性发育[35]。本研究中共鉴定了2 个CYC/TB1 亚家族成员LjTCP07和LjTCP12,通过表达谱分析表明,这2 个基因的表达模式非常相似,都是在金银花花发育初期(S1、S2、S3)表达量较高,在发育后期表达量降低,推测这2 个基因可能参与调控金银花花发育过程,有待于进一步通过实验验证。
大量研究发现,TCP转录因子参与植物花青素合成调控,如在拟南芥中Class Ⅰ中AtTCP15 负调控花青素的积累,并且在高光条件下,TCP 对花青素的负调控作用丧失[36]。在垂丝海棠MalushallianaL.中,来自于Class Ⅱ CIN 亚家族中的MhTCP4 通过直接结合于花青素合成结构基因MhCHI和MhF3’H启动子,激活其表达,正调控花青素的生物合成[37]。本研究以花青素含量较少的金银花品种封金1 号花青素含量较高的品种豫金2 号为研究对象,对LjTCP基因家族成员的表达量进行分析,结果表明来自CIN 亚家族的LjTCP05、LjTCP13和LjTCP17在封金1 号中表达量较高,来自Class ILjTCP16在豫金2 号中表达量较高,这暗示着这些LjTCP基因可能参与花青素合成调控,有待于通过转基因等实验进一步验证。这些结果表明,LjTCP在不同组织中表现出不同表达模式,暗示LjTCP家族成员参与了多个生长发育及生物代谢过程。
启动子顺式作用元件的预测分析发现LjTCP含有大量有关生长发育、生物胁迫与非生物胁迫相关元件,表明LjTCP基因家族可能参与相关调控途径从而影响金银花的生长发育。研究表明TCP基因家族参与抗寒、抗旱胁迫响应过程,在木薯中[38]有20%以上的TCP家族成员响应干旱和冷胁迫处理过程。在菊花脑中,miR319 和其预测目标基因CnTCP2/4/14能够对冷处理作出快速的表达响应,并且在拟南芥中过表达CnTCP4则导致植株对冷过度敏感,这说明CnTCP4可能在菊花脑对冷胁迫的响应中发挥负调控作用[39]。对6 个在启动子区含有LTR 顺式作用元件的LjTCP基因对低温胁迫的反应进行了研究,结果表明,这6 个LjTCP基因对低温处理都有不同程度的响应,其中LjTCP08和LjTCP14在低温处理48 h 后表达量最大,LjTCP16和LjTCP17在低温处理24 h 后表达量最大,这与苦荞中TCP 基因家族研究结果相一致[40],LjTCP15在低温处理6 h 后表达量最大,表明这些LjTCP 转录因子可能在冷胁迫反应的不同时期发挥不同的作用。尽管已经观察到TCP 在许多植物中对低温的反应,但TCP 如何对冷信号做出反应并调节下游基因表达的机制在很大程度上仍然未知。需要进一步的研究来证明这些基因在低温下的功能及其与冷信号通路的关系。
综上所述,本研究对金银花TCP转录因子家族从全基因组层面进行了全面的生物信息学分析,共鉴定出17 个LjTCPs,分为Class I 与Class II 2 大类,进一步划分3 个亚家族(PCF、CYC/TB1 和CIN)。理化性质分析显示,LjTCPs编码202~379个氨基酸,等电点分布于6.06~9.74,相对分子质量分布区域为22 119.09~42 098.05,亚细胞定位于细胞核中,均含非典型bHLH 保守结构域。表达模式分析显示LjTCP基因家族在金银花花发育中和花青素含量不同的金银花品种中具有不同的表达模式,推测LjTCP基因家族金银花花发育和花青素合成中起着重要的调控做,本研究为深入探索LjTCPs基因功能奠定理论基础
利益冲突所有作者均声明不存在利益冲突