壳聚糖和ε-聚赖氨酸对肉食杆菌抑菌机制初步研究
黄伟英,刘晓婷,关玉凤,吴忆惠,范灿烨,刘巧瑜, ,陈海光,,吴俊师,王小玉
(1.仲恺农业工程学院 轻工食品学院,广东省岭南特色食品科学与技术重点实验室,农业农村部岭南特色食品绿色加工与智能制造重点实验室,现代农业工程创新研究院,广东广州 510225;2.广州辐锐高能技术有限公司,广东省工业钴-60 伽玛射线应用工程技术研究中心,广东广州 511458;3.拱北海关技术中心,广东珠海 519015)
肉食杆菌(Carbibacterium divergens)是一种革兰氏阳性菌,耐盐性能较强,可利用碳水化合物产酸,易存在于鱼、肉和其他各种食物中产生异味并导致腐败变质。李成[1]研究发现蟹糊在-20 ℃和4 ℃贮藏温度下的优势腐败菌均为肉食杆菌属,该菌属能分解糖类产生乳酸,降低pH,其还能利用精氨酸产生氨类物质,产生不愉快气味;桂国弘等[2]研究得出肉食杆菌在保藏过程中逐渐成为冷鲜鸡的优势腐败菌,是导致挥发性盐基氮含量升高,继而发生腐败变质的主因。作为常用的天然抑菌剂,壳聚糖和ε-聚赖氨酸均具有抑菌效果好、抑菌性广等优点[3-4]。Wei等[5]提出,由于壳聚糖氨基的质子化,产生一个抑菌基团-NH3+,与细菌表面负电荷间的静电相互作用,使细胞膜破裂,难以形成细胞壁,从而达到抑菌目的[6]。ε-聚赖氨酸源于白色链霉菌的发酵产物[7],是一种高度安全的天然食品抑腐剂。其中,Hou 等[8]和Wei 等[9]研究表明,ε-聚赖氨酸的抑菌机制主要作用于细胞膜和细胞壁导致细胞死亡,同时还可能作用于酶。
目前除常规的热杀菌、辐照、气调包装等处理手段,在肉制品中添加天然抑菌剂是抑制肉类腐败菌生长繁殖的方法。王志琦[10]研究表明在4 ℃贮藏条件下将复配抑菌剂(0.03%ε-PL+0.08%百里香精油+0.06%肉桂醛+0.04%牛至精油)应用于阚疃板鸡成品,可显著抑制肉食杆菌属等菌群,使其货架期延长到 9 d。李新福[11]研究得出复配精油牛至+百里香(1:1,v/v)对肉食杆菌抑制作用最佳。李成[1]发现复配保鲜剂(0.01% Nisin+0.04%ε-PL+0.03%茶多酚+0.1%柠檬酸)抑制肉食杆菌的增长,有效提高腌制生食蟹糊冻藏期间的食用安全性。
本文拟通过研究壳聚糖和ε-聚赖氨酸对肉食杆菌细胞结构和细胞保护酶的作用,探讨其对肉食杆菌的抑菌作用机制。通过测定最小抑菌浓度(minimum inhibition concentration,MIC),结合微生物生长曲线,比较其抑菌作用强弱,评价其对肉食杆菌的抑菌活性;然后通过测定电导率值、胞外核酸、胞外蛋白、碱性磷酸酶(alkaline phosphatase,AKP)活力等指标,结合扫描电子显微镜观察,研究壳聚糖和ε-聚赖氨酸对肉食杆菌细胞结构的破坏作用,还通过检测超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性变化,进一步探究壳聚糖和ε-聚赖氨酸对肉食杆菌的细胞保护酶的作用影响,初步阐述壳聚糖和ε-聚赖氨酸的抑菌机理,为其在食品抑菌防腐领域中的开发应用提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
肉食杆菌P10(Carbibacterium divergens)为课题组早期从腐败酱卤肉鸽中分离、鉴定并保存的菌株;水溶性壳聚糖(分子量10W,脱乙酰度90.22%)河南万邦万邦化工科技有限公司;ε-聚赖氨酸(纯度99.26%)郑州拜纳佛生物工程股份有限公司;营养琼脂(NA)培养基、营养肉汤(NB)培养基广州环凯微生物科技有限公司;蛋白定量测试盒、AKP 测试盒、SOD 测试盒、CAT 测试盒 南京建成生物工程研究所;戊二醛 分析纯,上海源叶生物科技有限公司。
DDS-307 电导率仪 上海仪电科学仪器股份有限公司;760CRT 紫外可见光分光光度计 上海精密科学仪器有限公司;TDL80-2B 台式离心机 上海安亭科学仪器厂;HITACHI SU8100 扫描电子显微镜 日本Hitachi 株式会社。
1.2 实验方法
1.2.1 菌株活化及菌液制备 菌株活化:将肉食杆菌接种在NB 培养基中,并在37 ℃下培养24 h,反复传代培养[12]。
菌悬液制备:取活化的菌液以1%(体积分数,后同)接种量接入100 mL 的营养肉汤培养基中,37 ℃静置培养12 h,培养至对数生长期,得到原菌液备用。将营养肉汤在4 ℃、4000 r/min 条件下离心10 min,弃上清液,所得沉淀用无菌PBS 调整菌液,通过平板计数法得出具体菌落总数,在600 nm 下测定吸光度Abs(参考菌浓度-吸光度标准曲线),调整菌液浓度为107~108CFU/mL,现配现用[11]。
1.2.2 最小抑菌浓度(MIC)通过肉汤稀释法测定抑菌剂对肉食杆菌的最小抑菌浓度(minimal inhibitory concentration,MIC),即37 ℃下培养24 h,明显抑制微生物生长的最小浓度[13]。参考Wang 等[14]方法,稍作修改。收集对数生长期的菌液,稀释至106CFU/mL。采用二倍稀释法将壳聚糖和ε-聚赖氨酸在无菌PBS 中依次稀释,使壳聚糖浓度依次为12.5、6.25、3.125、1.5625、0.7813、0.3906、0.1953、0.0977、0.04885 g/kg;ε-聚赖氨酸浓度依次为5、2.5、1.25、0.625、0.3125、0.1563、0.0781、0.0391、0.00196 g/kg。以无菌水作为对照组。37 ℃下培养24 h。随后,取0.1 mL 活化后的菌液于平板上涂布均匀。以无菌水作为空白对照,将各平板于 37 ℃中倒置培养 24 h,以完全不长菌的最小浓度确定为壳聚糖和ε-聚赖氨酸对肉食杆菌作用的 MIC[15]。
1.2.3 细菌培养液的制备 参照蓝蔚青等[16]方法并做适当修改。将已制备的菌悬液按1%的接种量接种至NB 培养基中,以加入MIC、2 MIC 的抑菌液(壳聚糖、ε-聚赖氨酸)为实验组(MIC 组、2MIC 组),以不加抑菌液为对照组(CK 组),37 ℃静置培养。
1.2.4 微生物生长曲线 采用紫外-可见分光光度法测定肉食杆菌的生长曲线[17]。取制备好的细菌培养液,每隔2 h 测定600 nm 波长处的OD 值。
1.2.5 肉食杆菌细胞膜通透性的测定 通过测定电导率值,表示壳聚糖和ε-聚赖氨酸对菌体细胞膜通透性的影响,参照Liang 等[18]方法并做适当修改。取制备好的细菌培养液,每隔2 h 测定1 次电导率,连续12 h。
1.2.6 胞外核酸的测定 参照梅佳林等[19]方法并做适当修改。取制备好的细菌培养液,每隔2 h 取样一次,连续 12 h,以4000 r/min 低温离心10 min 后,取上清液,测定260 nm 波长处的OD 值。
1.2.7 胞外蛋白质含量的测定 参照Stec 等[20]方法并做适当修改。取制备好的细菌培养液,每隔2 h取样一次,连续 12 h,以4000 r/min 低温离心10 min后,取上清液,采用试剂盒测定细菌胞外蛋白质含量。
1.2.8 肉食杆菌细胞壁完整性的测定 通过测定碱性磷酸酶(AKP),研究壳聚糖和ε-聚赖氨酸对菌体细胞壁完整性的影响,参照Zhao 等[21]方法并做适当修改。分别在0、2、4、6、8、10、12 h 的细菌培养液离心后取上清液,用AKP 试剂盒来测定。
1.2.9 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的测定 参照张亮亮[22]和Motavallihaghi 等[23]方法,将肉食杆菌培养至对数期(107CFU/mL),分别于0、2、4、6、8、10、12 h 取制备好的细菌培养液,各取10 mL 在低温环境下超声破碎,每次破碎5 s,处理2 min,4000 r/min 低温离心10 min。吸取上清液,用试剂盒测定超氧化物歧化酶(SOD)活力和过氧化氢酶(CAT)活力。
1.2.10 扫描电子显微镜观察 取制备好的细菌培养液,在37 ℃、120 r/min 摇床培养12 h 后,将上述培养液于4 ℃、8000 r/min 离心5 min,收集沉淀的细菌;将菌体重悬于2.5%戊二醛溶液中,并在4 ℃下固定24 h。弃掉上清液,用磷酸缓冲液冲洗样品;1%的锇酸溶液固定样品2 h[24],再用磷酸缓冲液冲洗样品;用30%、50%、70%、80%、90%、95%的乙醇溶液和无水乙醇对菌体依次脱水。临界点干燥,将其涂在金属载体上,喷金,在扫描电子显微镜中观察[25]。
1.3 数据处理
试验各平行3 次,采用Microsoft Excel 2019(微软公司)制表,Origin 2018 软件(Origin Lab 公司)制图,IBM SPSS Statistics 22 软件(IBM 公司)做显著性分析,P<0.05 表示差异显著。
2 结果与分析
2.1 壳聚糖和ε-聚赖氨酸对肉食杆菌的最小抑菌浓度
最小抑菌浓度(MIC)是衡量和评价物质抑菌能力的主要指标之一[26],MIC 值越小,抑菌效果越好,即在较低的质量浓度下,就可以抑制微生物的生长[27]。由表1 和表2 可知,壳聚糖和ε-聚赖氨酸对肉食杆菌的生长均有较好的抑制作用,且抑菌效果随壳聚糖和ε-聚赖氨酸浓度的增大而增强,当壳聚糖和ε-聚赖氨酸分别稀释到最小浓度0.1953 和0.1563 mg/mL 时,培养基上肉眼看不见细菌生长,因此,其MIC 分别为0.1953 和0.1563 mg/mL,而ε-聚赖氨酸对肉食杆菌的MIC 低于壳聚糖对肉食杆菌的MIC,表明ε-聚赖氨酸对肉食杆菌的抑制作用强于壳聚糖。

表1 壳聚糖对肉食杆菌的MICTable 1 MIC of chitosan against Carnobacterium divergens

表2 ε-聚赖氨酸对肉食杆菌的MICTable 2 MIC of ε-polylysine against Carnobacterium divergens
2.2 壳聚糖和ε-聚赖氨酸对肉食杆菌生长曲线的影响
细菌的生长曲线可以直接反映其生长情况及生长速率。在一定的波长范围内,细菌悬液的浓度与吸光度值成正比[28],可通过OD 值变化来评判壳聚糖和ε-聚赖氨酸对肉食杆菌的抑制作用。如图1 所示,CK 组的肉食杆菌呈现出典型的“S”型生长曲线特点。4~10 h 为对数期,该阶段细菌迅速生长,10 h后进入稳定期。壳聚糖和ε-聚赖氨酸的MIC 组和2MIC 组,OD 值基本处于低值波动,显著低于CK组,说明细菌几乎停止生长。加入质量浓度为MIC和2MIC 的壳聚糖和ε-聚赖氨酸延缓了肉食杆菌细胞的生长周期,能有效抑制肉食杆菌的生长。

图1 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌生长曲线的影响Fig.1 Effect of chitosan (a),ε-polylysine (b) on the growth of Carnobacterium divergens
2.3 壳聚糖和ε-聚赖氨酸对肉食杆菌细胞膜通透性的影响
菌液电导率的变化可用来分析壳聚糖和ε-聚赖氨酸对肉食杆菌细胞膜的通透性的影响[29]。图2中,壳聚糖和ε-聚赖氨酸的MIC 组和2MIC 组的电导率均显著增加(P<0.05),而CK 组的电导率较为稳定。正常情况下,细胞内外离子在细胞膜屏障下,会保持动态平衡,膜外环境的电导率基本保持不变。CK 组菌液在2 h 内的电导率增加较明显,随后维持在相对稳定状态。在壳聚糖和ε-聚赖氨酸的作用下,肉食杆菌的细胞膜被破坏,失去保护能力和屏障作用,使原本细胞内容物中的带电离子泄漏到细胞膜外,包括K+、Ca2+、Na+,导致膜外环境的电导率升高[30],图2 中MIC 与2MIC 组菌液的电导率始终高于CK 组,壳聚糖的增长速率高于ε-聚赖氨酸,其与处理液浓度呈正相关。壳聚糖和ε-聚赖氨酸可以通过损伤细胞膜,增加细胞膜的通透性,影响其正常代谢,从而抑制细菌生长[31]。
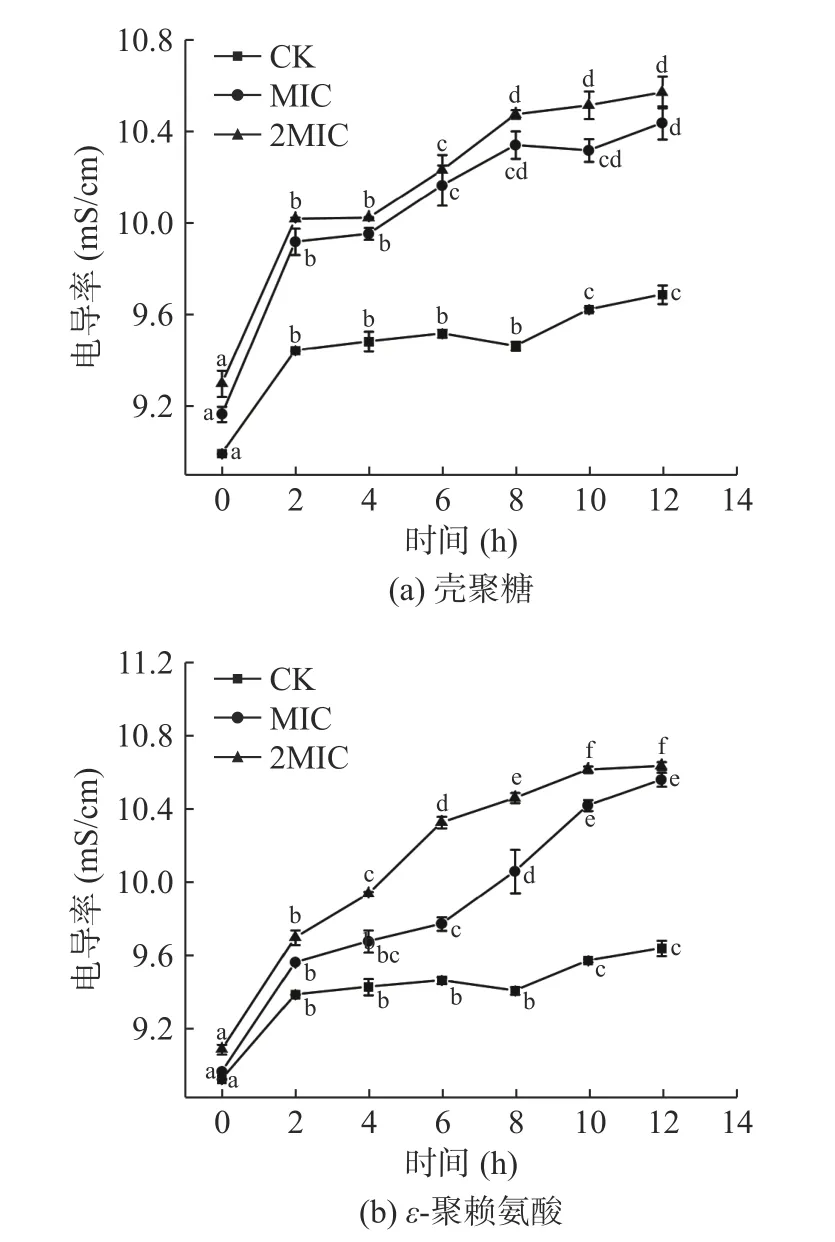
图2 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌细胞膜通透性的影响Fig.2 Effect of chitosan (a),ε-polylysine (b) on cell membrane permeability of Carnobacterium divergens
2.4 壳聚糖和ε-聚赖氨酸对肉食杆菌核酸泄漏的影响
核酸具有编码合成蛋白质的功能,在细胞的生命活动中起着重要作用[32],如果细胞内核酸丢失,将会导致细胞死亡。在不同培养时间,细胞内的核酸泄漏情况如图3 所示。各组的OD 值均呈现出上升趋势,MIC 和2MIC 的壳聚糖和ε-聚赖氨酸的OD 值均显著增大(P<0.05)。壳聚糖的MIC 组和2MIC组OD 值在4 h 后明显增长,ε-聚赖氨酸处理的MIC 组和2MIC 组OD 值在0~4 h 内增长最快,之后增长速度减慢,说明壳聚糖和ε-聚赖氨酸破坏了肉食杆菌的细胞膜,导致细胞内核酸不断从细胞膜内流出,破坏强度与浓度呈正相关。因此,壳聚糖和ε-聚赖氨酸不仅破坏细胞结构,还导致胞内遗传物质的泄漏,从而影响细胞的正常生理活动。

图3 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌核酸泄漏的影响Fig.3 Effect of chitosan (a),ε-polylysine (b) on extracellular nucleic acid of Carnobacterium divergens
2.5 壳聚糖和ε-聚赖氨酸对肉食杆菌胞外蛋白质量浓度的影响
由图4 可知,CK 组中胞外蛋白质量浓度趋于平稳,且均低于MIC 组和2MIC 组的胞外蛋白质量浓度,说明壳聚糖和ε-聚赖氨酸具有损伤细胞,破坏细胞的完整性,导致胞内蛋白质大量外泄的效果。0~2 h 内,壳聚糖作用菌液后的胞外蛋白质量浓度显著增加(P<0.05),4 h 后有轻微波动,2MIC 组的壳聚糖在6 h 有最大值为0.344 mg/mL。而ε-聚赖氨酸的MIC 组和2MIC 组是在4 h 后胞外蛋白质量浓度迅速增加,2MIC 组的ε-聚赖氨酸在6 h 有最大值为0.4287 mg/mL,随后趋于稳定。两者相比之下,壳聚糖抑菌的速度远远大于ε-聚赖氨酸,可明显抑制肉食杆菌的生长繁殖。细胞膜通透性增加,胞内蛋白外泄,引起胞外蛋白迅速增加,且高浓度壳聚糖和ε-聚赖氨酸对肉食杆菌蛋白质泄漏影响更剧烈,可能导致菌体内可利用的蛋白质较少[33],菌体无法继续繁殖,甚至死亡。
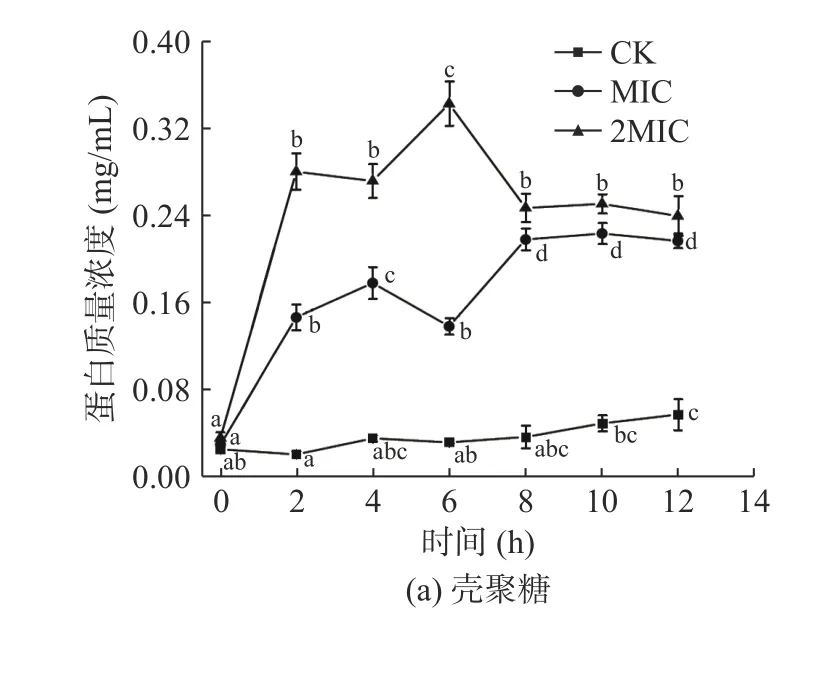

图4 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌胞外蛋白质量浓度的影响Fig.4 Effect of chitosan (a),ε-polylysine (b) on extracellular protein concentration of Carnobacterium divergens
2.6 壳聚糖和ε-聚赖氨酸对肉食杆菌细胞壁完整性的影响
碱性磷酸酶(AKP)主要存在于细胞壁与细胞膜间。当细胞结构被破坏时,AKP 会从细胞内渗出。可通过测定AKP 的活力变化来判断抑菌剂对菌体细胞壁的破坏情况[34]。由图5 所示,MIC 和2MIC的壳聚糖和ε-聚赖氨酸的AKP 活力均显著增加(P<0.05),而CK 组中的AKP 活力均维持较为稳定的水平。在0~2 h 时,检测到壳聚糖中MIC 组和2MIC 组的AKP 大量渗出,随后趋于稳定,且壳聚糖2MIC 组的菌液中的AKP 泄漏量高于MIC 组。当ε-聚赖氨酸作用于肉食杆菌时,0~2 h 内,MIC 组的菌液中AKP 活力迅速增加且高于2MIC 组,可能由于菌体受到高质量浓度的ε-聚赖氨酸后,刺激其自我修复功能,少数菌体恢复活力,继续生存繁殖[35]。壳聚糖和ε-聚赖氨酸可通过诱导细胞膜损伤而后作用在细胞壁,增加细胞壁的通透性,导致大量AKP 渗漏到细胞外。壳聚糖和ε-聚赖氨酸相比之下,壳聚糖的抑菌时间更短,可能是当壳聚糖达到高浓度时,也会诱导几丁质蛋白酶,即激发某些细菌本身的几丁质蛋白酶活力,使其降解微生物自身细胞壁的几丁质,细胞壁遭到破坏,细菌被杀灭,达到抑菌作用[36]。
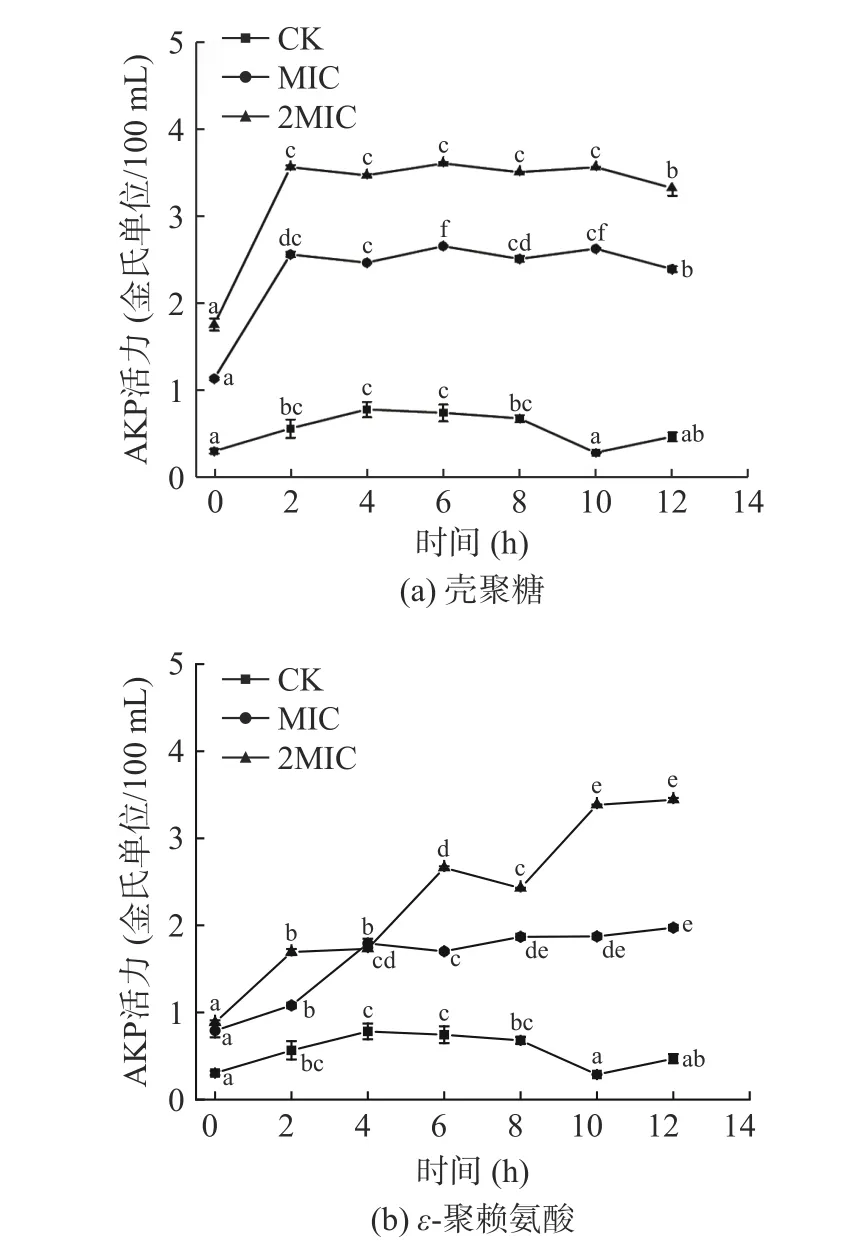
图5 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌细胞壁完整性的影响Fig.5 Effect of chitosan (a),ε-polylysine (b) on cell wall integrity of Carnobacterium divergens
2.7 壳聚糖和ε-聚赖氨酸对肉食杆菌CAT 活力的影响
过氧化氢酶(CAT)存在于细胞的过氧化物酶体内,能将过氧化氢催化分解为氧气和水,避免机体受到氧化损伤[37]。由图6 可知,CK 组菌体内CAT 活性较为稳定。壳聚糖和ε-聚赖氨酸处理导致肉食杆菌的CAT 活性先升高后降低。0~4 h 内,壳聚糖MIC组和2MIC 组的菌体CAT 活力显著升高(P<0.05),CAT 活力分别达到了13.58、15.44 U/mg。4 h 后,菌体内CAT 活性明显下降,在12 h 时,CAT 活力分别为5.92、3.81 U/mg。ε-聚赖氨酸MIC 组和2MIC组的CAT 活力迅速上升,在4 h 时MIC 组达到了15.93 U/mg,而2MIC 组在2 h 时达到最大值15.83 U/mg,随着抑菌时间的延长,在12 h 时出现最小值分别为5.50、3.77 U/mg。肉食杆菌在壳聚糖和ε-聚赖氨酸的逆环境胁迫下,CAT 酶活力前期呈上升趋势,可能是菌体为维持自身的氧化平衡状态,提高过氧化氧化酶活性,从而清除过量过氧化物的一种自我调节与保护作用[38]。后期呈下降趋势,可能由于高浓度的壳聚糖和ε-聚赖氨酸削弱了菌体细胞自身清除过氧化物的能力,加剧氧自由基的积累[39],细胞通透性增加,蛋白质变性严重,导致酶活性完全被抑制,造成菌体自身防御机能降低而死亡。
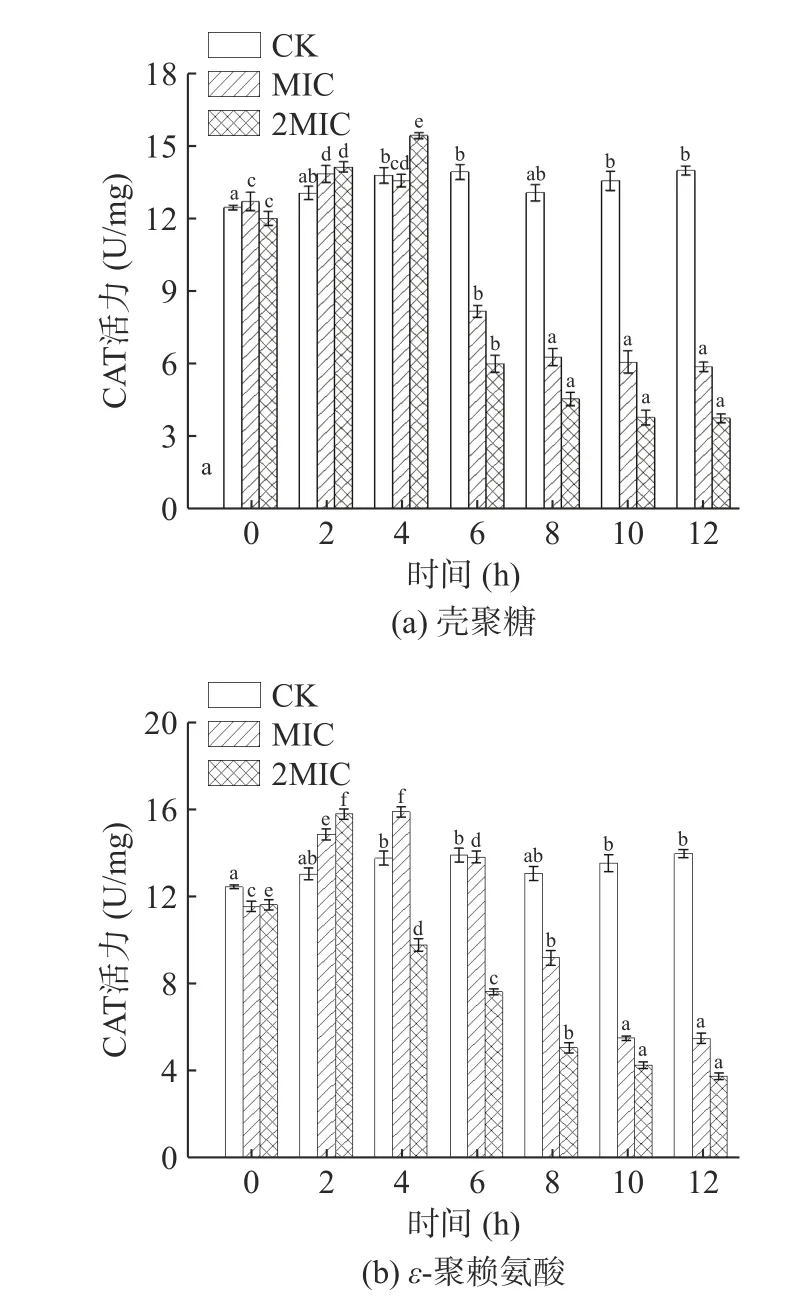
图6 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌CAT酶活力的影响Fig.6 Effect of chitosan (a),ε-polylysine (b) on CAT enzyme activity of Carnobacterium divergens
2.8 壳聚糖和ε-聚赖氨酸对肉食杆菌SOD 活力的影响
超氧化物歧化酶(SOD)是一种抗氧化金属酶,负责分解细胞体内超氧化物自由基,催化超氧阴离子(O2-)自由基歧化生成氧和过氧化氢,减少对膜的损害[40],在生物体氧化平衡中发挥关键作用。如图7所示,随着抑菌时间和抑菌剂(壳聚糖、ε-聚赖氨酸)浓度的升高,菌体细胞 SOD 活性呈现先升高,壳聚糖在4 h 达到最大活性,此时MIC 组和2MIC 组的SOD 活力分别为76.96、78.04 U/mg,4 h 后呈现下降趋势。而ε-聚赖氨酸在6 h 达到最大活性,此时MIC组和2MIC 组的SOD 活力分别为 74.35、71.17 U/mg,随后其SOD 活力迅速下降。因此,前期SOD 活力呈上升趋势,说明此时肉食杆菌受到壳聚糖和ε-聚赖氨酸的损害,可能胁迫作用导致细胞内超氧阴离子自由基代谢平衡被破坏[41],使SOD 活力升高。随后SOD 活力迅速下降,可能由于壳聚糖和ε-聚赖氨酸对菌体的影响发挥主导作用,影响了蛋白质与SOD生成,使SOD 对超氧离子清除率下降,导致超氧阴离子自由基的积累[42],影响机体氧化应激系统的动态平衡,触发细胞凋亡或坏死性死亡。

图7 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌SOD酶活力的影响Fig.7 Effect of chitosan (a),ε-polylysine (b) on SOD activity of Carnobacterium divergens
2.9 壳聚糖和ε-聚赖氨酸对肉食杆菌细胞形态的影响
通过扫描电子显微镜对菌体进行形态观察,更直观看到壳聚糖和ε-聚赖氨酸作用后肉食杆菌的细胞形态变化,结果如图8 所示。从图8 中(a1)、(a2)可以看出,CK 组的肉食杆菌的细胞呈正常的短棒状,细胞边界清晰,结构完整、形态饱满、表面光滑、分布均匀,没有细胞破裂或内容物溢出等现象。相比之下,壳聚糖实验组的变化则较为明显,壳聚糖的MIC 组和2MIC 组作用后,从图8 中(b1)、(b2)可知,肉食杆菌的细胞形态发生较大变化,观察到菌体表面粗糙,细胞出现扭曲变形,图8 中(c1)、(c2)的菌体变形的同时,细胞质从菌体细胞体内大量渗出,基本没有形态正常的细胞;ε-聚赖氨酸的MIC 组作用肉食杆菌后(图8 中(d1)、(d2)),肉食杆菌的细胞形态受到严重破坏,菌体表面粗糙,菌体发生扭曲变形,出现褶皱凹陷,ε-聚赖氨酸的2MIC 组作用后(图8中(e1)、(e2)),出现褶皱和扭曲变形的现象更加明显,细胞表面粗糙不平并出现孔洞,细胞内容物外泄。细胞形态改变可能是壳聚糖和ε-聚赖氨酸破坏了细菌的细胞膜,引起胞内物质外泄所致,最终导致菌体死亡。
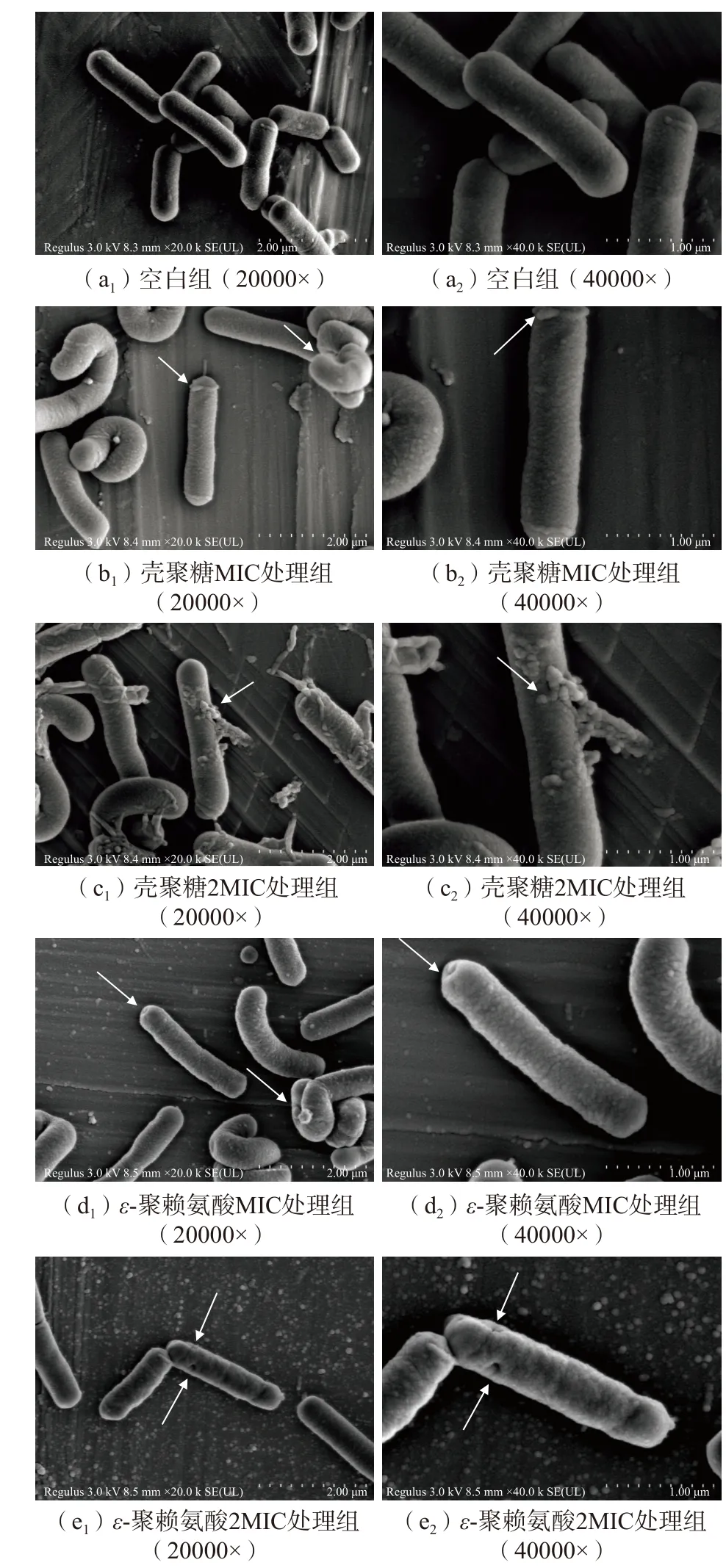
图8 壳聚糖(a)、ε-聚赖氨酸(b)对肉食杆菌处理前后微观结构的扫描电子显微镜观察Fig.8 Scanning electron microscopic observation of the microstructure of Carnobacterium divergens before and after treatment with chitosan (a) and ε-polylysine (b)
3 结论
本文研究表明,壳聚糖和ε-聚赖氨酸对肉食杆菌有良好的抑菌效果,能显著减缓细菌生长速率,损伤肉食杆菌的细胞膜,使细胞内物质向外渗出,导致电导率增大,胞外核酸和蛋白含量明显增加,从而导致菌体死亡。同时,AKP 活力增大,表明细胞壁完整性受损,抗氧化酶(CAT、SOD)活力降低,使菌体不能清除体内的自由基,造成菌体不可逆损伤,从而失去代谢和增殖活性。扫描电镜图显示,壳聚糖可使菌体细胞壁与细胞膜的通透性增加,核酸、蛋白质、Na+、K+等内容物发生泄漏,明显抑制细菌的正常生长,ε-聚赖氨酸能使菌体褶皱和扭曲变形的现象明显,细胞表面粗糙不平并出现孔洞,细胞内容物外泄,破坏微生物的正常生理代谢,最终导致细胞死亡。本文初步探究壳聚糖和ε-聚赖氨酸对肉食杆菌的抑菌机理,也为这两种天然抑菌剂在食品工业中的应用提供一定的理论参考。

