平胃胶囊对恶变后GES-1细胞氧化应激的抑制作用及机制研究*
王丽娟, 汪龙德, 牛小英, 汪 霞, 张瑞婷, 吴毓谦, 樊泽坤
(1甘肃中医药大学,甘肃 兰州 730000,2甘肃中医药大学附属医院,甘肃 兰州 730020)
胃癌(gastric cancer, GC)是世界范围内常见的恶性肿瘤之一,每年新发病例约为40 万人,死亡病例约29.1 万人[1]。胃癌前病变(precancerous lesion of gastric cancer, PLGC)是指胃黏膜从慢性炎症阶段,逐渐发展转变至癌的过程,即Correa 模式:浅表性胃炎-萎缩性胃炎-肠上皮化生-异型增生[2]。据统计,PLGC 患者在随访后10 年内罹患GC 的风险显著升高。因此,预防PLGC的发生发展对降低消化系统疾病癌变尤为重要。而研究显示,PLGC 与氧化应激有着密切的联系[3]。正常生理情况下,机体内活性氧(reactive oxygen species, ROS)的生成与清除处于动态平衡,适量的ROS对于人体杀灭病原菌,以及维持免疫功能等均有重要的生理意义。然而生物体细胞在遇到各种应激刺激时,会产生过多的ROS 导致体内生物大分子以及细胞结构发生氧化损伤以及炎症反应进而使细胞发生癌变。研究表明,GC 患者血清及胃黏膜中ROS 增多,抗氧化酶活性降低[4-5]。尽管有胃黏膜为其提供了保护屏障,但摄入的食物和微生物病原体仍可诱导氧化损伤和胃肠道上皮细胞发生炎症反应,最终导致DNA 的氧化损伤以及进一步的ROS蓄积和炎症反应。开发具有抗氧化活性的药物已成为PLGC 研究的目标和有效策略。临床疗效显著的平胃胶囊(Pingwei capsule/Pingwei Jiaonang,PWJN)方中苍术、柴胡、厚朴、延胡索、陈皮等药物均具有不同程度的抗氧化作用[6-9],这也为本实验的开展提供了新的研究思路。因此,本研究采用亚硝酸胺类化合物N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)模拟生活环境和食物中N-亚硝胺的有害化学物质诱导GES-1 细胞发生氧化损伤[10-11],观察PWJN 对MNNG 诱导的GES-1细胞氧化损伤的作用,并探讨其作用机制,为研究PWJN防治PLGC提供参考资料。
材 料 和 方 法
1 动物及细胞
SPF 级SD 雄 性 大 鼠15 只,6~8 周 龄,体 质 量(200±20) g,购自甘肃中医药大学实验动物中心[动物合格证号为No.62001000000709;实验动物使用许可证号为SYXK(甘)2020-0009;实验动物生产许可证号为SCXK(甘)2020-0001]。本研究通过甘肃中医药大学大学伦理委员会审查,伦理编号为2022-701,饲养条件均已达标。GES-1 细胞购自上海富衡生物科技有限公司(货号为FH0273)。
2 药物与试剂
PWJN 为甘肃中医药大学附属医院院内制剂(批准文号:甘药制字Z120022224;批号:20230201);MNNG 购自上海麦克林生化科技有限公司;ROS 测定试剂盒和JC-10 线粒体膜电位荧光探针溶液均购自大连美仑生物技术有限公司;丙二醛(malondialdehyde, MDA)测定试剂盒购自江苏麦莎实业有限公司;超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)测定试剂盒均购自南京建成生物科技有限公司;Ki67 抗体购自BOSTER;白细胞介素6(interleukin-6, IL-6)抗体和黑色素瘤分化相关基因7(melanoma differentiation-associated gene-7, MDA-7)抗体均购自BIOSS。
3 主要方法
3.1 含药血清的制备 随机将SD 大鼠分为PWJN组10 只,空白组5 只。按照人与动物体表面积折算等效剂量比值,PWJN 灌胃的大鼠使用PWJN 的等效剂量为:6.3×6 g/60 kg,得出大鼠PWJN 高剂量配比为48 g/L,每只大鼠给予2 mL PWJN 溶液进行灌胃,每日2次,空白组灌胃等量生理盐水,每日2次,连续给药3天,末次灌胃2 h后,3%戊巴比妥钠5 mL/kg麻醉,腹主动脉取血,静置2~3 h,离心分离血清,用一次性无菌滤器过滤备用;经56 ℃水浴中灭活处理30 min后,-80 ℃冰箱中保存备用。
3.2 细胞株培养模型制备及分组 GES-1细胞用含10%胎牛血清、100 U/mL 青霉素和100 mg/L 链霉素的DMEM 高糖培养液于37 ℃、5% CO2培养箱中培养。参照MNNG 诱导GES-1 细胞恶性转化细胞模型的建立方法[12-13],将MNNG 以20 μmol/L[14]浓度溶解在二甲基亚砜(dimethyl sulfoxide, DMSO)中,避光条件干预GES-1 细胞24 h。去除含有MNNG 的培养液,加入含10%胎牛血清的培养液。1周内可见大量细胞死亡脱落,期间正常换液,当残存细胞生长至70%~80%时进行传代并命名为MC细胞。
3.3 细胞分组及给药 将细胞分为正常组、模型组、空白血清组和PWJN 含药血清组。除正常组外,其余各组加入已配好的MNNG 工作液,正常组加入等剂量不完全DMEM 培养液继续培养。最佳造模时间后弃去原培养液,PBS洗涤2次,PWJN含药血清组加入已筛选的最佳浓度PWJN 含药血清,空白血清组加入同等浓度的空白血清继续培养24 h。
3.4 筛选PWJN含药血清的最佳干预浓度及时间实验分组:对照组(10%胎牛血清)、空白血清组(10%胎牛血清+10%空白血清)、10%含药血清组(10%胎牛血清+10%含药血清)、5%含药血清组(10%胎牛血清+5%空白血清+5%含药血清)、3.3%含药血清组(10%胎牛血清+6.7%空白血清+3.3%含药血清)、2.5%含药血清组(10%胎牛血清+7.5%空白血清+2.5%含药血清)、2%含药血清组(10%胎牛血清+8%空白血清+2%含药血清)、1.7%含药血清组(10%胎牛血清+8.3%空白血清+1.7%含药血清)、1.4%含药血清组(10%胎牛血清+8.6%空白血清+1.4%含药血清)和1.2%含药血清组(10%胎牛血清+8.8%空白血清+1.2%含药血清)。
当MC 细胞汇合度达到70%~80%时,制备单细胞悬液,96 孔板接种细胞,继续培养12 h,弃去原培养液,按照设置组别分别配制相应的培养液,依次加入对应孔中,分别培养24、48 和72 h 后于每孔分别加入10 μL CCK-8 试剂,孵育2 h,于酶标仪450 nm波长处读取吸光度(A)。细胞活力(%)=A实验组/A对照组×100%。
3.5 荧光探针DCFH-DA 检测ROS 含量 PWJN 组用已筛选的最佳含药血清预处理48 h,待各组细胞汇合度达到70%~80%时,加入1 mL 含有DCFH-DA 探针(10 μmol/L)的PBS,常温孵育30 min,在激光共聚焦显微镜(Ex:488 nm,Em:525 nm)下进行观察拍照。
3.6 ELISA 法测定MC 细胞中MDA 浓度 PWJN 组用已筛选的最佳含药血清预处理48 h,待汇合度达到70%~80%时收集各组细胞,PBS 清洗,收集沉淀细胞,研磨破碎细胞后离心收集上清液,按照试剂说明书进行稀释、加样、洗涤,加酶标抗体,进行显色、比色等操作。用酶标仪在450 nm波长处测定各孔的A值。
3.7 生化法检测细胞中SOD和GSH-Px活性 PWJN组用已筛选的最佳含药血清预处理48 h,待各组细胞汇合度达到70%~80%时收集各组细胞,PBS 清洗,离心收集细胞,研磨破碎后离心取上清液,按照试剂说明书进行检测。
3.8 JC-10检测MC细胞线粒体膜电位 PWJN组用已筛选的最佳含药血清预处理48 h,待各组细胞汇合度达到70%~80%时,加入1 mL 培养液和1 mL JC-10染色工作液,充分混匀,37 ℃孵育30 min。配制JC-10染色缓冲液,放置冰浴。37 ℃孵育结束后,用JC-10染色缓冲液洗涤2次(冰浴),荧光显微镜观察拍照。
3.9 实时荧光定量PCR 检测细胞中Ki67 和MDA-7的mRNA 表达 收集细胞提取总RNA,用逆转录试剂盒逆转录成cDNA。采用7500 real-time PCR 仪检测,反应条件包括逆转录反应和逆转录酶失活反应,每个样本重复6 孔。随后采用2-ΔΔCt法计算mRNA 相对表达水平,用于PCR的特异性引物见表1。
3.10 Western blot 测定细胞中Ki67、MDA-7 和IL-6蛋白表达 细胞处理后弃去原培养液,PBS 清洗、刮取细胞、离心15 min 弃上清,加入300 μL RIPA 裂解液,混匀冰上裂解15 min,再次离心取上清,进行BCA蛋白定量及蛋白变性。经10% SDS-PAGE后,转膜至PVDF 膜、5%脱脂奶粉溶液室温封闭2 h、加入Ⅰ抗(Ki67、IL-6 和MDA-7 抗体,1∶1 000;内参照GAPDH抗体,1∶2 000),4 ℃过夜孵育,洗膜后Ⅱ抗(1∶4 000)孵育1 h,ECL发光定影,用ImageJ软件分析灰度值。
4 统计学处理
采用SPSS 25.0 统计软件分析数据。计量数据采用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 MC细胞模型验证
1.1 倒置显微镜下观察细胞形态 倒置显微镜下正常组GES-1 细胞形态规则,排列稀疏整齐,呈散在性生长,经MNNG 处理后,部分细胞死亡,残存细胞形态不规则,外形模糊,排列零乱,呈“岛样”克隆样生长,以梭形细胞环绕,胞浆内可见空泡,也可见多核巨大细胞,见图1。

Figure 1. Inverted microscopic observation of cell morphology for model evaluation. A: GES-1 normal cells; B: GES-1 cells after 24 h of MNNG intervention; C: MC cells after modeling. After MNNG treatment, the morphology of GES-1 cells gradually becomes irregular, and some cells die. Image C shows that the remaining cell morphology is blurred, arranged disorderly,showing "island-like" clonal growth, clear boundaries between clones, spindle-shaped cells around, multinucleated giant cells, and vacuoles in the cytoplasm.图1 倒置显微镜观察细胞形态进行模型评价
1.2 免疫荧光法检测促癌因子Ki67 表达水平 通过荧光染色显微镜观察可见正常组GES-1 细胞中Ki67 几乎不表达;与正常组相比,MC 模型组中Ki67表达显著升高(P<0.01),提示MC 细胞模型成功建立,见图2。
2 PWJN 对MNNG 损伤的MC 细胞给药浓度及时间筛选
筛选PWJN 含药血清时间及浓度结果显示,相对胎牛血清及空白血清,PWJN 含药血清干预48 h时,不同浓度梯度对MC 细胞均具有抑制作用,故选用48 h 作为最佳干预时间;对比48 h 不同浓度含药血清对MC 细胞抑制率,含药血清呈剂量依赖性对MC 细胞具有抑制作用,当含药血清体积分数为5%时对MC 细胞抑制率可达30%,故选用5%的含药血清进行后续实验,见表2。

表2 不同处理时间和浓度平胃胶囊含药血清对MC细胞活力的影响Table 2. The effect of different treatment time and concentrations of Pingwei capsule-containing serum on the viability of MC cells(Mean±SD. n=3)
3 倒置显微镜下各组细胞形态学观察
通过倒置显微镜进行细胞形态观察,与正常组相比,模型组与空白血清组细胞形态不规则,排列零乱,细胞多呈“岛样”克隆样生长,胞浆内可见空泡,并出现多核巨大细胞;与空白血清组相比,PWJN 组细胞形态逐渐规则,排列稀疏整齐,呈散在性生长,见图3。

Figure 3. Morphological observation of the cells in each group under an inverted microscope. Compared with control group, the cells in model group showed irregular morphology and disordered arrangement, some cells exhibited "island-like" clonal growth,spindle-shaped cells and multinucleated giant cells were visible around, and vacuoles were observed in the cytoplasm.There was no significant change in cell morphology between model group and blank serum group. Compared with blank serum group, the cells in PWJN group gradually became regular, sparse, and orderly arranged, showing scattered growth.图3 倒置显微镜细胞形态观察
4 PWJN对MC细胞ROS含量的影响
活性氧荧光探检测结果显示,与正常组相比,模型组ROS 含量显著增多(P<0.01);模型组与空白血清组中ROS 含量无显著差异(P>0.05);与空白血清组相比,PWJN 组ROS 含量显著减少(P<0.01),见图4。
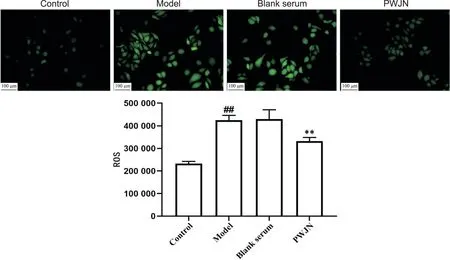
Figure 4. Detection of intracellular ROS levels using the fluorescent probe. Mean±SD. n=3. ##P<0.01 vs control group; **P<0.01 vs blank serum group.图4 荧光探针检测细胞内ROS水平
5 PWJN对MC细胞MDA浓度的影响
本研究结果显示,与正常组相比,模型组MDA浓度显著升高(P<0.01);模型组与空白血清组无显著差异(P>0.05);与空白血清组相比,PWJN 组MDA浓度显著降低(P<0.01),见图5。

Figure 5. The MDA content. Mean±SD. n=3. ##P<0.01 vs control group; **P<0.01 vsblank serum group.图5 MDA含量
6 PWJN 对MC 细胞SOD 活性和GSH-Px 含量的影响
本研究结果显示,与正常组相比,模型组SOD、GSH-PX活性显著降低(P<0.01);模型组与空白血清组中SOD、GSH-PX活性无显著差异(P>0.05);与空白血清组相比,PWJN 组SOD 和GSH-Px 含量显著升高(P<0.01),见图6。
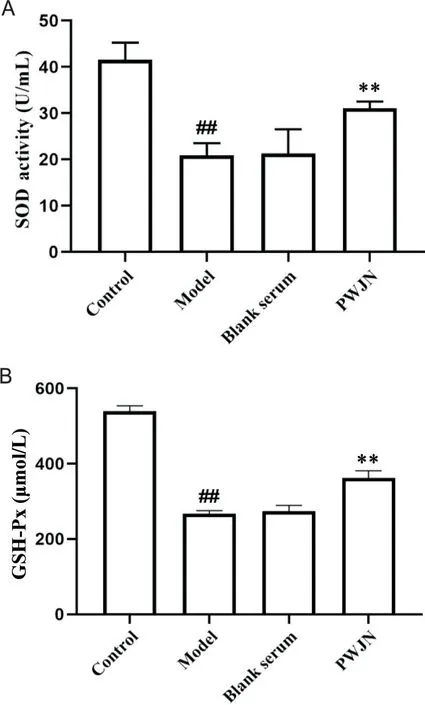
Figure 6. The SOD activity and GSH-Px concentration. Mean±SD. n=3. ##P<0.01 vs control group; **P<0.01 vs blank serum group.图6 SOD活性及GSH-Px浓度
7 PWJN对MC细胞线粒体膜电位的影响
新型荧光探针JC-10 标记细胞线粒体膜电位结果显示,与正常组相比,模型组中绿色荧光显著增多(P<0.01),红色荧光显著减少(P<0.01);模型组与空白血清组线粒体膜电位无显著差异(P>0.05);与空白血清组相比,PWJN 组绿色荧光显著减少(P<0.01),红色荧光显著增强(P<0.01),见图7。
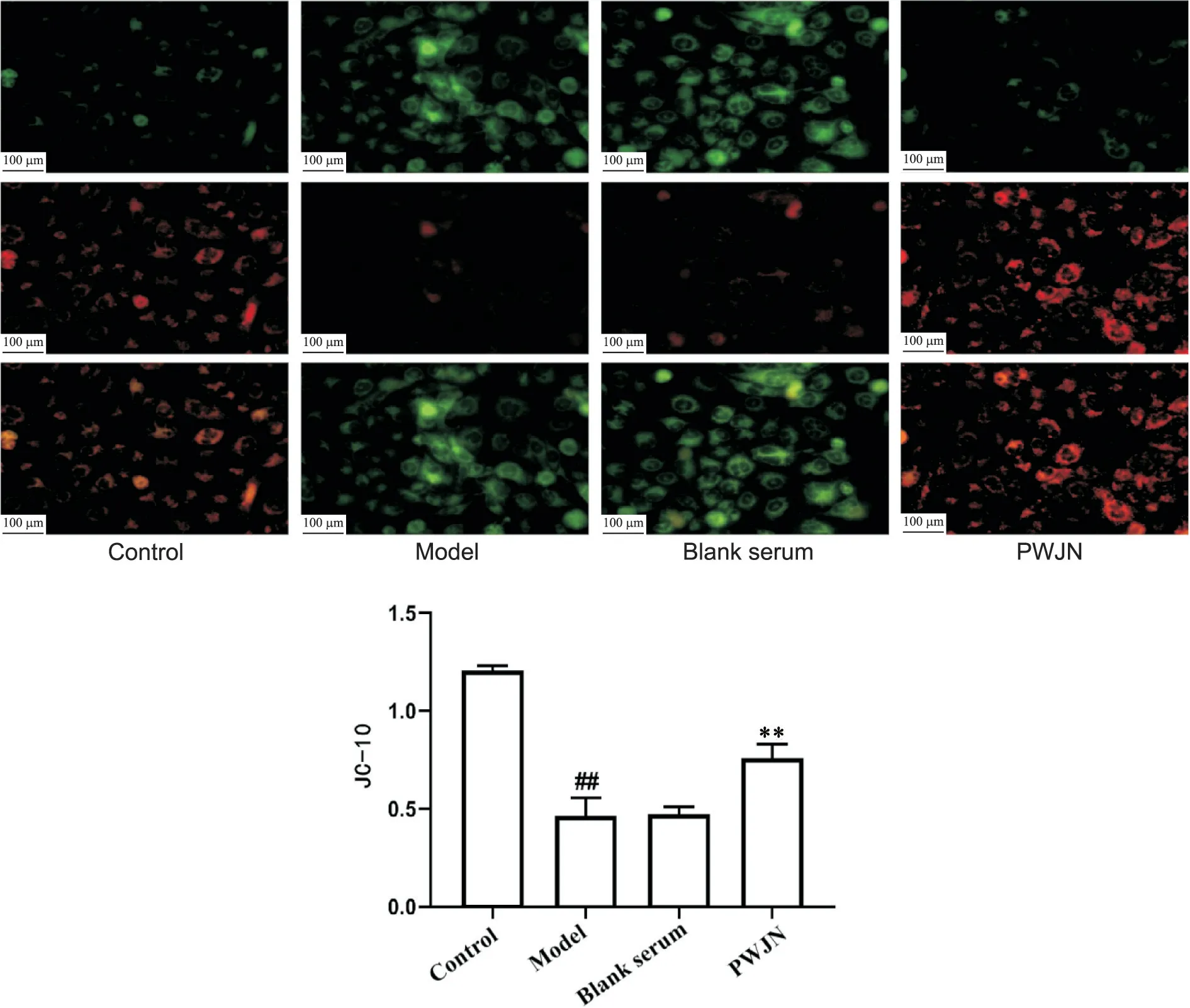
Figure 7. Fluorescent probe JC-10 was used to detect the level of mitochondrial membrane potential. Mean±SD. n=3. ##P<0.01 vs control group; **P<0.01 vs blank serum group.图7 荧光探针JC-10检测细胞线粒体膜电位水平
8 PWJN 对MC 细 胞 中Ki67 和MDA-7 mRNA 表达的影响
本研究结果显示,与正常组相比,MC 模型组Ki67 mRNA 表达显著增高(P<0.01),MDA-7 mRNA表达显著降低(P<0.01);MC模型组与空白血清组中Ki67 和MDA-7 mRNA 表达无显著差异(P>0.05);与空白血清组相比,PWJN 组Ki67 mRNA 表达显著降低(P<0.01),MDA-7 mRNA 表达显著升高(P<0.01),见图8。

Figure 8. The mRNA expression levels of Ki67 and MDA-7 in the cells. Mean±SD. n=3. ##P<0.01 vs control group; **P<0.01 vs blank serum group.图8 各组细胞中Ki67和MDA-7 mRNA表达水平
9 PWJN 对MC 细胞中Ki67、IL-6 和MDA-7 蛋白表达水平的影响
本研究检测结果显示,与正常组相比,MC 模型组Ki67 和IL-6 蛋白表达显著升高(P<0.01),MDA-7蛋白表达显著降低(P<0.01);模型组与空白血清组中Ki67、IL-6 和MDA-7 蛋白表达无显著差异(P>0.05);与空白血清组相比,PWJN 组Ki67 和IL-6 蛋白表达显著降低(P<0.01),MDA-7 蛋白表达显著升高(P<0.01),见图9。

Figure 9. The protein expression levels of Ki67, IL-6 and MDA-7 in the cells. Mean±SD. n=3. ##P<0.01 vs control group; **P<0.01 vsblank serum group.图9 各组细胞中Ki67、IL-6和MDA-7蛋白表达水平
讨 论
中医学将PLGC 根据胃脘部痞塞不通、满闷不舒、望之胀形、触之无块、压之不痛等临床特点,将其归属于“痞满”“胃脘痛”“嘈杂”等范畴。其根本病机是脾胃受损导致脾胃虚弱,致使运化无力,纳食不佳,脾不能升清,胃不能降浊,气滞,湿热停聚胃脘,久而化毒,瘀滞脉络。PWJN 由苍术、柴胡、厚朴、浙贝母、延胡索、枳壳、陈皮、木香、黄连、蒲公英、海螵蛸、赤芍、三棱、莪术、鸡内金、白及共16 味药组成,传承了国医大师周信有教授“复方多法、综合运用、整体调节”的学术思想,在宋代《太平惠民和剂局方》平胃散的基础上加减化裁而来,全方共奏疏肝理气、燥湿健脾、和胃止痛、活血消滞之效。
研究显示[15]经MNNG 诱导后的大鼠胃黏膜中ROS,MDA 等活性氧物质显著表达。而ROS,MDA等活性氧物质不仅能改变细胞膜通透性,使细胞线粒体膜电位下降,还会引起炎症因子的释放。IL-6是一种多功能促炎细胞因子[16],在机体炎症感染、促进肿瘤发生发展中发挥作用,Ki67 作为一种敏感又特异的肿瘤细胞标志物,常用于衡量肿瘤细胞的增殖,评价其生物学行为[17]。促癌因子MDA-7 作为肿瘤抑制基因,在多种肿瘤组织中呈现低表达状态,对人类多种肿瘤细胞的生长具有抑制作用[18],尤其对人SGC7901胃癌细胞系具有较强的抑制作用[19]。
本研究通过MNNG 诱导GES-1 细胞使细胞内氧化-还原反应速率失衡,使细胞发生了氧化损伤。从细胞形态看,经MNNG 诱导破坏了原有细胞的正常细胞形态,加速了增殖,使细胞出现了一系列类似肿瘤细胞的特性,经PWJN 干预能明显修复被破坏的细胞形态,抑制其增殖;氧化损伤后的细胞内不仅ROS、MDA 浓度显著升高,而且抗氧化酶SOD、GSHPX活性显著降低,经PWJN 干预能显著提高SOD、GSH-PX活性,而高浓度的ROS和MDA 能得到有效抑制;经MNNG 诱导也加速了炎症因子IL-6 和促癌因子Ki67 的释放,而抑癌因子MDA-7 明显被抑制,经PWJN 干预又能促进抑癌基因MDA-7 的表达,且抑制IL-6 和Ki67 的释放。因此推测,PWJN 可能通过增强细胞内抗氧化酶活性,提高细胞抗氧化能力,进而降低活性氧物质的生成以及大量活性氧物质引起的炎症和癌变损伤,体现了中药调节细胞内环境,恢复机体平衡状态而防治疾病的作用机制。
综上所述,本研究证实了PWJN 可以有效抑制胃黏膜上皮细胞的氧化损伤,保护细胞正常功能。其作用机制可能与上调SOD、GSH-PX抗氧化酶活性,下调IL-6 和Ki67 的表达,促进抑癌因子MDA-7 的释放,减缓胃黏膜细胞的恶性癌变有关。但中药复方是通过多途径、多靶而发挥治疗作用,PWJN 中药味较多,具体是哪几味药的哪些成分通过调控氧化-抗氧化平衡而起到治疗作用尚不明确,在今后的研究中课题组将进一步明确该方的有效成分及有效部位群,并增加细胞系或小分子抑制剂作为阳性对照进行深入研究,以明确PWJN 治疗PLGC 的具体作用机制。

