Piezo1通道激活促进大鼠冠脉平滑肌细胞内钙浓度升高的机制研究*
蔡泳江, 郑燕湘, 王梓帆, 邝素娟, 杨 慧, 饶 芳, 邓春玉,3△
(1南方医科大学药学院,广东 广州 510515;2南方医科大学附属广东省人民医院,广东省医学科学院,医学研究部临床药理重点实验室,广东 广州 510080;3华南理工大学医学院,广东 广州 510006)
Piezo1是一种机械敏感性离子通道蛋白,主要存在于内皮细胞、血管平滑肌细胞(vascular smooth muscle cells, VSMCs)和成纤维细胞等细胞中,能介导Na+、K+、Ca2+和Mg2+等阳离子内流,但对Ca2+具有偏向性[1]。Ca2+是VSMCs 内重要的第二信使,可以激活钙蛋白酶并调控多种转录因子,参与VSMCs 多种生理病理过程。VSMCs 中Ca2+调控方式包括细胞外Ca2+内流和细胞内Ca2+库的Ca2+释放。Piezo1 能感应机械力刺激并将机械信号转化为胞内Ca2+信号,这种钙信号转导可参与调控多种心血管生理功能已被明确[2],而且Piezo1 介导钙信号失调也与血管病变有关[3-4]。研究表明,Piezo1 介导细胞钙调控信号与心血管疾病存在密切关系,但是Piezo1 对细胞钙调节方式的研究报道较少,尤其是促进冠状动脉平滑肌细 胞(coronary artery smooth muscle cells, CASMCs)内Ca2+浓度升高的作用机制,更鲜为报道。因此,本研究主要在细胞水平上,探究Piezo1 参与调控大鼠CASMCs中Ca2+稳态的作用机制。
材 料 和 方 法
1 动物
SPF 级9~11 周 龄 雄 性SD 大 鼠30 只,体 质 量250~300 g,由广州锐格生物科技有限公司提供,许可证号为SCXK(粤)2021-0059。本研究所有动物实验已通过广东省人民医院(广东省医学科学院)的动物实验伦理审查(No. KY-Z-2021-581-01)。
2 主要实验仪器和试剂
SP5FCS 激光共聚焦显微镜(Leica);LSM900 激光共聚焦显微镜和Stemi DV4型体视显微镜(Zeiss);蛋白电泳仪和转膜仪(北京市六一仪器厂);LAS500超灵敏化学发光成像仪(GE)。
DMEM 培养液(C11885500BT)、澳洲胎牛血清(fetal bovine serum, FBS)、0.25%胰蛋白酶-EDTA 和青霉素-链霉素均购自Gibco;Piezo1 激动剂Yodal(HY-18723)、Piezo1 抑制剂GsMTx4(HY-P1410A)、钙库操纵性钙通道(store-operated calcium channel,SOCC)抑制剂BTP2(HY-100831)、雷诺丁受体(ryanodine receptor, RyR)抑制剂dantrolene(HY-12542)和1,4,5-三磷酸肌醇受体(inositol 1,4,5-triphosphate receptor, IP3R)抑制剂xestospongin C(HY-103312)均购 自MedChemExpress;肌 浆/内 质 网Ca2+-ATP 酶2(sarco-/endoplasmic reticulum Ca2+-ATPase 2, SERCA2)抑制剂毒胡萝卜素(thapsigargin, TG; 049M4032V)、L 型 钙 通 道 抑 制 剂 硝 苯 地 平(nifedipine, Nif;57H1139)和二甲基亚砜(dimethyl sulfoxide, DMSO;015K0151)均购自Sigma;Piezo1抗体(MA5-32876)购自Thermo Fisher;基质相互作用分子1(stromal interaction molecule 1, STIM1)抗体(#5668)和SERCA2抗体(#9580)购自Cell Signaling Technology;GAPDH 抗体(60004-1-lg)、TOM20 抗体(11802-1-AP)和lamin B1 抗 体(112987-1-AP)均 购 自Proteintech;Piezo1siRNA (si-Piezo1)购自广州锐博生物技术有限公司;STIM1siRNA (si-STIM1)购自上海吉凯基因有限公司;Lipofectamine 3000 (L3000075)购自Invitrogen;其余试剂均为国产分析纯。
无钙台式液成分(mmol/L):NaCl 136.00、KC1 5.40、NaH2PO40.33、MgCl2·6H2O 1.00、D-glucose 10.00 和HEPES 10.00,用NaOH 调 整pH 至7.35~7.40;含2 mmol/L Ca2+台式液成分(mmol/L):CaCl22.00、NaCl 136.00、KC1 5.40、NaH2PO40.33、MgCl2·6H2O 1.00、D-glucose 10.00 和HEPES 10.00,用NaOH调整pH至7.35~7.40。
3 实验方法
3.1 原代大鼠CASMCs 的获取及培养 冠状动脉分离方法参考同实验室前期发表的文献[5]。SD 大鼠吸入CO2麻醉后脱臼处死,75%乙醇消毒皮肤后用无菌剪刀和镊子打开胸腔,取出心脏,放入4 ℃预冷的无菌PBS 溶液中。在生物安全柜内,在体视显微镜下使用无菌显微剪和显微镊分离出大鼠心脏的左前降支、右冠脉和间隔支,去除冠脉周围脂肪和结缔组织,在直径35 mm 皿中加入100 μL DMEM 培养液(含20% FBS和1%双抗),在培养液中将分离好的冠脉剪碎,长度约0.5 mm,用无菌巴氏管吸取血管悬液,均匀铺于25 cm2培养瓶内,加入5 mL DMEM 培养液(含20% FBS 和1%双抗),倒置放于恒温培养箱,于37 ℃、5% CO2条件下静置1.5 h。待组织块贴牢后,培养瓶正常放置,继续培养。每隔4 d 更换培养液,待细胞从组织块边缘爬出并生长至融合成片达80%后,用0.25%胰酶进行消化传代,后续使用含10% FBS 和1%双抗的DMEM 培养液进行细胞培养,将第2~4代细胞用于实验。
3.2 原代CASMCs 的siRNA 转染 将第2~4 代的CASMCs 使用Lipofectamine 3000 试剂进行转染,设置阴性对照(si-NC)组和实验(si-Piezo1/si-STIM1)组。将125 μL Opti-MEM 培养液与5 μL Lipofectamine 3000 试剂混匀后振荡5 s,制备Lipofectamine 3000 试剂混合液;再将125 μL Opti-MEM 培养液与5 μL 浓度为20 μmol/L 的siRNA 混合,得到siRNA 混合液;按1∶1 体积比混合Lipofectamine 3000 试剂混合液和siRNA 混合液并吹打均匀,室温静置15 min;然后与750 μL 无双抗的DMEM 培养液(含10% FBS)混合,加入CASMCs中置于培养箱转染48 h,转染后的细胞用于钙离子浓度检测和Western blot实验。
3.3 CASMCs 细胞内钙离子浓度(intracellular Ca2+concentration, [Ca2+]i)检测 方法如前期研究所示[5],将CASMCs 种于激光共聚焦专用皿中,接种密度约50%~60%,待细胞贴壁生长48 h,需要转染处理的细胞按“3.2”进行干预。将贴壁的CASMCs用PBS清洗3 次,吸掉PBS 后每皿依次加入1 mL 含10%FBS 的DMEM 培养液、3 μL 浓度为5 μmol/L 的Fluo-4 AM 钙离子指示剂(从此开始全程避光操作),37 ℃、5% CO2孵育30 min;根据实验内容,用无钙或者含钙台式液洗2 遍,每皿加入1 mL 的无钙或者含钙台式液,分别加入实验所需抑制剂室温孵育15 min;在激光共聚焦显微镜下选取适合的视野,采用xyt模式扫描6 min或15 min,扫描6 min时在1 min加入终浓度为10 μmol/L 的Yoda1,扫描15 min 时分别在1 min 和8 min 加入不同的药物刺激细胞。实验结束后分别记录背景荧光值F0,第一次加药前的基线荧光值F1,第一次加药后达到的荧光峰值F2,第二次加药前的荧光值F3以及之后达到的荧光峰值F4。计算第一次加药干预后CASMCs 内Ca2+上升程度(F2-F0)/(F1-F0)和第二次加药干预后CASMCs 内Ca2+上升程度(F4-F0)/(F3-F0)。细胞内Ca2+荧光强度变化曲线使用SigmaPlot 14.0软件作图获得。
3.4 细胞免疫荧光染色 CASMCs培养在激光共聚焦专用皿约48 h,用PBS 清洗3 次,加入1 mL 4%多聚甲醛室温固定15 min,随后PBS 清洗3 次,加入含0.2% Triton X 的PBS溶液室温打孔15 min,PBS清洗3 次,再加入含4% BSA 的PBS 溶液室温封闭30 min,弃去封闭液,加入100 μL 用封闭液稀释的Ⅰ抗(1∶100),于湿盒内4 ℃孵育过夜。弃去Ⅰ抗后,PBS 清洗3 次,避光条件下加入与Ⅰ抗种属来源相同的荧光Ⅱ抗溶液(1∶500)室温孵育1 h,弃去Ⅱ抗,PBS 清洗3 次,加入适量含DAPI 的封片剂使细胞被覆盖,10 min 后用LSM900 激光共聚焦显微镜扫描染色结果。
3.5 Western blot siRNA 处理后的CASMCs 用PBS洗3 次,加入含蛋白酶抑制剂的强RIPA 于冰上裂解30 min,刮下细胞并收集于EP管中,4 ℃、13 500×g离心15 min,收集的上清液为细胞总蛋白。BCA 法测定蛋白浓度后加入上样缓冲液(4× loading buffer)和RIPA,配成等体积等质量的蛋白样品,100 ℃煮沸10 min使蛋白变性,依次进行SDS-PAGE、转膜、5%脱脂牛奶封闭、TBST洗涤3次(每次5 min)、Ⅰ抗4 ℃孵育过夜、TBST 洗涤3 次、Ⅱ抗室温孵育1 h、TBST 洗涤3次和ECL 试剂盒显影蛋白条带。最后利用ImageJ 图像分析软件进行灰度值结果分析。
4 统计学处理
实验数据用统计分析软件SPSS 21.0进行分析,使用GraphPad 9.0 将统计分析结果绘制图。计量资料以均数±标准误(mean±SEM)表示。两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 细胞免疫荧光染色检测Piezo1 蛋白在CASMCs中的表达
采用原代细胞培养获得CASMCs,再进行免疫荧光染色,结果显示Piezo1在原代培养CASMCs的胞质和胞核中均有所表达,Piezo1蛋白在细胞核周围的表达较高,见图1。
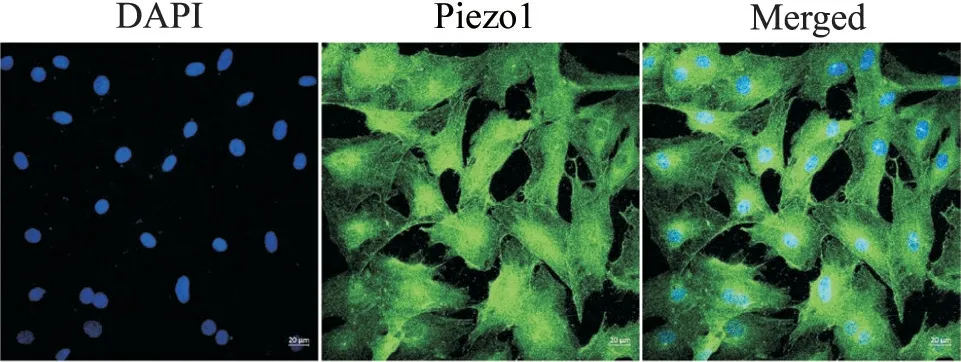
Figure 1. Cell immunofluorescence staining showed that Piezo1 was expressed in CASMCs (scale bar=20 μm).图1 细胞免疫荧光染色结果显示Piezo1在CASMCs中表达
2 Piezo1 诱导CASMCs 胞内Ca2+升高与L 型钙通道无关
如图2 所示,与DMSO 组相比,Yoda1 (10 μmol/L)组Ca2+荧光强度显著增加(P<0.01);与Yoda1组相比,Yoda1+GsMTx4(3 μmol/L;Piezo1 抑制剂)组Ca2+荧光强度显著降低(P<0.01),而Yoda1+Nif(1 μmol/L;L 型钙通道抑制剂)组Ca2+荧光强度没有明显变化。
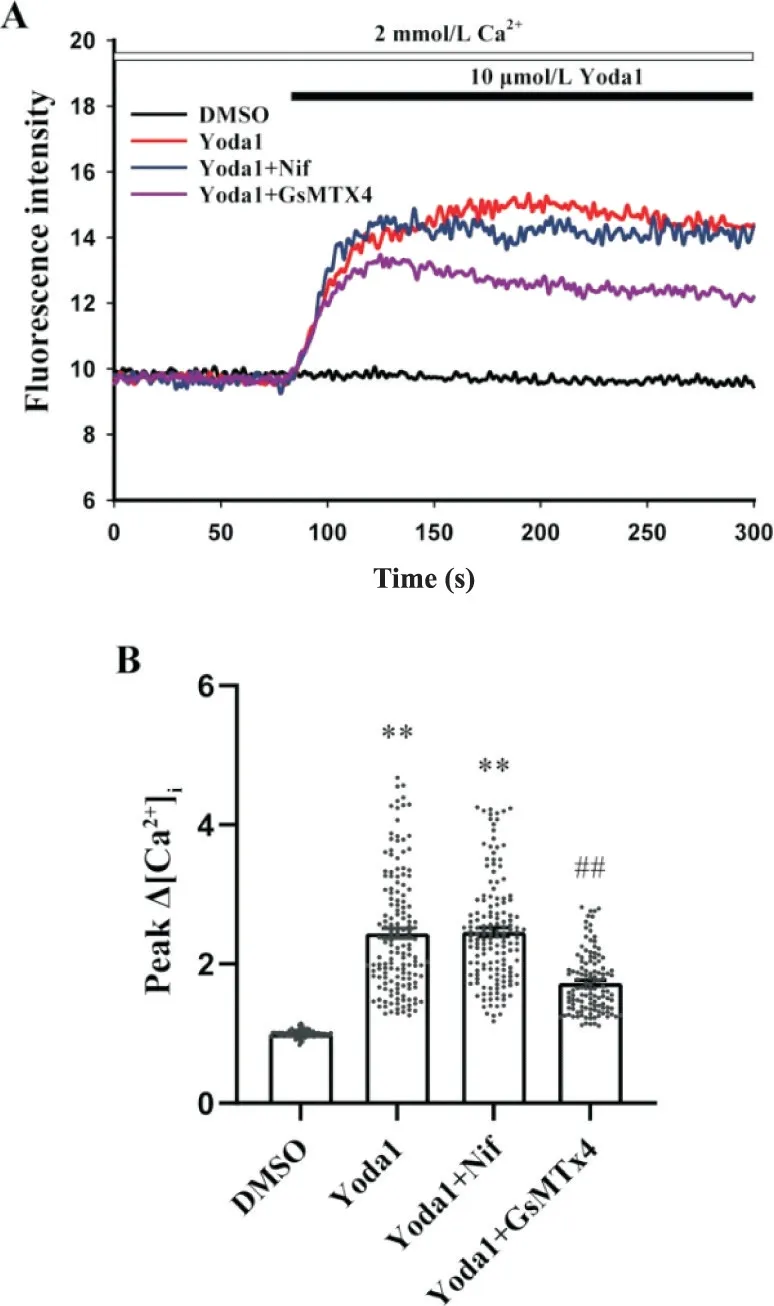
Figure 2. The changes of intracellular Ca2+ concentration mediated by Piezo1 were not affected by L-type calcium channels.A: representative fluorescence intensity of CASMCs stimulated by Yoda1 in Tyrode's solution with 2 mmol/L Ca2+; B: the changes of intracellular Ca2+ concentration in CASMCs stimulated by Yoda1. Mean±SEM. n=111 in DMSO group; n=154 in Yoda1 group; n=152 in Yoda1+Nif group; n=121 in Yoda1+GsMTx4 group.**P<0.01 vs DMSO group; ##P<0.01 vs Yoda1 group.图2 L型钙通道不参与Piezo1诱导CASMCs胞内Ca2+升高
3 Piezo1 诱导CASMCs 胞内Ca2+释放与IP3R 和RyR通道无关
无钙台式液中加入Yoda1(10 μmol/L),Yoda1组Ca2+荧光强度与DMSO组相比显著增加(P<0.01),见图3A。分别使用IP3R 抑制剂xestospongin C (0.1 μmol/L)和RyR 抑制剂dantrolene (10 μmol/L)抑制IP3R 和RyR 通道,实验结果表明,与Yoda1 组相比,Yoda1+xestospongin C 组 和Yoda1+dantrolene 组Ca2+荧光强度无明显变化,见图3B。
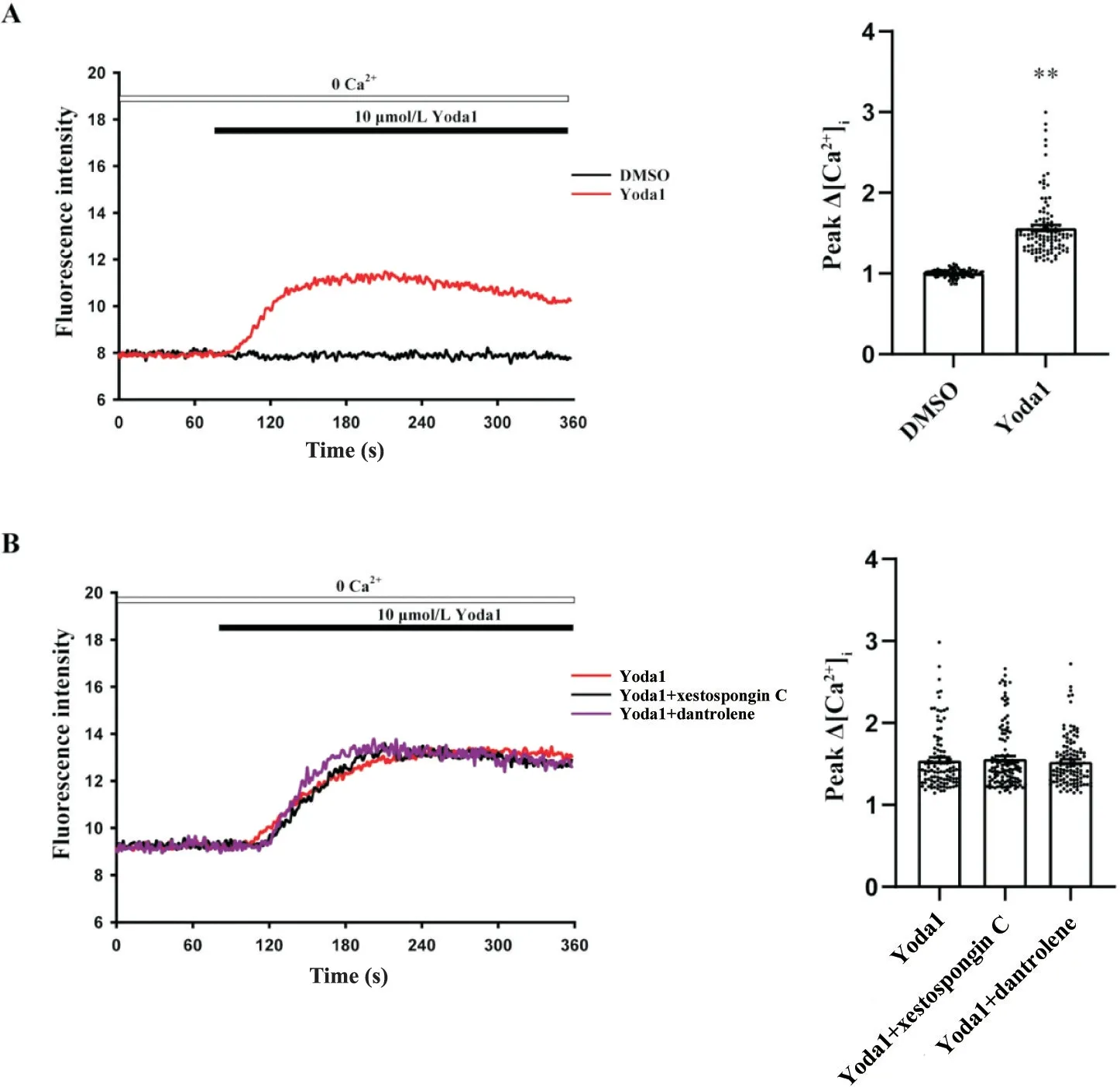
Figure 3. The intracellular calcium release mediated by Piezo1 were not affected by IP3R and RyR calcium channels. A: representative fluorescence intensity of CASMCs stimulated by Yoda1 in Tyrode's solution without Ca2+ (n=101 in DMSO group; n=110 in Yoda1 group); B: representative fluorescence intensity of CASMCs stimulated by Yoda1 in Tyrode's solution without Ca2+ after treatment with IP3R and RyR inhibitors (n=109 in Yoda1 group; n=122 in Yoda1+xestospongin C group; n=113 in Yoda1+dantrolene group). Mean±SEM. **P<0.01 vs DMSO group.图3 IP3R和RyR钙通道不参与Piezo1诱导胞内Ca2+释放
4 Piezo1 诱导CASMCs 内质网和其它细胞器Ca2+释放
无钙台式液中使用SERCA2 抑制剂TG (2 μmol/L),结果如图4A~E 所示,第一峰值中TG 引起的Ca2+荧光升高比值明显高于Yoda1(P<0.01);第二峰值中,TG-Yoda1 组Ca2+荧光强度与对照组TG-TG 组相比显著增加(P<0.01),Yoda1-TG 组Ca2+荧光强度与TG-TG 组相比显著增加(P<0.01)。免疫荧光染色结果显示,Piezo1 与内质网标志物SERCA2、线粒体外膜标志物TOM20和核膜标志物lamin B1共定位程度较高,见图4F~H。
5 Piezo1 通过诱导CASMCs 内质网Ca2+耗竭而激活SOCC
如图5A 所示,与Nif 组相比,Nif+BTP2(10 μmol/L;SOCC抑制剂)组中2 mmol/L CaCl2诱导的Ca2+荧光强度显著降低(P<0.01)。敲减STIM1后,Western blot 结果显示CASMCs 中STIM1 蛋白表达显著下调(P<0.01),见图5B;激光共聚焦显微镜检测结果显示si-STIM1 组中2 mmol/L CaCl2诱导的Ca2+荧光强度显著低于si-NC 组(P<0.01),见图5C。敲减Piezo1后,si-Piezo1 组蛋白表达显著下调(P<0.05),见图5D;敲减STIM1后,si-STIM1 组蛋白表达显著下调(P<0.01),见图5E;与si-NC 组相比,si-Piezo1 组中2 μmol/L TG 诱导的Ca2+荧光强度显著增加(P<0.05),si-STIM1 组中2 mmol/L CaCl2诱导的Ca2+荧光强度显著降低(P<0.01),见图5F。
6 抑制SOCC 后Piezo1 能诱导CASMCs 胞外Ca2+内流
Western blot 结果显示,与阴性对照组相比,si-Piezo1 组中Piezo1 蛋白表达显著减少(P<0.01),见图6A。在无钙台式液中使用1 μmol/L Nif 和10 μmol/L BTP2 抑制L 型钙通道和SOCC,与si-NC 组相比,si-Piezo1 组中10 μmol/L Yoda1 和2 mmol/L CaCl2诱导的Ca2+荧光强度显著降低(P<0.01),见图6B。
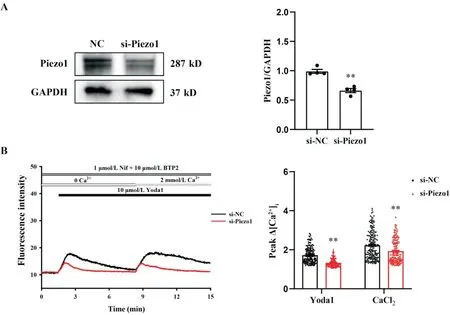
Figure 6. Piezo1 on cell membrane induced extracellular Ca2+ influx. A: the protein expression of Piezo1 in the CASMCs after knockdown of Piezo1 (n=4); B: representative fluorescence intensity of CASMCs stimulated by Yoda1 and CaCl2 in Tyrode's solution without Ca2+ after treatment with Nif and BTP2 (n=195 in si-NC group; n=250 in si-Piezo1 group). Mean±SEM. **P<0.01 vssi-NC group.图6 细胞膜上Piezo1诱导细胞外Ca2+内流
讨 论
多数机械转导过程依赖于机械激活的阳离子通道来使细胞内Ca2+浓度升高,导致Ca2+依赖的下游信号通路被激活,进而控制不同的细胞过程和生理反应[6]。Piezo1 作为一种机械敏感性阳离子通道,在心血管系统中充当压力传感器[6],并与多种心血管疾病的发生发展有关。研究表明,Piezo1存在于内皮细胞、VSMCs和成纤维细胞等多种细胞中,它能将机械信号转化为胞内Ca2+信号,参与细胞的分化、增殖、迁移等生物过程[4,7]。其中,VSMCs 具备感受机械刺激和传导的能力,它在维持血管完整性和血管重塑方面发挥着重要作用[8]。冠状动脉是供应心脏血液的血管,位于冠脉中层VSMCs 的收缩状况是影响冠脉血流量大小的重要因素,Piezo1能将脉管系统中的生物力学转化为CASMCs 内Ca2+信号,通过Ca2+信号传导途径调节血管功能[2,4],从而影响心脏的供血。因此,选择探索Piezo1 在CASMCs 中对Ca2+稳态调节的机制对心血管系统研究有重要意义。本研究通过细胞免疫荧光实验证实,Piezo1存在于原代细胞培养的CASMCs 中,在细胞质和细胞核中均有表达,且在细胞核周围表达较高,可能是由于Piezo1 广泛表达于内质网上[9],而内质网与核膜相互连接所导致。
VSMCs 内Ca2+浓度变化主要包括细胞膜上Ca2+通道诱导细胞外Ca2+内流和细胞内Ca2+储存器诱导内Ca2+释放。血管平滑肌功能异常在一定程度上取决于细胞内Ca2+浓度变化[10],包括Piezo1在内的各种Ca2+通道在维持胞内Ca2+稳态以及调节血管平滑肌兴奋性中发挥着重要作用[11]。小分子Yoda1 是Piezo1 的特异性激动剂,可直接与Piezo1 结合,通过改变其构象来激活Piezo1。已有研究证实Yoda1 可以诱导CASMCs 中Ca2+水平升高[5],但Piezo1 参与CASMCs 的Ca2+浓度调节机制还不太明确。本研究在含钙台式液中使用Piezo1 的选择性抑制剂GsMTx4,结果显示Yoda1 诱导Ca2+内流显著减少,证明CASMCs 中Ca2+水平升高是由Piezo1 导致的。L 型钙通道属于常见的细胞内外Ca2+交换通道,本研究实验结果表明Piezo1 诱导CASMCs 中Ca2+水平升高与细胞膜上的L 型钙通道无关。在无钙台式液中加入Yoda1,CASMCs 的Ca2+荧 光 强 度 显 著 增 加,提 示Piezo1 可以诱导细胞内Ca2+库的Ca2+释放。使用Ca2+通道抑制剂后,实验结果表明Piezo1诱导CASMCs内Ca2+释放与内质网上的RyR和IP3R无关。
细胞内大部分Ca2+储存在细胞器中[12],包括内质网、线粒体和核膜等。内质网上的SERCA2 可以将胞质中Ca2+重新摄回内质网中,使用其阻断剂TG 可以导致内质网中Ca2+耗竭。本研究实验结果显示,在无钙台式液中加入TG 引起胞内Ca2+释放显著高于Yoda1所诱导的Ca2+释放,而且加入Yoda1之后TG仍能引起内质网Ca2+释放,说明Piezo1只能诱导内质网中部分Ca2+释放;在无钙台式液中使用TG 排空内质网中Ca2+后,加入Yoda1 也能显著引起细胞内Ca2+释放,说明Piezo1 能诱导细胞内除内质网以外其它细胞器Ca2+释放。双标免疫荧光染色结果显示,Piezo1与CASMCs 中内质网标志物SERCA2、线粒体外膜标志物TOM20 和核膜标志物Lamin B1 的共定位程度较高,表明除内质网以外,Piezo1 也可能诱导线粒体和核膜Ca2+释放。
SOCC 在心血管疾病的发生发展中起重要作用[13],它主要由STIM1 和通道蛋白ORAI1 构成。内质网中Ca2+浓度变化信号能被跨膜Ca2+传感器STIM1所感知,导致位于内质网上的STIM1 迁移至细胞膜与ORAI1 结合,随后激活SOCC,进而触发钙库操纵性Ca2+内流(store-operated calcium entry, SOCE)[14]。因此,进一步探究Piezo1 诱导CASMCs 内质网Ca2+释放后是否会导致SOCE 发生。本研究在无钙台式液中抑制L 型钙通道以及使用SOCC 阻断剂BTP2,实验结果表明抑制SOCC后Yoda1诱导细胞外Ca2+内流减少;通过敲减STIM1抑制SOCC 的功能,实验结果再次证明Yoda1 可以诱导细胞膜上SOCE 发生。为了探究Piezo1 诱导SOCE 发生的机制,分别敲减Piezo1和STIM1,并且在实验中抑制了L 型钙通道,实验结果表明敲减Piezo1并不影响TG 诱导的SOCE,提示Piezo1 是通过诱导内质网Ca2+释放从而激活SOCC,可能不会直接影响SOCC。有研究报道SERCA2 和Piezo1 的相互抑制作用[15],本研究实验结果显示敲减Piezo1后TG 诱导的Ca2+释放显著增加,证明了Piezo1 对SERCA2 具有抑制作用。敲减Piezo1并抑制细胞膜上的SOCC 和L 型钙通道,实验结果表明细胞膜上Piezo1通道能诱导胞外Ca2+内流。
研究表明Piezo1 介导细胞Ca2+稳态失衡是疾病的重要触发因素:Piezol 通过升高[Ca2+]i促进肺动脉高压的进展[9];高血压下Piezo1 激活引起细胞内Ca2+调控异常是血栓形成的关键[16];Piezo1 激活调控Ca2+信号传导加重主动脉瓣钙化病的发展[17]等。目前大部分研究关注Piezo1 的机械转导和Ca2+信号调控作用,而Piezo1促进CASMCs钙浓度增加的机制仍不清楚。研究正常生理状态下Piezo1 对CASMCs 钙调节的机制,以及Piezo1 与重要Ca2+通道之间的关系,为疾病状态Piezo1 导致钙稳态失衡提供了干预策略。[Ca2+]i增加受离子通道和蛋白的调节,除了常见的Ca2+通道和Ca2+库,细胞中还有其它更复杂的钙调节机制,并且在疾病状态下,Piezo1 是如何感知病理变化进行Ca2+调节仍然未知,因此Piezo1在细胞中钙调控机制有待更深入的研究。
综上所述,本研究初步证实Piezo1 激动剂在CASMCs 中诱导细胞外Ca2+内流主要通过细胞膜上Piezo1 通道和间接激活的SOCC,也能触发胞内细胞器Ca2+释放,共同增加CASMCs 中[Ca2+]i。这些结果为Piezo1调控细胞Ca2+平衡提供更多可能性。

