脂多糖诱导年轻小鼠骨髓及脾脏造血干细胞衰老表型的作用研究*
白 可, 邹 密, 詹 蔷, 黄颖欣, 鞠振宇, 陈陟阳
(暨南大学教育部再生医学重点实验室,衰老与再生医学研究院,生命科学技术学院,广东 广州 510632)
造血干细胞(hematopoietic stem cells, HSCs)具有自我更新及多潜能分化能力,可以产生所有成熟的血液细胞,对整个生命时长的造血系统及免疫系统的稳态维持起到重要作用[1]。在下游成熟细胞减少的缺血应激压力条件下,为满足机体对成熟血液细胞的需求,造血干细胞进行应激造血以维持血液系统的稳态平衡[2]。脾脏作为髓外重要的造血器官,脾脏介导的骨髓外造血对缓解应激造血具有重要作用[3-4]。炎症刺激导致血液和免疫系统出现一系列的反应,固有免疫和适应性免疫的先后激活促进炎症的消除,同时伴随着大量成熟血液细胞的损失,造血干细胞随即启动应激造血以满足机体的需求[5-6]。有研究报道,造血干细胞表达多种炎症因子受体,提示除了被动响应下游成熟血液细胞损失的负反馈调控以外,造血干细胞可以直接对炎症进行反应应答[7-8]。慢性炎症累积是衰老的重要特征,造血干细胞应对炎症的应答及炎症对造血干细胞衰老的影响有待进一步研究。LPS 作为一种常见的细菌内毒素,具有易于使用,模型重现性好,反应机制明确的特点,因此被作为构建炎症模型的金标准试剂[9]。本研究应用LPS诱导的急性炎症小鼠模型,旨在探究急性炎症刺激对骨髓及脾脏中造血干/祖细胞的影响。并初步探索了LPS 诱导的急性炎症反应与造血干/祖细胞衰老之间的关系,以期为拓宽靶向干预炎症信号延缓衰老的策略提供参考。
材 料 和 方 法
1 动物
年轻小鼠以及年老小鼠由北京维通利华实验动物技术有限公司提供,生产许可证号为SCXK(京)2021-0006,引进并饲养繁殖于暨南大学实验动物中心SPF 级屏障环境SYXK(粤)2017-0174,雌雄及数量不限,2~24 月龄,所有小鼠均为C57BL/6J 品系。本实验已获得暨南大学动物实验中心伦理委员会批准,并严格按照动物使用原则执行。
2 主要仪器和试剂
流式细胞分析仪(BD,Fortessa);流式细胞分选仪(BD,Aria III)。流式细胞实验相关抗体: Biotin-Gr1(13-5931-86),Biotin-CD11b(101204),Biotin-B220(103204),Biotin-CD4(100508),Biotin-CD8(100704),FITC-CD4(100510),FITC-CD8(100706),FITC-B220(48-0452-82),APC-Cy7-CD11b(A15390),PE-Cy7-Sca-1(122514),PE-CD150(115927),APC-c-Kit(17-1171-83),APC-Cy7-SA(405208),PE-CD45(11-0459-42),FITC-Ki67(11-5698-82)购自Thermo Fisher; BV510-CD48 (563536) , BV605-CD150(567309) 购自BD Biosciences;脂多糖(PA173178)购自Thermo Fisher;红细胞裂解液(555899)购自BD Pharmingen;胎牛血清(FSP500)购自ExCellbio;DAPI(D9542-10MG)购自Sigma;BD Cytofix/Cytoperm buffer (554714)购自BD Biosciences。
3 主要方法
3.1 小鼠体内急性炎症模型的建立 参考前期发表的文章[10],腹腔注射LPS 进行建模,LPS 注射剂量为1.5 mg/kg。对照组腹腔注射等体积的磷酸缓冲盐溶液(phosphate buffer saline,PBS)。建模成功后的小鼠分为PBS 对照组、LPS 刺激3 h、6 h、16 h、24 h、96 h、168 h组,共七组,每组3~5只。
3.2 小鼠骨髓中造血干/祖细胞(hematopoietic stem/progenitor cells, HSCPs)分析参考已发表的文章[11-12],小鼠颈椎脱臼牺牲,取小鼠小腿骨、大腿骨、髂骨及脊柱,使用研杵挤压骨头释放骨髓细胞。按照1×108/mL 的细胞密度使用染色缓冲液(1×PBS+2%胎牛血清)重悬细胞,从中取1×107全骨髓细胞置于U 型底96 孔细胞培养板中。每孔加入10 μL Lin抗体混合物[生物素标记的lineage 细胞抗体组合,生物素(biotin)分别与CD4、CD8、B220、Ter119、CD11b和Gr1 偶联的抗体用于标记HSPCs],冰上避光孵育30 min。每孔加200 μL 染色缓冲液后离心(288×g、4 ℃离心5 min),弃上清,30 μL 染色缓冲液重悬细胞。按照表1 进行其他表面标记抗体染色,冰上避光孵育30 min。用300 μL染色缓冲液重悬细胞并转移至流式管中,使用流式细胞分析仪(BD Fortessa)分析。上机前加入0.3 μL 1 g/L 浓度的DAPI 进行染色,使用FlowJo 10软件处理流式细胞数据。

表1 骨髓细胞及脾脏细胞HSPC流式染色方案Table 1. Flow cytometry staining protocol for bone marrow and splenic HSPCs
3.3 小鼠脾脏中造血干/祖细胞分析 小鼠颈椎脱臼牺牲后,取出小鼠脾脏置于PBS 中。使用5 mL 注射器的推针器尾部(平底部分)研磨脾脏,按照1×108mL 的细胞密度使用染色缓冲液重悬细胞,从中取1×107脾脏单细胞悬液置于U 型底96 孔细胞培养板中。每孔加入10 μL Lin 抗体混合物,冰上避光孵育30 min。染色缓冲液洗去抗体后,按照表1进行其他表面标记抗体染色,冰上避光孵育30 min。每孔加200 μL 染色缓冲液后离心(288×g、4 ℃离心5 min),弃上清;使用400 μL染色缓冲液重悬细胞并转移至流式管中,使用流式细胞分析仪(BD Fortessa)分析。上机前加入0.4 μL 1 g/L 浓度的DAPI 进行染色,使用FlowJo 10软件处理流式细胞数据。
3.4 小鼠外周血和脾脏中各类成熟细胞的分析对小鼠进行深度麻醉后,使用取血针通过眼眶后静脉丛采集小鼠全血(每只20 μL)。使用U 型底96 孔细胞培养板进行抗体染色。参照表2 每孔加入30 μL抗体混合物,与20 μL全血样本充分混合后,冰上避光孵育30 min。每孔加入200 μL 1×裂红缓冲液重悬细胞,在室温下避光放置5~10 min 完成裂红处理。200 μL 染色缓冲液重悬细胞后转移到流式管中,使用流式细胞分析仪(BD Fortessa)进行分析;对于小鼠脾脏中各类成熟细胞的分析,参考3.3 制备小鼠脾脏细胞悬液。取1×107脾脏细胞进行抗体染色,参照表2每孔加入30 μL抗体混合物,在4 ℃避光条件下孵育30 min。每孔加入200 μL 1×裂红缓冲液重悬细胞,在室温避光下放置5~10 min 完成裂红处理。200 μL染色缓冲液重悬细胞后转移到流式管中,使用流式细胞分析仪(BD Fortessa)进行分析。

表2 外周血和脾脏成熟细胞流式染色方案Table 2. Flow cytometry staining protocol for peripheral blood and splenic mature cells
3.5 细胞周期分析 参考方法3.2,使用针对 Sca-1、c-Kit、Lin/SA 的流式抗体对全骨髓以及脾脏细胞进行染色,以标记HSPCs(Lin-Sca1+c-Kit+, LSK)。抗体标记后的细胞使用BD Cytofix/Cytoperm buffer 进行固定,0.4% Triton X-100 破膜。将固定破膜后的细胞与FITC-Ki67 抗体混合后冰上孵育1.5 h;加入1 μL 1 g/L 浓 度 的DAPI 冰 上 孵 育30 min 后 上 机 分析,使用流式细胞仪(BD Fortessa)分析。
3.6 转录组数据分析 基于GSE100425[13]数据集:筛选数据集中同时满足|log2(fold change)|≥2 和P<0.01 的基因,分别作为相应处理的差异基因。利用clusterProfiler 对表达变化趋势相同的差异基因进行GSEA富集分析。
4 统计学处理
应用GraphPad Prism 9.0 软件进行统计分析。数据均为至少3 次独立重复实验结果,以均数±标准差(mean±SD)表示。两组间比较采用Student'st检验。P<0.05为差异有统计学意义。
结 果
1 LPS 诱导骨髓中的造血干细胞数量增多及外周血和脾脏出现髓系分化偏向
构建LPS 诱导的急性炎症小鼠模型,对年轻小鼠进行腹腔注射LPS (1.5 mg/kg)处理(图1A),不同时间点取小鼠骨髓进行流式细胞术检测(图1B)。与对照组小鼠相比,骨髓中LSK 的百分率在LPS 刺激16 h 显著升高(P<0.01),见图1C。进一步对外周血和脾脏中B细胞、T细胞和髓系细胞(CD11b+)进行分析,结果可见,与PBS对照组相比,LPS刺激24 h小鼠外周血中B 细胞和T 细胞百分率显著下降(P<0.01),但髓系细胞显著上升(P<0.01),且小鼠脾脏中髓系细胞数目增多(P<0.05),见图1D、E。

Figure 1. LPS stimulation resulted in an elevated percentage of HSPCs in bone marrow (BM) and a shift towards myeloid cell production in peripheral blood (PB) and spleen. A. experimental scheme of LPS-induced acute inflammation model in mice.Young (2-month-old) WT mice were injected with LPS (1.5 mg/kg) or PBS. B and C: the percentage of HSPCs (Lin-Sca1+ c-Kit+ cells, LSKs) in BM. The ratio of mature cells in PB and the number of mature cells in spleen were analyzed by FACS. Representative FACS files (B) and histograms (C) showing the percentage of LSKs in BM at the indicated time points post LPS treatment. D: the percentage of B cells (B220+), T cells (CD4+ CD8+) and myeloid cells (CD11b+) in PB of young(2-month-old) WT mice with or without LPS treatment. E: the number of B cells, T cells and myeloid cells in spleen was analyzed by FACS. Mean±SD. n=3~11. *P<0.05, ** P<0.01 vs PBS group.图1 LPS诱导骨髓造血干/祖细胞及外周血和脾脏髓系细胞增多
2 LPS对小鼠脾脏髓外造血的影响
与PBS 组相比,LPS 刺激24 h 小鼠脾脏变大(图2A)。称重及细胞计数的结果显示,LPS 组小鼠脾脏重量显著增多(P<0.01),脾脏细胞数目增多(P<0.05),见图2B、C。对年轻小鼠进行腹腔注射LPS(1.5 mg/kg)之后,在不同时间点检测脾脏中造血干/祖细胞的百分率。结果显示,与PBS 对照组相比,LPS 刺激诱导小鼠脾脏中LSK 的百分率升高(P<0.05),见图2D。
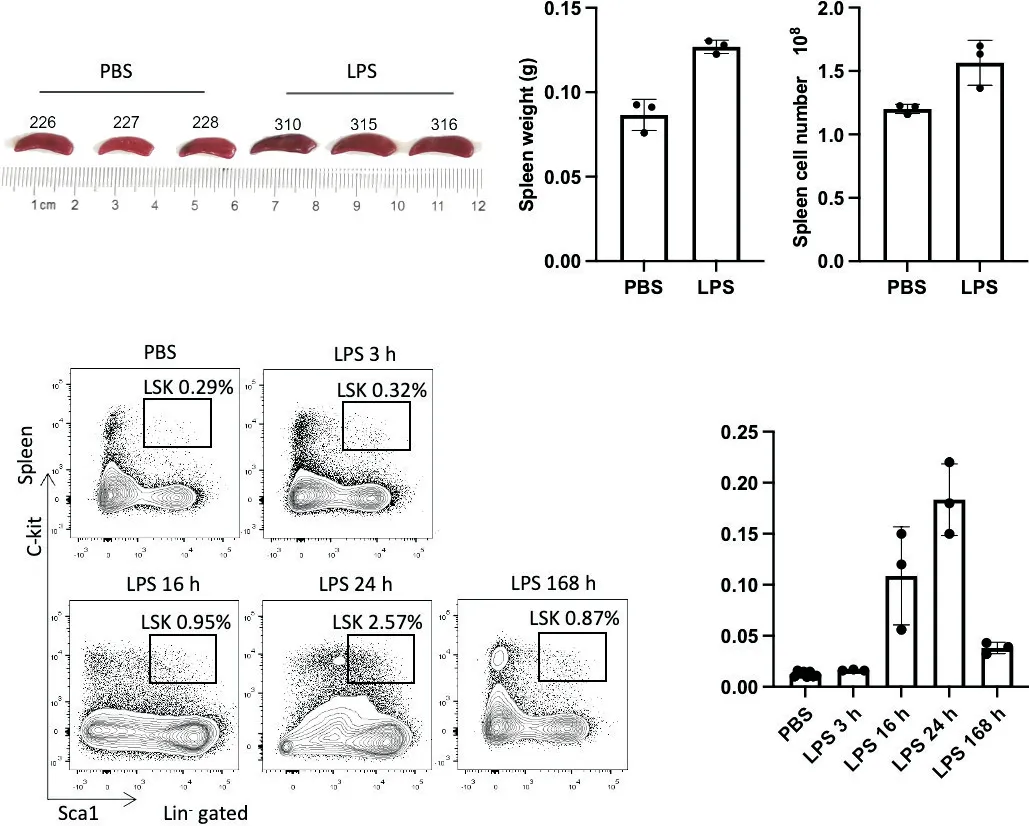
Figure 2. LPS induced extramedullary hematopoiesis in spleen of young mice. A: picture showed the size of spleen from mice after LPS (right, 1.5 mg/kg) or PBS (left) injections; B: weight of spleens; C: the bar graph showed the number of spleen cells; D: representative FACS files and histogram showing the percentage of HSPCs (Lin- Sca1+ c-Kit+ cells, LSKs) in spleen at the indicated time points after LPS exposure (1.5 mg/kg). Mean±SD. n=3~11. *P<0.05, **P<0.01 vs PBS group.图2 LPS刺激促进小鼠脾脏髓外造血
3 LPS对骨髓和脾脏中造血干/祖细胞增殖的影响
细胞周期分析结果显示,在稳态下,年轻小鼠骨髓和脾脏中的LSK 绝大多数处于G0和G1期;我们对脾脏中LSK 的增殖情况进行分析,流式细胞术结果显示,稳态下,脾脏中的LSK 多处于G1期;与PBS 对照组相比,LPS 刺激促进脾脏中LSK 的增殖(P<0.05),见图3A。同时,与PBS 对照组相比,LPS 刺激6 h和24 h,骨髓中处于S-G2-M 期的LSK 百分率显著升高(P<0.01),与之对应,处于G0 期的LSK 百分率显著降低(P<0.01),见图3B。通过流式细胞术对脾脏中LSK 的CD45 蛋白表达进行分析,结果显示,与PBS 对照组相比,LPS 刺激24 h 后CD45 蛋白表达降低(P<0.01),见图3C。

Figure 3. LPS promoted proliferation of HSPCs in the BM and spleen. A: representative FACS files and bar graphs showing the cell cycle status of HSPCs (Lin- Sca1+ c-Kit+ cells, LSKs) in spleen; B: representative FACS files and bar graphs showing the cell cycle status of LSKs in BM; C: representative FACS files and bar graphs showing the percentage of CD45high and CD45low LSKs in spleen. Mean±SD. n=4. *P<0.05, **P<0.01 vs PBS group.图3 LPS刺激促进骨髓和脾脏造血干/祖细胞增殖
4 衰老对小鼠脾脏髓外造血的影响
与年轻小鼠相比,24 月龄的年老小鼠脾脏变大(图4A)。称重及细胞计数的结果显示,与年轻小鼠相比,老年小鼠的脾脏重量显著升高(P<0.05),脾脏细胞数目无显著差异(P>0.05),见图4B、C。对2 月龄的年轻小鼠与24 月龄的年老小鼠脾脏中造血干/祖细胞的分析显示,与2 月龄年轻小鼠相比,24 月龄的年老小鼠脾脏中的LSK 和HSC(CD48-CD150+LSK)的百分率显著升高(P<0.01),见图4D。

Figure 4. Old mice exhibited extramedullary hematopoiesis in spleen. A: picture shows the size of spleens from young(upper) and old (lower) mice; B: the weight of spleen in young and old mice; C: the total number of cells in spleens from young and old mice; D: representative FACS files and bar graphs showing the percentage of HSPCs in spleen from young and old mice. Mean±SD. n=3~14. #P<0.05, ## P<0.01 vs yong group.图4 衰老促进小鼠脾脏髓外造血
5 衰老促进骨髓中造血干/祖细胞比例升高及外周血和脾脏出现髓系偏向
使用流式细胞仪检测2 月龄的年轻小鼠与不同年龄(10月龄、18月龄、24月龄)年老小鼠骨髓中LSK和HSC 的百分率。统计结果显示与年轻小鼠相比,年老小鼠骨髓中LSK 和HSC 的百分率显著升高(P<0.01),见图5A。进一步针对外周血及脾脏的流式细胞分析结果显示,与年轻小鼠相比,年老小鼠外周血中的B 细胞百分率显著降低(P<0.01),髓系细胞百分率显著升高(P<0.01);年老小鼠脾脏中的B 细胞百分率显著降低(P<0.01),见图5B。
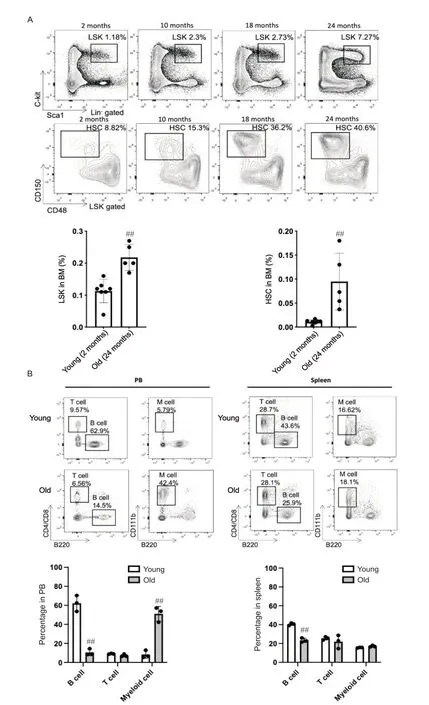
Figure 5. Old mice exhibited increased percentage of HSPCs in BM and a shift in myeloid cell production in PB and spleen. A: representative FACS files and bar graph showing the percentage of HSPCs (Lin- Sca1+ c-Kit+ cells, LSKs) and HSCs(CD48- CD150+ LSKs) in BM from young and old mice; B: representative FACS files and bar graphs showing the percentage of B cells (B220+), T cells (CD4+ CD8+) and myeloid cells (CD11b+) in PB and spleen from young (2-month-old)and old (24-month-old) WT mice. Mean±SD. n=3~7. ##P<0.01 vs young group.图5 衰老促进骨髓造血干/祖细胞及外周血和脾脏髓系细胞增多
6 LPS处理诱导造血干细胞炎症、ROS和凋亡信号激活
为了探究炎症诱导造血干细胞功能损伤的潜在调控机制,我们重新分析了GSE100425[13]数据集中TLR4 和TLR2 炎症受体激活剂LPS 和Pam3CSK4(Pam3)体内刺激后12 h小鼠造血干细胞的转录组变化。针对炎症刺激诱导的差异基因进行GSEA分析。分析结果显示,IL-6、TNF-α、INF-γ、TGF-β 及IL-2/STAT5等炎症信号通路被激活(图6A),此外,刺激导致氧化应激及凋亡通路富集(图6B)。

Figure 6. LPS induced activation of inflammatory, ROS and apoptosis signaling in HSCs. A: dot plot showing the up-regulated pathways in HSCs of mice 12 h after LPS and Pam3 treatment; B: gene set enrichment analysis (GSEA) showed that the genes involved in apoptosis pathway were enriched in HSCs of mice 12 h after LPS and Pam3 treatment.图6 LPS诱导造血干细胞炎症、ROS和凋亡信号通路激活
讨 论
慢性炎症累积会导致干细胞衰老,进而影响多种组织器官的长期稳态维持。炎症刺激导致造血干细胞功能受损,损害移植后造血重建能力及诱导髓系偏向分化[14-16]。多数研究以连续炎症刺激作为切入点研究炎症累积对造血干细胞功能及衰老的影响[8],而急性炎症刺激对造血干/祖细胞的影响仍有待进一步探索。在本研究中,我们应用LPS 刺激模拟细菌炎症构建急性炎症小鼠模型,开展了针对小鼠造血干/祖细胞应对炎症刺激后动态变化的研究。我们的研究显示,炎症刺激后短时间内,骨髓造血干/祖细胞展现出迅速的增殖,提示骨髓造血干细胞在第一时间响应LPS刺激。伴随着LPS刺激,骨髓造血干细胞向脾脏迁移进而促进髓外造血,提示骨髓和脾脏在应对炎症时协同调控应激造血。有研究提示,炎症是潜在推动造血干细胞衰老相关功能失调的关键因素[17]。本研究中,LPS诱导的急性炎症反应导致的骨髓造血干/祖细胞增殖、外周成熟细胞髓系分化偏向以及脾脏中的髓外造血等现象与小鼠造血衰老表型非常相似,提示衰老过程中的炎症累积导致造血系统功能异常。明确炎症调控造血干细胞功能的具体机制,将为缓解造血干细胞衰老及治疗衰老相关血液学疾病提供重要的干预靶点。

