地榆皂苷I 调控IGFL2-AS1/miR-138-5p 抑制卵巢癌细胞增殖、侵袭和迁移
许运巧,刚小清,李金锋
1. 驻马店市中心医院 妇产科,河南 驻马店 463000
2. 河南省人民医院 妇产科,河南 郑州 450000
卵巢癌是死亡率最高的妇科肿瘤,严重威胁女性健康。中药在抗肿瘤治疗中发挥重要的作用,能够直接抑制肿瘤细胞生长,具有多靶点、综合调节、不良反应少的优点,使用包括植物化学物质在内的天然产品是一种潜在且有用的癌症治疗方法[1-2]。地榆药材为蔷薇科植物地榆SanguisorbaofficinalisL.或长叶地榆S.officinalisL. var.longifolia(Bert.) Yu et Li 的干燥根,是一种常见的草本植物,广泛分布于我国和其他亚洲国家,具有多种药用价值,地榆中含有多种皂苷类化合物,主要包括地榆皂苷I、II,其中以地榆皂苷I 含量最高,具有较强的抗氧化、抗炎、抗肿瘤活性,应用前景广阔[3]。研究报道,地榆皂苷II 可诱导人结肠癌细胞凋亡[4];地榆皂苷II 可抑制三阴性乳腺癌细胞的迁移和侵袭[5];地榆皂苷I 可通过激活线粒体通路抑制人甲状腺乳头状癌细胞生长[6],但其对卵巢癌细胞肿瘤特性的影响尚不清楚。
miR-138-5p在卵巢癌组织和细胞中下调表达,miR-138-5p上调可抑制卵巢癌进展,且其受lncRNATRPM2-AS调控[7]。IGFL2-AS1表达下调限制胃癌细胞增殖及转移[8]。生物学软件预测发现miR-138-5p与IGFL2-AS1有结合位点。而IGFL2-AS1对卵巢癌细胞增殖、侵袭迁移的影响及其与miR-138-5p的关系也尚未可知。本研究旨在探讨地榆皂苷I 对卵巢癌细胞增殖、侵袭迁移的影响是否涉及IGFL2-AS1和miR-138-5p。
1 材料
1.1 细胞
人卵巢癌A2780细胞购自上海雅吉生物科技有限公司。
1.2 药品与试剂
地榆皂苷I(质量分数≥98%,批号35286-58-9)购自四川精萃天成药物科技有限公司;RPMI 1640 培养基(批号R101)、E-钙黏蛋白(E-cadherin,批号147301)一抗、N-钙黏蛋白(N-cadherin,批号350802)一抗、磷酸缓冲盐溶液(批号CC0005)购自上海雅吉生物科技有限公司;MTT 试剂盒(批号OX01472)、pcDNA3.1(+)载体(批号MZ0157)购自上海圻明生物科技有限公司;带有基质胶的Transwell 小室(批号3407)购自美国Corning 公司;胎牛血清(批号AB20180244D)购自上海诺娃医药科技有限公司;胰蛋白酶(批号T8150)、二抗(批号SE131、SE134)、qRT-PCR 试剂(批号SR1111)双荧光素酶报告基因检测试剂盒(批号D0011)、RIPA 裂解液(批号R0010)、Trizol 试剂(批号15596018)吉姆萨(批号51811-82-6)购自北京索莱宝科技有限公司。
1.3 仪器
CKX53 型倒置显微镜(日本Olympus 公司);TG16 型离心机(上海卢湘仪实验室仪器有限公司);Synergy H1 型酶标仪(美国伯腾公司);XCell4 SureLock 型电泳仪(美国Thermo Fisher Scientific 公司);IQ5 型qRT-PCR 仪(美国Bio-Rad 公司)。
2 方法
2.1 MTT 检测细胞增殖
A2780 细胞用RPMI 1640 培养,收集处于对数生长期的细胞并调整密度,以3×103个/孔接种于96 孔板,分别加入不同浓度(7.5、15.0、30.0 μmol/L)的地榆皂苷I,另设置不含药物的对照组,培养至铺满孔底,每孔加入MTT 溶液20 μL,培养4 h,小心吸去培养液,加入二甲基亚砜,采用酶标仪测定吸光度(A)值,计算细胞增殖抑制率。
细胞增殖抑制率=1-A实验/A对照
2.2 克隆形成实验检测细胞克隆形成
将处于对数生长期的A2780细胞重悬成细胞悬液,以500~700 个/孔接种于6 孔板,分别加入不同浓度(7.5、15.0、30.0 μmol/L)的地榆皂苷I,另设置不含药物的对照组,培养直至出现肉眼可见克隆,甲醇固定,吉姆萨染色,磷酸缓冲液洗涤细胞并晾干,计数>50 个细胞的集落。
2.3 Transwell 实验检测细胞迁移和侵袭能力
取对数生长期的A2780 细胞,用无血清培养液稀释,调整细胞密度,接种至Transwell 小室上层,用镊子将小室置于培养板内,分别加入不同浓度(7.5、15.0、30.0 μmol/L)的地榆皂苷I,另设置不含药物的对照组,培养24 h,甲醇固定,结晶紫染色,用磷酸缓冲液除去没有结合的结晶紫,并用棉签轻轻擦掉上层细胞,显微镜下随机观察并记数迁移细胞数。用无血清培养基稀释Matrigel 胶,并涂于上室的聚碳酸酯膜表面,其余步骤同迁移实验,分析细胞侵袭能力。
2.4 Western blotting 检测 E-cadherin 和 Ncadherin 蛋白表达
将处于对数生长期的A2780细胞重悬成细胞悬液,以2×105个/孔接种于6 孔板,分别加入不同浓度(7.5、15.0、30.0 μmol/L)的地榆皂苷I,另设置不含药物的对照组,培养24 h。用细胞刮刮下各组细胞,加入RIPA 裂解液提取蛋白,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于封闭液中缓慢摇荡1 h,分别加入E-cadherin、N-cadherin 一抗后孵育过夜;加入二抗室温孵育,滴加化学发光液显影。
2.5 qRT-PCR 检测IGFL2-AS1 和miR-138-5p 的表达
将处于对数生长期的A2780细胞重悬成细胞悬液,以2×105个/孔接种于6 孔板,分别加入不同浓度(7.5、15.0、30.0 μmol/L)的地榆皂苷I,另设置不含药物的对照组,培养24 h。收集细胞,加入Trizol试剂提取RNA,测定RNA 浓度和纯度后加入逆转录酶合成cDNA,进行qRT-PCR 分析,用2-ΔΔCt法计算相对表达量。以GAPDH和U6为内参,引物序列见表1。

表1 引物序列Table 1 Primer sequences
2.6 细胞转染
将IGFL2-AS1 干扰表达载体及阴性对照转染至A2780 细胞,记为si-NC 组、si-IGFL2-AS1 组;将IGFL2-AS1过表达载体及阴性对照转染至A2780细胞,然后用30 μmol/L 的地榆皂苷I 处理,记为地榆皂苷I+pcDNA-IGFL2-AS1 组、地榆皂苷I+pcDNA 组。分别检测细胞活性、增殖、迁移、侵袭、IGFL2-AS1、miR-138-5pmRNA 表达和E-cadherin、N-cadherin 蛋白表达。
2.7 双荧光素酶报告实验
设置miR-138-5p 与MUT-IGFL2-AS1 组、miR-138-5p 与WT-IGFL2-AS1 组、miR-NC 与MUTIGFL2-AS1 组以及miR-NC 与WT-IGFL2-AS1 组。用转染试剂依据分组情况将载体转染A2780 细胞中,按照说明书分析荧光素酶活性。
2.8 统计学分析
采用SPSS 20.0 软件进行统计学分析,本研究相关数据均为计量资料,且符合正态分布,用±s表示,两组比较行t检验,多组间比较采用单因素方差分析。
3 结果
3.1 地榆皂苷I 对A2780 细胞增殖、迁移、侵袭和E-cadherin、N-cadherin 蛋白表达的影响
如图1 和表2 所示,不同浓度的榆皂苷I 处理A2780 细胞后,细胞增殖抑制率和E-cadherin 蛋白表达水平均显著升高(P<0.05),克隆形成数、迁移细胞数、侵袭细胞数和N-cadherin 蛋白表达水平均显著降低(P<0.05),呈剂量相关性。
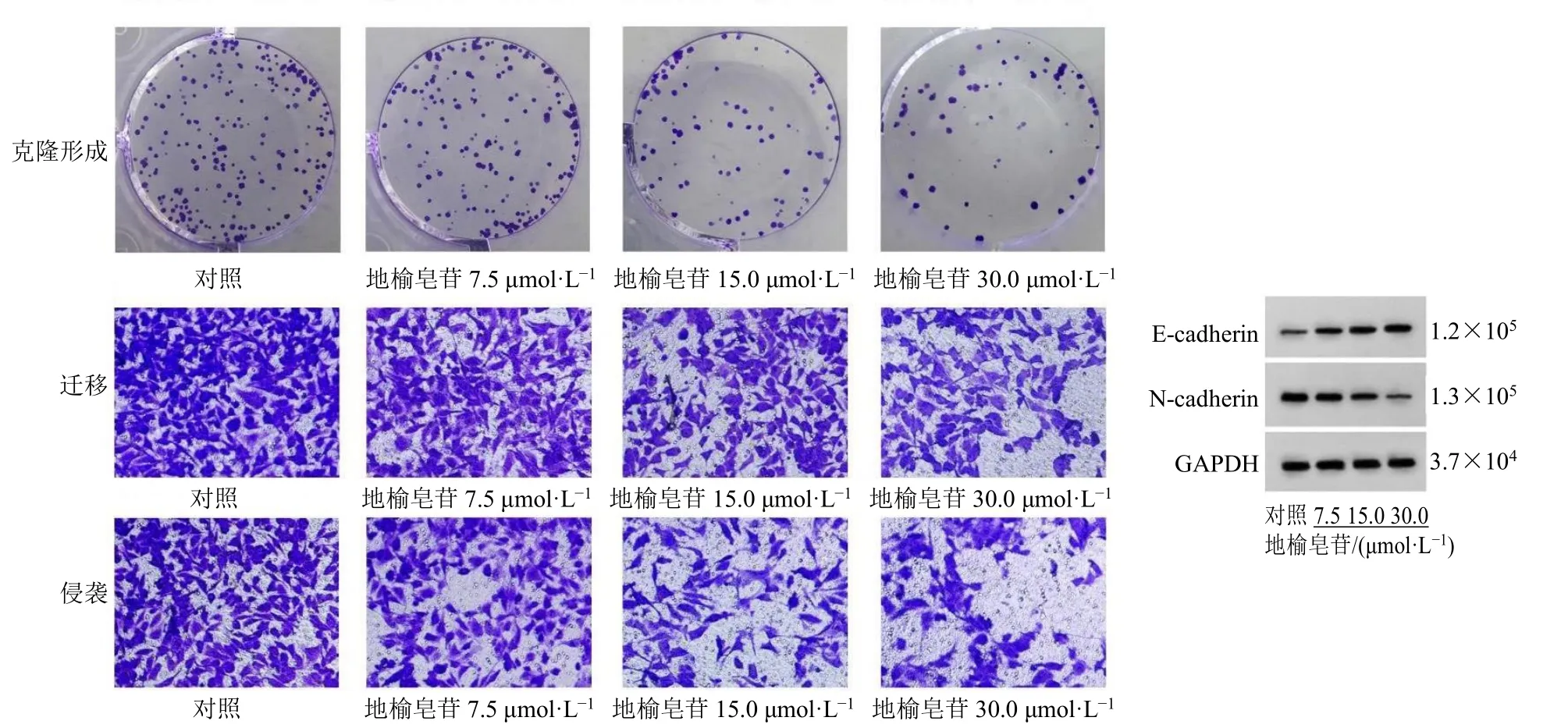
图1 地榆皂苷I 对A2780 细胞克隆形成、迁移和侵袭以及E-cadherin、N-cadherin 蛋白表达的影响Fig. 1 Effect of ziyuglycoside I on colony formation, migration, invasion and E-cadherin, N-cadherin protein expressions in A2780 cells
表2 地榆皂苷I 抑制A2780 细胞增殖、迁移和侵袭 (±s, n = 9)Table 2 Inhibit of proliferation, migration and invasion of A2780 cells by ziyuglycoside I (±s, n = 9)
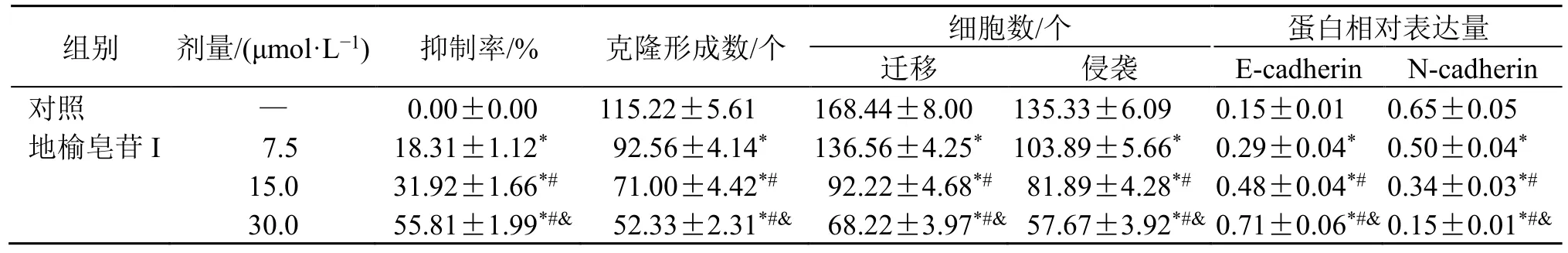
表2 地榆皂苷I 抑制A2780 细胞增殖、迁移和侵袭 (±s, n = 9)Table 2 Inhibit of proliferation, migration and invasion of A2780 cells by ziyuglycoside I (±s, n = 9)
与对照组比较:*P<0.05;与地榆皂苷I(7.5 μmol·L-1)组比较:#P<0.05;与地榆皂苷I(15.0 μmol·L-1)组比较:&P<0.05,表3 同。*P < 0.05 vs control group; #P < 0.05 vs ziyuglycoside I (7.5 μmol·L-1) group; &P < 0.05 vs ziyuglycoside I (15.0 μmol·L-1) group, same as table 3.
组别 剂量/(μmol·L-1) 抑制率/% 克隆形成数/个 细胞数/个 蛋白相对表达量迁移 侵袭 E-cadherin N-cadherin对照 — 0.00±0.00 115.22±5.61 168.44±8.00 135.33±6.09 0.15±0.01 0.65±0.05地榆皂苷I 7.5 18.31±1.12* 92.56±4.14* 136.56±4.25* 103.89±5.66* 0.29±0.04* 0.50±0.04*15.0 31.92±1.66*# 71.00±4.42*# 92.22±4.68*# 81.89±4.28*# 0.48±0.04*# 0.34±0.03*#30.0 55.81±1.99*#& 52.33±2.31*#& 68.22±3.97*#& 57.67±3.92*#& 0.71±0.06*#& 0.15±0.01*#&
3.2 地榆皂苷I 对A2780 细胞IGFL2-AS1 和miR-138-5p mRNA 表达的影响
如表3 所示,与对照组比较,地榆皂苷I 显著抑制A2780 细胞IGFL2-AS1mRNA 表达(P<0.05),促进miR-138-5pmRNA 表达(P<0.05),呈剂量相关性。
表3 地榆皂苷I 对A2780 细胞IGFL2-AS1 和miR-138-5p mRNA 表达的影响 (±s, n = 9)Table 3 Effect of ziyuglycoside I on IGFL2-AS1 and miR-138-5p mRNA expressions in A2780 cells (±s, n = 9)

表3 地榆皂苷I 对A2780 细胞IGFL2-AS1 和miR-138-5p mRNA 表达的影响 (±s, n = 9)Table 3 Effect of ziyuglycoside I on IGFL2-AS1 and miR-138-5p mRNA expressions in A2780 cells (±s, n = 9)
组别 剂量/(μmol·L-1) mRNA 相对表达量IGFL2-AS1 miR-138-5p对照 — 1.00±0.00 1.00±0.00地榆皂苷I 7.5 0.75±0.04* 1.59±0.09*15.0 0.51±0.05*# 2.16±0.13*#30.0 0.25±0.03*#& 3.01±0.16*#&
3.3 IGFL2-AS1 转染效率的检测
如表4 所示,与si-NC 组比较,si-IGFL2-AS1组IGFL2-AS1mRNA 表达水平显著降低(P<0.05);与pcDNA 组比较,pcDNA-IGFL2-AS1 组IGFL2-AS1mRNA 表达水平显著升高(P<0.05)。
表4 各组IGFL2-AS1 mRNA 表达 (±s, n = 9)Table 4 IGFL2-AS1 mRNA expression in each group(±s, n = 9)

表4 各组IGFL2-AS1 mRNA 表达 (±s, n = 9)Table 4 IGFL2-AS1 mRNA expression in each group(±s, n = 9)
与si-NC 组比较:*P<0.05;与pcDNA 组比较:#P<0.05。*P < 0.05 vs si-NC group; #P < 0.05 vs pcDNA group.
组别 IGFL2-AS1 mRNA 相对表达量si-NC 1.00±0.00 si-IGFL2-AS1 0.34±0.03*pcDNA 1.00±0.00 pcDNA-IGFL2-AS1 3.21±0.06#
3.4 下调IGFL2-AS1 对A2780 细胞增殖、迁移和侵袭的影响
如图2 和表5 所示,IGFL2-AS1表达下调显著增加miR-138-5p表达、增殖抑制率以及E-cadherin蛋白表达(P<0.05),但减少克隆形成数、迁移细胞数、侵袭细胞数和N-cadherin 蛋白表达(P<0.05)。

图2 下调IGFL2-AS1 对A2780 细胞克隆形成、迁移和侵袭以及E-cadherin、N-cadherin 蛋白表达的影响Fig. 2 Effect of down-regulation of IGFL2-AS1 on colony formation, migration, invasion and E-cadherin, N-cadherin protein expressions in A2780 cells
表5 下调IGFL2-AS1 抑制A2780 细胞增殖、迁移和侵袭 (±s, n = 9)Table 5 Down-regulation of IGFL2-AS1 inhibits proliferation, migration and invasion of A2780 cells (±s, n = 9)

表5 下调IGFL2-AS1 抑制A2780 细胞增殖、迁移和侵袭 (±s, n = 9)Table 5 Down-regulation of IGFL2-AS1 inhibits proliferation, migration and invasion of A2780 cells (±s, n = 9)
与si-NC 组比较:*P<0.05。*P < 0.05 vs si-NC group.
组别 miR-138-5p mRNA相对表达量 抑制率/% 克隆形成数/个 细胞数/个 蛋白相对表达量迁移 侵袭 E-cadherin N-cadherin si-NC 1.00±0.00 0.00±0.00 114.33±6.31 165.67±4.85 136.44±7.79 0.16±0.01 0.66±0.05 si-IGFL2-AS1 2.62±0.09* 46.51±2.59* 61.44±2.71* 78.67±4.71* 67.22±2.97* 0.59±0.05* 0.24±0.02*
3.5 IGFL2-AS1 和miR-138-5p 的靶向关系
Starbase 在线软件预测显示IGFL2-AS1和miR-138-5p有互补序列(图3)。如表6 所示,miR-138-5p与WT-IGFL2-AS1 共转染后细胞荧光素酶活性降低,而miR-138-5p 与MUT-IGFL2-AS1 共转染后细胞荧光素酶活性无显著变化。
表6 荧光素酶活性分析 (±s, n = 9)Table 6 Analysis of luciferase activity (±s, n = 9)

表6 荧光素酶活性分析 (±s, n = 9)Table 6 Analysis of luciferase activity (±s, n = 9)
与miR-NC 组比较:*P<0.05。*P < 0.05 vs miR-NC group.
组别 荧光素酶活性WT-IGFL2-AS1 MUT-IGFL2-AS1 miR-NC 0.95±0.06 1.00±0.09 miR-138-5p 0.38±0.04* 1.02±0.12
3.6 过表达IGFL2-AS1对地榆皂苷I处理的A2780细胞增殖、迁移和侵袭的影响
如图4 和表7 所示,与地榆皂苷I+pcDNA 组比较,地榆皂苷I+pcDNA-IGFL2-AS1 组miR-138-5pmRNA 表达、增殖抑制率和E-cadherin 蛋白表达水平均显著降低(P<0.05),克隆形成数、迁移细胞数、侵袭细胞数和N-cadherin 蛋白表达水平均显著升高(P<0.05)。

图4 过表达IGFL2-AS1 对地榆皂苷I 处理的A2780 细胞克隆形成、迁移和侵袭以及E-cadherin、N-cadherin 蛋白表达的影响Fig. 4 Effect of overexpression of IGFL2-AS1 on colony formation, migration, invasion and E-cadherin, N-cadherin protein expressions in A2780 cells treated with ziyuglycoside I
表7 过表达IGFL2-AS1 对地榆皂苷I 处理的A2780 增殖、迁移和侵袭的作用 (±s, n = 9)Table 7 Effect of overexpression of IGFL2-AS1 on proliferation, migration and invasion of A2780 cells treated with ziyuglycoside I (±s, n = 9)

表7 过表达IGFL2-AS1 对地榆皂苷I 处理的A2780 增殖、迁移和侵袭的作用 (±s, n = 9)Table 7 Effect of overexpression of IGFL2-AS1 on proliferation, migration and invasion of A2780 cells treated with ziyuglycoside I (±s, n = 9)
与地榆皂苷I+pcDNA 组比较:*P<0.05。*P < 0.05 vs ziyuglycoside I + pcDNA group.
组别 剂量/(μmol·L-1)miR-138-5p mRNA相对表达量 抑制率/% 克隆形成数/个细胞数/个 蛋白相对表达量迁移 侵袭 E-cadherin N-cadherin地榆皂苷I+pcDNA 30 1.00±0.00 55.99±2.20 52.22±3.52 70.22±4.13 58.33±3.92 0.69±0.04 0.15±0.02地榆皂苷I+pcDNAIGFL2-AS1 30 0.37±0.04* 21.21±1.67* 85.22±4.41* 121.22±5.09* 90.33±5.23* 0.35±0.03* 0.43±0.03*
4 讨论
中药抗肿瘤有其独特的优势,能改善患者生活质量,延长生存期,或能够为卵巢癌的维持治疗提供新的思路[9-10]。因此,开发可用于防治卵巢癌的中药及有效成分有助于卵巢癌的治疗。研究报道,地榆皂苷II 可抑制肝癌细胞的增殖和转移[11];地榆皂苷II 可抑制人舌鳞癌CAL27 细胞的增殖[12];地榆皂苷I 通过诱导p53 介导的G2/M 细胞周期阻滞和细胞凋亡,抑制乳腺癌MDA-MB-231 细胞的增殖[13];地榆皂苷I 可以抑制细胞活力并诱导视网膜母细胞瘤WERI-Rb-1 细胞的凋亡[14]。本研究结果显示,地榆皂苷I 处理A2780 细胞后,细胞增殖、迁移和侵袭能力减弱,E-cadherin 和miR-138-5p表达上调,N-cadherin 和IGFL2-AS1表达下调,呈剂量相关性;表明地榆皂苷I 抑制A2780 细胞增殖、迁移和侵袭。然而,尚未知地榆皂苷I 在卵巢癌的分子机制。
lncRNAIGFL2-AS1可以通过竞争性结合miRNA 来解除靶下游靶点的表达抑制,进而调控人类肿瘤的进展。研究报道,IGFL2-AS1在结直肠癌细胞和组织中显著上调,敲低IGFL2-AS1抑制了舌鳞状细胞癌细胞的增殖、迁移、侵袭通过靶向调控miR-433-3p的表达[15]。同时,过表达的IGFL2-AS1可以促进胃癌细胞的生长和转移通过竞争性结合miR-802调控环磷酸腺苷调节的磷酸蛋白19(cyclic adenosine monophosphate-regulated phosphoprotein 19,ARPP19)[8]。本研究结果表明IGFL2-AS1沉默可抑制A2780 细胞增殖、迁移和侵袭。此外,通过Starbase 预测网站发现,miR-138-5p在IGFL2-AS1上存在结合位点,随后,本研究证实miR-138-5p是IGFL2-AS1的靶基因。此外,一些研究表明miR-138-5p在人类多种癌症中发挥抑癌作用。过表达miR-138-5p可通过靶向细胞周期蛋白依赖性激酶6(cyclin-dependent kinase 6,CDK6)使抗性上皮性卵巢癌细胞对紫杉醇敏感[16]。同时,研究报道敲除lncRNA HOTAIR 可以通过抑制miR-138-5p调控的zeste 增强子同源物2(enhancer of zeste homolog 2,EZH2)和沉默信息调节因子1(silent information regulator factor 1,SIRT1)逆转卵巢癌细胞的顺铂耐药[17]。本研究发现IGFL2-AS1靶向调控miR-138-5p。提示IGFL2-AS1可能通过调控miR-138-5p影响卵巢癌进展。
本研究用不同浓度的地榆皂苷I 处理A2780 细胞后,IGFL2-AS1表达水平降低,miR-138-5p表达水平逐渐升高,表明地榆皂苷I 可调控IGFL2-AS1和miR-138-5p的表达。且本研究还发现过表达IGFL2-AS1可减弱地榆皂苷I 对A2780 细胞增殖、迁移和侵袭的作用。综上,地榆皂苷I 可通过抑制IGFL2-AS1的表达来促进miR-138-5p产生,进而抑制卵巢癌细胞肿瘤特性。提示IGFL2-AS1可能是卵巢癌的潜在治疗靶点。但本研究仅限于体外实验,其在体内的作用还有待进一步研究。
利益冲突所有作者均声明不存在利益冲突

