中药多糖抗纤维化作用机制研究进展
张明慧,冀 蒙,高静东,王培培*
1. 上海海洋大学食品学院,上海 201306
2. 海军军医大学第二附属医院(上海长征医院)胰胆外科,上海 200003
3. 南京中医药大学附属苏州市中医医院 肿瘤科,江苏 苏州 215008
纤维化是一类具有显著损伤的慢性代谢性器脏疾病,其特征是肌成纤维细胞的异常增多及细胞外基质(extracellular matrix,ECM)蛋白的过度产生与沉积,随着患病时间推移,易导致癌变和死亡[1]。该病证涉及多个器官,尤其是与一些慢性代谢性疾病密切相关,包括肝炎、肝硬化、糖尿病、心脏衰竭、特发性肺纤维化、慢性肾脏病(chronic kidney disease,CKD)和硬皮病等[2]。据统计,全球约有25%的人患有与纤维化相关的疾病[3]。在工业化国家,45%的死亡与纤维化疾病有关[4-5]。已有研究表明,一些抗纤维蛋白溶解成分,如免疫抑制剂糖皮质激素和抗氧化剂等,可用于治疗纤维化[6]。免疫抑制剂如糖皮质激素在抑制炎症反应、减缓细胞增生等方面具有一定的抗纤维化作用,而抗氧化剂则有助于减少氧化应激对细胞的损害,减缓纤维化的进程[7-8]。如N-乙酰半胱氨酸是谷胱甘肽的前体,而谷胱甘肽是人体内重要的抗氧化剂[7]。维生素E 作为另一种抗氧化剂,也对转化生长因子-β(transforming growth factor-β,TGF-β)/Smad 信号通路有抑制作用[8]。然而,这些免疫抑制剂和抗氧化剂的使用也伴随着严重的不良反应,对患者的预后产生不良影响[9-10]。免疫抑制剂可能导致免疫系统的抑制,增加感染风险,同时抗氧化剂的长期使用也可能引发一系列问题[9],包括抗氧化剂过量导致的负面效应。此外,这些药物的长期使用可能会对身体其他系统产生负面影响,影响患者的生活质量。因此,尽管这些药物在一定程度上显示了对纤维化的治疗效果,但其不良反应使寻找更为安全、有效的替代治疗方法尤为重要[11]。
中药复方及中药提取物在治疗器官纤维化方面表现出显著的潜力[12]。中药具有复杂的组分和多样的作用靶点,导致对其机制研究较为困难,同时使用统一的方法评价其疗效也面临一定挑战。然而,正是其多组分、多通路的综合效应,使中药在治疗纤维化方面呈现出独特的优势。因此,为了更深入理解中药在纤维化治疗中的作用机制,有必要加强对中药药效物质基础的明确,深入挖掘中药抗纤维化潜在靶点,通过系统研究和药物设计开发新的治疗方法,为发展更为安全、有效的抗纤维化治疗策略提供重要的科学支持。
1968 年日本学者首次发现香菇多糖具有抗肿瘤活性,引发了天然活性多糖的研究热潮[13]。现代药理学研究表明,中药活性多糖具有多种生物活性,如抗肿瘤、抗氧化、抗辐射、抗病毒、调血脂和免疫调节等[14-19]。相较于其他抗纤维化药物和中药有效成分,中药多糖具有多靶点、多通路及低不良反应等优势[20]。目前,人参多糖注射液、黄芪多糖注射液和茯苓多糖注射液等中药多糖制剂已广泛用于临床[21]。
随着对中药多糖研究的不断深入,越来越多研究表明中药多糖能通过TGF-β/Smad、Toll 样受体4(Toll-like receptor 4,TLR4)/核因子-κB(nuclear factor-κB , NF-κB )、 磷脂酰肌醇 3- 激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)等通路影响和调节纤维化进程,改善纤维化损伤[22]。目前,针对中药多糖调控纤维化的研究日益增加,但近年研究缺乏系统的梳理。基于此,本文针对中药多糖对不同纤维化的作用机制进行综述,为中药多糖防治纤维化疾病提供一定的理论支持和临床参考意义。有望为开发安全、有效的纤维化治疗药物提供重要的科学依据。
1 基于CiteSpace 分析中药多糖和纤维化的研究趋势
1.1 数据来源及处理
本研究利用中国知网文献数据库(China National Knowledge Infrastructure,CNKI),通过“中药多糖、多糖、纤维化”等关键词检索,截至2023年9 月,获得620 篇中文文献,并通过Refworks 格式输出,输出文件命名为“download_1.txt”。采用CiteSpace 6.1.R2 软件完成数据筛选及转换,对关键词进行共现分析及突现分析,知识图谱见图1。借助PubMed 英文数据库,以“Fibrosis、Chinese herbal polysaccharides”等关键词检索分析中药多糖及纤维化的发文情况,数据截至2022 年12 月31 日。

图1 基于CiteSpace 的中药多糖及纤维化可视化分析图谱Fig. 1 Visualization analysis map of traditional Chinese medicine polysaccharides and fibrosis based on CiteSpace
1.2 结果及趋势分析
关于中药多糖和纤维化的相关研究论文呈现逐年上升的趋势(图1-A)。中药多糖防治纤维化疾病的相关文献共620 篇,包含263 个关键词,与中药多糖抗纤维化机制相关的高频关键词包括“氧化应激”“炎症”“免疫调控”“信号转导”“肠道菌群”和“细胞因子”等。基于CiteSpace 的关键词可视化分析,可见纤维化领域的研究主要集中在肝脏、肾脏和肺等纤维化疾病。中药多糖和氧化应激成为较新的研究热点。
2 中药多糖防治纤维化的作用机制
2.1 中药多糖防治肝纤维化的作用机制
肝病是全球公共卫生的主要问题之一。据调查显示,全世界有超过800 亿人受到影响,每年的死亡人数约为2 万[23]。普通人群中显著肝纤维化的患病率为7.6%[24],但在全世界范围内,其数值更高。肝纤维化是由肝炎、非酒精性脂肪肝、酒精性肝病、病毒或药物等持续的损伤修复反应导致的肝组织中ECM 异常沉积的病理过程,进一步导致肝脏结构功能异常[25-26]。肝星状细胞(hepatic stellate cell,HSC)的激活是引起肝脏损伤和导致肝纤维化的重要因素[27-28]。研究发现,中药多糖可以通过调节脂质代谢紊乱、影响氧化应激和炎症反应、调控肠道菌群等,抑制HSC 活化和ECM 沉积,改善肝纤维化等肝脏疾病。
2.1.1 调节脂质代谢 脂质代谢紊乱已被证明是肝纤维化的重要诱因[29]。腺苷酸活化蛋白激酶(adenosine phosphate activated protein kinase,AMPK)作为细胞能量传感器,在其中发挥着重要的调节作用。Zhang 等[30]研究发现麦冬多糖能够调节AMPK脂代谢信号通路,显著抑制肝脏中脂肪生成和细胞分化,从而改善脂质紊乱,抑制纤维化发展。同时,麦冬多糖可显著增强AMPK 的磷酸化水平,阻断体质量增加,调节肝脂代谢[31]。随着肝纤维化的发展,血清中透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、IV 型胶原(IV-collagen,IV-C)、III 型前胶原(pro-collagen III,PCIII)等指标逐渐升高,成为判断纤维化病情和治疗效果的血清学指标[32]。此外,天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、血清碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素(total bilirubin,TBIL)含量与肝损伤程度呈正相关,被认为是诊断肝损伤的重要指标。Li 等[33]发现灰树花多糖(Grifola frondosepolysaccharide,GFP)可抑制肝细胞坏死和肝纤维化组织增殖,有效降低肝纤维化大鼠血清IV-C、PCIII、LN、HA、ALT、AST 和TBIL 水平,改善肝组织病理改变。枸杞多糖可通过降低患病大鼠三酰甘油、总胆固醇、AST、ALT 水平来抑制肝纤维化[34-35]。此外,枸杞多糖通过激活AMPK,增加控制肝脂肪酸氧化的过氧化物酶体增殖剂激活受体α(peroxisome proliferators activated receptor α,PPARα)的表达,改善脂肪性肝病[36]。PPARα 还参与肝脏脂质代谢和胆汁酸的代谢及细胞命运的调控[37]。红景天多糖是从红景天根茎中分离纯化出的多糖,可改善血脂紊乱,显著降低血清三酰甘油、总胆固醇、ALT、AST 水平,激活AMPK 信号通路,增加PPARα的表达[38]。此外,在肝细胞中,细胞毒性脂质的积累及葡萄糖代谢的改变导致HSC 的激活和纤维化的发展[39]。综上,中药多糖通过调节AMPK 信号通路、抑制脂肪生成及改善脂质代谢等途径,对肝纤维化的预防和治疗具有显著的潜力。
2.1.2 抗炎 炎症是导致肝纤维化的核心原因之一,主要与NF-κB 信号通路有关[40-41]。抑制TLR4/NF-κB 信号通路可缓解肝纤维化。Fang 等[42]研究发现栀子花多糖(Gardeniajasminoidespolysaccharide,GPS)可抑制TLR4/NF-κB 信号传导,减少相关炎症因子表达,改善肝脏炎症。枸杞多糖可抑制TLR/NF-κB 信号通路,降低Wistar 大鼠肝脏的TLR4、TLR2 和NF-κB 蛋白水平,对CCl4诱导的肝纤维化具有保护作用[43]。黄芪多糖可抑制TLR4受体信号激活[44],下调髓样分化因子88(molecule myeloid differentiation factor 88,MyD88)表达[45],促进NF-κB 抑制剂活性。此外,NF-κB 水平磷酸化的降低可导致下游炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和IL-1β 下调,从而改善肝纤维化[46]。肝细胞被炎症因子入侵后,肝细胞、免疫细胞和血小板分泌的TGF-β1 等细胞因子刺激HSC的持续增殖[47]。TGF-β/Smad 是肝纤维化的主要信号传导途径之一。通过调节Smads 信号通路促进相关蛋白α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和Smad3 的上调,并分泌大量ECM,促进纤维化的发展。党参根多糖干预肝纤维化大鼠后,肝组织中α-SMA、TGF-β1、Smad3 表达显著降低,显著抑制肝纤维化进程[48]。狗肝菜多糖(dicliptera chinensispolysaccharide,DCP)可显著下调α-SMA、TGF-β1、TNF-α、IL-6 和IL-1β 水平,有效改善肝纤维化[49-51]。因此,中药多糖通过抑制炎症相关信号通路,如TLR4/NF-κB 和TGF-β/ Smad,对肝纤维化的干预具有重要作用,为探索肝纤维化治疗的新途径提供了重要的理论支持。
2.1.3 抗氧化 氧化应激也是加速肝纤维化进程的重要因素。GFP 中、高剂量组肝组织中超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性显著升高,丙二醛含量及一氧化氮水平显著降低[33]。彭景华等[52]发现虫草多糖可抑制脂质过氧化,从而显著抑制大鼠肝纤维化。枸杞多糖可激活PPARα 表达,进而促进AMP 活化AMPK 信号通路,增加了脂肪酸的氧化,同时有效抑制糖酵解代谢,减少三磷酸腺苷的产生,抑制肝纤维化发生[53]。这些研究表明,通过调节氧化应激反应,中药多糖在抑制肝纤维化过程中具有重要的保护作用。
2.1.4 调节肠道菌群 肠道微生物与肝纤维化的进程密切相关,改善肠道菌群失调,为治疗或改善肝纤维化提供了新途径[54]。此外,补充益生菌鼠李糖乳杆菌被证明可以减少肝脏炎症和纤维化[55]。灵芝多糖可显著降低厚壁菌门(Firmicutes)与拟杆菌门(Bacteroides)的相对丰度(F/B)值,调节有益菌的相对丰度,抑制其肝脏损伤和肠道菌群结构紊乱[56]。麦冬多糖-1 可以恢复肠道微生物群平衡,增加有益菌的含量。麦冬多糖-1 经肠道微生物降解利用后,可升高乙酸和戊酸的含量,抑制炎症并调节肝脏脂质代谢,并增加有益菌含量,调节肠道微生物群失衡[31]。通过调节肠道微生物群的平衡,中药多糖展现出在肝纤维化治疗中的潜在开发价值。中药多糖抗肝纤维化的作用机制见图2 和表1。
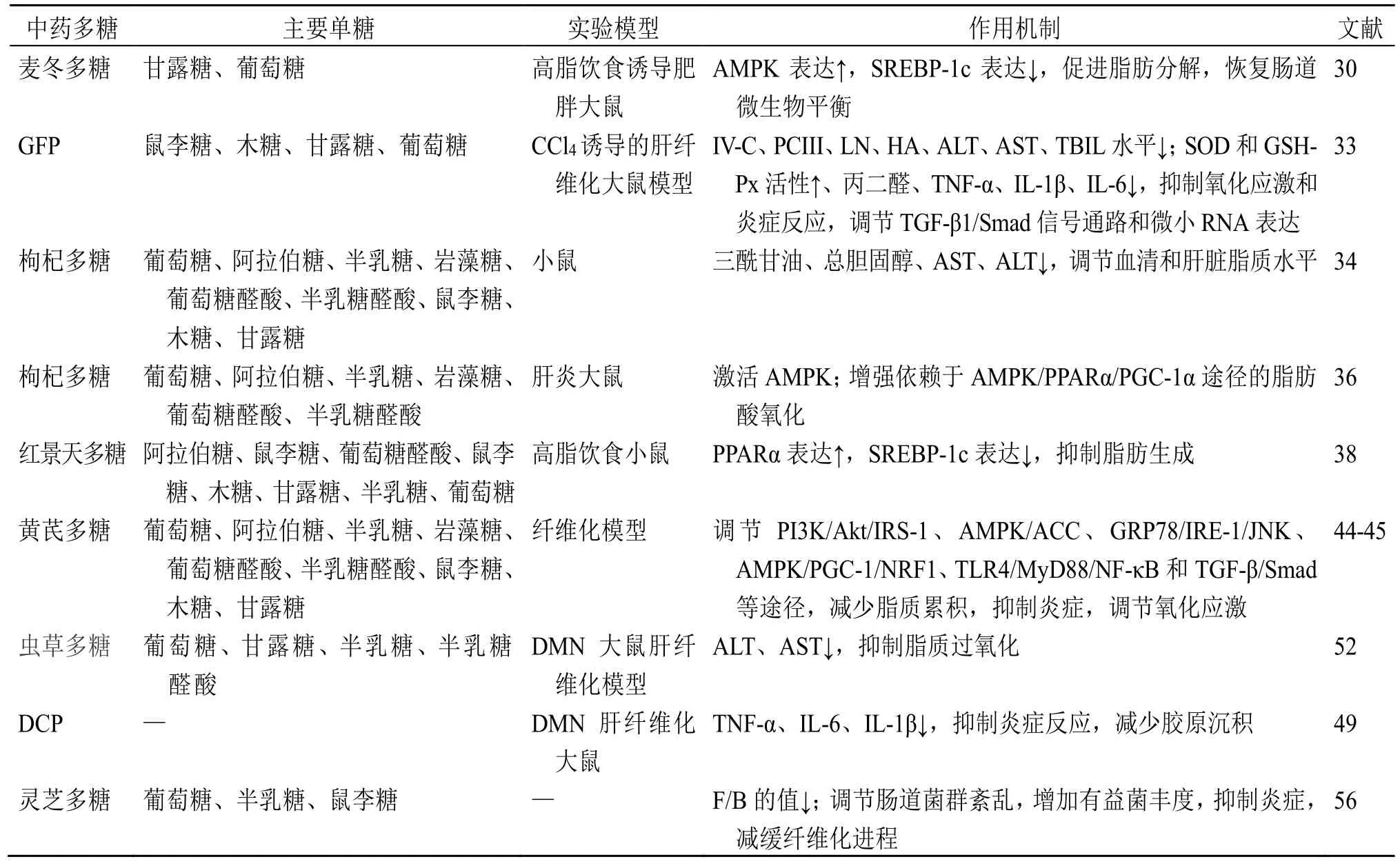
表1 中药多糖抗肝纤维化的作用机制Table 1 Mechanisms of traditional Chinese medicine polysaccharides against hepatic fibrosis
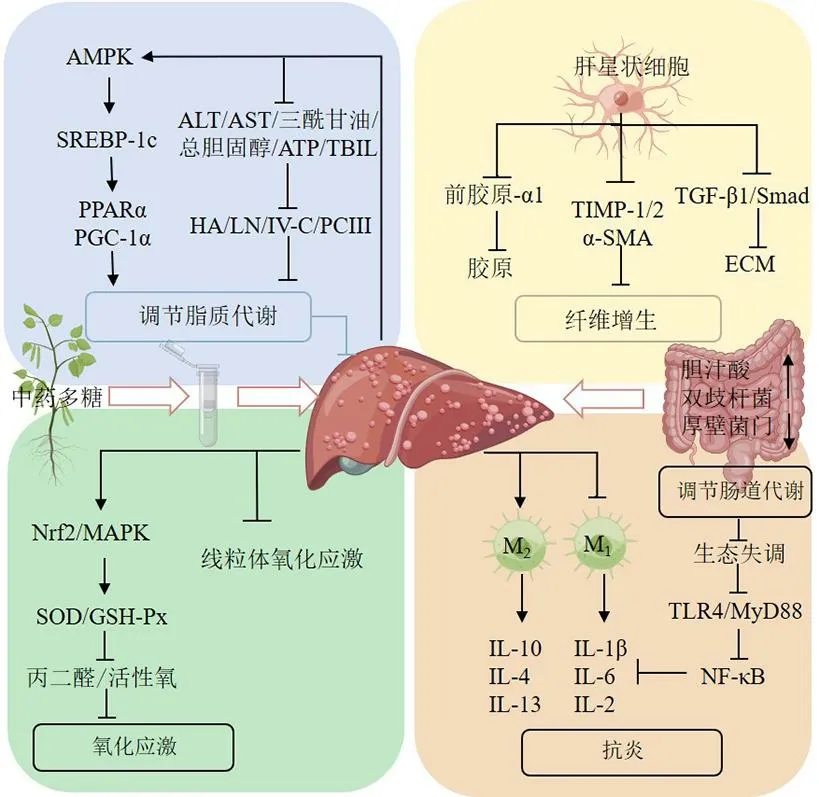
图2 中药多糖抗肝纤维化机制图Fig. 2 Mechanisms of traditional Chinese medicine polysaccharides against hepatic fibrosis
2.2 中药多糖防治肺纤维化的相关作用机制
肺纤维化病变过程包括炎症细胞堆积、结缔组织增生及ECM 过度沉积,从而引发弥漫性肺泡炎、肺泡结构紊乱等病理变化,最终导致慢性通气功能障碍和肺组织损伤等[57]。特发性肺纤维化是最常见的间质性肺炎疾病之一[58],一旦确诊,患者的中位生存期仅有3~5 年[59]。肺纤维化发病机制涉及TGF-β 异常积累、细胞募集及凋亡、炎症反应、氧化应激及基质金属蛋白酶( matrix metalloproteinase,MMP)/基质金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinase,TIMP)不平衡等多个方面[60-61]。近年来的研究表明,中药多糖在肺纤维化的治疗中发挥显著作用。其可以有效改善TGF-β信号通路诱导的肺组织中各种细胞的异常募集和凋亡,调节肺部炎症引起的机体失衡,并能通过氧化应激的调控来抑制肺组织的损伤,从而抑制肺纤维化的进程。这些研究表明中药多糖可能成为治疗肺纤维化的潜在治疗药物,为肺纤维化的防治提供新的研究方向。
2.2.1 抑制TGF-β 异常积累 TGF-β1 过量累积是肺纤维化进程中最主要因素之一,可诱导细胞外基质(extracellular matrix,EMT)过程,促进成纤维细胞分化、增殖和迁移,同时诱导成纤维细胞向肌成纤维细胞的表型转化[62]。在博来霉素诱导的肺纤维化小鼠模型中,经过75 d 的黄芪多糖给药,肺组织中TGF-β1 水平降低,NF-κB 信号传导被抑制,胶原蛋白沉积及纤维化区域显著减少[63]。罗勒多糖可抑制TGF-β 诱导的人肺癌A549 细胞的侵袭和运动,抑制TGF-β 诱导的波形蛋白上调及α-SMA 表达和E-钙黏蛋白表达下调[64],且在EMT 方面具有明显的抑制作用[65-66]。铁皮石斛多糖在博来霉素诱导的大鼠纤维化模型中显著改善了肺部炎症和纤维化指数,降低大鼠肺组织中TGF-β1 表达和Smad2/3磷酸化水平[67]。人参多糖通过抑制TGF-β 诱导的Smad2 的磷酸化,逆转胶原蛋白-1 和纤连蛋白的合成,也显著降低细胞中TGF-β3 受体TβRI 和TβRII的蛋白表达[68]。综上,中药多糖在调节TGF-β1 介导的肺纤维化过程中具有显著的抑制作用。
2.2.2 抑制炎症反应 由肺巨噬细胞表达的多种纤维化介质在肺的损伤和纤维化过程中具有重要作用。主要表型为M1巨噬细胞分泌的Th1 相关细胞因子(如TNF-α、IL-1β 和IL-6)及M2巨噬细胞释放Th2 相关细胞因子。昆布多糖在肺纤维化小鼠模型中显示出对巨噬细胞极化和标志物表达的抑制作用[69]。另一方面,单核趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)可以增进M1和M2的迁移和侵袭能力。冬虫夏草多糖对博来霉素诱导的小鼠肺纤维化表现出显著抑制作用,通过增加IL-1RA 水平、抑制MCP-1 的产生及减少羟脯氨酸(hydroxyproline,HYP)含量和纤维化区域[70]。此外,黄根多糖能够抑制炎症细胞浸润,降低肺组织中异常因子水平,展现出抗矽肺纤维化的潜力[71]。这些研究结果表明中药多糖在干预肺纤维化中对巨噬细胞的调节作用和炎症介质的调控具有重要的意义。
2.2.3 抗氧化 氧化应激损伤一定程度上也影响着肺纤维化的进程[72]。灵芝多糖可以增加模型组大鼠组织中SOD、谷胱甘肽、GSH-Px 和过氧化氢酶(catalase,CAT),同时降低丙二醛、HYP 含量,缓解肺纤维化损伤[73]。
2.2.4 调控非编码RNA 研究发现分化拮抗非编码 RNA(differentiation antagonizing non-protein coding RNA,DANCR)可以作为治疗肺纤维化的潜在靶点[74]。作为一种新型的长链非编码RNA(long noncoding RNA,LncRNA),DANCR 可阻断表皮分化,在细胞的生长、迁移、侵袭和分化等方面发挥关键作用[75-77],并且可以促进EMT 进展及恶性细胞侵袭能力[78-79]。当归多糖可显著下调DANCR 的表达,进而抑制DANCR 和AU 结合因子-1(AUbinding factor 1,AUF-1)间的相互作用及叉头型转录基因子O 亚型(fork head box class O3a,FoxO3)mRNA 的翻译,从而抑制EMT 和肺纤维化[80-81]。这些发现为针对LncRNA 和其相关调控因子的治疗策略提供了新的思路,为肺纤维化的治疗和干预提供了潜在的药物靶标。中药多糖抗肺纤维化的作用机制见图3。

图3 中药多糖抗肺纤维化调节机制Fig. 3 Modulation mechanisms of traditional Chinese medicine polysaccharides against pulmonary fibrosis
2.3 中药多糖防治肾脏纤维化的相关作用机制
CKD 也是当今主要公共卫生问题之一,排名仅次于艾滋病和糖尿病,成为第3 大导致过早死亡的原因(占比82%)[82]。肾间质纤维化是CKD 发展到后期的病理学特征,可导致肾衰竭甚至死亡。CKD 和肾纤维化影响着全球10%的人口和70 岁以上的半数成年人[83]。TGF-β 是导致慢性肾脏纤维化的关键因子,可激活蛋白激酶等多种细胞内信号通路,刺激ECM 的产生并抑制降解,从而介导肾纤维化的进展[84]。
黄芪多糖具有多重作用,一方面,可增加肾血流量,减少在肾小球和肾间质中的脂质过氧化物等沉积,保护肾组织[85];另一方面,黄芪多糖能有效抑制TGF-β1 在受损肾小管上皮细胞中的表达,抑制肾小球纤维化[86]。Wu 等[87]研究证明桑叶多糖可以抑制大鼠尿白蛋白、尿蛋白和结缔组织生长因子(connective tissue growth factor,CTGF)表达,从而有效抑制肾纤维化。此外,灵芝多糖可以预防促炎因子的增加,降低尿素、肌酐、TNF-α 及IL-6 的水平,抑制ECM 的累积,影响早期肾纤维化[88-89]。黄连多糖可以显著提高肾组织中SOD、CAT 和GSHPx 活性,显著降低肾组织中丙二醛含量、血清中TNF-α、IL-6 和超敏C 反应蛋白水平,抑制氧化应激和炎症反应对肾组织的损伤[90]。多蕊蛇菰多糖可通过增加MMP 的表达水平、降低TIMP 的表达水平及通过减少ECM 成分(如胶原蛋白I、III 和IV)和减少成纤维细胞的活化来显著缓解间质纤维化[91]。柴胡多糖可抑制TLR4 和高迁移率族蛋白1(high mobility group box 1,HMGB1)的过表达,降低NF-κB 的活性,从而抑制肾脏炎症和纤维化过程[92]。这些研究为开发治疗CKD 和纤维化的新策略提供了有益的线索。
2.4 中药多糖防治心肌纤维化相关作用机制
心肌纤维化是心血管疾病中的重要病理进程,通常由炎症和过度扩张引起,激活肌成纤维细胞并导致ECM 中胶原蛋白I、III 和IV 等过度积累[93-95]。黄芪多糖可通过调控TLR4/NF-κB 信号通路抑制病毒性心肌炎和细胞损伤[96]。黄精多糖可抑制NOD样受体热蛋白结构域相关蛋白3 和半胱氨酸天冬氨酸蛋白酶-1 的表达,减轻炎症,缓解心肌纤维化[97]。此外,线粒体功能障碍会影响纤维化进程[98-99],与氧化应激反应密切相关。当归多糖可降低丙二醛和活性氧的水平,增强SOD、GSH-Px 的活性,抑制心肌细胞凋亡并缓解氧化应激,从而抑制心肌纤维化[100]。此外,研究发现枸杞多糖可降低TGF-β1/Smads 信号通路相关蛋白表达,抑制TGF-β1 诱导的成纤维细胞增殖[101]。铁皮石斛多糖可加速脂质转运,抑制TGF-β1 和波形蛋白的表达,抑制EMT 转化诱导的纤维化,减缓心脏损伤[102]。这些研究结果表明,中药多糖在调节多个信号通路、减轻炎症反应、抑制氧化应激等方面发挥着对心肌纤维化的潜在保护作用。
2.5 中药多糖防治其他纤维化疾病
据报道,中药多糖在改善其他器官的纤维化方面表现出显著效果,包括腹膜纤维化、皮肤纤维化[103-104]、视网膜纤维化[105]等。腹膜纤维化是长期腹膜透析的一种严重并发症。研究发现,促进腹膜纤维化进程的主要机制涉及炎症和EMT,相关的信号通路主要有TGF-β 信号通路和非编码RNA调控的信号通路[106-107]。灵芝多糖能够显著降低大鼠腹腔内 Smad3 及 CTGF 的水平,抑制Smad3/CTGF 信号通路活化,从而改善大鼠腹腔纤维化[108]。黄芪多糖可以抑制TGF-β1 产生,减轻博来霉素诱导的硬皮病小鼠模型中胶原蛋白的过度积累[103],同时,黄芪多糖作用于脾脏和胸腺等免疫器官,增强免疫器官指数,促进免疫细胞增殖,抑制肿瘤的生长[109]。此外,Hu 等[104]对昆明小鼠受损皮肤创面进行处理,发现灵芝多糖可以提高成纤维细胞的活力,促进其迁移能力,多糖处理组的愈合率显著高于对照组。因此,中药多糖在不同器官的纤维化病变中展现出多方面的调节作用,对相关信号通路的调控有望成为治疗这些疾病的潜在策略。
3 结语与展望
纤维化是指ECM 的异常增生和沉积,是多种慢性器官疾病向器官硬化发展的关键环节,目前尚缺乏确切有效的药物治疗手段[110]。近年来,中药多糖因其能够通过多靶点、多通路治疗器官纤维化而成为研究的焦点。本文对中药多糖在治疗肝纤维化、肺纤维化、肾纤维化和心肌纤维化等疾病中的主要作用机制进行了总结(图4),为中药多糖治疗纤维化疾病新药开发提供了理论依据和参考价值。

图4 中药多糖抗纤维化机制Fig. 4 Anti-fibrotic mechanisms of traditional Chinese medicine polysaccharides
中药多糖在治疗纤维化过程中展现出多方位的调控作用,可通过调节多种细胞因子,如TGFβ、IL-1β、IL-6、IL-10 等,作用于TGF-β/Smad、NF-κB、HMGB1/TLR4、DANCR/AUF-1/FoxO3 等多条信号通路。在这个多层面的调控网络中,中药多糖介导了以下主要途径,以调控纤维化的发展。(1)中药多糖通过调节脂质代谢途径,影响关键酶的活性或基因表达,从而调解纤维化过程中的脂质积累;(2)通过抑制炎症反应,中药多糖可减缓或抑制纤维化过程中的炎症,调控NF-κB 信号通路中关键因子的表达;(3)通过调控非编码RNA 的表达,尤其是DANCR 等,进而调节纤维化相关的信号通路;(4)中药多糖具有抗氧化作用,通过降低氧化损伤,保持氧化还原平衡,减缓纤维化的进程;(5)中药多糖通过调节肠道菌群组成,影响肠-肝轴通路,调整免疫反应、代谢产物等多方面因素,影响纤维化进程。
然而,中药多糖抗纤维化研究仍主要停留在细胞和动物层面,其临床方面的应用及作用机制研究仍需深入探究。同时,由于多糖结构的复杂性和微观不均一性,未来研究还需关注多糖结构与功能的关系,明确其作用靶点及构效关系等方面的问题。新兴技术,如纳米颗粒技术、药物-靶点-通路网络、智能物联网等,已被应用于中药多糖抗纤维化机制的分析,这些新技术将有望在深入研究中药多糖的具体机制方面发挥积极作用。
利益冲突所有作者均声明不存在利益冲突

