黄精炮制品多糖多元指纹图谱的建立及化学模式识别
刁 卓,胡 冲 ,杨青山,张亚中 , *
1. 安徽医学高等专科学校,安徽 合肥 230031
2. 安徽省食品药品检验研究院,安徽 合肥 230051
3. 国家药监局中药质量研究与评价重点实验室,安徽 合肥 230051
4. 安徽中医药大学,安徽 合肥 230012
黄精PolygonatiRhizoma为百合科植物滇黄精PolygonatumkingianumColl. et Hemsl.、黄精P.sibiricumRed.或多花黄精P.cyrtonemaHua 的干燥根茎[1]。具有补气养阴、健脾、润肺、益肾的功效[2]。用于脾胃气虚、体倦乏力、胃阴不足等症[3]。黄精作为安徽省特色道地中药材,其使用历史至今已逾两千年,是著名的食疗补益中药[4],其被视为传统的中药材,是融药用、食用、观赏为一体具有很高经济价值的植物[5]。主要含有黄精多糖、甾体皂苷类、木脂素类等成分,具有抗疲劳、调节免疫、降血糖、抗菌和延缓衰老等作用[6],其中多糖为黄精的主要药效成分[7-9]。
黄精生品刺激性强,需蒸晒后方可入药,且诸多本草学著作所记载的黄精炮制方法基本都是以“九蒸九晒”为主[10-12]。然而黄精在蒸晒过程中不仅外观性状发生了改变,其糖类成分也发生了明显的改变[13-15]。虽然已经有研究表明炮制对黄精多糖中单糖组成、相对分子质量、抗氧化和免疫调节活性的影响[16-17],但基于糖类图谱对于黄精炮制品多糖影响的综合研究仍是必要的,这是一种有效的多糖分析方法,也是药理活性研究的基础。
为寻找不同蒸晒次数黄精多糖结构特征变化规律,探讨黄精炮制品多糖的变化,本实验建立了不同蒸晒次数的黄精炮制品多糖的高效薄层色谱(high thin-layer chromatography,HPTLC)、亲水作用色谱-高效液相色谱-蒸发光检测器(hydrophilic interaction liquid chromatography-high performance liquid chromatography-evaporative light scattering detector,HILIC-HPLC-ELSD)和超高效液相色谱-四级杆飞行时间串联质谱(ultra high pressure liquid chromatography-quadrupole time of flight tandem mass spectrometry,UHPLC-QTOF/MS)多元指纹图谱的方法,以果糖苷酶为特异性糖苷酶,所得酶解产物经色谱分析,后采用相似度以及偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA)的分析方法,对不同蒸晒次数黄精多糖的结构特征进行差异性研究,以期阐释不同蒸晒次数黄精炮制品的科学内涵,为其质量控制提供参考。
1 仪器与试药
1.1 仪器
Acquity UPLCTM型超高效液相色谱仪、Xevo G2 Q-Tof 质谱仪,美国Waters 公司;U3000 型高效液相色谱仪,配备Allech ELSD 6000 型蒸发光散射检测器,美国Dionex 公司;Elmasonic S 30(H)型超声波清洗器,德国Elma 公司;ML204 型万分之一电子天平、XP26 型百万分之一电子天平,瑞士Mettler Toledo 公司;FD240 型电热恒温干燥箱,德国Binder 公司;XMTD205 型水浴锅,常州国宇仪器制造有限公司;JW-3021HR 型高速冷冻离心机,安徽省嘉文仪器装备有限公司;CAMAG-ATS4 型全自动点样仪、Amga-7LC-Visualizer TLC 型数码相机成像,瑞士Camag 公司;LGJ-10S 型真空冷冻干燥机,北京松源华兴科技发展有限公司;Millipore Simplicity-185 型超纯水仪,美国Millipore 公司。
1.2 材料与试剂
硅胶G 板高效薄层板,批号1.05729,德国默克公司;对照品果糖(批号111504-201703,质量分数99.8%)、蔗糖(批号111507-202105,质量分数99.8%)、葡萄糖(批号110833-201908,质量分数99.8%),中国食品药品检定研究院;三氯甲烷(批号10006818)、醋酸乙酯(批号20210514)、冰醋酸(批号20211104)、正丁醇(批号20211026)、异丙醇(批号20171121)、苯胺(批号T20110218)、二苯胺(批号F20100728)、丙酮(批号T20110218)、乙醇(批号20211026)、氨水(批号20201225)、甲酸铵(批号91C2008AP)均为分析纯,国药集团化学试剂有限公司;乙腈(批号F22M7D201,色谱级)、乙腈(批号219087,质谱级),美国Fisher Scientific公司;甲酸,批号C12122684,质谱级,上海麦克林生化科技有限公司;磷酸,批号1849251,赛默飞世尔科技(中国)有限公司;α-淀粉酶(批号S11GS160659)、果糖苷酶(批号J21M11K10978),上海源叶生物科技有限公司;黄酒,酒精度10% vol;总糖15.1~40.0 g/L,安徽海神黄酒集团有限公司。
黄精采自安徽省池州市青阳县,经安徽省食品药品检验研究院张亚中教授鉴定,为百合科黄精属植物多花黄精P.cyrtonemaHua 的干燥根茎。
2 方法与结果
2.1 不同蒸晒次数样品的制备
选用个头均匀的干黄精药材(P0),除去杂质,洗净,切厚片,加20%黄酒(海神黄酒),置于带盖容器内,不时翻动,使药材能够均匀吸收黄酒,待黄酒完全被药材吸收(黄酒用量依据《中国药典》2020 年版“酒黄精”项下“每100 kg 黄精,用黄酒20 kg”[2])。再将药材均匀摆放在有孔的托盘上,置于蒸锅内,首次蒸制药材透心(约4 h),然后夜露1 晚,在45 ℃烘至表面不粘手为止(约4 h),再置于蒸锅内蒸2 h,依次进行,如此反复蒸制共13 次。在炮制过程中,每蒸晒1 次进行取样,编号P1~P13,备用。记录外观火候,如图1 所示。

图1 不同蒸晒次数黄精性状鉴别Fig. 1 Character identification of Polygonati Rhizoma with different steaming and drying times
2.2 黄精炮制品多糖的提取
将炮制后的黄精样品置于烘箱中烘干至恒定质量,并粉碎过三号筛。粉末于85%乙醇中浸泡24 h。滤过并离心,收集沉淀并烘干,加入15 倍的蒸馏水在80 ℃条件下超声提取2 次,每次2 h,离心,上清液合并,浓缩至10 mL 左右。在浓缩液中加入多糖溶液体积2% α-淀粉酶,在60 ℃水浴下酶解4 h,反应完成后,沸水浴灭酶10 min,除去淀粉。取上清液加相当于其体积1/4 的Sevage 试剂,剧烈震摇,离心,重复以上操作直到无白色絮状物产生为止。所得上清液加入无水乙醇(慢加快搅)至乙醇体积分数为80%,置4 ℃冰箱中放置24 h,离心,倒去上清液。沉淀加95%乙醇洗涤2 次,每次10 mL,离心,得沉淀物,加热水使沉淀溶解,冷冻干燥,得黄精粗多糖冻干粉。
2.3 供试品溶液的制备
取黄精炮制品多糖溶液(10 mg 多糖溶于4 mL纯化水)0.6 mL 若干份,加入100 U/mL 果糖苷酶溶液,随后将混合液置于40 ℃保温16 h;反应结束后,将混合液置于80 ℃加热20 min,终止酶解;4 500 r/min 离心15 min 除去变性酶,上清液经冷冻干燥(24 h)后即得酶水解产物。取酶水解产物,用60%乙醇1 mL 溶解制得供试品溶液后,作TLC 分析。取10 mg 黄精多糖,加20 mL 水制成质量浓度为0.5 mg/mL 黄精多糖溶液,取5 mL 黄精多糖溶液与5 mL 100 U/mL 果糖苷酶溶液混合。
混合物在振荡器中水解(55 ℃,200 r/min,3 h),并在80 ℃下加热20 min 以使酶变性。4 500 r/min 离心(离心半径8.56 cm)15 min,取上清液,干燥,溶解在2 mL 乙腈-水(1∶1)溶液后待HILICHPLC-ELSD 以及UHPLC-QTOF/MS 分析。
2.4 对照品溶液的制备
取果糖、蔗糖、葡萄糖约10 mg,精密称定,转移至10 mL 量瓶中,加水定容至刻度,分别配制成质量浓度均为1 mg/mL 的对照品溶液。
2.5 色谱条件
2.5.1 HPTLC 色谱条件 采用高效薄层色谱板(默克公司),展开剂为正丁醇-异丙醇-水-醋酸(7∶5∶2∶1),展开至95 mm,取出吹干,用苯胺-二苯胺显色剂进行显色,显色后放置于加热板上105 ℃加热10 min,在日光灯下观察。
2.5.2 HILIC-HPLC-ELSD 色谱条件 U3000 型高效液相色谱仪(配备Allech ELSD 6000 蒸发光散射检测器),色谱柱为Hypersil Gold™ Pei HILIC HPLC(250 mm×4.6 mm,5 μm);流动相为乙腈-水;洗脱程序:0~25 min,85%~65%乙腈;25~35 min,65%~50%乙腈;体积流量1.0 mL/min;柱温35 ℃;进样量10 μL。
2.5.3 液质联用分析条件
(1)色谱条件:Acquity UPLCTM超高效液相色谱仪,色谱柱为Waters Cortecs HILIC 色谱柱(100 mm×2.1 mm,2.7 μm);流动相为乙腈-8 mmol/L 甲酸铵水溶液(pH 9.8),洗脱程序:0~10 min,12%乙腈;10~18 min,12%~20%乙腈;18~22 min,20%~25%乙腈;22~27 min,25%~30%乙腈;柱温55 ℃;体积流量0.30 mL/min;进样体积2 μL。
(2)质谱条件:Xevo G2 Q-Tof 质谱仪,电喷雾电离(ESI-);毛细管电压为3 kV,锥孔电压为30 V;离子源温度为120 ℃,脱溶剂气温度为350 ℃;脱溶剂气流量为500 L/h;碰撞气体为氩气;碰撞电压20~50 V;扫描时间为0.2 s;质量扫描范围m/z50~1 500,采用Leucine enkephalin 对采集过程进行实时校准。
2.6 方法学考察
2.6.1 精密度试验 取P0 供试品1 份,按“2.3”项下方法制备供试品溶液,连续进样6 次,并记录各共有峰的相对保留时间和相对峰面积(以果糖的出峰时间和峰面积为参照,其他各峰出峰时间和峰面积与其的比值,下同),测得其共有峰相对保留时间和相对峰面积的RSD 均小于3.0%,表明该仪器系统精密度良好,符合指纹图谱要求。
2.6.2 重复性实验 取P0 供试品6 份,按“2.3”项下方法制备供试品溶液,按“2.5”项下色谱条件进行测定,测得各共有峰的相对保留时间和相对峰面积的RSD 均小于3.0%,同一样品每次提取之间的结果比较一致,表明该提取方法重复性良好,符合指纹图谱要求。
2.6.3 稳定性实验 取同一份P0 供试品溶液,分别在0、2、4、8、12、24 h 进样,测得其共有峰相对保留时间和相对峰面积的RSD 均小于3.0%,表明供试品溶液在24 h 内较稳定,化学成分及含量不会发生改变,符合指纹图谱要求。
2.7 数据处理与分析
采用ChemPattern 化学指纹和代谢组学系统解决方案软件1.0 版扫描HPTLC 色谱图上各条带光密度值,生成电子扫描特征图谱,随后采用相似性评价系统创建各电子扫描特征图谱共有模式图谱,并计算各特征图谱与共有模式图谱之间的相关系数。采用SIMCA 13 统计软件进行PLS-DA。每个色谱峰对鉴别结果的影响由变量重要性投影(variable importance projection,VIP)值确定。
2.8 黄精炮制品HPTLC 指纹图谱的建立
针对不同蒸晒次数的黄精炮制品使用专业软件ChemPattern 化学指纹图谱和代谢组学系统解决方案软件(1.0 版)展开分析,发现随着蒸晒次数的改变色谱峰发生了变化,这一发现也证实了日光下薄层色谱图肉眼观察所得出的结果。根据对照品比对可知,黄精生品(P0)薄层色谱中比移值0.42 处棕色斑点为果糖,由图2 显示,随着蒸晒次数的变化,果糖斑点逐渐变淡,直至六蒸六晒(P6)时无法检出。同时利用软件将斑点信号转化为色谱峰信号,如图3 所示,黄精生品(P0)~至五蒸五晒(P5)时为7 个共有峰,而六蒸六晒(P6)之后比移值在0.42 处的色谱峰(果糖)同样无法检出。此外,六蒸六晒(P6)~十一蒸十一晒(P11)的样品相较于黄精生品(P0)~五蒸五晒(P5)的样品在比移值为0.09 处的色谱峰也有所减少,但十二蒸十二晒(P12)之后该比移值处的色谱峰又再次检出。根据前处理可知,本实验是通过糖苷酶水解黄精多糖得到其特异性寡糖片段,故而随着色谱峰的变化说明黄精炮制过程中糖类成分发生了变化。
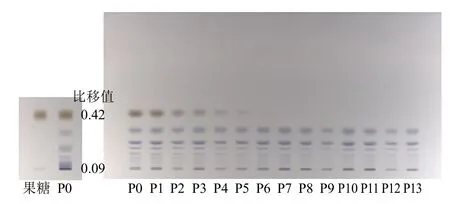
图2 黄精生品和炮制品的薄层鉴别图Fig. 2 Thin layer identification of raw and processed Polygonati Rhizoma
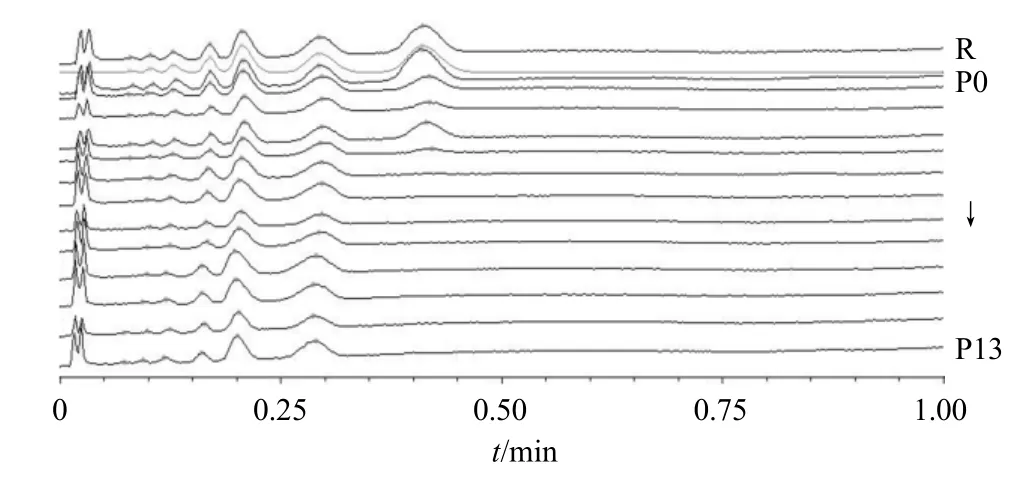
图3 黄精炮制品HPTLC 指纹图谱Fig. 3 HPTLC fingerprint of processed Polygonati Rhizoma
采用ChemPattern 化学指纹和代谢组学系统解决方案软件1.0 版中相似性评价系统对黄精炮制品进行相似度评价,指定炮制0 次的生黄精(P0)指纹图谱为参照图谱。结果P0~P13 的相似度分别为1.000、0.995、0.959、0.998、0.955、0.745、0.619、0.588、0.512、0.515、0.516、0.518、0.518、0.518,相似度在0.512~0.998,结果表明,不同蒸晒次数的黄精炮制品较为分散。其中从六蒸六晒(P6)之后相似度低于0.620。表明不同蒸晒次数的黄精炮制品具有不同的HPTLC 指纹图谱,由此可以推断出各炮制品多糖之间结构特征存在差异。
2.9 黄精炮制品多糖的HILIC-HPLC-ELSD 分析
将所得的14 批黄精炮制品指纹图谱依次导入到“中药色谱指纹图谱相似度评价软件(2012 版)。以样品P0 作为参照图谱,时间窗宽度设为0.1 min,采用中位数法,利用多点校正法进行峰匹配,生成对照图谱(R),14 批黄精炮制品色谱图与对照图谱的叠加图谱如图4 所示,将黄精炮制品多糖水解产物指纹图谱中共有峰的保留时间与单糖标准品的保留时间比对,发现峰1、2、4 分别为果糖、葡萄糖和蔗糖。
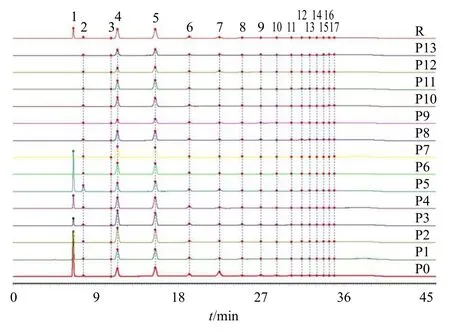
图4 果糖苷酶水解下黄精炮制品HPLC 指纹图谱Fig. 4 HPLC fingerprint of processed Polygonati Rhizoma by hydrolysis of fructosidase
指定炮制0 次的生黄精(P0)指纹图谱为参照图谱,将蔗糖峰定为参照峰(峰4),结果表明,果糖苷酶酶解下的不同炮制规格的黄精样品中色谱峰存在差异,果糖(峰1)峰面积呈逐渐减小的趋势至六蒸六晒(P6)时果糖无法检出,故除峰1 外样品共有峰为16 个峰。样品共有指纹峰相对保留时间及相对峰面积分析结果表明,不同样品16 个共有峰相对保留时间的RSD 值均小于3%,说明不同炮制规格的样品存在共有峰且各共有峰的保留时间稳定,同时证明了采用酶解法成功得到了聚合度较高的特异性寡糖片段。
除蔗糖(峰4)其余共有峰相对峰面积的RSD值相差较大,说明不同蒸晒次数的黄精炮制品,随着蒸晒次数的增加结构特征发生改变。综上所述,黄精不同炮制程度样品之间存在着明显的差异,黄精生品基线平稳,黄精炮制品基线随着蒸晒次数的增加出现波动。从样品HPLC 指纹图谱(图4)中可以看出,黄精不同炮制程度样品在0~7 min 峰形和峰位有明显的区别,根据对照品比对可知是果糖随着炮制次数的增加在发生改变。
2.10 黄精炮制品多糖的UHPLC-QTOF/MS 定性鉴定
取黄精供试品溶液,按“2.5.3”项下色谱条件对黄精炮制品中的低聚糖成分进行定性分析,得到负离子模式下黄精质谱总离子流图,见图5。结果表明,黄精炮制品多糖化学成分在负离子模式下具有较好的响应,因此,本实验采用负离子模式进行质谱分析。在负离子模式下,准分子离子峰一般为[M-H]-,根据tR、准分子离子质荷比、一级及二级MS 裂解信息,结合相关文献数据[18-22],共鉴定了7个低聚糖类成分,分别是蔗糖、蔗果三糖、蔗果四糖、蔗果五糖、蔗果六糖、蔗果七糖和蔗果八糖,见表2 和图6。
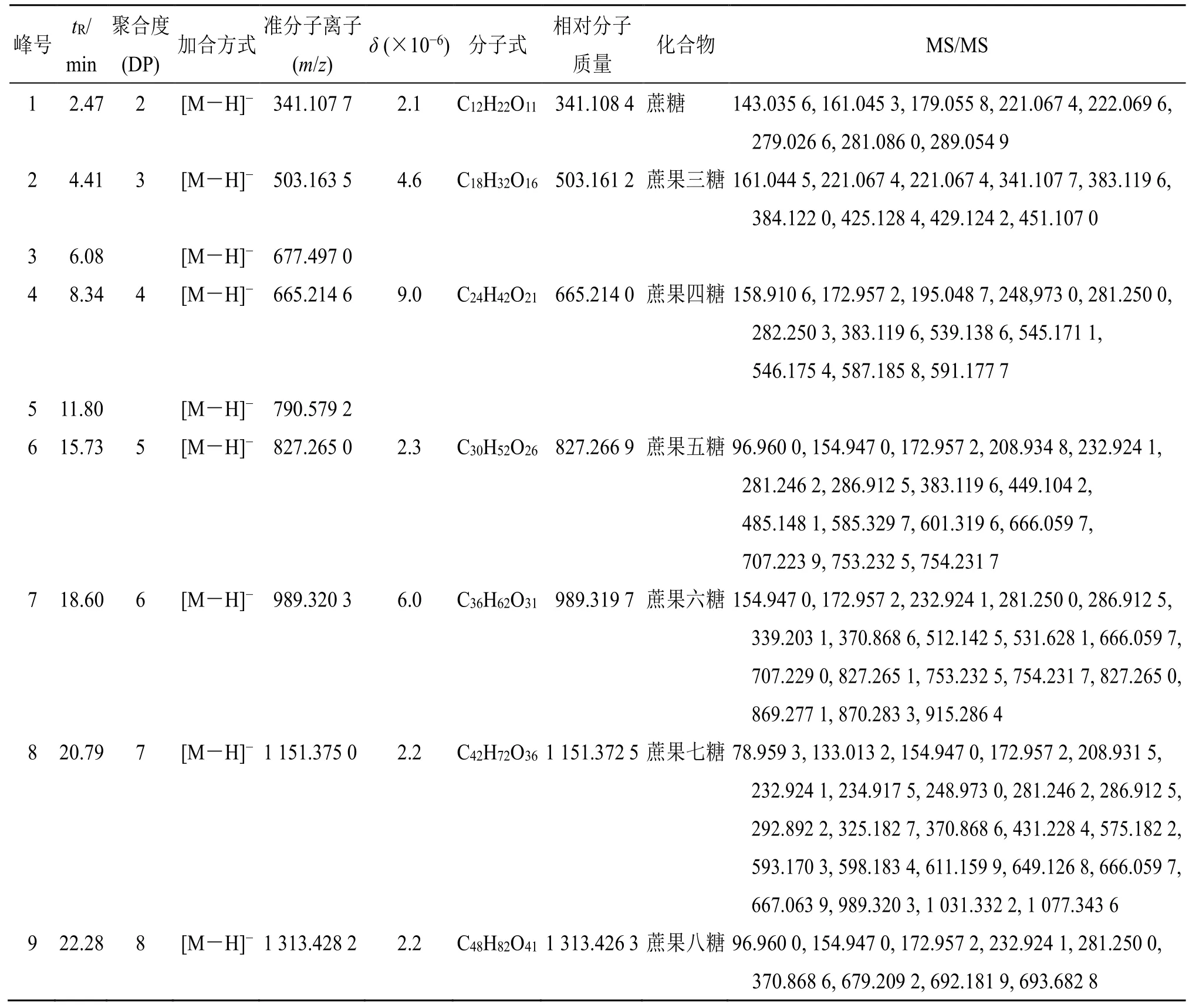
表2 黄精低聚糖成分的UHPLC-Q-TOF/MS 鉴定Table 2 UHPLC-Q-TOF/MS identification of Polygonati Rhizoma oligosaccharides
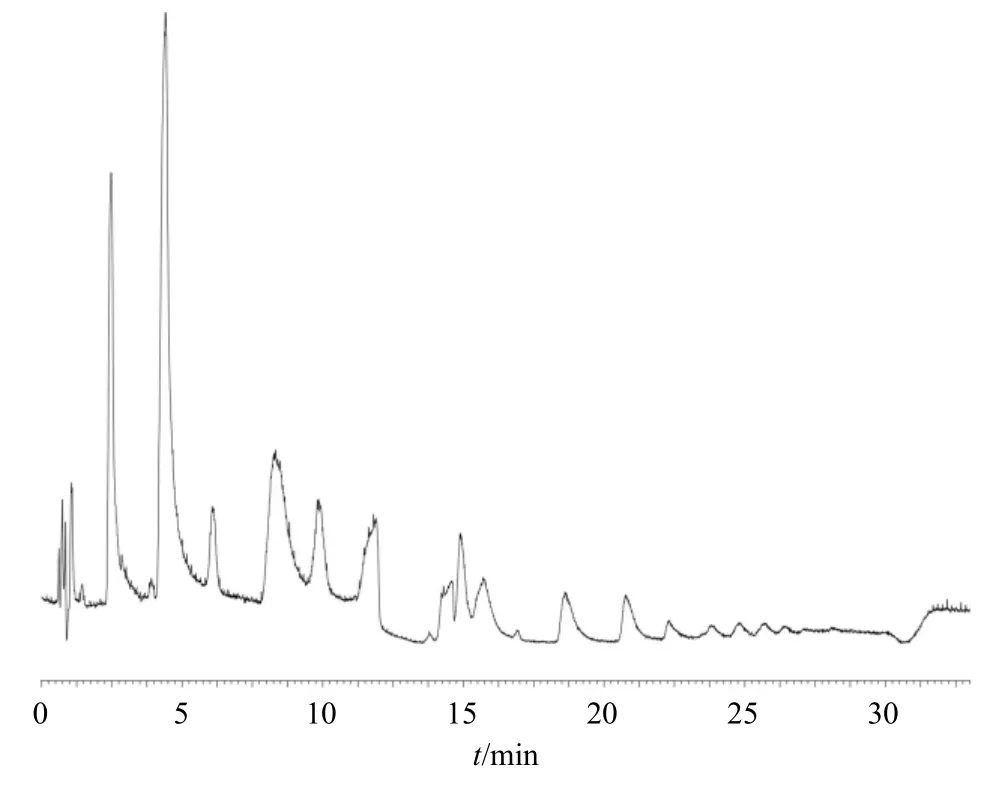
图5 黄精多糖酶水解产物在负离子模式下的总离子流图Fig. 5 Total ion flow diagram of Polygonati Rhizoma polysaccharide enzymatic hydrolysate in negative ion mode
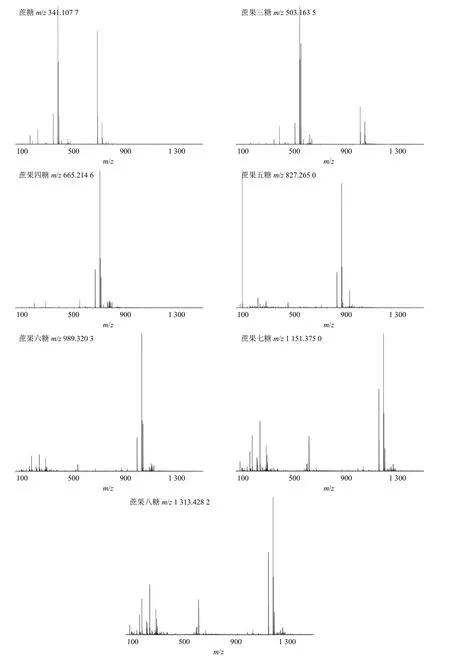
图6 黄精多糖酶水解产物中寡糖的二级质谱图Fig. 6 MS/MS spectrum of oligosaccharides in Polygonati Rhizoma polysaccharide enzymatic hydrolysate
2.11 PLS-DA
使用专业软件ChemPattern 软件(1.0 版)将上述HPTLC 指纹图谱的数据继续采用多元统计分析模块中的PLS-DA 进行分析,该模型中,RY2和Q2的值大于0.5,且RY2和Q2的值越趋近于1,说明该PLS-DA 模型的预测能力越好。分析结果如图7 所示,把黄精生品(P0)~五蒸五晒(P5)分为1 一组,六蒸六晒(P6)~十一蒸十一晒(P11)分为第2 组,十二蒸十二晒(P12)、十三蒸十三晒(P13)分为第3 组。

图7 黄精炮制品偏最小二乘判别分析图Fig. 7 PLS-DA chart of processed Polygonati Rhizoma
采用黄精炮制品多糖的HILIC-HPLC-ELSD 分析结合VIP 法,筛选出了具有统计学意义的7 个差异标志物(VIP>1)见图8,其影响程度依次为峰17>峰15>峰1>峰7>峰10>峰3>峰5。结合不同炮制程度样品共有指纹峰相对峰面积结果可知,7 个差异标志成分峰17、15、1、7、10、3、5 所占比例均小于生品,说明在炮制过程中黄精多糖发生了水解反应,导致随着蒸晒次数的增加黄精多糖中的结构特征发生了变化。另外,从六蒸六晒(P6)~十三蒸十三晒(P13)除峰1(果糖)无法检出外,峰17、15、7、10、3、5 这7 个色谱峰代表的成分呈先降低后增高的趋势,具体体现为在六蒸六晒(P6)~十一蒸十一晒(P11)时逐渐降低,而十二蒸十二晒(P12)之后有所回升,这一发现与薄层指纹图谱所得到的结果相吻合,提示经过六蒸六晒(P6)与十二蒸十二晒(P12)后黄精化学成分发生变化。

图8 果糖苷酶水解下黄精炮制品PLS-DA 分析结果VIP 图Fig. 8 VIP chart of PLS-DA analysis of processed Polygonati Rhizoma under fructosidase hydrolysis
3 讨论
目前,《中国药典》2020 年版[2]中黄精项下规定以黄精多糖的含量作为黄精质量评价指标。但是研究表明黄精在炮制过程中,发生了美拉德反应,产生了一定量的酸,在高温条件下,黄精中多糖发生水解反应,导致了炮制品中多糖的含量降低,单糖的含量增加。本课题组曾在前期研究[23]中发现随着蒸晒次数的增加,黄精双糖、单糖含量在炮制过程中呈现先增加后递减的趋势。在此基础之上,本实验进一步对于黄精炮制前后多糖的变化展开研究,相较于特异性差的苯酚硫酸法,首次采用果糖苷酶水解黄精炮制品中多糖的方法对于不同蒸晒次数的黄精进行差异性分析,发现不同蒸晒次数的黄精炮制品在结构特征方面存在差异。
采用HPTLC、HILIC-HPLC-ELSD 和UHPLCQTOF/MS 对黄精炮制前后成分进行快速识别,并结合化学模式识别方法对黄精炮制前后成分进行分析,建立了一种灵敏、快速的分析方法。其中HPTLC结果表明,六蒸六晒(P6)与十二蒸十二晒(P12)为黄精炮制过程中的转折点,这一发现提示,黄精不同蒸晒次数的炮制品药效可能随之发生了改变。HILIC-HPLC-ELSD 分析成功得到了17 组特异性寡糖片段,含果糖、蔗糖、葡萄糖等,但在果糖苷酶水解作用下,黄精炮制品中果糖(峰1)差异明显至六蒸六晒(P6)时无法检出,说明黄精多糖在炮制过程中特异性寡糖片段发生了变化,此外共有峰相对保留时间及相对峰面积分析结果表明,黄精样品随着蒸晒次数的增加结构特征发生了改变。后采用UHPLC-QTOF/MS 技术可进一步从黄精炮制品中得到蔗糖、蔗果三糖、蔗果四糖、蔗果五糖、蔗果六糖、蔗果七糖和蔗果八糖。
本研究不同于之前的报道中,多针对九蒸九晒(P9)样品进行差异性比较[24-25],课题组在九蒸九晒(P9)的基础上增添至十三蒸十三晒(P13),对于黄精糖类成分的变化趋势分析更为透彻。结合PLSDA 将不同蒸晒次数黄精炮制品分为了3 类,结果也再次印证了六蒸六晒(P6)和十二蒸十二晒(P12)是黄精炮制过程中的转折,而VIP 值结果表明,峰17、15、1、7、10、3、5 可以作为黄精蒸制的标志物。综上所述,黄精的蒸制过程不仅使黄精多糖的含量减少,还会使其出现降解、聚集、解聚的现象[26],后续可以进一步考察黄精炮制品糖类成分变化与药理药效之间的关系,并增大相对分子质量扫描范围,更为全面的解析黄精多糖中存在的化合物。
此外,本研究所建立的方法不需要糖分析中常用的试剂还原、衍生化或柱后加成,首次采用可以分离特异性寡糖片段的酶解法对不同蒸晒次数的黄精多糖展开研究,得到了更为丰富的糖类成分变化的信息,所建立的指纹图谱与黄精炮制品多糖的化学组成和结构特征相关,未来基于结构特征的多元指纹图谱以及化学计量学分析可成为通过提供更全面的信息来控制多糖质量更为有效的策略,对于黄精多糖产品的质量控制具有较大的实用价值,也为其他中草药多糖的研究提供了新的视角。
利益冲突所有作者均声明不存在利益冲突

