杜仲多糖的提取分离纯化、结构特征及其药理活性研究进展
王 瑞,王景媛,郭 敏,邹俊波,王智超,栾 飞*,翟思程*
1. 陕西科技大学镐京学院,医药工程学院,陕西 咸阳 712046
2. 陕西中医药大学药学院,陕西省中药基础与新药研究重点实验室,陕西 咸阳 712046
杜仲为杜仲科植物杜仲EucommiaulmoidesOliv.的干燥树皮和叶,是我国传统药材,具有2 000多年的药用历史,主产于陕西、甘肃和河南等地。《神农本草经》中将其列为上品,性温,味甘,归肝、肾经,具有补肝肾、强筋骨、安胎等功效,临床用于肝肾不足、腰膝酸痛、筋骨无力、头晕目眩、妊娠漏血和胎动不安的治疗[1-2]。杜仲是雌雄异株,其地上部分,包括树皮、叶子和雄蕊花,均被用于医疗[3]。现代药理研究表明,杜仲粗提取物及其活性单体在体内、外实验中具有广泛的药理活性,可用于预防和治疗抑郁症[4]、糖尿病肾病[5]、肌肉老化[6]、急性肝炎[7]、炎性疾病[8-10]、急性肺损伤[11-12]、高脂血症[13]、高血压[14]、骨质疏松症[15]、骨关节炎[16]、阿尔茨海默病[17]、肥胖[18]和免疫功能低下[19]等多种疾病。其主要包括环烯醚萜类、多糖类、木脂素类、黄酮类、酚酸类、萜类和甾体类等多种化学成分[20]。近年来,杜仲多糖被认为是杜仲中最主要的生物活性成分之一,具有调节免疫、抗骨质疏松、降血糖、调血脂、抗炎镇痛、抗氧化、抗疲劳、抗衰老、抗肝纤维化和心血管保护活性等药理活性。因此,本文聚焦近年来国内外对杜仲多糖的研究进行归纳与总结,综述了杜仲多糖的提取分离纯化方法、结构特征、药理活性及其潜在机制,为杜仲多糖的深入研究与相关产品开发提供理论依据。
1 杜仲多糖的提取方法
多糖的提取方法多种多样,可根据多糖性质选择不同的提取方法。目前,常用提取杜仲多糖的方法有溶液提取法、超声波辅助提取法、微波辅助提取法等。提取过程的料液比、温度、时间、萃取介质、超声功率、微波功率等条件均会影响多糖得率,故通常采用单因素和响应面法进一步对提取工艺进行优化提高多糖得率。
1.1 热水提取法
Hong 等[21]通过响应面法优化杜仲多糖的提取参数,得到的最佳提取条件为提取时间80 min、料液比1∶3(g∶mL)和提取3 次,此时多糖得率最高。闫芝茜等[22]通过单因素试验结合响应面实验考察液料比、提取时间、提取次数及乙醇体积分数对杜仲多糖得率的影响,得到杜仲多糖提取的最佳提取工艺为料液比1∶20(g∶mL)、提取3 h、提取3次、乙醇体积分数60%,杜仲多糖得率为4.79%。朱琳等[23]在单因素试验的基础上,将料液比、提取时间、乙醇浓度结合响应面法,进一步优化提取条件,得出最佳的提取参数为料液比1∶60(g∶mL)、提取时间40 min、乙醇浓度60%,杜仲多糖得率为44.53%,为最高提取率。戚晓渊等[24]采用均匀设计法和多元回归分析法优化杜仲多糖的最佳提取工艺条件,得到优化后的提取参数为料液比 1∶5(g∶mL)、提取温度100 ℃、提取时间7 h、此时杜仲多糖的最大得率为8.231%。曾桥等[25]采用单因素结合响应面法优化杜仲叶茯砖茶多糖提取工艺,得到其最佳提取工艺条件为料液比1∶25(g∶mL)、提取时间1.5 h、提取温度51 ℃,在该最佳条件下,杜仲叶茯砖茶多糖的得率为8.48%。
1.2 超声波辅助提取法
杨申明等[26]采用单因素和正交试验对杜仲板皮多糖提取参数进行了优化,得到较佳的提取工艺参数为料液比1∶30(g∶mL),超声温度50 ℃,超声功率400 W,超声时间30 min,杜仲板皮多糖的平均提取率为2.16%。夏树林等[27]采用正交试验优化超声波提取杜仲多糖的最佳条件,结果发现在超声功率为250 W,提取温度为80 ℃,提取时间40 min,料液比1∶35(g∶mL),提取次数2 次,杜仲多糖得率为4.892%。为了提高杜仲叶多糖的提取效率,陈雪花等[28]采用超声波-协同酶法提取杜仲叶多糖并对其工艺条件进行优化,通过Plackett-Burman 实验筛选发现pH 值、超声波功率和复合酶添加量是影响多糖得率的主要因素。通过Box-Behnken 实验结果显示,超声波-协同酶法提取杜仲叶多糖的最佳工艺条件为复合酶添加量3.7%、pH 4.0、超声波功率100 W、提取时间15 min、提取温度45 ℃和料液比1∶20(g∶mL),其多糖得率为4.79%,与理论得率4.87%接近。
1.3 微波辅助提取法
冀经伦等[29]报道采用单因素和正交试验法优化微波辅助提取法提取杜仲籽壳中酸性多糖的工艺条件,得到最佳的提取条件为微波功率640 W、微波时间90 s,NaOH 体积分数3%和浸泡时间90 min,其酸性多糖提取率达到6.35%。该提取工艺极大缩短了提取时间,操作更加便捷,提高了杜仲籽壳的利用效率。Xu 等[30]采用微波诱导技术结合响应面法对杜仲叶多糖的提取工艺进行优化。结果发现,在74 ℃条件下,料液比1∶29(g∶mL),微波提取15 min,杜仲叶多糖得率最高,可达到12.31%,与预测值接近,比传统热回流提取法的多糖得率提高2.9 倍。陈艳萍等[31]通过研究超声波结合微波辅助提取杜仲叶多糖的最优工艺条件。Plackett-Burman 试验结果表明,料液比、提取时间和提取温度为关键影响因素。Box-Behnken 试验结果得到杜仲叶多糖最佳提取工艺为料液比1∶30(g∶mL)、超声功率为130 W、提取温度为49 ℃、微波功率为200 W 和提取时间为20 min,杜仲叶多糖的实际得率为4.02%,与理论得率4.08%接近。
1.4 其他方法
除上述几种方法,也有研究者采用其他方法提取杜仲多糖。齐善厚等[32]采用闪式提取法提取杜仲叶中的多糖并对其提取工艺参数进行研究,发现提取次数、时间、电压和料液比均对提取率有不同程度的影响,经优化后得到最佳提取工艺参数,即料液比1∶30(g∶mL)、提取电压160 V、提取时间60 s 和提取次数2 次,其多糖得率可达3.36%。
对现有几种提取方法的比较可以得出,不同的提取方法导致杜仲多糖的得率有所差异。与热水提取法相比,采用超声波辅助提取法、微波辅助提取法和闪式提取法提取杜仲多糖的得率甚至低于热水提取法。此外,目前报道的几种提取方法对杜仲多糖的得率仍然相对较低,为适应杜仲多糖的工业化生产,需要进一步开发更高效的提取技术,加速杜仲多糖在功能性食品和医药领域的应用。如采用多种方法协同提取杜仲多糖值得研究者进一步深入研究。综上,鉴于热水提取法工艺简便、易于操作、成本较低、提取率较高,在后续杜仲多糖的大生产上可考虑使用。
2 杜仲多糖的分离与纯化方法
采用上述方法提取得到的杜仲粗多糖通常含有大量的色素、蛋白质和无机盐等杂质,影响后续结构表征及活性研究,因此需要进一步脱脂、去除色素、脱蛋白及分离多个多糖组分。目前,杜仲多糖脱蛋白方法主要有Sevage 法、三氯乙酸法和盐酸法,多糖脱色素方法主要有过氧化氢法和活性炭法。黄伟等[33]通过实验测得盐酸法、三氯乙酸法和Sevage 法脱蛋白率分别为 95.76%、93.23%和91.48%,而多糖保留率则分别为30.44%、40.29%和65.49%。从以上结果可知,盐酸法脱蛋白率最高,但盐酸可能导致多糖降解,使多糖保留率降低。而三氯乙酸法和Sevage 法脱蛋白率比较接近,但三氯乙酸法多糖保留率相比Sevage 法低很多,因此Sevage 法为杜仲叶多糖最佳脱蛋白方法。其次,采用过氧化氢方法对杜仲叶多糖脱色的效果显著优于活性炭方法。闫芝茜等[22]采用Sevage 法(正丁醇-三氯甲烷4∶1)进行脱蛋白,再利用Sephadex G-200 凝胶柱进行洗脱,经纯化后得到杜仲叶多糖的总糖质量分数为89.12%、蛋白质质量分数为2.03%、糖醛酸质量分数为9.45%。杨申明等[26]利用正交试验优化活性炭对杜仲板皮多糖脱色,得到最佳的脱色条件为活性炭用量为0.6%、脱色温度为60 ℃、脱色时间为50 min 和脱色溶液pH 5.0,平均脱色率为76.20%和多糖平均保留率为62.68%。大孔树脂纯化法是同时将蛋白和色素去除的方法,能较大程度上减少多糖损失。张涛涛[34]以该方法纯化杜仲多糖,通过单因素与正交试验得到最佳纯化条件即采用质量浓度为0.6 mg/mL 和pH 值为6 的杜仲多糖提取液,再以1.0 mL/min 上样至AB-8 型大孔树脂吸附后,用65%乙醇溶液150 mL,以体积流量1.0 mL/min 洗脱,产物多糖质量分数由10.2%提高至35.8%,为纯化前的3.5 倍,同时可显著增强动物的抗运动性疲劳能力。然而,单靠一种方法纯化多糖并不能达到后续结构表征和活性研究的要求,要想得到相对分子质量和极性均一的杜仲多糖对于其后续研究至关重要,需进一步经过离子交换柱色谱法和葡聚糖凝胶色谱法纯化出多种杜仲多糖组分,最终得到纯杜仲多糖。
3 杜仲多糖的结构特征
对多糖的结构特征解析极其重要,因为多糖结构的多样性直接决定其生物活性[35]。多糖的结构特征解析包括单糖组成、相对分子质量、糖苷键类型、连接方式及高阶结构构象等[36]。杜仲多糖的单糖组成呈多样化,主要以葡萄糖(glucose,Glc)、果糖(fructose,Fru)、甘露糖(mannose,Man)、岩藻糖(fucose,Fuc)、半乳糖(galactose,Gal)和阿拉伯糖(arabinose,Ara)为主,此外还含有少量的木糖、鼠李糖(rhamnose,Rha)、核糖(ribose,Rib)和半乳糖醛酸(galacturonic acid,GalA)等。Cui 等[37]从杜仲叶中分离得到一个具有免疫增强活性的多糖(E.ulmoidesleaf polysaccharide,ELP),采用高效液相色谱法(high performance liquid chromatography,HPLC)分析其组成,结果显示ELP 主要由阿拉伯糖、半乳糖醛酸、半乳糖和鼠李糖组成,并含有少量的葡萄糖。Song 等[38]从杜仲皮中分离得到一个酸性多糖(EuOCP3),采用1-苯基-3-甲基-5-吡唑啉酮柱前衍生化法和凝胶渗透色谱法(gel permeation chromatography,GPC)解析其单糖组成和相对分子质量,发现EuOCP3 主要由阿拉伯糖、半乳糖醛酸、鼠李糖、半乳糖、葡萄糖、葡萄糖醛酸、甘露糖和岩藻糖8 种单糖组成,其相对分子量为3.81×104。进一步采用傅里叶变换红外光谱(fourier transforminfrared spectroscopy,FT-IR)和核磁共振(nuclear magnetic resonance,NMR)技术对EuOCP3 的基本结构进行测定。结果显示EuOCP3 主链由→4)-α-GalpA-(1→4)-α-GalpA-(1→,→4)-α-GalpA-(1→5)-α-Araf-(1→,→4)-α-GalpA-(1→2)-α-Rhap-(1→,→4)-α-GalpA-(1→5)-α-Araf-(1→2)-α-Rhap-(1→重复片段组成。在→2,3,5)-α-Araf-(1→)的C-2 和C-5 位置取代的侧链上,有T-β-Araf→和T-β-Araf→4)-GalpA-(1→ 的残基。黄伟等[33]从杜仲叶中纯化得到一个酸性杂多糖EOP-1,高效凝胶渗透色谱法(high performance gel permeation chromatography ,HPGPC)结果显示其相对分子质量为6.0×105。进一步采用部分酸水解和甲基化分析结合气相色谱-质谱(gas chromatography-mass spectrometry,GCMS)技术,对EOP-1 的糖链结构进行表征。结果显示EOP-1 糖残基主要由D-GalpA、D-Glcp、D-Galp、L-Araf和L-Rhap组成,主链由1,4-D-GalpA 连接,为半乳糖醛酸聚糖,侧链主要由1,4-D-Galp、1,6-DGalp、1,5-L-Araf、1,2-L-Rhap构成,其质量分数比为45.11∶35.90∶0.90∶10.50∶6.90。闫芝茜等[22]采用扫描电子显微镜和圆二色谱仪对杜仲叶多糖的形态和结构进行初步分析,并采用热重分析仪和差示扫描量热仪对杜仲叶多糖热稳定性进行研究。结果发现杜仲叶多糖结构为致密、光滑、卷曲的网状结构,表明该多糖是不含有3 股螺旋结构、纯度较高的酸性多糖。在200 ℃以下的环境中具有良好的热稳定性。综上,当前从杜仲药材分离纯化出的多糖种类较少,且对其精确结构表征还不完善,有待进一步研究。杜仲多糖的提取、分离纯化和结构特征见表1。

表1 杜仲多糖的结构特征信息Table 1 Structural characteristics of E. ulmoides polysaccharides
4 杜仲多糖的药理活性及其相关机制研究
4.1 免疫调节活性
叶颖霞等[44]发现杜仲叶多糖(polysaccharides fromE.ulmoidesleaves,PsEUL)可增强小鼠腹腔巨噬细胞的清楚能力、吞噬速度及血清中溶血素含量,升高胸腺和脾脏系数,进而对环磷酰胺诱导的免疫抑制小鼠具有保护作用。Feng 等[41]发现杜仲皮多糖(polysaccharides fromE.ulmoidesbarks,PsEUB)处理后能增加树突状细胞(dendritic cells,DCs)MHC I/II、CD80、CD40 和CD86 的表达,显著增强淋巴细胞增殖和细胞因子白细胞介素-4(interleukin-4,IL-4)和γ 干扰素的产生,提示PsEUB 能够诱导DCs 成熟。结果表明,PsEUB 可以显著增强口蹄疫病毒(foot-and-mouth disease virus,FMDV)特异性免疫球蛋白G(immunoglobulin G,IgG)、IgG1、IgG2a和IgG2b抗体滴度和T 细胞增殖,暗示PsEUB可能是一种强大的免疫刺激剂。为了提高PsEUL 诱导抗原卵清蛋白(ovalbumin,OVA)免疫应答的佐剂活性,Feng 等[45]采用N-(3-二甲氨基丙基)-N′-乙基碳二亚胺盐酸法将PsEUL 与OVA 偶联,制备一种新型递送系统(PsEUL-OVA)并探讨其免疫调节作用。体外结果发现,PsEUL-OVA 200 μg/mL 能增加巨噬细胞增殖并提高其吞噬效率。体内研究发现,PsEUL-OVA 能显著提高OVA 特异性抗体(IgG、IgG1、IgG2a 和IgG2b)的滴度和细胞因子(IL-2、IL-4、IL-6)的水平。此外,PsEUL-OVA 能激活T淋巴细胞并促进DCs 成熟。由于PsEUL-OVA 的释放率和抗原呈递效率相对较低,Feng 等[46]进一步采用植烷三醇和F127 将PsEUL-OVA 进行封装,得到另1 种新型递送系统PsEUL-OVA 立方体(PsEULOVA cubosomes,PsEUL-OVA/Cubs),探讨其免疫调节活性。结果发现,PsEUL-OVA/Cubs 被巨噬细胞快速吞噬,上调巨噬细胞增殖,刺激细胞因子的产生。体内结果发现PsEUL-OVA/Cubs 能显著增加IgG 等的滴度和细胞因子水平。PsEUL-OVA/Cubs 能促进脾脏CD8+和CD4+T 细胞分化和DCs 成熟,提示PsEUL-OVA/Cubs 通过增强DCs 和巨噬细胞的吞噬活性进而和提高抗原呈递效率来刺激细胞和体液免疫反应,效应显著优于PsEUL-OVA。提示PsEUL 能促进巨噬细胞和DCs 的吞噬活性来诱导体液和细胞免疫反应,具有改善免疫反应的潜力,并为新型递送系统的设计提供了理论基础。Cui 等[37]研究发现PsEUL 能显著增加环磷酰胺诱导的免疫抑制小鼠的脾脏指数和胸腺指数,升高白细胞和淋巴细胞的密度,增强巨噬细胞的吞噬能力和升高IL-2、IL-4、γ 干扰素和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,显示出明显的免疫增强活性,其机制可能与激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路有关。陈蕾[47]分别采用水热法和微波辅助法提取杜仲叶和皮中的多糖,命名为EUSP1、EUSP2、EUOP1 和EUOP2,并探讨其免疫活性。结果发现,微波辅助提取法较水热提取法能明显提高多糖产量,且叶中多糖EUOP1 和EUOP2 产量显著高于皮中获得的EUSP1 和EUSP2。4 种多糖均可提高健康男性血清中IL-2、IL-4、IgG 和IgM 含量,提高机体免疫应答能力,从而提高运动人体免疫机能。
此外,DEC-205 受体介导的树突状细胞(dendritic cells,DCs)靶向纳米脂质体是一种很有前景的递送系统,可激发针对病原体的免疫反应。当该递送系统同时携带抗原和免疫调节剂时,可有效调节DCs 功能及T 细胞的初始反应。Feng 等[48]将OVA 和杜仲多糖包封在长环纳米脂质体中,并与抗DEC-205 受体抗体偶联,获得了针对DEC-205的纳米脂质体(anti-DEC-205-EUPs-OVA-LPSM),并研究其免疫调节作用,评价其靶向效率。体外结果表明,anti-DEC-205-EUPs-OVA-LPSM 160 μg/mL能促进DCs 增殖,提高其吞噬效率。体内结果显示,anti-DEC-205-EUPs-OVA-LPSM 显著提高了OVA特异性IgG 和IgG 同型水平,增强脾细胞增殖,诱导自然杀伤细胞(natural killer cell,NK)和细胞毒性淋巴细胞(cytotoxic lymphocytes,CTLs)的细胞毒性。anti-DEC-205-EUPs-OVA-LPSM 还能促进DCs 的成熟,提示DEC-205 受体抗体结合的杜仲多糖纳米脂质体可以作为一种有效的抗原递送系统,通过促进DCs 成熟来增强细胞和体液免疫反应,具有作为免疫增强剂和抗原递送系统的巨大潜力。而且,Feng 等[49]将杜仲多糖包封至PLGA 纳米颗粒(PLGA nanoparticles,NPs)中,与抗CD205 单克隆抗体偶联,制备出靶向DEC-205 受体的PLGA 纳米颗粒(anti-DEC-205-EUPs-PLGA NPs),研究其对手足口病毒的影响。结果发现,anti-DEC-205-EUPs-PLGA NPs 200 μg/mL 可显著促进DCs 增殖和成熟,提高抗原摄取活性。在FMDV 诱导的免疫小鼠模型中,anti-DEC-205-EUPs-PLGA NPs 100 μg 能显著控制药物和抗原释放、诱导持续免疫反应、改善辅助性T 细胞1(helper T cell 1,Th1)和Th2 型细胞因子的分泌、增加T 细胞亚上调FMDV 特异性IgG 抗体水平、促进CTLs 和NK 细胞的细胞毒活性,促进脾细胞增殖。提示anti-DEC-205-EUPs-PLGA NPs通过促进DCs 的成熟来诱导体液和细胞免疫活性,为疫苗佐剂研发提供新的思路。杜仲多糖发挥免疫调节活性的潜在机制见图1。
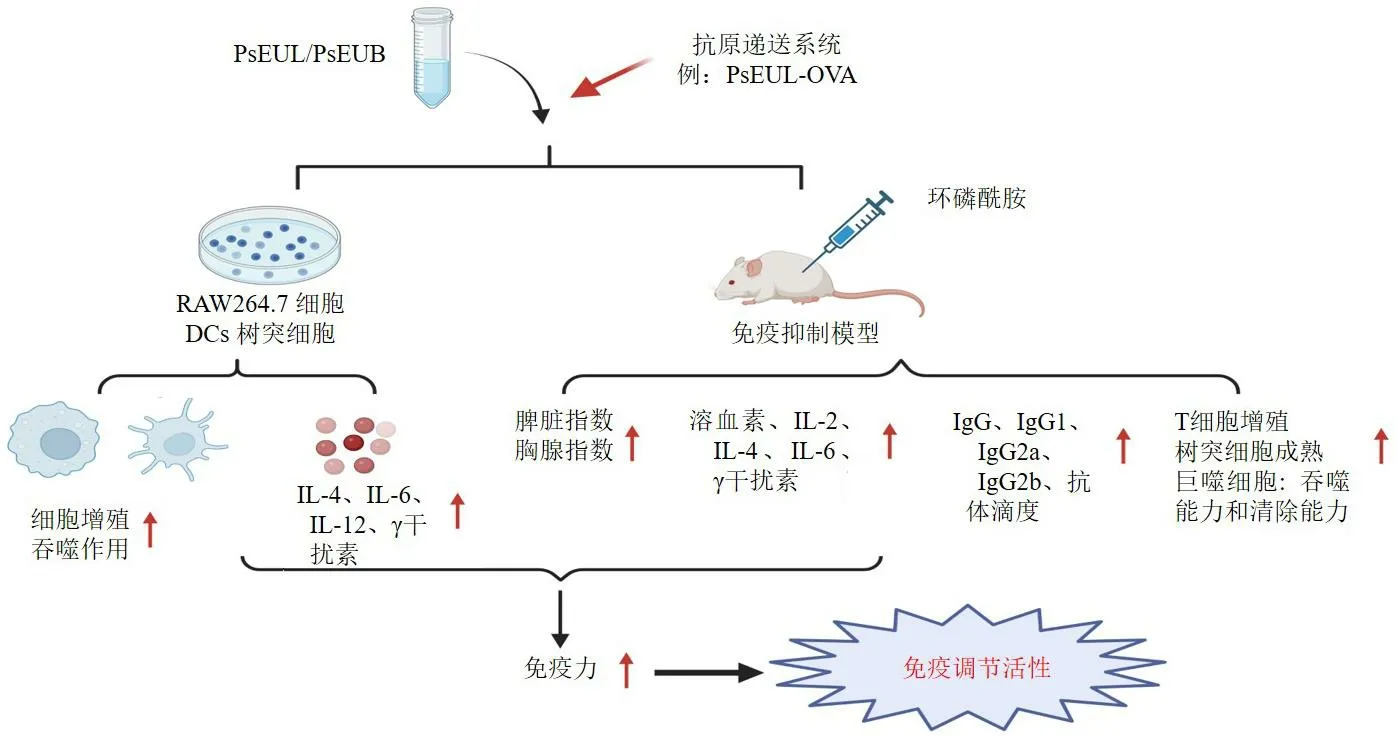
图1 杜仲多糖免疫调节活性的潜在机制示意图Fig. 1 Schematic representation of underlying mechanism of immunoregulatory activity of E. ulmoides polysaccharides
4.2 骨保护活性
骨免疫环境在骨再生过程中发挥着不可或缺的作用,直接决定后续的骨生成和骨整合。为开发一种具有骨再生潜力的新型骨免疫调节生物材料,Deng 等[40]合成了锶化杜仲多糖(srontiumE.ulmoidespolysaccharides,EUPs-Sr)并探讨其骨免疫调节活性。结果发现EUPs-Sr 可以抑制炎症因子和破骨细胞因子的生成,增强RAW264.7 细胞成骨因子的表达,提示EUPs-Sr 有望成为一种有前途的免疫调节骨修复候选物,具有为骨骼组织工程创造积极的促再生环境的能力。 聚醚醚酮(polyetheretherketone,PEEK)是一种有前景的骨植入聚合物材料,具有与天然皮质骨组织匹配的机械性能。为改善PEEK 生物活性,Zhang 等[50]通过聚多巴胺涂层将EUPs-Sr 引入PEEK 表面,形成具有生物活性的 DPEEK@EUPs-Sr,发现 DPEEK@EUPs-Sr 能有效促进鼠胚胎成骨细胞前体MC3T3-E1 细胞增殖并增强细胞黏附,下调炎症相关基因IL-1β、IL-18和基质金属蛋白酶 9(matrix metalloproteinase 9,MMP9)的表达及上调成骨基因如Runt 相关转录因子2(Runt-related transcription factor 2,RUNX2)和I 型胶原蛋白-α1(collagen type I-α1,Col1-α1)的表达,显示出抗炎和骨形成等双重活性,具有开发成为骨修复材料的潜力。最新研究发现EUPs-Sr 改性钛种植体(Ti-EUP-Sr)能促进人牙槽骨成骨HABOBs 细胞增殖并上调成骨相关基因如RUNX2、碱性磷酸酶、骨桥蛋白、骨钙素的表达水平,改善成骨性能,具有显著的骨免疫调节活性,为未来的多糖修饰金属/无机表面的研究提供有益的基础[51]。
Sun 等[52]发现杜仲多糖在体内、外实验均显示良好的骨关节炎保护活性。杜仲多糖能促进巨噬细胞增殖,抑制炎症相关基因IL-6、IL-18和IL-1β的表达,促进成骨和软骨相关基因骨形态发生蛋白-6(bone morphogenetics protein-6,BMP-6)、精氨酸酶-1(arginase-1,Arg-1)和转化生长因子-β(transforming growth factor-β,TGF-β)的表达。杜仲多糖能显著减轻兔关节软骨的破坏程度、增加软骨下松质骨密度及小梁骨的数量和厚度、降低国际骨关节炎研究学会评分和小梁骨的分离度。此外,杜仲多糖可减少M1极化的巨噬细胞,增加M2极化的巨噬细胞。以上结果提示杜仲多糖能促进关节软骨修复和软骨下骨重建,进而延缓骨关节炎进展,其机制可能与调节巨噬细胞的极化状态有密切关系[52]。Song 等[38]发现在地塞米松诱导的骨质疏松症小鼠模型中,EuOCP3 可显著增加小鼠质骨厚度和矿化骨面积及成骨细胞的数量,并减少皮质骨表面破骨细胞的数目,改善肠道菌群结构,其机制与调控细胞外信号调节激酶(extracellular signalregulated kinase,ERK)/c-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)/核因子E2 相关因子2(nuclear factor E2 related factor 2,Nrf2)信号通路,进而增强成骨功能和恢复骨代谢有关。李宁博等[53]研究表明,杜仲多糖预处理可显著增加IL-1β 诱导的小鼠软骨ATDC5 细胞增殖,抑制其凋亡、炎症反应和基质降解,进而减轻ATDC5 细胞损伤,其机制可能与抑制核因子-κB(nuclear factor-κB,NFκB)通路的激活有关,具有开发为治疗骨关节炎药物的潜在价值。综上,杜仲多糖发挥骨保护活性的潜在机制见图2。

图2 杜仲多糖骨保护活性的潜在机制示意图Fig. 2 Schematic representation of underlying mechanism of bone protective activity of E. ulmoides polysaccharides
4.3 降血糖和调血脂活性
郎茜等[54]研究表明,PsEUL 能降低链脲佐菌素(streptozotocin,STZ)致糖尿病大鼠模型的空腹血糖(fasting blood glucose,FBG)和尿素氮,增加谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide dismutase,SOD)的活性,减少丙二醛含量,并下调半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、p38 MAPK 和TGF-β1 等蛋白表达,具有一定的降血糖和抗氧化作用。许碧琪等[55]研究发现,杜仲多糖可显著降低STZ 联合高脂饮食诱导的糖尿病小鼠的FBG,其机制可能与增强机体抗氧化因子活性,减少氧化应激对胰腺的损伤,进而减轻胰腺组织损伤。陈小娟等[56]研究报道,杜仲多糖对自发性2 型糖尿病db/db 小鼠表现的肥胖、高血糖、高血脂和肝损伤均具有较好的改善作用,其机制可能与调控炎症反应及氧化应激水平密相关。
苏卓等[57]发现给予STZ 致糖尿病小鼠模型杜仲多糖后,小鼠体内FBG、总胆固醇、三酰甘油和低密度脂蛋白胆固醇(low-density lipoprotein cholesterin,LDL-C)水平明显降低,高密度脂蛋白胆固醇(high-density lipoprotein cholesterin,HDL-C)水平、空腹胰岛素和胰岛素敏感指数明显升高,血清IL-6、IL-8 和TNF-α 含量明显减少,且胰腺组织中Toll 样受体4(Toll-like receptor 4,TLR4)和NFκB 蛋白表达显著下调,表明杜仲多糖具有降血糖和调血脂作用,其机制可能与抑制TLR4/NF-κB 炎症通路介导的胰岛细胞功能,改善胰岛素水平有关。Tang 等[58]研究发现杜仲多糖可呈剂量相关性增加棕榈酸诱导的人肝癌HepG2 细胞的糖摄取,促进肝糖原的合成,上调葡萄糖转运蛋白2(glucose transporters 2,GLUT2)和GLUT4 的表达,进而改善胰岛素抵抗,其机制可能与上调胰岛素受体底物-1/磷脂酰肌醇-3-激酶/蛋白激酶B/糖原合成酶激酶-3β 信号通路有关。雷燕妮等[59]研究表明,ig PsEUL 可显著减少高脂血症小鼠模型血清中总胆固醇、三酰甘油、LDL-C、脂蛋白a、载脂蛋白B 和粪便总胆汁酸的含量,增加HDL-C 和载脂蛋白A的含量,降低动脉硬化指数和冠心指数,肝脏组织中总胆固醇和三酰甘油含量亦显著减少,提示PsEUL 可有效调节血脂水平和肝脏脂质代谢,较好地促进胆汁酸排泄,显示出良好的调血脂活性。综上,杜仲多糖发挥降血糖和调血脂活性的潜在机制见图3。

图3 杜仲多糖降血糖和调血脂的潜在机制示意图Fig. 3 Schematic representation of underlying mechanism of hypoglycemic and hypolipidemic activities of E. ulmoides polysaccharides
4.4 抗炎和镇痛活性
在脂多糖诱导的败血症小鼠模型中,杜仲多糖1 能有效减轻肺损伤,抑制炎性细胞因子的表达,提高动物存活率,但是具体的机制尚未阐明[41]。多糖纳米颗粒作为药物输送系统可以更好地发挥药效。Ye 等[60]首次采用杜仲多糖对纳米硒颗粒(nanoselenium particle,SeNP)进行改性,得到粒径170 nm 的EUPs-SeNP,并探讨其对3%葡聚糖硫酸钠诱导的小鼠结肠炎的影响。结果表明,EUPs-SeNP 治疗能恢复结肠炎小鼠的体质量减轻、降低疾病活动指数、改善肠道通透性、调节肠道微生物群组成、增加结肠抗氧化能力、修复肠道屏障功能、调节肠上皮细胞凋亡和增殖及炎症细胞因子表达。体外实验结果发现EUPs-SeNP 能明显抑制脂多糖诱导的肠上皮细胞系TRL-4/NF-κB 信号通路的激活。江增宏等[61]研究发现EUPs 具有明显的镇痛作用,杜仲多糖能够显著抑制慢性吗啡耐受小鼠的进展,下调慢性吗啡耐受小鼠脊髓水平炎症因子如IL-1β等mRNA 水平,其机制与抑制脊髓促炎症因子和细胞因子释放有关。此外,杜仲多糖对坐骨神经慢性压迫模型(chronic constriction injury,CCI)大鼠也具有明显的镇痛活性,杜仲多糖单次给药能显著降低CCI 诱导的大鼠机械学痛觉超敏,延长镇痛时间,下调CCI 大鼠脊髓活化的p-JNK 和p-ERK 的蛋白水平,而杜仲多糖连续给药则能抑制CCI 诱导的神经胶质纤维酸蛋白的表达,提示杜仲多糖发挥镇痛活性与抑制星形胶质细胞活化和JNK/ERK/MAPK信号通路有关,但其具体机制仍需要进一步研究探索[62]。综上,杜仲多糖发挥抗炎和镇痛活性的潜在机制见图4。

图4 杜仲多糖抗炎和镇痛的潜在机制示意图Fig. 4 Schematic representation of underlying mechanism of anti-inflammatory and antinociceptive activities of E. ulmoides polysaccharides
4.5 抗氧化活性
大量研究表明杜仲多糖可显著提高SOD、过氧化氢酶(catalase,CAT)、GSH-Px 和谷胱甘肽还原酶(glutathione reductase,GR)活性,降低丙二醛含量,对缺血再灌注损伤诱导的家兔肾脏氧化损伤具有抑制作用[21]。Gao 等[63]研究表明杜仲多糖可显著降低血清丙氨酸氨基转移酶( alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、高迁移率族蛋白B1、IL-1β、TNF-α 和丙二醛水平,提高SOD 活性,减轻肝脏病理性改变,从抗炎和抗氧化角度对肝缺血再灌注损伤大鼠具有保护作用,其机制与减少活性氧水平和抑制TLR4/NF-κB 通路激活有关。雷燕妮等[64]采用水提醇沉法提取杜仲叶多糖并以DEAE-52 色谱柱进行纯化得到EFPs-1 和EFPs-2,进一步评价其抗氧化活性。结果发现EFPs-1 和EFPs-2均能剂量相关性清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)、、和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐 ( 2,2-azinobis-3-ethyl-benzthiazoline-6-sulfonic acid,ABTS)等自由基,且EFPs-2 作用比EFPs-1强。EFPs-1 对上述自由基体系的半数有效浓度(median effective concentration,EC50)分别为3.393、5.259、3.692和2.463 mg/mL,EFPs-2的EC50为2.379、2.893、2.516 和2.066 mg/mL。刘梦培等[65]研究了动态 高 压 微 射 流 ( dynamic high pressure microfluidization,DHPM)对杜仲雄花多糖(E.ulmoidesmale flower polysaccharides,EUMFPs)溶液粒径、结构及抗氧化能力的影响。结果显示,DHPM 处理后的EUMFPs 溶液,其粒径逐渐减小,从0 MPa 的449.5 nm 降低到140 MPa 的370.4 nm,而EUMFPs 结构无明显变化,但其抗氧化能力逐渐增强。直到压力达到140 MPa 时,羟自由基、ABTS和DPPH 等自由基的清除率增幅依次为15.1%、16.2%和40.7%,其中DPPH清除率最高,为EUMFPs作为一种新的抗氧化剂的研发提供理论支撑,也为DHPM 在多糖改性上的应用提供参考依据。综上,杜仲多糖发挥抗氧化的潜在机制见图5。
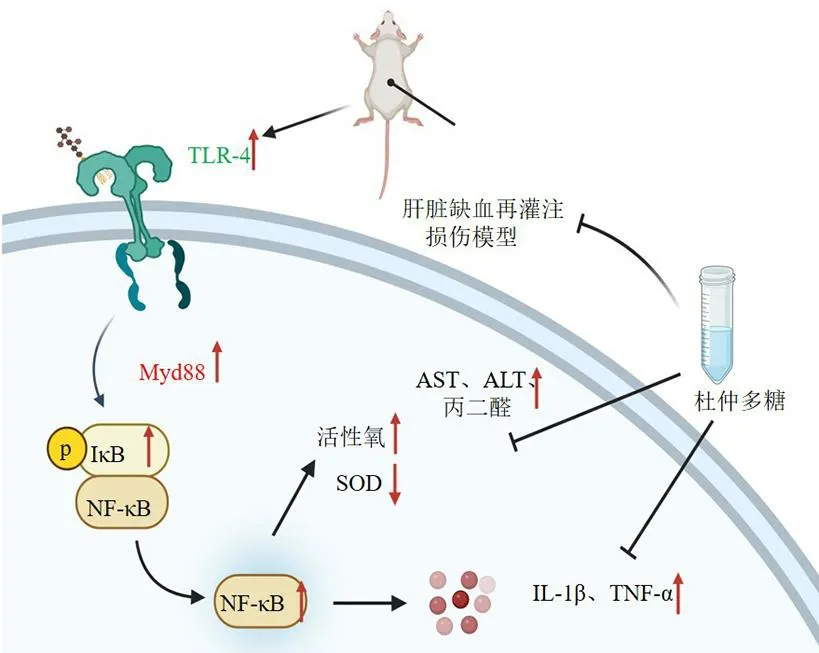
图5 杜仲多糖抗氧化的潜在机制示意图Fig. 5 Schematic representation of underlying mechanism of antioxidant activity of E. ulmoides polysaccharides
4.6 抗疲劳和抗衰老活性
夏树林等[27]研究发现,在电刺激诱导的蟾蜍肌肉疲劳模型中,杜仲多糖能明显延长肌肉收缩持续的时间,并延缓肌肉疲劳的发生,具有明显的抗疲劳作用,其具体机制有待进一步深入研究。王一民等[66]研究指出,在小鼠游泳模型中,杜仲多糖能明显增加小鼠的体质量,延长游泳力竭时间,降低血清中肌酸激酶活性和尿素氮含量,发挥明显的抗疲劳活性,其机制可能与其调节机体糖代谢和抗氧化能力有关。肠道菌群被认为在人体免疫和健康中发挥着关键作用。衰老过程改变了微生物群的组成,这与炎症、活性氧、组织功能下降和与年龄相关疾病的易感性增加有关。Wei 等[39]研究发现在发育过程中给予杜仲多糖能通过上调Kelch 样ECH 相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)/Nrf2 信号通路显著延长果蝇的寿命,减少年龄相关的活性氧积累,并能抑制老年果蝇肠道内葡萄糖杆菌、普罗维顿菌和肠杆菌科细菌的相对丰度。其中,微生物群中葡萄糖杆菌、普罗维登斯菌和肠杆菌科的增加可能会导致果蝇年龄相关的肠道功能障碍,缩短其寿命。此外,杜仲多糖还能有效改善年龄引起的衰退,如运动活性和繁殖力,其延寿作用机制主要是通过重塑肠道菌群失调来实现的。因此,杜仲多糖在保健品领域可开发益生元剂来预防衰老相关的肠道生态失调和反应性氧化应激。
4.7 抗肝纤维化活性
周程艳等[67]研究指出,在CCl4致肝纤维化大鼠模型中,杜仲多糖能明显增加肝纤维化模型大鼠肝脏和脾脏指数,减少血清ALT、AST、透明质酸、层黏连蛋白、III 型前胶原、IV 型胶原和球蛋白含量,升高总蛋白和白蛋白的含量,降低肝组织中丙二醛水平和羟脯氨酸水平,亦能升高肝组织SOD 和GSH-Px 活性,降低肝组织中TGF-β1 蛋白的表达,杜仲多糖显示出良好的抗肝纤维化作用,其机制与抗氧化、抑制胶原增生、调节TGF-β1 水平等有关。王乾宇等[68]进一步证实报道,杜仲多糖能通过抑制肝纤维化(hepatic fibrosis,HF)大鼠肝脏组织的I、III型胶原蛋白、金属蛋白酶组织抑制因子-1及TGFβ1mRNA 表达,上调MMP1mRNA 表达,减少细胞外基质沉积,进而对CCl4联合高脂饮食诱导的大鼠肝脏纤维化具有保护作用。
4.8 心血管保护活性
杜仲多糖还显示出良好的心血管保护活性。研究表明,杜仲多糖能通过减少心肌酶谱肌酸激酶、肌酸激酶同功酶、乳酸脱氢酶和AST 的水平,提高SOD 活性并降低丙二醛含量,增强自由基清除能力、减少脂质过氧化物形成,从抗氧化角度对兔心肌缺血再灌注损伤具有较好的保护作用[69]。邓华[70]研究发现,杜仲多糖能显著抑制氧化型低密度脂蛋白诱导的血管平滑肌VSMC 细胞的增殖和迁移,减少TNF-α 和IL-6 的分泌,同时能显著下调细胞周期蛋白D1 和细胞周期蛋白依赖激酶2 蛋白表达,其机制可能与抑制TGF-β1/Smad 信号通路的活化而发挥作用。以上结果均提示杜仲多糖可为肝脏相关疾病和心血管疾病的预防及治疗提供新的靶点和方向。
4.9 其他生物活性
除上述报道的生物活性之外,杜仲多糖还显示出其他生物活性。杜仲多糖能通过减少免疫球蛋白沉积和蛋白尿,减轻肾小球损伤,同时抑制血清自身抗体和总IgG 的增加,对空肠弯曲杆菌诱导的BALB/c 小鼠系统性红斑狼疮样综合征具有保护作用[71]。沈磊等[72]研究发现,杜仲多糖能通过下调miR-1207-5p 表达,进而抑制肾小管上皮细胞损伤和凋亡及炎症因子释放,对高糖诱导的人肾皮质近曲小管上皮HK-2 细胞损伤具有保护作用。杜仲多糖能通过激活Caspase-3 途径进而抑制小鼠Lewis肺癌LLC 细胞的增殖、侵袭和迁移并诱导肺癌细胞凋亡,发挥抗癌活性[73]。 间充质干细胞(mesenchymal stem cell,MSC)作为一种基于细胞的治疗策略已被广泛用于治疗各种疾病和组织损伤。其中,细胞递送载体在决定MSC 的治疗性能及其植入后的命运方面发挥重要作用。Niu 等[74]发现了1 种新的杜仲多糖生长因子复合物EUP3-血小板源性生成因子-BB(EUP3-platelet-derived growth factor-BB,EUP3-PDGF-BB)并探讨其对MSC 和成纤维细胞的影响。结果发现,EUP3-PDGF-BB 在体外可调节PDGF-BB 的活性,促进细胞迁移、增殖和保持细胞干性。进一步将EUP3-PDGF-BB 制成微球,并在微球上植入细胞。结果发现,EUP3-PDGFBB 微球对rMSC 的增殖表现出强有力的影响,并对维持干性具有持久的影响,提示EUP3-PDGF-BB具有调节PDGF-BB 的活性,作为一种有价值的细胞载体在干细胞的递送中具有广阔的应用前景。Sun 等[75]研究发现杜仲多糖通过降低肥胖相关指标水平、重塑肠道微生物群和控制色氨酸代谢减轻肥胖饮食诱导的小鼠认知和社会功能障碍,提示杜仲多糖可作为一种新的治疗选择预防神经发育障碍。最新研究表明,慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)破坏了小鼠肠道菌群组成,诱导神经炎症,引发行为和生理缺陷。而补充杜仲多糖能显著减轻CUMS 小鼠的生理应激反应,包括菌群失调、肠道通透性增加以及神经炎症反应。同时,杜仲多糖可恢复CUMS 小鼠的神经发生节律,并表现出行为学测试特异性的抗抑郁和抗焦虑作用,其机制与抑制小胶质细胞介导的TLR4/NF-κB/MAPK 信号通路减轻海马炎症有关。这些结果提示杜仲多糖对CUMS 引起的神经炎症和抑郁样症状有改善作用,可能与其对肠道菌群组成的有益影响密切相关[76]。
5 结语与展望
杜仲作为陕西省“十大秦药”品种之一,因其“药食同源”属性在功能性食品和医药方面的健康益处而受到研究者的广泛关注。以杜仲为原料开发的保健食品种类较多,且剂型丰富,有杜仲饮料、茶饮、口服液、胶囊、颗粒剂和丸剂等,在缓解疲劳、增强免疫、降糖调脂、增加骨密度、改善睡眠和通便等方面效果显著[77]。Ren 等[78]以杜仲叶超细粉为添加剂,在糯米发酵中,研制了新型保健品杜仲叶甜米酒。该米酒在体外实验中展现出较强的抗氧化、降血糖和调血脂作用,为杜仲叶的广泛利用提供依据,增加了甜米酒的品种,从而进一步扩大杜仲的保健食品市场。近年来研究发现,从杜仲皮和叶中分离纯化出的多糖凭借其优良的健康活性及较高的营养价值,开发新型生物活性多糖及研发多糖功能性食品和药物已成为当前研究的热点。
未来对杜仲多糖的研究应聚焦在以下几个方面。(1)多糖的生物活性与其提取方法和结构特征密切相关。然而,目前对杜仲多糖的结构特征与活性之前的关系研究缺乏。需要进一步阐明杜仲多糖的高级结构及其与生物活性的多维相关性,以阐明其的构效关系,为深入开发杜仲多糖相关产品奠定基础。(2)关于杜仲多糖的合成生物学研究很少。提取特异性杜仲多糖合成基因并对其进行靶向修饰以进一步提高其生物活性也是未来研究的重点。而且,通过对杜仲多糖结构修饰或制备杜仲多糖的脂质体和纳米制剂等剂型,能有效改善药理活性和药物递送能力,开发其作为药物载体和传递系统等,实现杜仲多糖的进一步分析利用、新药研发及安全用药。虽然已经报道了杜仲多糖的多种生物活性,但其在免疫调节、抗骨质疏松、降血糖、调血脂、抗炎镇痛、抗氧化、抗疲劳和抗衰老及神经保护等方面的活性仅停留在表观指标测定上,其潜在分子机制值得进一步深入研究。(3)目前对杜仲多糖结构表征文献较少,与其他植物多糖相比较,无法体现出差异性,导致对杜仲多糖的生物活性的研究主要集中在细胞和动物实验上,临床试验尚更未见报道,极大地限制了其在保健食品和制药等领域的应用。因此,未来的研究需要利用更先进的技术如宏基因组学和代谢组学等高度跨学科和动态的方法进行更深入的分子机制探讨。随着我国医疗健康产业高速发展及“健康中国2030”的战略布局下,功能性食品逐渐受到人们的青睐,特别是以杜仲多糖为主要成分的绿色保健食品在增强免疫、骨保护、降血糖、调血脂、抗疲劳和抗氧化等方面拥有广阔的市场前景和商业价值,可在此领域深入探索挖掘,在食品、保健品及药品开发领域做出贡献。
利益冲突所有作者均声明不存在利益冲突

