赛默飞HistoStar 包埋机不同模具温度和冷却方式及注蜡方式对病理标本包埋质量的影响
谢秀芳,李文燕(通信作者)
福建省龙岩市第一医院 (福建龙岩 364000)
石蜡包埋是现阶段制作病理切片的重要方法。该方法通过将标本置于融化石蜡中冷却固化,从而达到支撑组织和维持标本形态稳定的效果,包埋质量可直接影响后续切片、染色和诊断结果[1]。近年来,恶性肿瘤发病率快速增长,临床对病理诊断的要求逐渐提升,且小标本活检情况增多,对石蜡切片质量的要求明显提升,因此病理科需要不断改进石蜡包埋等病理操作流程[2]。既往研究表明,石蜡包埋过程中模具温度、冷却方式和注蜡方式等技术细节均为影响包埋质量的重要因素[3-5]。此外,不同包埋机对石蜡包埋操作流程和细节也可能存在不同要求。本研究探讨赛默飞HistoStar 包埋机不同模具温度、冷却方式、注蜡方式对病理标本包埋质量的影响,为进一步提升组织切片质量和病理诊断准确率提供参考信息,现报道如下。
1 资料与方法
1.1 设备和材料
徕卡生物系统(里士满)有限公司生产的赛默飞HistoStar 组织包埋机、Pathcenitre 脱水机、Finessemit 切片机及苏木精-伊红染色液,广东金泉医疗科技有限公司生产的脱水盒、载玻片,西陇科学股份有限公司生产的脱水剂。
1.2 方法
选取2022 年1—12 月我院病理科的500 份组织标本,随机分为对照组和实验1、2、3、4 组,每组100 份。
对照组采用常规模具温度、冷却方式和注蜡方式进行石蜡包埋:采用常温模具,首次注蜡注满模具,将标本置于模具底部正中央,待模具侧壁石蜡逐渐凝固时覆盖包埋盒,二次注蜡至液面与包埋盒上缘平齐,转移至冷台,充分冷却后切片并染色。
实验1 组将模具加热至70 ℃并置于包埋机蜡嘴下方热台上;实验2 组采用冷却台加水冷却(在冷却台上添加少量水);实验3 组首次注蜡至模具容量的2/3,二次注蜡前将模具和包埋盒倾斜25°,并注蜡至液面没过包埋盒下缘;实验4 组采用70 ℃模具,首次注蜡至模具容量的2/3,将标本置于模具底部正中央处,待模具侧壁石蜡逐渐凝固时覆盖包埋盒,将模具和包埋盒倾斜25°后二次注蜡至液面没过包埋盒下缘,然后转移至冷却台加水冷却,充分冷却后切片染色。实验1、2、3 组其他操作同对照组。
1.3 观察指标
(1)比较各组包埋质量:标本居中、组织模块与包埋模具平行且无裂隙、包埋面准确且高度一致、蜡块无气泡或污染情况、多条组织排列整齐且方向保持一致为包埋合格。(2)比较各组包埋时间。(3)比较各组切片评分:由2 名具有5 年以上工作经验的病理科医师采用双盲法评分,结果取2 名医师评分的均值;评分标准依据《免疫组织化学病理诊断》[6],内容包括组织结构完整性(切片完整、无折叠、无皱褶、无刀痕)、细胞显示效果(细胞透明度、核质对比度)及网状纤维显示效果(背景清洁度、纤维完整度、网状/胶原纤维对比度)3 大项9 小项,每个小项总分均为10 分,大项评分为大项内各小项平均评分。
1.4 统计学处理
采用SPSS 22.0 统计软件进行数据分析。满足正态分布的计量资料以±s表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析。计数资料以率表示,采用χ2检验或Fisher精确检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组包埋质量、包埋时间比较
各实验组包埋合格率均高于对照组,实验4 组与对照组比较,差异有统计学意义(P<0.05);实验1 组包埋时间长于对照组,差异有统计学意义(P<0.05);实验2、3、4 组包埋时间均短于对照组,其中实验2、4 组与对照组比较,差异有统计学意义(P<0.05),见表1。

表1 各组蜡块包埋质量、包埋时间比较
2.2 各组组织结构完整性比较
各实验组切片完整、无折叠、无皱褶和无刀痕评分均高于对照组,实验4 组切片完整、无折叠和无皱褶评分高于其他实验组,实验3 组和实验4 组无刀痕评分高于实验1 组和实验2 组,差异均有统计学意义(P<0.05),见表2。
表2 各组组织结构完整性比较(分,±s)
注:与对照组比较,aP<0.05;与实验1 组比较,bP<0.05;与实验2 组比较,cP<0.05;与实验3 组比较,dP<0.05
组别 份数 切片完整 无折叠 无皱褶 无刀痕实验1 组 100 9.51±0.18a 9.40±0.13a 9.57±0.14a 9.04±0.16a实验2 组 100 9.47±0.14a 9.38±0.15a 9.61±0.12a 9.05±0.14a实验3 组 100 9.48±0.16a 9.42±0.18a 9.58±0.15a 9.26±0.12abc实验4 组 100 9.72±0.09abcd 9.68±0.07abcd 9.74±0.10abcd 9.27±0.15abc对照组 100 9.24±0.25 9.05±0.16 9.42±0.18 9.02±0.13 F 11.320 245.259 65.875 79.646 P<0.001 <0.001 <0.001 <0.001
2.3 各组细胞显示效果比较
各实验组细胞透明度和核质对比度评分均高于对照组,且实验4 组高于其他实验组,差异均有统计学意义(P<0.05),见表3。
表3 各组细胞显示效果比较(分,±s)
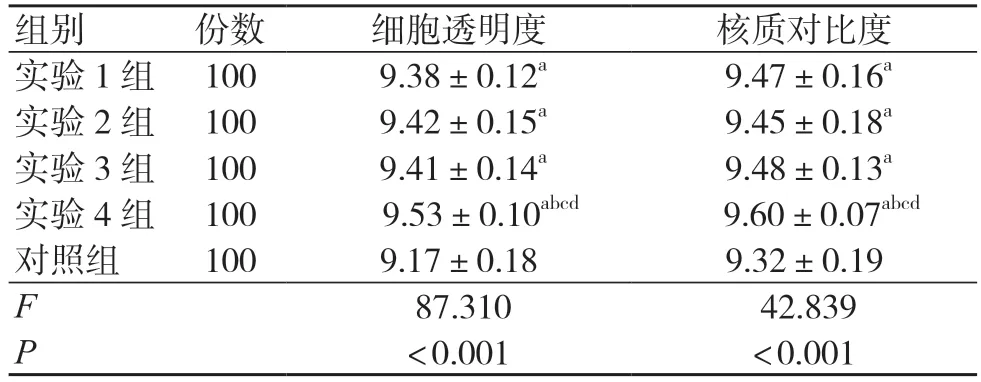
表3 各组细胞显示效果比较(分,±s)
注:与对照组比较,aP<0.05;与实验1 组比较,bP<0.05;与实验2 组比较,cP<0.05;与实验3 组比较,dP<0.05
组别 份数 细胞透明度 核质对比度实验1 组 100 9.38±0.12a 9.47±0.16a实验2 组 100 9.42±0.15a 9.45±0.18a实验3 组 100 9.41±0.14a 9.48±0.13a实验4 组 100 9.53±0.10abcd 9.60±0.07abcd对照组 100 9.17±0.18 9.32±0.19 F 87.310 42.839 P<0.001 <0.001
2.4 各组网状纤维显示效果比较
各组背景清洁度、网状/胶原纤维对比度评分比较,差异无统计学意义(P>0.05);各实验组纤维完整度评分均高于对照组,且实验4 组高于其他实验组,差异均有统计学意义(P<0.05),见表4。
表4 各组网状纤维显示效果比较(分,±s)
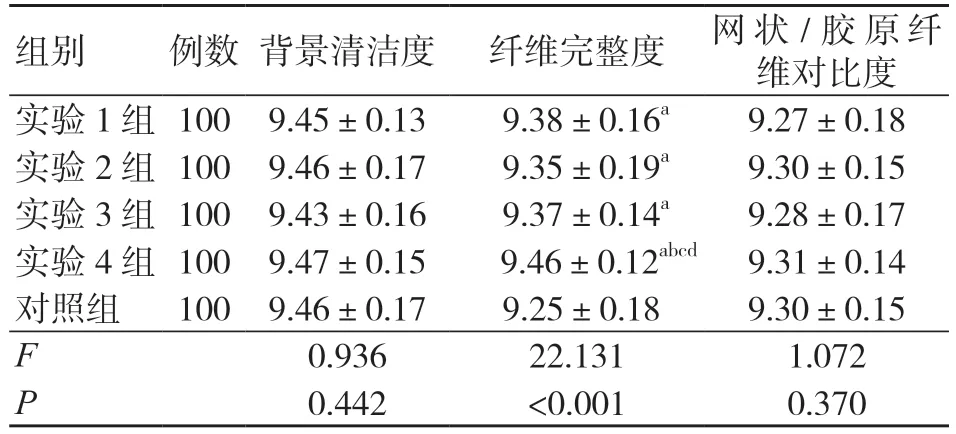
表4 各组网状纤维显示效果比较(分,±s)
注:与对照组比较,aP<0.05;与实验1 组比较,bP<0.05;与实验2 组比较,cP<0.05;与实验3 组比较,dP<0.05
组别 例数 背景清洁度 纤维完整度 网状/ 胶原纤维对比度实验1 组100 9.45±0.13 9.38±0.16a 9.27±0.18实验2 组100 9.46±0.17 9.35±0.19a 9.30±0.15实验3 组100 9.43±0.16 9.37±0.14a 9.28±0.17实验4 组100 9.47±0.15 9.46±0.12abcd 9.31±0.14对照组 100 9.46±0.17 9.25±0.18 9.30±0.15 F 0.936 22.131 1.072 P 0.442 <0.001 0.370
3 讨论
自19 世纪德国病理学家Rudolf Virchow 开创细胞病理时代以来,组织切片在疾病诊断中的作用日益重要,切片质量成为影响诊断准确性的重要因素[7]。病理切片制作包括取材、脱水及石蜡包埋等多个环节,且每个环节均可能影响切片质量。虽然目前已形成较为规范和完善的切片操作流程,但仍有较多细节因仪器设备、组织类型及技术人员操作习惯等因素不同而存在较大差异,还需根据临床需求不断改进和完善。其中石蜡包埋是后续切片、染色和诊断的基础,因此提升包埋质量具有重要意义。包埋的关键环节包括选择适宜模具温度、冷却方式和注蜡方式等。
正常情况下包埋模具置于热台时,仅有底部可以受热,石蜡注入后为融化状态,而其他部位由于温度降低可在短时间内凝固,难以将组织标本沉降至包埋盒底部并按压平整,导致石蜡包埋合格率低。同时制作切片时常因组织不在同一切面导致结构完整性丧失,细胞和网状纤维显示效果也明显降低[7]。本研究中,实验1 组将包埋模具加热至约70 ℃,与石蜡熔点(56~62 ℃)相近,因此可有效延缓石蜡凝固速度,为将组织标本按照正确位置方向置入包埋盒底部提供充足时间。实验1 组包埋合格率达97.00%,同时切片组织结构完整性、细胞显示效果及网状纤维完整度评分高于对照组,表明将包埋模具加热至70 ℃是提升包埋质量的有效方法,与罗添友等[8]研究结果相似。但由于石蜡冷却和凝固速度减慢,导致完成包埋时间较对照组延长,工作效率降低,因此还需对冷却方式进行改进。
石蜡包埋完成组织定位后需要置于冷台进行冷却,但常规冷却方式仅有模具底部可以受冷,导致石蜡凝固速度较慢,不仅使工作效率降低,组织样本在石蜡凝固过程中还容易出现易位。在冷却台上添加少量水,可有效增加包埋模具受热面积,使石蜡在较短时间内成为半凝固状态,不仅有利于提升包埋合格率和速度,减少周围残蜡,对防止包埋模具底部样本组织移位也具有积极作用,从而可提升切片组织结构完整性及染色效果。本研究结果显示,实验2 组包埋合格率为98.00%,包埋时间仅(194.36±12.54)s,较其他各组明显降低,表明在冷却台上添加少量水可能是提升石蜡包埋质量和速度的有效方法,但实验2 组和对照组的包埋合格率比较,差异无统计学意义,可能是因样本容量不足所致,因此该结果还有待后续进一步研究证实。此外,本研究结果显示,实验2 组切片组织结构完整性、细胞显示效果及网状纤维完整度评分均较对照组升高,可见在冷却台上添水冷却是提升石蜡包埋质量的有效方法。
注蜡量和注蜡方式也可影响包埋质量。既往研究认为,一次注蜡时若注满包埋模具,组织样本放入后可导致多余石蜡外涌并在蜡块周围形成残蜡,且二次注蜡过程中若方向与包埋模具垂直,则可能因冲击力较大产生气泡,导致包埋质量和切片质量较差[9]。为有效避免上述问题,实验3 组首次注蜡至模具容量的2/3,以减少石蜡涌出和二次注蜡冲击力,同时又将二次注蜡量减少至仅没过石蜡包埋盒下缘,从而进一步减少石蜡溢出风险。此外,实验3 组在二次注蜡前将模具和包埋盒倾斜25°以减少石蜡冲击造成的包埋面下气泡形成。本研究结果显示,实验3 组包埋合格率为96.00%,切片组织结构完整性、细胞显示效果及网状纤维完整度评分均较对照组升高,表明优化注蜡量和注蜡方式对提升包埋质量和切片质量具有积极作用。
由于模具温度、冷却方式和注蜡方式均为石蜡包埋质量的重要影响因素,本研究实验4 组对各环节同时进行优化,结果显示包埋合格率达100.00%,较实验1、2、3 组均进一步提升,而包埋时间仅稍长于实验2 组,较对照组明显缩短,可见该方案可有效保证包埋效率,与张睿等[10]研究结果相似。此外,本研究结果显示,实验4 组组织结构完整性、细胞显示效果及网状纤维完整度评分均高于其他各组,表明切片质量获得有效提升。
综上所述,模具温度、冷却方式和注蜡方式均可影响病理标本包埋质量,对以上因素进行优化可提升包埋质量和切片评分。本研究主要局限性为未对组织样本类型、数量和大小进行区分和讨论,且不同样本石蜡包埋操作细节差异较大,不同组织样本对模具温度、冷却方式和注蜡方式的要求可能不同,后续将沿此方向开展深入研究,以不断完善各类型组织石蜡包埋操作规范。

