大分割适形调强放射治疗对非小细胞肺癌患者的治疗效果
温江妹,郑庆伟
福建省龙岩市第二医院 (福建龙岩 364000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)发病初期症状不显著,经临床确诊时多已发展至中晚期,错失最佳治疗时机,无法进行手术根治,导致疾病治疗难度增加[1]。近年来,随着肿瘤综合治疗技术水平的不断提高,肺癌治疗的临床疗效得到明显改善,但对NSCLC 患者的治疗效果仍不理想。因此,临床需寻求更为有效的治疗方案。有研究将分割适形强调放射治疗用于NSCLC 患者中,取得了一定效果[2-3]。常规分隔适形强调放射治疗方案多为每周5 次,剂量维持在1.8~2.0 Gy/次。但许多患者初诊时病情已处于进展期,健康状况较差,对常规方案不耐受,易影响治疗效果[2-3]。郭连洪等[4]将大分割适形调强放射治疗应用于肺癌骨转移患者中,发现该方案具有治疗周期短、单次生物等效剂量高等优势,且可抑制治疗后肿瘤细胞再次增殖,提高病灶对化疗的敏感性,进而提高局部肿瘤控制率。但目前临床对大分割适形调强放射治疗在NSCLC 患者中的应用效果尚存在争议。鉴于此,本研究旨在探讨大分割适形调强放射治疗对NSCLC 患者的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2021 年10 月至2022 年10 月我院收治的86 例NSCLC 患者作为研究对象,按照随机数字表法分为对照组和试验组,每组43例。对照组男26例,女17 例;年龄45~80 岁,平均(65.38±3.52)岁;病理类型,鳞癌21 例,腺癌16 例,其他6 例。试验组男24 例,女19 例;年龄46~78 岁,平均(65.24±3.46)岁;病理类型,鳞癌20例,腺癌16例,其他7例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及家属均自愿签署知情同意书。
纳入标准:经组织病理检查确诊为NSCLC;肿瘤分期为ⅢA~Ⅳ期;预计生存期>3 个月。排除标准:合并其他脏器疾病;存在免疫功能障碍;存在放化疗禁忌证;治疗依从性较差,未完成治疗。
1.2 方法
放射治疗靶区划分:指导患者取仰卧位,平心静气,均匀呼吸,并使用热塑膜固定身体;采用64 排螺旋CT(荷兰飞利浦公司,Philips Brilliance 型)进行增强扫描,扫描速度为0.3 s/层,厚度为5 mm,扫描完成后将影像数据上传至治疗系统中,由治疗医师根据影像勾画治疗靶区,需明确原发肿瘤及淋巴结转移位置,并勾画肺窗、纵隔窗,结合患者的呼吸运动、摆位误差情况综合分析靶区;肿瘤靶区为肺内肿瘤范围与纵隔窗中纵隔受累范围;临床靶区为肿瘤靶区向周边外扩6~8 mm;计划靶区为肿瘤靶区及其运动范围和摆放误差之和。
对照组实施常规分割适形调强放射治疗,2 Gy/次,1 次/d,5 次/周,总剂量为60~66 Gy。试验组实施大分割适形调强放射治疗,4 Gy/次,1 次/d,5 次/周,持续治疗13 次。
1.3 观察指标
(1)治疗总有效率[5]:病灶消失并维持4 周为完全缓解;病灶缩小≥30%,并维持4 周为部分缓解;20%<病灶缩小<30%为稳定;病灶增大≥20%或出现新病灶为进展;总有效率=(完全缓解例数+部分缓解例数)/总例数×100%。(2)肿瘤标志物和免疫功能指标水平水平:分别于治疗前后采集患者空腹静脉血3 ml,离心10 min(转速3 000 r/min,离心半径15 cm)后取血清,低温保存。采用电化学发光免疫分析法检测糖类抗原125(carbohydrate antigen 125,CA125)、癌胚抗原(carcinoembryonic antigen,CEA)水平。采用流式细胞仪[安捷伦科技(中国)有限公司,NovoCyte Penteon 型]检测CD3+、CD4+、CD8+水平。(4)并发症发生率:记录两组治疗期间恶心呕吐、骨髓抑制、贫血、放射性肺炎的发生情况。
1.4 统计学处理
采用SPSS 25.0 统计软件进行数据分析。计量资料以±s表示,采用t检验。计数资料以率表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗总有效率比较
试验组治疗总有效率高于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组治疗总有效率比较
2.2 两组肿瘤标志物水平比较
治疗前,两组CA125、CEA 水平比较,差异均无统计学意义(P>0.05);治疗后,两组CA125、CEA 水平均低于同组治疗前,且试验组低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组肿瘤标志物水平比较(±s)
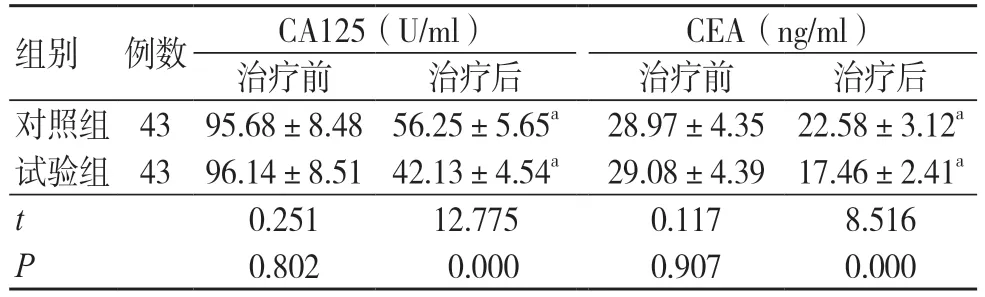
表2 两组肿瘤标志物水平比较(±s)
注:与同组治疗前比较,aP<0.05;CA125 为糖类抗原125,CEA 为癌胚抗原
组别 例数 CA125(U/ml) CEA(ng/ml)治疗前 治疗后 治疗前 治疗后对照组 43 95.68±8.48 56.25±5.65a 28.97±4.35 22.58±3.12a试验组 43 96.14±8.51 42.13±4.54a 29.08±4.39 17.46±2.41a t 0.251 12.775 0.117 8.516 P 0.802 0.000 0.907 0.000
2.3 两组免疫功能指标水平比较
治疗前,两组CD3+、CD4+、CD8+水平比较,差异均无统计学意义(P>0.05);治疗后,两组CD3+、CD4+水平均低于同组治疗前,CD8+水平高于同组治疗前,且试验组CD3+、CD4+水平均低于对照组,CD8+水平高于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组免疫功能指标水平比较(%,±s)

表3 两组免疫功能指标水平比较(%,±s)
注:与同组治疗前比较,aP<0.05
组别 例数 CD3+ CD4+治疗前 治疗后 治疗前 治疗后对照组 43 39.68±4.79 33.45±3.15a 31.27±4.16 25.43±3.64a试验组 43 39.73±4.82 30.27±2.67a 31.34±4.18 20.68±2.51a t 0.048 5.050 0.078 7.045 P 0.962 0.000 0.938 0.000组别 例数 CD8+治疗前 治疗后对照组 43 22.79±3.65 27.46±4.25a试验组 43 23.05±3.69 31.64±5.85a t 0.329 3.791 P 0.743 0.000
2.4 两组并发症发生率比较
治疗期间,两组并发症发生率比较,差异无统计学意义(P>0.05),见表4。

表4 两组并发症发生率比较[例(%)]
3 讨论
NSCLC 患者确诊时病情多已进展至晚期,且多存在转移病灶,手术治疗效果欠佳,预后较差[6]。针对NSCLC 患者,放射治疗可通过射线灭杀肿瘤细胞,具有选择性强、定位精准等特点,疗效较好,且患者可耐受[7]。
CA125 是临床诊断肺癌的常见肿瘤标志物,为糖蛋白复合物,可促进肿瘤的进展及新生[8]。CEA 是一种光谱肿瘤标志物,在乳腺癌及胃癌患者中呈高表达,是临床诊断肿瘤良恶性的重要指标。相关研究指出,肺癌的发生与躯体免疫功能密切相关,放化疗均可损伤患者的免疫功能,而淋巴细胞亚群水平的变化可体现患者的免疫功能[9]。T 淋巴细胞亚群在机体免疫能力及杀伤特异性细胞调节上扮演重要角色。其中,CD3+主要分布在成熟T 细胞表面;CD4+为辅助性T 细胞,可刺激细胞诱发炎症反应,辅助其他细胞参与免疫调节;CD8+为免疫抑制细胞,参与机体的免疫控制及调节功能[10]。本研究结果显示,试验组治疗总有效率高于对照组,治疗后试验组CA125、CEA、CD3+、CD4+水平低于对照组,CD8+水平高于对照组,差异均有统计学意义(P<0.05)。以上结果说明,NSCLC 患者实施大分割适形调强放射治疗可提高临床疗效,抑制肿瘤生长,改善患者免疫功能。分析其原因为,大分割适形调强放射治疗通过增加单次照射剂量实施大分割模式,在增强灭杀肿瘤细胞效果的同时可缩短治疗周期,进一步提高生物等效剂量,可抑制肿瘤细胞增殖,继而降低肿瘤标志物水平,抑制肿瘤生长[11];大分割适形调强放射治疗的准确性较高,能够提高肿瘤靶区的照射精准度,并能够通过控制器官运动与修正摆位误差减少治疗误差,精准灭杀肿瘤细胞,减少对周围正常组织的损伤,进而减少对机体的免疫抑制[12]。本研究结果显示,两组并发症发生率比较,差异无统计学意义(P>0.05),提示大分割适形调强放射治疗虽然提高了单次治疗剂量,但可有效控制正常组织的受照射剂量,安全性与常规方案相当。
综上所述,大分割适形调强放射治疗对NSCLC患者的治疗效果优于常规分割适形调强放射治疗,可降低肿瘤标志物水平,改善机体免疫功能,且不增加并发症发生风险。

