甲状腺乳头状癌PDRG1基因表达与临床病理特征的相关性分析
刘佳 袁栩昕 郑惊雷 袁崇德


基金项目:东莞市社会发展科技项目(编号:20211800903692)
作者简介:刘佳,大学本科,主治医师,研究方向:肝、胆、甲状腺相关疾病的诊疗。
【摘要】目的 探究甲状腺乳头状癌PDRG1基因表达与临床病理特征的相关性,为临床提供理论参考。方法 回顾性分析2020年11月至2022年8月东莞市人民医院收治的100例行甲状腺乳头状癌手术治疗患者的临床资料。取甲状腺癌组织及相邻的正常组织,检测甲状腺癌组织及相邻正常组织中PDRG1基因的表达水平,根据 PDRG1基因表达情况分为低表达组(30 例, PDRG1基因表达 <30%) 和高表达组(70例,PDRG1基因表达≥30%)。 分析不同组织PDRG1基因的表达情况、不同PDRG1基因表达患者的生存情况及甲状腺乳头状癌PDRG1基因表达与临床病理特征的相关性。结果 甲状腺乳头状癌组织的PDRG1基因表达水平高于相邻正常组织(P<0.05)。PDRG1基因高表达组患者的生存期短于低表达组,生存率低于低表达组(均P<0.05)。高表达组淋巴结转移、被膜外侵犯及伴桥本甲状腺炎患者占比高于低表达组(均P<0.05)。Pearson相关性分析显示,甲状腺乳头状癌PDRG1基因表达水平与淋巴结转移、被膜外侵犯及伴桥本甲状腺炎均呈正相关(均P<0.05)。结论 甲状腺乳头状癌PDRG1基因表达与淋巴结转移、被膜外侵犯及伴桥本甲状腺炎等临床病理特征密切相关,可作为甲状腺乳头状癌患者预后的判断依据。
【关键词】甲状腺乳头状癌;PDRG1基因;病理特征;相关性
【中图分类号】R736.1 【文献标识码】A 【文章编号】2096-2665.2024.01.0115.04
DOI:10.3969/j.issn.2096-2665.2024.01.038
甲状腺乳头状癌是临床常见的内分泌肿瘤,一般生长较慢,但若甲状腺乳头状癌发展至晚期,可能会影响患者的呼吸系统和神经系統功能,甚至会导致恶病质的发生[1]。因此,必须高度重视甲状腺乳头状癌的早期筛查和诊断,以便给予相关治疗措施。目前,用于甲状腺乳头状癌的诊断方法较多,如触诊、超声检查、细针穿刺细胞学活检等。其中,细针穿刺细胞学活检是现阶段最有效的甲状腺乳头状癌早期诊断方式,但其也存在一定的局限性,如假阴性率高、存在漏诊等情况[2-3]。PDRG1基因是指p53和DNA损伤修复相关的基因,参与了多种肿瘤的发生和发展进程,广泛存在于睾丸癌、肝癌及宫颈癌等恶性肿瘤中,对于各种肿瘤细胞的增殖能力、凋亡均有影响[4]。本研究探讨PDRG1基因在甲状腺乳头状癌组织及相邻的正常组织中的表达情况,分析其在不同临床分期、不同病理分型的甲状腺乳头状癌组织中的表达情况,研究PDRG1基因表达与该恶性肿瘤临床病理特征及预后的相关性,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年11月至2022年8月东莞市人民医院收治的100例行甲状腺乳头状癌手术治疗患者的临床资料。患者中男性32例,女性68例;年龄35~68岁,平均年龄(47.46±2.30)岁;单发病灶81例,多发病灶19例;行甲状腺全叶切除术者42例,行患侧叶、狭部及部分对侧叶切除术者32例,行患侧叶及狭部切除术者26例。根据PDRG1基因表达情况分为低表达组(30例,PDRG1基因表达<30%)和高表达组(70例,PDRG1基因表达≥30%)。低表达组患者中男性10例,女性20例;年龄35~67岁,平均年龄(47.55±2.26)岁。高表达组患者中男性22例,女性48例;年龄36~68岁,平均年龄(47.28±2.31)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经东莞市人民医院医学伦理委员会批准。纳入标准:①符合甲状腺乳头状癌手术指征[5],符合以下任意一条高危因素即可进行手术,a.存在颈部放射暴露史;b.有甲状腺癌家族史;c.已确定或高度怀疑颈淋巴结转移甚至远处转移;d.癌灶有腺外侵犯(如侵犯喉返神经、气管或食管等);e.病理学高危亚型(高细胞亚型、柱状细胞亚型、弥漫硬化型、实体/岛状型、嗜酸细胞亚型);f.穿刺标本检测BRAF基因突变阳性;g.癌灶短期内进行性增大(6月内增大超过3 mm)。②年龄≥18岁。③精神和认知正常,意识清晰。排除标准:①缺乏病理诊断报告;②缺乏淋巴结转移情况相关检查报告;③合并复发性甲状腺乳头状癌者;④合并远处转移至甲状腺的恶性肿瘤者;⑤合并其他类型的恶性肿瘤者;⑥合并自身免疫性或传染性疾病者;⑦妊娠期或哺乳期患者。
1.2 研究方法 ①样品采集:患者行相应手术治疗,取甲状腺乳头状癌组织及相邻的正常组织标本,正常组织切除距甲状腺乳头状癌组织边界5 cm以上,送至病理科进行确认。获取的组织置于装有RNA保存液(RNA later RNA stabilization reagent)的无核酸酶的1.5 mL离心管中,4 ℃过夜后转移至-80 ℃保存,待集中提取RNA。②标本检测:采用实时荧光定量多聚核苷酸链式反应(real-time PCR)检测甲状腺乳头状癌及相邻正常组织中PDRG1基因的表达。采用新型总RNA抽提试剂(TRIZOL法)提取组织总RNA,按试剂盒操作说明反转录合成cDNA后,以甘油醛-3-磷酸脱氢酶作为内参,采用real-time PCR检测泛酸激酶3(PANK3)的相对表达水平。③术后随访:观察手术后6、12个月的预后情况,比较两组患者生存期和生存率。总生存期:随机化开始至因任何原因引起死亡的时间。无进展生存期:随机化开始至第一次发生疾病进展或任何原因死亡的时间。
1.3 观察指标 ①比较不同组织PDRG1基因的表达情况。②比较不同PDRG1基因表达患者的生存情况。③比较高表达组与低表达组患者临床病理特征。临床病理特征包括性别、年龄、肿瘤大小(≥1 cm或<1 cm)、病灶数量(单个或多个)、淋巴结转移、组织学亚型(滤泡型和经典型)、被膜外侵犯、桥本甲状腺炎及临床分期[6]。④分析甲状腺乳头状癌患者PDRG1基因表达水平与临床病理特征的相关性。
1.4 统计学分析 采用SPSS 22.0统计学软件进行数据分析。计量资料以(x)表示,组间比较采用独立样本t检验;计数资料以[例(%)]表示,组间比较采用χ2检验;相关性分析采用Pearson检验。以P<0.05为差异有统计学意义。
2 结果
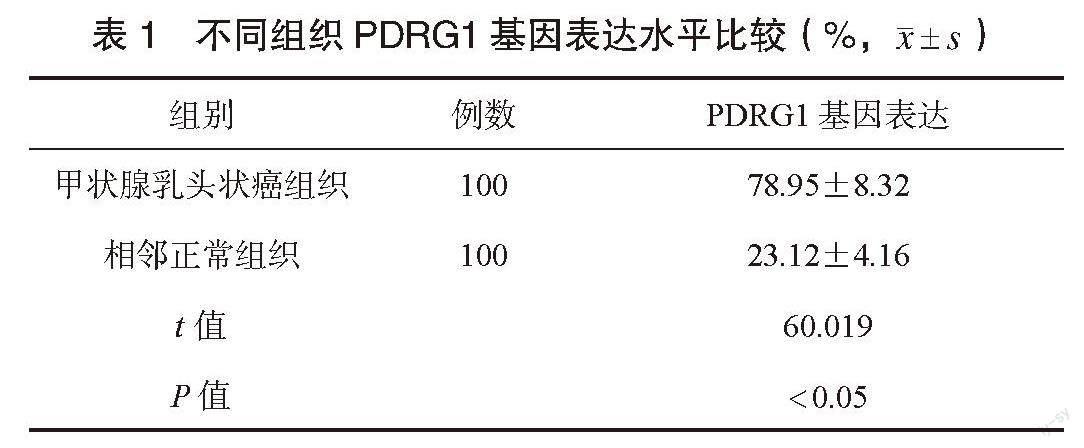
2.1 不同组织PDRG1基因表达水平比较 甲状腺乳头状癌组织的PDRG1基因表达水平高于相邻正常组织,差异有统计学意义(P<0.05),见表1。
2.2 不同PDRG1基因表达患者的生存情况比较 高表达组患者生存期短于低表达组,生存率低于低表达组,差异均有统计学意义(均P<0.05),见表2。
2.3 高表达组与低表达组患者临床病理特征比较 高表达组淋巴结转移、被膜外侵犯及伴桥本甲状腺炎患者占比均高于低表达组,差异均有统计学意义(均P<0.05),见表3。
2.4 甲状腺乳头状癌PDRG1基因表达水平与临床病理特征的相关性分析 Pearson相关性分析显示,甲状腺乳头状癌PDRG1基因表达水平与淋巴结转移、被膜外侵犯、伴桥本甲状腺炎均呈正相关(均P<0.05),见表4。
3 讨论
甲状腺乳头状癌治疗方法十分有限,尤其是针对早期转移的患者并无有效的治疗手段,因此,从分子水平探讨并阐明甲状腺乳头状癌转移发生的机制,寻找针对甲状腺乳头状癌转移侵袭的有效治疗靶点,对于阻止癌细胞扩散、改善患者预后及提高患者远期生存率具有重要意义[7]。与其他肿瘤一样,甲状腺乳头状癌的发生、恶性程度的改变可能与多个癌基因、抑癌基因的突变、激活、失活及缺失等相关[8]。
p53基因为抑癌基因;p53蛋白为转录因子,其生物学作用为细胞周期G1期DNA损伤的监控点,在维持正常细胞生长、抑制恶性肿瘤细胞增殖过程中起重要作用[9]。当p53丢失、突变或与病毒蛋白结合而失活时,细胞增殖周期失去控制,或同时引起其他肿瘤抑制因子的损伤及癌基因的激活,从而引发肿瘤[10-11]。PDRG1为一种新发现的基因,被p53和紫外辐射差异性调控。在甲状腺肿瘤中p53基因突变几乎全部发生在恶性度极高的间变性癌或低分化癌中,p53基因突变提示甲状腺肿瘤已进展至晚期,其存在常预示预后不良[12]。而PDRG1基因与甲状腺乳头状癌临床病理特征的相关性研究较少,因此,本研究对此进行分析。本研究结果显示,甲状腺乳头状癌组织的PDRG1基因表达水平高于相邻正常组织,高表达组患者生存期短于低表达组,生存率低于低表达组,说明甲状腺乳头状癌患者PDRG1基因可能存在高表达的现象。进一步分析发现,PDRG1基因高表达组患者淋巴结转移、被膜外侵犯及伴桥本甲状腺炎占比高于低表达组,且相关性分析显示,甲状腺乳头状癌PDRG1基因表达与淋巴结转移、被膜外侵犯、伴桥本甲状腺炎均呈正相关,这与临床相关报道类似[13]。有研究认为,合并淋巴细胞性甲状腺炎的甲状腺乳头状癌淋巴结转移率较低,预后好于单纯性甲状腺乳头状癌[14]。另有研究显示,不同 肿瘤分期标准(TNM) 分期、是否有淋巴结转移及包膜浸润患者癌组织中PDRG1 基因表达存在差异[15],可佐证本研究结果,提示 PDRG1 表达情况可用于判断甲状腺乳头状癌的病理特征。
综上所述,甲状腺乳头状癌PDRG1基因表达与淋巴结转移、被膜外侵犯及伴桥本甲状腺炎等临床病理特征密切相关,可作为甲状腺乳头状癌患者预后的判断依据。
参考文献
黄立娜,田亚杰. 甲状腺乳头状癌临床及病理特征与气管前淋巴结转移的关系[J]. 临床医学工程, 2022, 29(6): 867-868.
张文杰,王桂芝,张桂芬,等.细针吸取细胞学检查对甲状腺乳头状癌的诊断[J].中国实验诊断学, 2009, 13(4): 553-554.
邹好楠,邹密密,肖海燕,等.超声造影对甲状腺乳头状癌被膜侵犯患者的诊断价值[J].西部医学, 2019, 31(1): 118-122.
ZHANG Y J, LI J Q, LI H Z, et al. PDRG1 gene silencing contributes to inhibit the growth and induce apoptosis of gastric cancer cells[J]. Pathol Res Pract, 2019, 215(10): 152567.
中华医学会内分泌学分会,中华医学会外科学分会内分泌学组,中国抗癌协会头颈肿瘤专业委员会,等. 甲状腺结节和分化型甲状腺癌诊治指南[J]. 中华核医学与分子影像杂志, 2013, 33(2): 96-115.
张磊,董云伟,胡神保,等.美国癌症联合委员会甲状腺癌分期系统(第8版)修订对甲状腺乳头状癌分期的影响[J].中国癌症杂志, 2018, 28(7): 491-496.
魏佳,高嘉雪,王瑤琪,等.基于基因芯片的荧光分析方法在甲状腺乳头状癌相关BRAFV600E突变高灵敏及特异性检测中的应用[J].分析化学, 2019, 47(6): 855-861.
税春燕,李超,孙荣昊,等.甲状腺乳头状癌临床病理特征对颈部淋巴结转移风险预测[J].中华肿瘤防治杂志, 2019, 26(13): 952-958.
田艳,朱军. p53rs1625895基因多态性与弥漫大B细胞淋巴瘤预后相关性分析[J].北京大学学报(医学版), 2019, 10(5): 791-796.
孟祥彪,刘廷廷,刘晓彤,等. PKD1基因与抑癌基因P53多态性与非综合征性唇腭裂的关联研究[J].现代生物医学进展, 2019, 19(3): 556-559.
段东峰,贾国战. 甲状腺乳头状癌p53基因及蛋白的表达情况及临床意义[J]. 检验医学与临床, 2019, 16(22): 3256-3259.
TAO Z, CHEN S, MAO G, et al. The PDRG1 is an oncogene in lung cancer cells, promoting radioresistance via the ATM-P53 signaling pathway[J]. Biomed Pharmacother, 2016, 83(12): 1471-1477.
赵文晶.Ⅰ、细胞周期检测点激酶2(CHK2)调控甲状腺乳头状癌恶性表型及机制研究;Ⅱ、人甲状腺乳头状癌耐失巢凋亡细胞株中差异表达LncRNA/mRNA的初步筛选研究[D].北京:北京协和医学院, 2017.
张静,王莉,李依群. 76例淋巴细胞性甲状腺炎合并甲状腺乳头状癌临床病理分析[J].新疆医科大学学报, 2018, 31(3): 259-261.
林梓仪,苏少雪. PDRG1表达水平与甲状腺癌临床病理特征及预后的相关性研究[J]. 保健文汇, 2023, 24(18): 49-52.

