T1期外周型肺癌临床病理特征及淋巴结转移分析
朱栋麟 茹怡 刘晓强 袁光达 谢宏亚
【摘要】 目的 探讨T1期外周型肺癌的临床病理特征、淋巴结转移情况及二者相关性, 并进一步评估肺段切除术的适应证。方法 133例临床T1期外周型肺癌标本根据2015版WHO肺癌分类对其进行分类, 并进行统计分析。结果 腺癌103例, 鳞癌16例, 腺鳞癌4例, 其他类型10例。手术共清扫胸内淋巴结1022枚, 有155枚淋巴结存在癌转移, 转移率15.2%, 有淋巴结转移的患者占26.3%(35/133)。肿瘤直径≤1 cm患者淋巴结转移率5.3%, 明显低于其他两种直径的24.1%、35.7%(P<0.05)。肿瘤为实性者共76例, 转移率46.1%, 明显高于磨玻璃样组的0(P<0.05)。结论 T1期肺癌患者也会发生淋巴结转移, 对于肿瘤直径>2 cm者, 淋巴结清扫是必要的。对于肿瘤直径≤1 cm, 及CT提示病灶磨玻璃结节的患者, 可不做淋巴结清扫, 可行淋巴结取样。
【关键词】 外周型肺癌;T1期;病理特征;淋巴结转移
DOI:10.14163/j.cnki.11-5547/r.2016.26.006
【Abstract】 Objective To investigate pathological characteristics and lymphatic metastasis in stage T1 peripheral lung cancer, and their correlation, so as to further evaluate indication of pulmonary segmentectomy. Methods A total of 133 samples with stage T1 peripheral lung cancer were classified and statistically analyzed by 2015 WHO lung cancer classification. Results There were 103 adenocarcinoma cases, 16 squamous carcinoma cases, 4 adenosquamous carcinoma cases and 10 cases with other types. A total of 1022 intrathoracic lymph nodes were cleaned in operation, and 155 cases with cancerometastasis, with metastasis rate as 15.2%. Patients with lymphatic metastasis accounted for 26.3% (35/133). Patients with tumor diameter ≤1 cm had much lower lymphatic metastasis rate as 5.3% than 24.1% and 35.7% in the other two diameters (P<0.05). Metastasis rate in 76 solid tumor cases was obviously higher as 46.1% than 0 in ground glass cases (P<0.05). Conclusion Due to occurrence of lymphatic metastasis in patients with stage T1 lung cancer, it is necessary for patients with tumor diameter > 2 cm to take lymph node dissection. Patients with tumor diameter ≤1 cm and ground glass node shown by CT can receive lymph node sampling instead of dissection.
【Key words】 Peripheral lung cancer; Stage T1; Pathological characteristics; Lymphatic metastasis
肺癌是全球致死率最高的肿瘤, 每年大约有140万患者死于肺癌。随着断层CT扫描、低剂量螺旋CT等技术的应用, 早期肺癌的检出率越来越高[1]。T1期肺癌是指肿瘤最大径≤3 cm, 周围由肺或脏层胸膜包绕, 支气管镜下见肿瘤未超出叶支气管。最大径≤2 cm的为T1a期, >2 cm并≤3 cm为T1b期[2]。T1期病变如何选择诊疗方案是很大挑战。本研究对133例T1期外周型肺癌进行回顾性研究, 结合临床表现、CT影像学表现、病理特征及淋巴结转移等因素进行系统性分析, 探讨T1期外周型肺癌的临床特点, 进而探讨手术方式的选择, 报告如下。
1 资料与方法
1. 1 一般资料 选取2012年1月~2015年12月在苏州市立医院东区行肺癌切除术的患者133例。入组标准为:外周型;单结节;肿瘤直径≤3 cm;无远处转移。男66例, 女67例, 年龄30~83岁。55例因咳嗽咳痰、胸痛等症状就诊入院。术前均经多层螺旋CT扫描检查, 肿瘤最大径0.4~3.0 cm。病灶位于左肺63例(左上肺39例, 左下肺24例);右肺70例
(右上肺38例, 右中肺12例, 右下肺20例)。
1. 2 方法 患者在双腔气管插管全身麻醉下行标准肺叶切除术+淋巴结清扫术, 101例为胸腔镜下手术, 32例为开胸手术。淋巴结清扫的分组参照国际肺癌研究协会肺癌淋巴结分布图谱。比较不同临床病理特征患者淋巴结转移情况。
1. 3 统计学方法 采用SPSS18.0统计学软件进行统计分析。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 病理特征 病理巨检77例肿瘤直径≤2 cm, CT与其符合率为93.5%(72/77)。腺癌103例, 鳞癌16例, 腺鳞癌4例, 小细胞癌7例, 复合性小细胞癌1例, 大细胞癌1例, 类癌1例。高分化癌27例, 中分化癌66例, 低分化癌40例。
2. 2 淋巴结转移 133例手术共清扫淋巴结1022枚, 平均每例7.68枚。155枚淋巴结存在癌转移, 转移率15.2%。其中, 第1组淋巴结癌转移率为0(0/5), 第2组为10.5%(6/57), 第3组为7.7%(1/13), 第4组为31.0%(26/84), 第5组为10.9%(6/55), 第6组为21.4%(3/14), 第7组为17.5%(42/240), 第8组为10.0%(1/10), 第9组为0(0/52), 第10组为13.6%(32/236), 第11组为14.6%(7/48), 第12组为23.1%(6/26)。第4、12、6、7、10、11组淋巴结癌转移率相对较高。有癌转移的淋巴结来自于35例患者, 占总例数的26.3%(35/133)。TMN分期0期(TisN0M0)5例, ⅠA期(T1aN0M0, T1bN0M0)93例, ⅡA期(T1aN1M0, T1bN1M0)9例, ⅢA期(T1N2M0)26例。
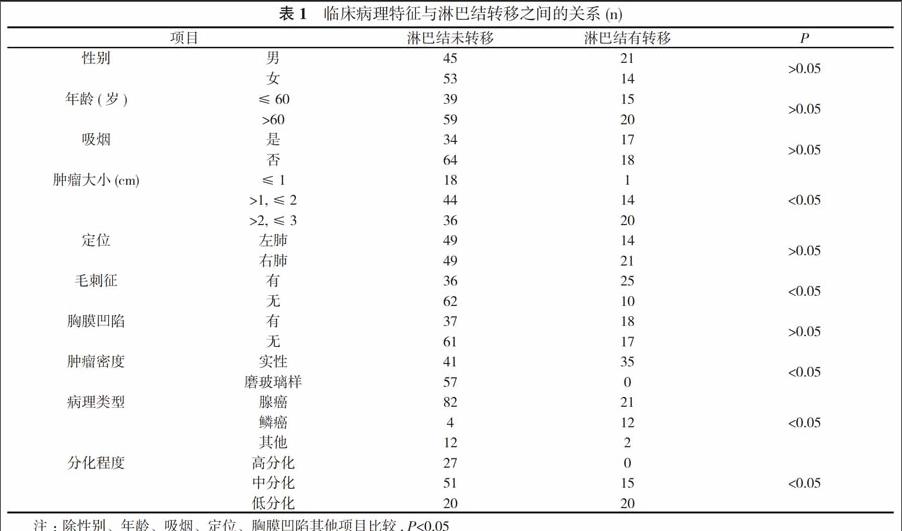
2. 3 临床病理特征与淋巴结转移的关系 肿瘤直径≤1 cm共19例, 仅1例发生淋巴结转移, 转移率5.3%, 明显低于其他两种直径的24.1%、35.7%(P<0.05)。CT影像有毛刺征共61例, 淋巴结转移率为41.0%, 明显高于无毛刺征者的13.9%(P<0.05)。肿瘤为实性者共76例, 转移率46.1%, 明显高于磨玻璃样组的0(P<0.05)。高分化及中分化组淋巴结转移率为0、22.7%, 显著低于低分化组的50.0%(P<0.05)。鳞癌淋巴结转移率为75.0%, 高于腺癌的20.4%及其他类型肺癌的14.3%(P<0.05)。其他项目比较差异无统计学意义(P>0.05)。见表1。
3 讨论
早期外周型肺癌预后较好, ⅠA期肺癌的5年生存率>80%。且肺癌的不同病理类型预示着不同的预后。因此肺癌的早期诊断、准确分型等对提高肺癌患者的生存率尤为重要。
目前对于T1期肺癌, 肺叶切除及系统性淋巴结清扫依然是标准术式。能否在不影响患者生存率的情况下尽可能减小手术范围、减少淋巴结的清扫, 有重要研究价值。有学者认为肺楔形切效果较差[3]。然而Sugi等[4]认为肺楔形切及肺叶切无显著性差异。Darling等[5]研究显示行系统性淋巴结清扫和淋巴结采样的中位生存时间无明显差异。因此, 对于Ⅰ期的患者, 可尽量减少手术范围。然而影像学直径≤3 cm的T1期肺癌, 有多少是属于临床Ⅰ期, 临床Ⅰ期的小肺癌有何特点, 尚无系统性研究。
本研究共入组133例病例, 处于0期及ⅠA期共98例, 其余35例有不同程度淋巴结转移, 为ⅡA期及ⅢA期, 占总例数的26.3%。因此, 并非所有T1期外周型肺癌都是临床I期, 这一点应引起临床医生的足够重视。
作者按病灶大小对病例进行分组研究, 结果提示19例肿瘤直径≤1cm的病例中仅有1例发生淋巴结转移, 转移率5.3%, 明显低于其他两类。谢远财等[6]也对直径≤3 cm的周围型肺癌淋巴结转移规律进行研究, 发现肿瘤直径处于0~1 cm、1~2 cm和2~3 cm时, 其N2组淋巴结转移率分别为0、10.5%和29.7%, 差异有统计学意义(P<0.05)。Baba等[7]对58例直径<1 cm及203例直径1.1~2.0 cm的非小细胞肺癌进行对比研究, 发现前者5年生存率显著高于后者(P<0.05)。这些研究结果与本结果一致, 提示病灶大小与淋巴结转移关系密切, 术前可参考CT影像中的病灶大小考虑是否进行系统性淋巴结清扫。
除了病灶的大小, 其他特征也与淋巴结转移有联系, 如肿块的密度及毛刺征等。Matsuguma等[8]对383例直径≤3 cm、磨玻璃样改变的非小细胞肺癌进行回顾性研究, 发现在占位病变直径相似时, 患者CT表现磨玻璃改变成分>50%组的肿瘤侵袭纵膈淋巴结、肺门淋巴结、胸膜及周围血管的几率, 以及手术后复发率明显低于磨玻璃改变成分<50%组。其他研究也认为CT上磨玻璃成分高的患者不易出现淋巴结及周围组织的转移, 预后较好[9]。在本研究结果中, 病灶主要成分为磨玻璃结节的患者共57例, 均未发生淋巴结或其他部位的转移, 远远低于以实性成分为主者(35/76)。同时, CT显示有毛刺征者61例, 有25例可检测到淋巴结转移, 而边缘光滑的病例72例, 仅有10例出现淋巴结转移。提示影像学的形态特征是预测淋巴结转移的较好指标。有研究发现肺腺癌比鳞癌更容易发生淋巴结转移[10], 而本组研究中鳞癌转移率高于腺癌, 分析原因可能与入组鳞癌病例较少有关。
综上所述, 术前通过影像学可对原发肿瘤进行准确的 T 分期 , 而无法对淋巴结有无转移进行准确判断 , 作者通过对T1期肺癌切除标本进行回顾性分析, 发现肿瘤直径≤1 cm, CT提示病灶磨玻璃结节, 病灶无毛刺征的患者, 淋巴结转移率极低, 可为今后小肺癌是否选择清扫淋巴结提供有用的线索。
参考文献
[1] Patz EF Jr, Goodman PC, Bepler G. Screening for lung cancer. New England Journal of Medicine, 2000, 343(22):1627-1633.
[2] Travis WD, Brambilla E, Burke AP, et al. Introduction to The 2015 World Health Organization Classification of Tumors of the Lung, Pleura, Thymus, and Heart. Journal of Thoracic Oncology Official Publication of the International Association for the Study of Lung Cancer, 2015, 10(9):1240-1242.
[3] Nakamura H, Taniguchi Y, Miwa K, et al. Comparison of the surgical outcomes of thoracoscopic lobectomy, segmentectomy, and wedge resection for clinical stage I non-small cell lung cancer. Thoracic & Cardiovascular Surgeon, 2011, 59(3):137-141.
[4] Sugi K, Ssudou K. Long-term prognosis of video-assisted limited surgery for early lung cancer. European journal of cardio-thoracic surgery, 2010, 37(2):456-460.
[5] Darling GE, Allen MS, Docker PA, et al. Randomized trial of mediastinal lymph node samping versus complete lymphademectomy during pulmonary resection in the patient with N0 or N1(less than hilar) non-small cell carcinoma: Results of the American College of Surgery Oncology Group Z0030 Trial. J Thorac Cardiovasc Surg, 2011, 141(3):662-670.
[6] 谢远财, 李运, 刘彦国, 等. 直径≤3 cm的周围型非小细胞肺癌纵隔淋巴结转移规律的初步研究. 中国微创外科杂志, 2010, 10(7):577-580.
[7] Baba T, Uramoto H, Kuwata T, et al. A study of surgically resected peripheral non-small cell lung cancer with a tumor diameter of 1.0 cm or less. Scand J Surg, 2011, 100(3):153-158.
[8] Matsuguma H, Oki I, Nakahara R, et al. Comparison of three measurements on computed tomography for the prediction of less invasiveness in patients with clinical stage I non-small cell lung cancer. Ann Thorac Surg, 2013, 95(6):1878-1884.
[9] Heuvelmans MA, Oudkerk M. Management of subsolid pulmonary nodules in CT lung cancer screening. J Thorac Dis, 2015, 7(7):1103-1106.
[10] Watanabe S, Oda M, Tsunezuka Y, et al. Peripheral small-sized (2 cm or less) non-small cell lung cancer with mediastinal lymph node metastasis; clinicopathologic features and patterns of nodal spread. Eur J Cardiothorac Surg, 2002, 22(6):995-999.
[收稿日期:2016-07-11]

