姜黄素调控miR-134对癫痫海马突触重塑的实验研究
徐春强 林青 刘素芝
癫痫持续状态(status epilepticus,SE)是神经内科常见的急危重症,癫痫反复发作可造成脑组织和脑功能严重损害,其中苔藓纤维出芽[1]和突触重塑是最普遍的病理学改变。miRNA 是一种具有转录后水平调控作用的保守的内源性非编码RNA,在神经系统中的表达丰富[2]。miR-134 作为特异性表达于神经系统的miRNA,与树突棘形态改变、突触的重塑和突触蛋白合成关系密切[3]。SE 小鼠海马组织中miR-134 表达水平明显上调,抑制miR-134 表达后,可明显控制癫痫发作,发挥明显的抗癫痫发作以及神经保护作用[4-5]。姜黄素是来源于植物根茎的多酚化合物,具有抗炎、抗肿瘤、抗氧化、清除自由基、调节免疫、保护神经系统等药理作用[6-9],且这些作用的机制与姜黄素调控miRNA 表达密切相关[10-12]。大量研究均提示姜黄素在多种癫痫动物模型中有明确的神经保护及潜在的抗癫痫作用,但其作用机制复杂多样且未完全阐明,miRNA 可能是姜黄素治疗癫痫的一个重要靶点[13-15]。本实验主要研究姜黄素治疗SE 大鼠后其miR-134 及靶蛋白LIM 激酶1(LIM kinase 1,LIMK1)表达规律及海马突触重塑情况,探讨姜黄素通过调控miR-134 发挥神经保护及潜在抗癫痫作用的机制,为姜黄素的临床应用提供新的理论方向。
1 材料和方法
1.1 实验动物 清洁级SD 雄性大鼠48 只,6~8 周龄,体重180~220 g,由浙江省医学科学院提供,实验动物使用许可证号:SYXK(浙)2019-0030。所有大鼠适应性饲养1 周后开始实验。动物实验均经台州恩泽医疗中心(集团)实验动物伦理委员会审查通过(批准文号:TZY-2022153)。
1.2 主要试剂 氯化锂(粉剂,批号:310468)、匹罗卡品(粉剂,批号:P6503)和姜黄素(粉剂,批号:MKCD2451)均购自美国Sigma 公司;溴化甲基阿托品(批号:H41021257)购自天津药业集团;Timm 染色液配制相关试剂、miR-134 引物和U6 引物均购自上海生工公司;Trizol 试剂(批号:G3013-100ML)、qRT-PCR 试剂盒(批号:G3330-50)均购自武汉赛维尔生物公司;反转录试剂盒(批号:K1622)购自美国Biomiga 公司;兔抗LIMK1 多克隆抗体(批号:PB0756)购自武汉博士德公司;辣根过氧化酶标记的羊抗兔二抗以及蛋白免疫印迹相关试剂购自江苏碧云天生物技术研究所。
1.3 动物分组及模型建立 按照随机数字表法将大鼠分为对照组、癫痫组和姜黄素组3 组,每组16 只。姜黄素组:腹腔注射氯化锂(125 mg/kg,2.5 g 溶于20 mL 0.9%氯化钠注射液中,1 mL/kg),18~20 h 后腹腔注射溴化甲基阿托品(10 mg/kg,300 mg 溶于30 mL 0.9%氯化钠注射液中,1 mL/kg),30 min 后腹腔注射匹罗卡品(20 mg/kg,400 mg 溶于20 mL 0.9%氯化钠注射液中,1 mL/kg),10~30 min 后大鼠出现反复强直阵挛发作并最终形成SE(根据Racine 分级标准,4 级以上发作即认为处于SE),建立大鼠SE 模型,进行行为学观察,持续1 h 后腹腔注射溴化甲基阿托品1 mL/kg 和10%水合氯醛3 mL/kg 终止发作。第2 天开始每天固定时间腹腔注射姜黄素[100 mg/kg,0.5 g 溶于10 mL 二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,2 mL/kg],持续给药10 d。癫痫组:建模及终止发作方法同上,第2天开始每天固定时间腹腔注射DMSO 溶液(2 mL/kg),持续给药10 d。对照组:腹腔注射0.9%氯化钠注射液(1 mL/kg),18~20 h 后腹腔注射0.9%氯化钠注射液(1 mL/kg),30 min 后腹腔注射0.9%氯化钠注射液(1 mL/kg),1 h 后分别予腹腔注射0.9%氯化钠注射液(1 mL/kg)和0.9%氯化钠注射液(3 mL/kg);第2 天开始每天固定时间腹腔注射DMSO 溶液(2 mL/kg),持续给药10 d。每日观察大鼠活动情况。在造模后第14 天,通过颈椎脱臼法处死3 组大鼠,每组随机各取10 只制备冰冻海马组织切片用于Timm 染色,每组剩余6 只留取海马组织及血清用于qRT-PCR 及Western blot 检测。
1.4 大鼠海马组织苔藓纤维出芽程度检测 采用Timm 染色。将大鼠海马组织切片染色前通风橱内过夜晾干,把新鲜配制的Timm 染色液倒入染色盒中,放入切片,在26 ℃恒温摇床中孵育60~120 min,避光环境下孵育60~120 min,蒸馏水中冲洗15 min,常规脱水、透明及封片。光镜下进行齿状回及CA3 区苔藓纤维出芽评分。(1)齿状回颗粒细胞上层评分标准如下:0 分,嵴和尖端间无颗粒;1 分,偶见散在的棕黄色或棕褐色斑片状颗粒;2 分,较多的棕黄色或棕褐色斑片状颗粒;3 分,接近几乎连续分布的棕黄或棕褐色颗粒;4分,连续或几乎连续分布的高密度棕黄色或棕褐色颗粒;5 分,嵴到尖端连续分布的高密度棕黄色或棕褐色颗粒。(2)CA3 区锥体细胞层或始层评分标准如下:0分,锥体细胞层及始层无明显颗粒分布;1 分,偶见稀疏的散在棕黄色或棕褐色颗粒;2 分,偶见至中等数量的棕黄色或棕褐色颗粒;3 分,明显的棕黄色或棕褐色颗粒分布;4 分,可见明显棕黄色或棕褐色颗粒,接近于沿整个CA3 区连续分布;5 分,浓密的棕黄色或棕褐色颗粒沿整个CA3 连续分布[16]。
1.5 大鼠海马组织及血清中miR-134 表达水平检测 采用qRT-PCR 法。使用Trizol 试剂从3 组大鼠海马组织及血清中分别提取总RNA,反转录合成cDNA,然后进行PCR 扩增,以U6 为内参;miR-134 的引物序列:上游引物5'-CCGCGTGTGACTGGTTGACCA-3',下游引物5'-ATCCAGTGCAGGGTCCGAGG-3';U6 的引物序列:上游引物5'-CTCGCTTCGGCAGCACA-3',下游引物5'-AACGCTTCACGAATTTGCGT-3'。反应体系:SYBR Green I Master 10.0 μL,上游引物1.0 μL,下游引物1.0 μL,DNA 模板2.0 μL,RNase-Free H2O 8.5 μL。反应条件:95 ℃预变性10 min,95 ℃15 s、60 ℃1 min,40 个循环。qRT-PCR 反应根据反转录试剂盒说明书进行,每组均设置3 个复孔,实验重复3 次。采用2-ΔΔCt法计算miR-134 相对表达水平。
1.6 大鼠海马组织中LIMK1 蛋白表达水平检测 采用Western blot 法。从-80 ℃冰箱取出部分海马组织匀浆后,4 ℃、13 000 r/min 离心5 min,取上清液。然后用BCA 法检测上清液中蛋白质的浓度,将上清液与5×SDS 样品缓冲液混合,在沸水浴中加热5 min,使蛋白变性;之后将变性蛋白进行聚丙烯酰胺凝胶电泳,转移到聚偏二氟乙烯膜上,与LIMK1 一抗(1∶1 000)在4 ℃孵育过夜。用TBST 冲洗膜3 次,10 min/次,室温下在辣根过氧化物酶标记的二抗(1∶5 000)中孵育1 h。TBST 洗涤后在暗室中曝光显影,使用Quantity One 凝胶分析软件测定蛋白条带灰度值,以目的蛋白条带与β-肌动蛋白(β-actin)条带的灰度值比值表示目的蛋白表达水平。实验重复3 次。
1.7 统计学处理 采用SPSS 22.0 统计软件。符合正态分布的计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t检验;不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,两两比较采用Nemenyi 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组大鼠海马组织苔藓纤维出芽程度评分比较对照组大鼠海马组织苔藓纤维出芽不明显,齿状回颗粒细胞上层及CA3 区锥体细胞层及始层偶见或未见少许苔藓纤维染色颗粒。癫痫组大鼠CA3 区苔藓纤维出芽明显,染色纤维形成致密浓染条带,齿状回苔藓纤维出芽亦存在。姜黄素组大鼠CA3 区苔藓纤维出芽程度较癫痫组减轻,染色颗粒浓密程度减轻,偶见散在的棕黄色或棕褐色斑片状颗粒;齿状回的苔藓纤维出芽程度亦较癫痫组减轻,见图1(插页)。与对照组比较,癫痫组大鼠齿状回和CA3 区苔藓纤维出芽程度评分均升高,差异均有统计学意义(均P<0.05)。与癫痫组比较,姜黄素组大鼠齿状回和CA3 区苔藓纤维出芽程度评分均降低,差异均有统计学意义(均P<0.05),见表1。

图1 3 组大鼠海马组织病理学Timm 染色图
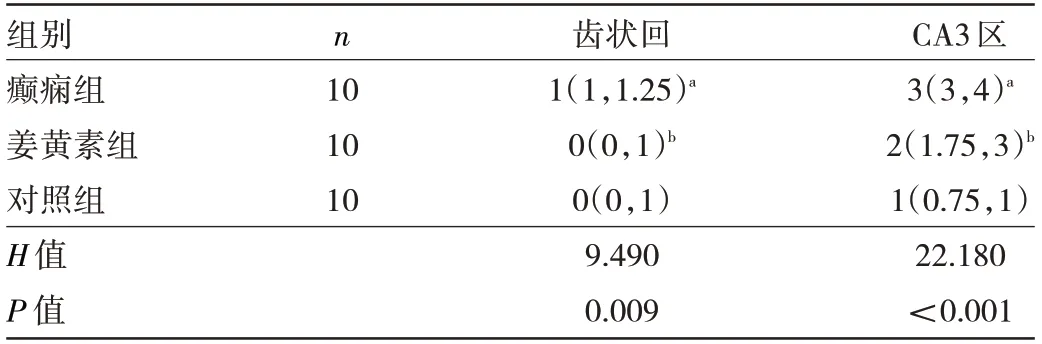
表1 3 组大鼠海马苔藓纤维出芽程度评分(分)
2.2 3 组大鼠海马组织中miR-134 表达水平比较 与对照组比较,癫痫组大鼠海马组织中miR-134 表达水平升高,差异有统计学意义(P<0.05);与癫痫组比较,姜黄素组大鼠海马组织中miR-134 水平下降,差异有统计学意义(P<0.05),见图2。
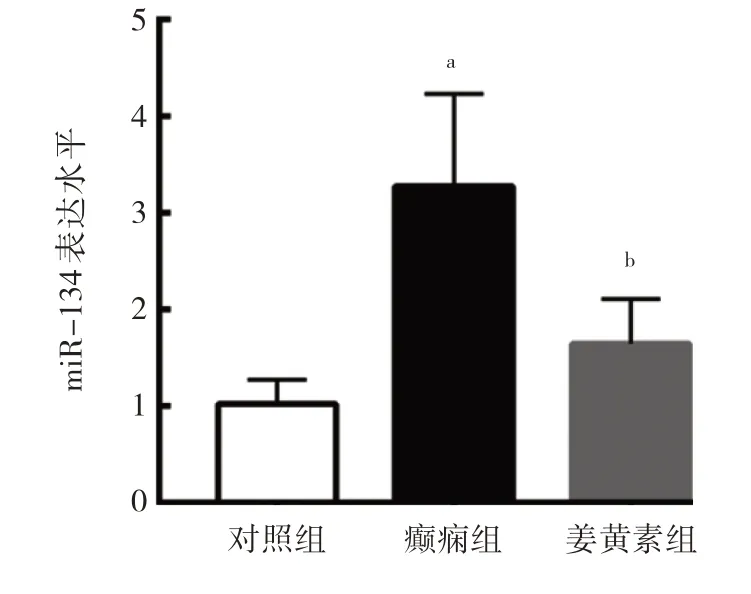
图2 3 组大鼠海马组织中miR-134 表达水平比较
2.3 3 组大鼠血清中miR-134 表达水平比较 与对照组比较,癫痫组和姜黄素组大鼠血清中miR-134 表达水平均下降,差异均有统计学意义(均P<0.05);癫痫组和姜黄素组大鼠血清中miR-134 表达水平比较,差异无统计学意义(P>0.05),见图3。
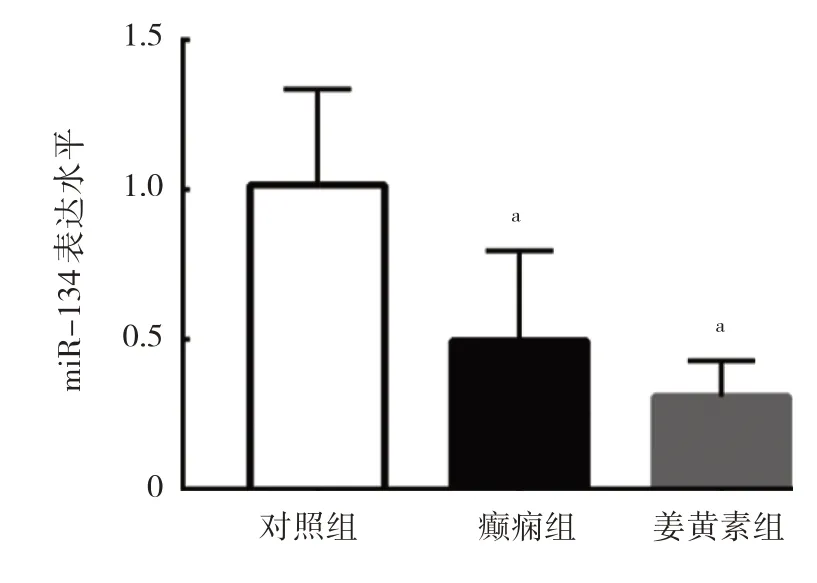
图3 3 组大鼠血清中miR-134 表达水平比较
2.4 3 组大鼠海马组织中LIMK1 蛋白表达水平比较与对照组比较,癫痫组大鼠海马组织中LIMK1 蛋白表达水平下降,差异有统计学意义(P<0.05);与癫痫组比较,姜黄素组大鼠海马组织中LIMK1 蛋白表达水平升高,差异有统计学意义(P<0.05),见图4。

图4 3 组大鼠海马组织中LIMK1 蛋白表达水平比较(A:电泳图;B:柱状图,与对照组比较,aP<0.05;与癫痫组比较,bP<0.05)
3 讨论
SE 是神经内科较常见的急症,如何有效治疗SE是目前亟待解决的难题。苔藓纤维出芽越过齿状回颗粒细胞层进入内分子层,大多在此与颗粒细胞的树突棘形成单突触联系,这些异位突触引起的突触重塑导致海马内回返性的兴奋性环路形成,并以正反馈的形式出现,最终导致癫痫长期自发性反复发作[1,17]。以苔藓纤维出芽为主要形式的突触重塑及异常神经环路形成可能与癫痫发作互为因果,形成恶性循环导致癫痫发作。miRNA 是内源性非编码RNA,在中枢神经系统中表达丰富,抑制或者降解目标mRNA,进而抑制靶蛋白的翻译,最终产生基因调控作用[18]。研究显示miRNA 在神经元的增殖、分化、迁移,树突棘的形成和成熟,轴突引导,突触可塑性调节等方面参与神经系统的结构和功能改变[19]。因此,通过靶向调控miRNA及其通路可能成为新的治疗靶点。
miR-134 是定位于树突的大脑特异性miRNA,在神经元增殖、分化、凋亡及神经元微观结构改变中起重要作用。有研究发现miR-134 在大鼠海马神经元中高表达,通过LIMK1 对树突棘大小起负向调节作用[3]。小鼠模型中miR-134 特异性拮抗剂增大树突棘体积,减轻癫痫发作程度,产生神经保护作用[5]。随后在其他动物模型及癫痫患者中也检测到miR-134 水平的上调[20]。在无镁细胞外液诱导癫痫细胞模型中miR-134 表达升高,miR-134 抑制剂预处理后可以减轻神经元高兴奋性,神经元树突棘密度减少[21]。上述实验表明抑制miR-134,能够减轻SE 发作程度,降低发作频率,具有神经保护作用。本研究发现氯化锂-匹罗卡品诱导制备的SE 大鼠模型中,大鼠海马组织中miR-134 水平升高,靶蛋白LIMK1 水平下降,这与多数研究结果相符。但本实验也存在不足之处:未进行树突棘形态学观察,无法直接证明miR-134 是否通过LIMK1 影响树突棘的大小、密度等结构及功能改变;未行miR-134 特异性拮抗来证明其与下游靶点之间的直接关系,需后续实验探究。
综上所述,姜黄素治疗可抑制大鼠SE 后海马组织中miR-134 表达,上调LIMK1 蛋白表达水平,影响突触重塑,可能因而发挥神经保护及潜在的抗癫痫作用。

