雷酚内酯通过NF-κB 途径逆转肺气管上皮细胞上皮间充质转化进程的研究
岑梦姣 翁鹏程
哮喘是一种高发病率的慢性病,主要症状为气喘、胸闷等。预计到2025 年,哮喘患者将达到4 亿人[1]。气道重塑是慢性哮喘最典型的病变,其特征是上皮间充质转化(epithelial-mesenchymal transition,EMT)[2]。转化生长因子β(transforming growth factor-β,TGF-β)是上皮纤维化的主要介质,在哮喘性支气管组织中上调,并引发哮喘气道上皮损伤和EMT 诱导的气道纤维化[3]。而TNF-α 的存在会破坏抗炎平衡并加重哮喘进展[4]。转录因子NF-κB 在过敏性哮喘中被持续激活,抑制NF-κB 可显著缓解卵清蛋白诱导的哮喘[5]。目前已有许多研究将NF-κB 通路作为哮喘气道性炎症的关键治疗靶点,如郑岩等[6]发现溴结构域蛋白4 可介导NF-κB/RelA 通路调控EMT 参与哮喘气道重塑。另外,Huang 等[7]通过气道平滑肌细胞证明TGF-β 能够激活NF-κB p65(p65)及其磷酸化水平,并促进细胞迁移及EMT。根据以上研究结果,推测NFκB 在哮喘疾病气道重塑过程中可能起到关键作用。
雷酚内酯是从雷公藤中分离得到的二萜类成分,具有较强的免疫抑制活性。已有研究报道雷酚内酯能够缓解大鼠肾间质纤维化并抑制炎症因子的释放[8]。这与哮喘疾病的治疗机制不谋而合。因此,本研究利用TGF-β 及TNF-α 联合诱导人支气管肺上皮细胞气道重塑模型,观察雷酚内酯的治疗效果,同时探讨雷酚内酯对NF-κB 通路及EMT 的调控作用,为治疗哮喘早期的气道重塑提供实验依据。
1 材料和方法
1.1 细胞、试剂和仪器 人支气管肺上皮细胞系Beas-2b 购自浙江如耀生物科技有限公司。10% FBS(批号:10099-141)、DMEM 培养基(批号:12491015)均购自美国Gibco 公司;雷酚内酯(5 mg 粉剂装,Cas 号:74285-86-2,纯度:98%,溶解于二甲基亚砜)、TGF-β1试剂盒(批号:H980365)均购自上海麦克林试剂有限公司;TNF-α 试剂盒(批号:SEKH-0047)购自北京索莱宝有限公司;1st Strand cDNA Synthesis Kit gDNA Purge 试剂盒(批号:E042)、SYBR qPCR SuperMix Plus试剂盒(批号:E096)均购自苏州近岸蛋白质科技股份有限公司;细胞计数试剂盒8(cell counting kit-8,CCK-8)(批号:CK04)购自日本Dojindo 公司;兔抗人α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)(批号:ab124964)、E-钙黏蛋白(E-cadherin,批号:ab40772)、波形蛋白(Vimentin,批号:ab92547)、p65(批号:ab32536)、磷酸化p65(phosphorylated- p65,p-p65)(批号:ab76302)、Twist 家族BHLH 转录因子1(twist family BHLH transcription factor 1,TWIST1)(批号:ab50581)、锌指E-Box 绑定同源盒1(zinc finger E-box binding homeobox 1,ZEB1)(批号:ab203829)、Snail 家族锌指1(snail family zinc finger 1,SNAI1)(批号:ab180714)、山羊抗兔IgG-HRP 二抗(批号:ab6721)及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(批号:ab181602)抗体均购自美国Abcam 生物公司;化学发光底物试剂盒(批号:SB-WB001)购自上海圣尔生物;倒置荧光显微镜(型号:CKX53)购自日本Olympus 公司;相差显微镜(型号:DMIL LED)和荧光正置显微镜(型号:DM500)均购自德国Leica 公司;实时荧光定量PCR 仪(型号:7500F)购自美国ABI公司;多功能酶标仪(型号:Varioskan LUX)购自美国Thermo 公司;蛋白成像仪(型号:ChemiDoc-It Imaging System)购自美国UVP 公司。
1.2 细胞培养和处理 Beas-2b 细胞接种于含10% FBS 的DMEM 培养基中,置于37 ℃、5% CO2恒温培养箱中培养。分别用10 ng/mL TGF-β1和10 ng/mL TNF-α处理Beas-2b 细胞进行模型诱导[9]。
1.3 细胞活性检测 采用CCK-8 法。将Beas-2b 细胞以3 000 细胞/孔的密度接种到96 孔板中,贴壁24 h后,分别给予终浓度为0、0.5、1、10、20、30、40 μmol/L的雷酚内酯处理细胞,每个浓度5 个复孔。48 h 后每孔加入10 μL CCK-8 溶液,37 ℃避光孵育2 h。使用多功能酶标仪测定450 nm 波长处的吸光度(optical density,OD)值。细胞活性(%)=(OD加药-OD空白)/(OD零加药-OD空白)×100%。根据雷酚内酯对Beas-2b 的活性影响,选择1 和10 μmol/L 雷酚内酯作为后续细胞实验的药物处理浓度。
1.4 细胞分组 将Beas-2b 细胞分为对照组、模型组、1 μmol/L 雷酚内酯组和10 μmol/L 雷酚内酯组4 组。对照组:Beas-2b 细胞不作任何处理;模型组:Beas-2b 细胞给予10 ng/mL TGF-β1 联合10 ng/mL TNF-α 处理48 h;1 和10 μmol/L 雷酚内酯组:Beas-2b 细胞在模型组基础上,再分别添加终浓度为1、10 μmol/L 雷酚内酯共孵育48 h,然后使用相差显微镜观察各组细胞形态变化。
1.5 细胞迁移能力检测 采用细胞划痕实验。将Beas-2b细胞以1×106个接种在6 cm 培养皿中,待细胞长满后,在细胞培养皿中按照直线采用200 μL的枪头进行细胞划痕,枪头经过的部位细胞被去除,按照上述实验分组进行细胞处理。在培养皿盖上标记3 个点,并在0 和48 h后通过相差显微镜观察标记部位细胞迁移距离。
1.6 EMT 相关蛋白α-SMA、E-cadherin、Vimentin 荧光强度检测 采用免疫荧光实验。将Beas-2b 细胞接种到6 孔板中,完全贴壁后按照实验分组进行处理。用4%多聚甲醛在室温下固定细胞15 min。然后,将细胞在0.5% Triton X-100 中孵育10 min。再用1% BSA 封闭30 min。然后使用兔抗人α-SMA、E-cadherin 及Vimentin抗体在4 ℃下孵育过夜。第2天将细胞与FITC标记的山羊抗兔二抗在黑暗中孵育1 h,再使用0.1 μg/mL DAPI 孵育细胞10 min。在荧光显微镜下拍摄细胞荧光图,曝光时长控制在35 ms。通过Image Pro Plus 6.0 软件对细胞荧光图荧光强度进行量化统计。
1.7 EMT相关基因α-SMA、E-cadherin、Vimentin mRNA表达水平检测 采用RT-PCR 法。通过Trizol 法提取细胞总RNA 后,使用1st Strand cDNA Synthesis Kit gDNA Purge 试剂盒将2 μg mRNA 反转录成cDNA。RT-PCR 采用SYBR qPCR SuperMix Plus 试剂盒构建体系,并在实时荧光定量PCR 仪运行程序,反应条件如下:95 ℃变性2 min;95 ℃变性10 s,60 ℃退火10 s,共40 个循环;72 ℃延伸30 s。以GAPDH 为内参,使用2-ΔΔCt法计算目的基因相对表达量。扩增引物通过NCBI 在线网站设计,引物序列见表1。

表1 RT-PCR 引物序列(5'-3')
1.8 EMT 相关蛋白α-SMA、E-cadherin、Vimentin 及EMT 相关转录因子p65、p-p65、TWIST1、ZEB1、SNAI1蛋白表达水平检测 采用Western blot 法。收集细胞用PBS 洗涤3 次,然后用含有1%蛋白酶抑制剂混合物的100 μL RIPA 裂解液在冰上裂解30 min。13 000 r/min离心20 min 后,收集上清液,用BCA 检测试剂盒检测每个样品的蛋白质浓度。5 μg 变性蛋白质在SDSPAGE 凝胶中电泳,然后转移到聚偏二氟乙烯膜上。在室温下用5%脱脂牛奶封闭1 h 后,将膜与一抗α-SMA、E-cadherin、Vimentin、p65、p-p65、TWIST1、ZEB1、SNAI1 及GAPDH 抗体在4 ℃孵育过夜。用TBST 清洗3 次后再与山羊抗兔IgG-HRP 二抗在室温下孵育1 h。再用TBST 清洗3 次后,使用化学发光底物试剂盒和蛋白成像仪对蛋白条带进行显影和曝光拍摄。使用Image J 软件计算各个条带的光密度值。
1.9 统计学处理 采用GraphPad Prism 8.0 统计软件。所有实验均重复3 次。符合正态分布的计量资料以表示,方差齐时,组间比较采用单因素方差分析,两两比较采用Tukey 检验;方差不齐时,组间比较采用Welch 方差分析,两两比较采用t'检验。P<0.05 为差异有统计学意义。
2 结果
2.1 雷酚内酯对细胞活性的影响 与0 μmol/L 雷酚内酯组比较,1 和10 μmol/L 雷酚内酯处理后,细胞活性均提高(均P<0.05),而20 μmol/L 以上浓度雷酚内酯处理后,细胞活性呈现下降趋势,且在30 和40 μmol/L时候细胞活性明显抑制(均P<0.05),见表2。因此,使用1和10 μmol/L雷酚内酯作为后续实验主要浓度。

表2 不同浓度雷酚内酯对Beas-2b 细胞活性的影响(%)
2.2 雷酚内酯对细胞形态学的影响 在相差显微镜观察下,对照组细胞呈典型的上皮样细胞形态,而其他3 组细胞呈长梭形间充质样细胞形态,见图1。
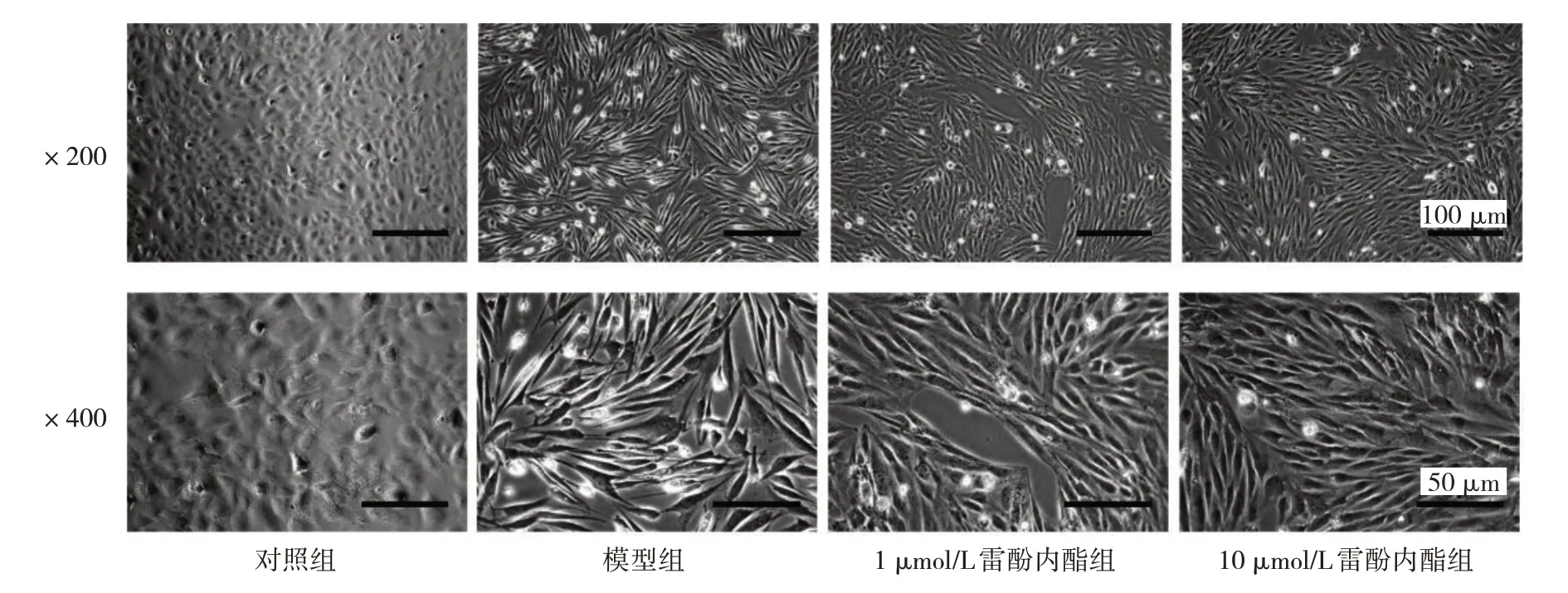
图1 雷酚内酯处理后4 组细胞形态的比较
2.3 雷酚内酯对细胞迁移能力的影响 与对照组的(128±36)μm 比较,模型组细胞迁移距离(748±65)μm 变长,差异有统计学意义(P<0.01)。与模型组比较,1 μmol/L 雷酚内酯组和10 μmol/L 雷酚内酯组细胞迁移距离[(388±42)和(366±51)μm]均变短,差异均有统计学意义(均P<0.01),见图2。

图2 雷酚内酯处理后4 组细胞迁移能力的比较
2.4 雷酚内酯对EMT 相关蛋白荧光强度的影响 与对照组比较,模型组细胞α-SMA 和Vimentin 蛋白荧光强度均上调,而E-cadherin 蛋白荧光强度下调,差异均有统计学意义(均P<0.01)。与模型组比较,1 μmol/L雷酚内酯组和10 μmol/L 雷酚内酯组α-SMA、Vimentin蛋白荧光强度均下调,而E-cadherin 蛋白荧光强度上调,差异均有统计学意义(均P<0.01),见表3 和图3(插页)。
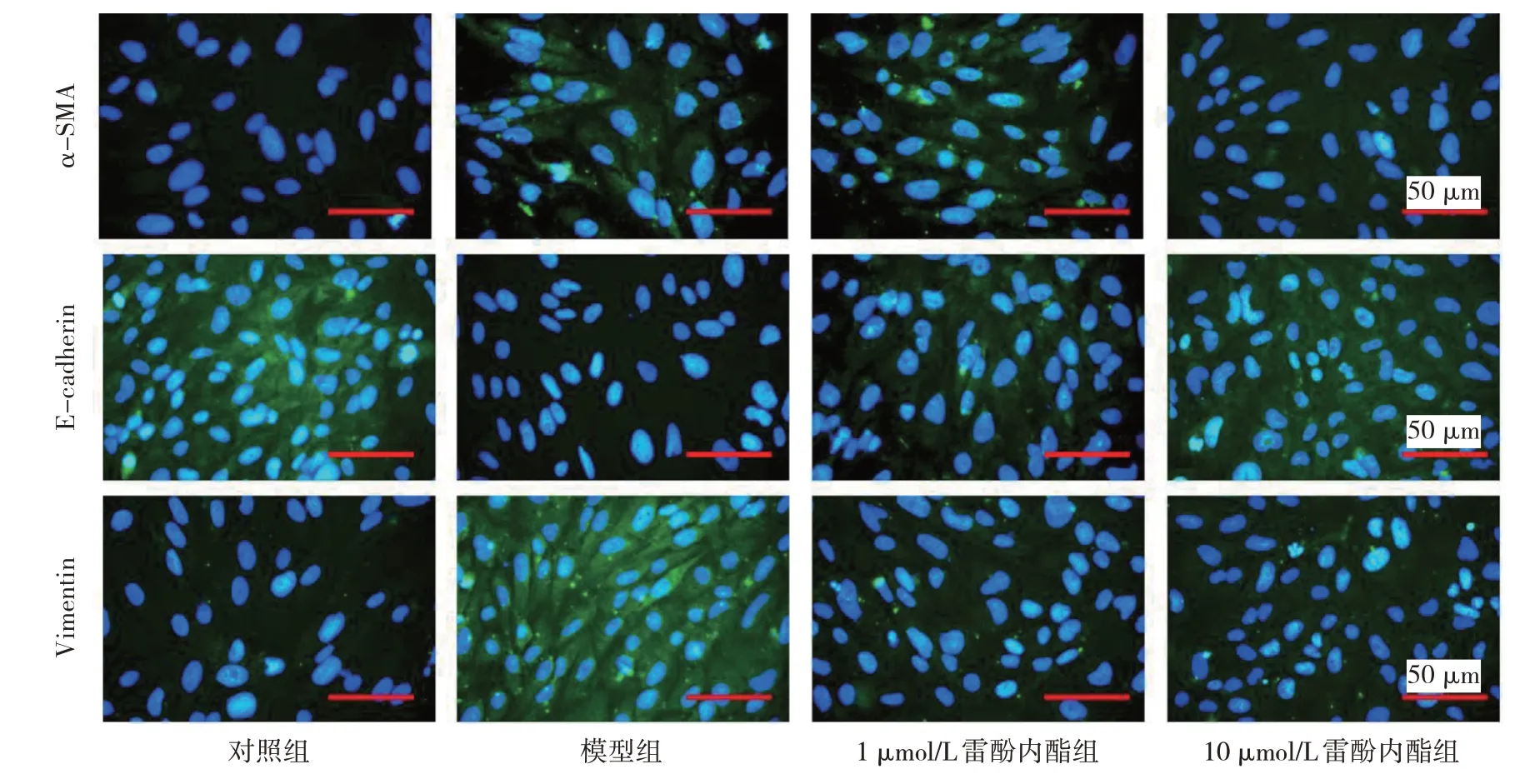
图3 雷酚内酯处理后4 组EMT 相关蛋白的免疫荧光图

表3 雷酚内酯对EMT 相关蛋白荧光强度的影响
2.5 雷酚内酯对EMT 相关基因表达水平的影响 与对照组比较,模型组细胞α-SMA 和Vimentin mRNA 表达水平均上调,而E-cadherin mRNA 表达水平下调,差异均有统计学意义(均P<0.01)。与模型组比较,1 μmol/L 雷酚内酯组和10 μmol/L 雷酚内酯组α-SMA和Vimentin mRNA 表达水平均下调,而10 μmol/L 雷酚内酯组E-cadherin mRNA 表达水平上调,差异均有统计学意义(均P<0.01),见表4。
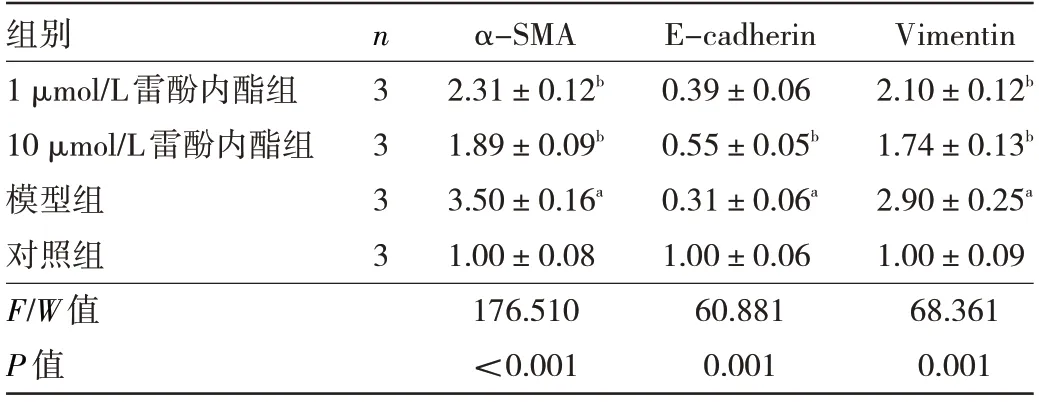
表4 雷酚内酯对EMT 相关基因表达水平的影响
2.6 雷酚内酯对EMT 相关蛋白表达水平的影响 与对照组比较,模型组细胞α-SMA 和Vimentin 蛋白表达水平均上调,而E-cadherin 蛋白表达水平下调,差异均有统计学意义(均P<0.01)。与模型组比较,1 μmol/L雷酚内酯组和10 μmol/L 雷酚内酯组α-SMA、Vimentin蛋白表达水平均下调,而E-cadherin 蛋白表达水平上调,差异均有统计学意义(均P<0.01),见表5 和图4。
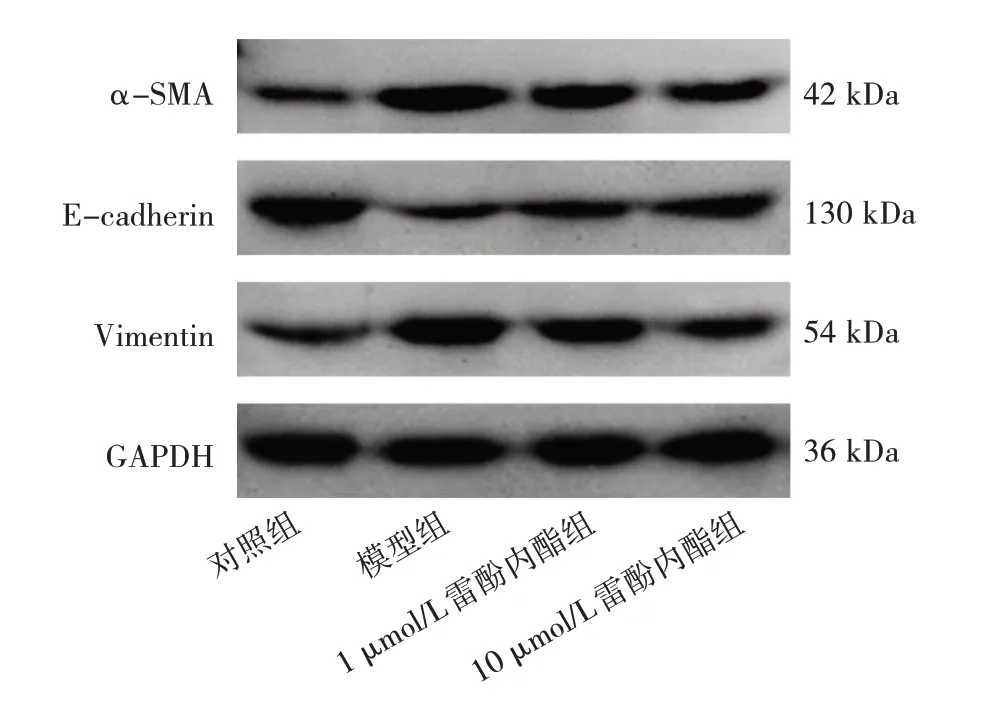
图4 雷酚内酯处理后4 组细胞EMT 相关蛋白表达的电泳图

表5 雷酚内酯对EMT 相关蛋白表达水平的影响
2.7 雷酚内酯对EMT 相关转录因子的影响 与对照组比较,模型组细胞p-p65、TWIST1、ZEB1、SNAI1 蛋白表达水平均上调,差异均有统计学意义(均P<0.01)。与模型组比较,1 μmol/L雷酚内酯组和10 μmol/L雷酚内酯组p-p65、TWIST1、ZEB1、SNAI1 蛋白表达水平均下调,差异均有统计学意义(均P<0.01),见表6和图5。

图5 雷酚内酯处理后4 组细胞EMT 相关转录因子蛋白表达的电泳图
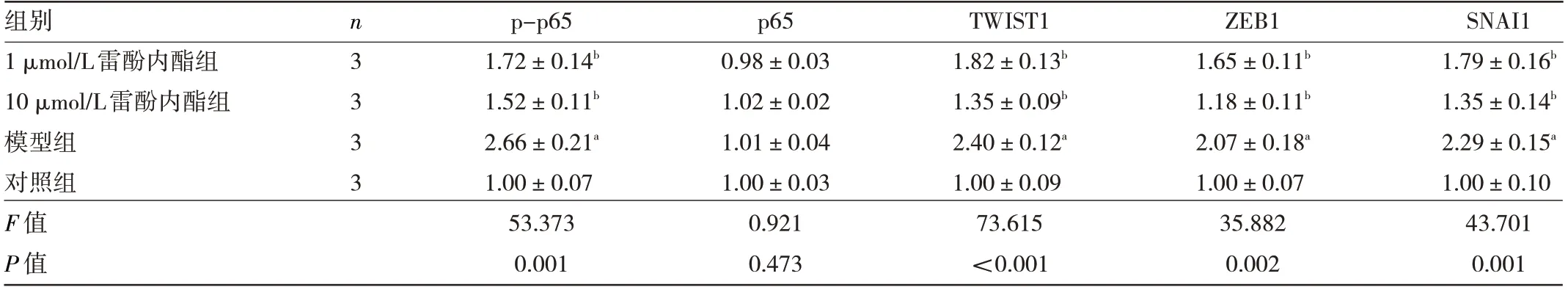
表6 雷酚内酯对EMT 相关转录因子的影响
3 讨论
哮喘是一种常见的气道炎症疾病,目前的治疗方法多是针对气道炎症和恶化,并不针对气道重塑,导致部分患者的病情仍会继续发展并出现不可逆转的气道损伤,引起气流受限、气道狭窄和气道高反应[10]。EMT 是一个与组织重塑相关的复杂过程,表现为上皮细胞丧失细胞黏附功能和细胞极性,从而获得间充质样细胞迁移和侵袭能力,在此过程中,上皮细胞的生物标志物(如E-cadherin)受到抑制,而间充质标志物(如Vimentin 和α-SMA)被上调[11]。有研究表明,气道重塑在哮喘的发病机制中发挥重要作用,而EMT 则积极参与哮喘的气道重塑,抑制EMT 过程可能减缓哮喘患者的气道重塑[12-14]。据此,本研究主要针对哮喘患者气道重塑特征进行探索性治疗,并通过细胞层面验证雷酚内酯对气道上皮细胞EMT 的抑制作用,从而探究雷酚内酯在哮喘治疗中的潜在功效。
气道重塑的典型特征是气道平滑肌层增厚,气道上皮下方基质沉积,导致上皮下纤维化,整个细胞呈现明显的长梭形间充质样形态[15]。在本研究中,通过给予气管上皮细胞TGF-β 及TNF-α 刺激后,可使得细胞发生长梭形变化,这与既往研究结果一致,提示气道重塑模型诱导成功。气道重塑的另一重要表征是细胞迁移能力增强,在哮喘与肺上皮细胞EMT 导致的气道重塑研究中,发现划痕实验中细胞的迁移距离有所增加,这是因为在EMT 过程中,E-cadherin 的下调以及Vimentin 上调,让细胞间的黏附性降低,使其获得了较高的运动能力[16-18]。本研究结果也证实了这一现象,即Beas-2b 细胞在TGF-β 和TNF-α 诱导下,EMT进程加剧,并获得较高迁移能力;但在雷酚内酯处理后,其迁移能力受到显著抑制,并且雷酚内酯浓度越高,抑制程度越强。进一步通过免疫荧光、RT-PCR 及Western blot 验证EMT 相关蛋白发现,雷酚内酯处理后Vimentin 和α-SMA 表达水平明显下调,而E-cadherin表达水平则有一定程度上调,这说明雷酚内酯可以缓解由TGF-β 及TNF-α 诱导的Beas-2b 的EMT 进程,即可能减轻哮喘患者气道重塑病理症状。而雷酚内酯对上述蛋白的调控可能是通过影响其上游的转录因子的表达实现的,但这仍需要进一步的实验验证。
NF-κB 是一类重要的核转录调控因子,能调节TNF 和多种与哮喘发病机制关系密切的促炎因子的转录和表达。Ijaz 等[19]发现NF-κB 是TGF-β 诱导上皮细胞EMT 的主要介质,TGF-β 可通过激活NF-κB,致使丝氨酸276 磷酸化,进而介导NF-κB 发生核易位。在细胞核中,NF-κB 通过与EMT 核心调节因子(包括SNAI1、Twist1 家族和ZEB1)结合并激活其表达,直接上调其基因表达水平[20]。上述转录因子被激活时能够使维持上皮状态基因的表达受到抑制,如E-cadherin基因;同时,随着α-SMA 和Vimentin 的激活,细胞则会获得部分间充质表型[21-22]。研究表明,当NF-κB 失活时,气道平滑肌细胞的迁移和增殖均会受到抑制,从而抑制气道重塑和气道炎症[23]。本研究发现,雷酚内酯对NF-κB 的磷酸化水平以及ZEB1、SNAI1 和TWIST1蛋白的表达水平具有下调作用,这与Chen 等[24]的结果类似,他们在利用从雷公藤中提取的另一种化合物雷公藤甲素,治疗卵清蛋白致敏小鼠时,发现雷公藤甲素可降低p65 的磷酸化,抑制气道内壁增厚。因此,笔者推测雷酚内酯对TGF-β 联合TNF-α 诱导的细胞EMT 抵抗作用可能是通过抑制NF-κB 来调控EMT 相关转录因子的活性实现的。
综上所述,本研究证实雷酚内酯可防止由TGF-β和TNF-α 引起的EMT 进程,但仍存在一些不足之处,例如并未在哮喘动物模型中作进一步的验证;同时,缺少较为合适的NF-κB 激动剂进行功能回复实验,因此,本课题组在下一步将考虑构建过表达NF-κB细胞系作进一步的机制探索,以弥补实验中存在的欠缺。

