IL-6 通过调控JAK2/STAT3 信号通路减轻急性肺损伤的机制研究
周斌 万少兵 王瑛 余平 典万康 周莹 周琴
急性肺损伤(acute lung injury,ALI)指由各种直接或间接因素造成肺泡上皮细胞及弥漫性毛细血管内皮损伤,临床表现为低氧血症及呼吸窘迫,严重时可导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[1]。ARDS 的发病率高达40%[2],尽管如今医疗水平不断提高,但针对ARDS 的有效治疗手段仍然十分缺乏。因此,探究ALI/ARDS 的发病机制和治疗手段是肺部疾病的研究热点之一。ALI 发病时肺部发生过度炎症反应,炎性因子被大量分泌,与效应细胞相互作用,使肺部促炎与抗炎失衡,导致ALI 的持续发展[3]。IL-6 在免疫、炎症、造血、肿瘤等方面具有重要作用,其通过酪氨酸蛋白激酶2(janus kinase 2,JAK2)/信号传导与转录激活因子(signal transducer and activator of transcription,STAT)3 信号通路转导细胞信号[4]。近年来,JAK2/STAT3 信号通路被报道参与多种疾病过程,且与呼吸系统疾病密切相关[5]。有研究显示IL-6 可能是脂多糖(lipopolysaccharide,LPS)诱导激活STAT 过程中的关键因子[6]。笔者团队前期研究发现细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)通过调控JAK2/STAT3 信号通路改善ALI,且JAK2/STAT3 信号通路通过调控Th17/调节性T 细胞平衡从而调控ALI[7-8]。但IL-6 能否通过调控JAK2/STAT3 信号通路改善ALI 尚未明确。本研究通过LPS 诱导人肺癌细胞A549 建立ALI 细胞模型,探讨IL-6 通过调控JAK2/STAT3 信号通路减轻ALI 的机制。
1 材料和方法
1.1 细胞、试剂和仪器 人肺癌细胞A549 来自中国科学院上海细胞库(货号:TCHu150);F12K 完全培养基(美国Gibco 公司,货号:21127-022);PBS(中国Solarbio 公司,货号:P1010);减血清培养基Opti-MEM(美国Gibco 公司,货号:31985-062);去内毒素质粒提取试剂盒(美国OMEGA,货号:D6950-02);Lipofectamine 2000(美国Invitrogen 公司,货号:11668-027);Trizol(美国Ambion 公司,货号:15596026);细胞计数试剂盒(cell counting kit-8, CCK-8)(中国Solarbio 公司,货号:CA1210);LPS(德国Sigma 公司,货号:L2880);AnnexinV-PE/7-AAD 凋亡检测试剂盒(美国BD 公司,货号:559763);活性氧(reactive oxygen species,ROS)检测试剂盒(中国Beyotime 公司,货号:S0063);TNF-α ELISA检测试剂盒(中国Bioswamp 公司,货号:HM10205);IL-6 ELISA 检测试剂盒(中国Bioswamp 公司,货号:HM10001);IL-1β ELISA 检测试剂盒(中国Bioswamp公司,货号:HM10206);丙二醛(malondialdehyde,MDA)测定试剂盒(中国南京建成公司,货号:A003-1-1);超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(中国南京建成公司,货号:A001-3-2);RIPA(强)组织细胞快速裂解液(中国Solarbio公司,货号:R0010);BCA蛋白浓度测定试剂盒(中国Solarbio 公司,货号:PC0020);JAK2、STAT3、磷酸化JAK2(phosphorylated JAK2,p-JAK2)、磷酸化STAT3(phosphorylated STAT3,p-STAT3)、GAPDH 一抗及羊抗兔二抗(中国贝茵莱公司,货号:PAB47912、PAB46077、ab32101、ab32143、PAB36269、SAB43714)。DMIL LED 倒置荧光显微镜(德国Leica 公司);T100-Thermal Cycler PCR 仪(美国Bio-Rad 公司);CO2恒温培养箱(美国Thermo 公司,货号:311);Universal HoodⅡ凝胶成像系统(美国Bio-Rad 公司);CFX-Connect 96 荧光定量PCR 仪(美国Bio-Rad 公司);Nano-300 超微量分光光度计(杭州奥盛公司);AMR-100 酶标仪(杭州奥盛公司);NovoCyte流式细胞仪(中国艾森公司)。
1.2 方法
1.2.1 细胞培养及ALI 细胞模型的建立 取A549 细胞接种于F12K 完全培养基中,置于37 ℃,5% CO2培养箱内培养并进行传代培养。取培养的A549 细胞5×106/mL 接种于6 孔板,置于37 ℃、5% CO2培养箱中培养24 h,在F12K 完全培养基中加入10 μg/mL LPS,继续在培养箱中培养24 h,即建立ALI 细胞模型。
1.2.2 IL-6 基因过表达及干扰质粒构建 设计合成IL-6 目的基因序列和3 个IL-6 干扰序列即IL-6 shRNA1、IL-6 shRNA2 和IL-6 shRNA3,将IL-6 目的基因序列和IL-6 干扰序列酶切线性化,将双酶切后目的片段与载体进行连接。转化后进行菌落PCR 鉴定并测序,用去内毒素质粒提取试剂盒提取阳性菌落质粒,质粒用于后续转染实验。
1.2.3 细胞转染 IL-6 过表达实验分组:对照组、空载组、IL-6 过表达质粒。IL-6 干扰实验分组:对照组、IL-6 shRNA1 组、IL-6 shRNA2 组、IL-6 shRNA3 组和阴性对照组。用减血清培养基Opti-MEM 稀释各组质粒DNA,和减血清培养基Opti-MEM 稀释的Lipofectamine 2000 混匀,静置20 min。将500 μL 复合物加到准备好的含有细胞的培养板孔中,来回轻柔摇晃细胞培养板。将细胞板置于37 ℃、5% CO2培养箱中,转染4 h 后换新鲜培养基,培养48 h。收集细胞,Trizol 法提取总RNA,反转录合成cDNA。以cDNA 为模板,进行qRTPCR 扩增。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,用2-ΔΔCt法计算IL-6 相对表达水平,并比较3 个IL-6 干扰序列的干扰效率,筛选最佳干扰效率进行后续实验。
1.2.4 实验分组及干预 将处于对数生长期的细胞分为空白对照组、LPS 组、LPS+IL-6 过表达组、LPS+IL-6干扰组和LPS+空载组。空白对照组细胞正常培养48 h;LPS 组LPS 处理细胞24 h 后继续培养24 h;LPS+IL-6过表达组LPS 处理细胞24 h 后,IL-6 过表达质粒转染细胞继续培养24 h;LPS+IL-6 干扰组LPS 处理细胞24 h 后,IL-6 干扰质粒转染细胞继续培养24 h;LPS+空载组LPS 处理细胞24 h 后,空载质粒转染细胞继续培养24 h。收集细胞用于后续实验。
1.2.5 细胞增殖率检测 采用CCK-8 法。收集细胞,调整细胞悬液浓度,分于96 孔板,置于37 ℃、5% CO2培养箱中培养过夜,使细胞贴壁。按照不同分组处理细胞。取出细胞培养板,向每孔加入CCK-8 溶液,继续培养4 h。使用酶标仪测量各孔450 nm 波长处的吸光度(optical density,OD)值。以对照组细胞增殖率为100%,计算各组细胞增殖率。细胞增殖率=OD实验组/OD对照组×100%。
1.2.6 细胞凋亡率检测 采用流式细胞术。收集各组细胞,PBS 重悬细胞,用AnnexinV-PE/7-AAD 凋亡检测试剂盒检测,即加入Annexin V-PE 和7-AAD,轻轻混匀,4 ℃避光孵育30 min;加入PBS,使用流式细胞仪检测细胞凋亡,NovoExpress 分析软件分析并计算细胞凋亡率。
1.2.7 细胞氧化应激因子ROS、MDA、SOD 水平检测采用试剂盒法。使用ROS 检测试剂盒检测ROS 水平,即用无血清培养液稀释好的DHE 悬浮细胞并使细胞浓度为1×107/mL,37 ℃细胞培养箱内孵育20 min。洗涤并收集各组细胞,上流式细胞仪检测ROS,NovoCyte分析软件进行分析。严格按照MDA 检测试剂盒和SOD 检测试剂盒说明书检测MDA 和SOD 水平。
1.2.8 细胞上清液中炎症因子TNF-α、IL-6、IL-1β 水平检测 采用ELISA 法。收集各组细胞,1 000 g 室温离心15 min,取上清液。严格按照ELISA 检测试剂盒说明书测定细胞上清液中各炎症因子水平。
1.2.9 细胞中IL-6、JAK2、STAT3 mRNA 表达水平检测 采用qRT-PCR 法。根据Trizol 法提取总RNA,反转录合成cDNA。以cDNA 为模板,进行qRT-PCR 扩增。以GAPDH 为内参,采用2-ΔΔCt法计算IL-6、JAK2 和STAT3 mRNA 相对表达水平。引物由武汉天一华煜基因科技有限公司合成,引物序列见表1。

表1 qRT-PCR 引物序列
1.2.10 细胞中JAK2、STAT3、p-JAK2、p-STAT3 蛋白表达水平检测 采用Western blot 法。从培养箱中取出各组细胞,吸去培养液,适量预冷的1×PBS 洗涤2次。吸去PBS,按照每1×106个细胞加入含有蛋白酶和磷酸酶抑制剂的裂解液200 μL,4 ℃充分裂解细胞,将细胞刮入1.5 mL EP 管中,在4 ℃12 000 g 离心10 min,取上清液,使用BCA 蛋白浓度测定试剂盒测定蛋白浓度。制备SDS-PAGE 胶,上样电泳并转膜。5%脱脂奶粉室温封闭4 ℃过夜,一抗与膜室温孵育1 h。PBS 洗涤干净后加入二抗,继续室温孵育1 h。PBS 洗涤后,显色成影。通过TANON GIS软件读取相关条带灰度值。
1.3 统计学处理 采用SPSS 23.0 统计软件。多组间比较采用单因素方差分析,两两比较采用Duncan 检验。本实验重复3 次。P<0.05 为差异有统计学意义。
2 结果
2.1 IL-6 过表达及干扰转染效率验证 与对照组和空载组比较,过表达IL-6 组IL-6 mRNA 表达水平升高(均P<0.05),表明IL-6 过表达质粒转染成功,见图1A。与对照组和阴性对照组比较,IL-6 干扰组即IL-6 shRNA1 组、IL-6 shRNA2 组、IL-6 shRNA3 组IL-6 mRNA 表达水平均降低(均P<0.05),表明IL-6 干扰质粒转染成功,见图1B。其中,3 条干扰质粒中shRNA1 干扰效率最高,故后续干扰试验均选用shRNA1。
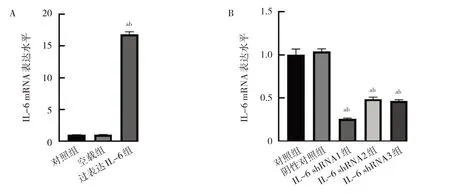
图1 IL-6 过表达及干扰转染效率验证(A:IL-6 过表达;B:IL-6 干扰)
2.2 IL-6 过表达及干扰处理对细胞IL-6 mRNA 表达的影响 与空白对照组比较,LPS 组和LPS+空载组IL-6 mRNA 表达水平均上升(均P<0.05);与LPS 组和LPS+空载组,LPS+IL-6 过表达组IL-6 mRNA 表达水平上升,LPS+IL-6 干扰组IL-6 mRNA 表达水平下降,差异均有统计学意义(均P<0.05),见图2。

图2 IL-6 过表达及干扰处理后细胞IL-6 mRNA 表达水平的比较
2.3 IL-6 过表达及干扰处理对细胞增殖的影响 与空白对照组,LPS 组和LPS+空载组细胞增殖率均下降(均P<0.05);与LPS 组和LPS+空载组比较,LPS+IL-6过表达组细胞增殖率下降,LPS+IL-6 干扰组细胞增殖率上升,差异均有统计学意义(均P<0.05),见图3。
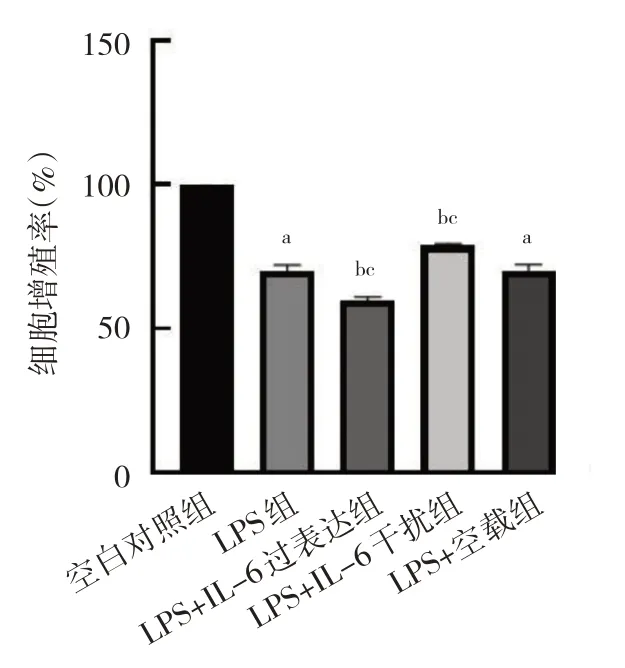
图3 IL-6 过表达及干扰处理后细胞增殖率的比较
2.4 IL-6 过表达及干扰处理对细胞凋亡的影响 与空白对照组,LPS 组和LPS+空载组细胞凋亡率均上升(均P<0.05);与LPS 组和LPS+空载组比较,LPS+IL-6 过表达组细胞凋亡率上升,LPS+IL-6 干扰组细胞凋亡率下降,差异均有统计学意义(均P<0.05),见图4(插页)。
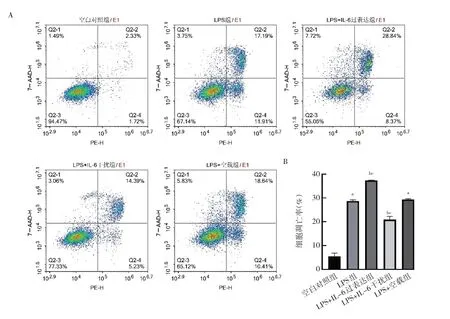
图4 IL-6 过表达及干扰处理后细胞凋亡率的比较(A:各组细胞流式图;B:各组细胞凋亡率的比较)
2.5 IL-6 过表达及干扰处理对细胞氧化应激因子ROS、MDA 和SOD 水平的影响 与空白对照组比较,LPS 组和LPS+空载组细胞ROS 和MDA 水平均上升,SOD 水平均下降,差异均有统计学意义(均P<0.05)。与LPS 组和LPS+空载组比较,LPS+IL-6 过表达组细胞ROS 和MDA 水平均上升,SOD 水平下降;LPS+IL-6 干扰组细胞ROS 和MDA 水平均下降,SOD水平上升,差异均有统计学意义(均P<0.05),见图5。
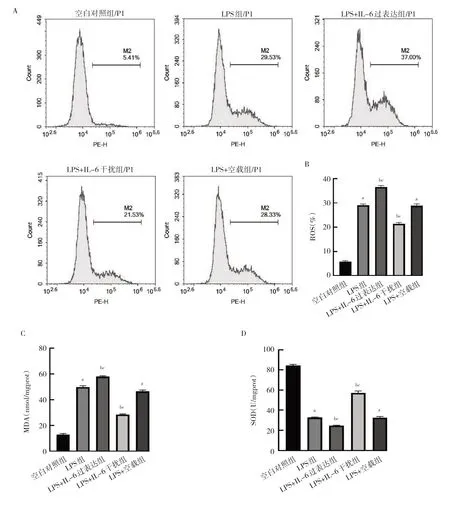
图5 IL-6 过表达及干扰处理后细胞氧化应激因子ROS、MDA 和SOD 水平的比较(A:各组细胞ROS 流式图;B:各组细胞ROS 水平的比较;C:各组细胞MDA 水平的比较;D:各组细胞SOD 水平的比较)
2.6 IL-6 过表达及干扰处理对细胞炎症因子TNF-α、IL-6、IL-1β 水平的影响 与空白对照组比较,LPS 组和LPS+空载组细胞TNF-α、IL-6、IL-1β 水平均上升(均P<0.05);与LPS 组和LPS+空载组比较,LPS+IL-6过表达组细胞TNF-α、IL-6、IL-1β 水平均上升,LPS+IL-6 干扰组细胞TNF-α、IL-6、IL-1β 水平均下降,差异均有统计学意义(均P<0.05),见图6。
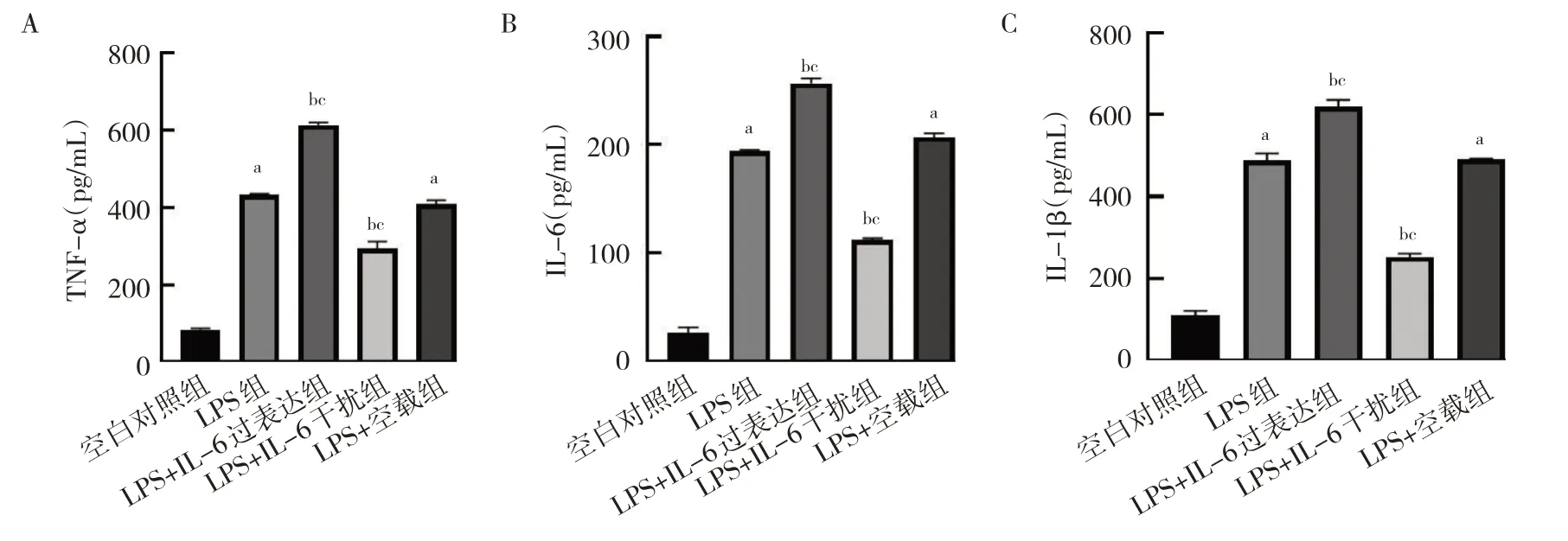
图6 IL-6 过表达及干扰处理后细胞炎症因子TNF-α、IL-6、IL-1β 水平的比较(A:各组细胞TNF-α 水平的比较;B:各组细胞IL-6的比较;C:各组细胞IL-1β 的比较)
2.7 IL-6 过表达及干扰处理对细胞JAK2、STAT3 mRNA 和蛋白表达水平的影响 与空白对照组比较,LPS 组和LPS+空载组细胞JAK2、STAT3 mRNA 及p-JAK2、p-STAT3 蛋白表达水平均上升(均P<0.05);与LPS 组和LPS+空载组比较,LPS+IL-6 过表达组细胞JAK2、STAT3 mRNA 及p-JAK2、p-STAT3 蛋白表达水平均上升,LPS+IL-6 干扰组细胞JAK2、STAT3 mRNA及p-JAK2、p-STAT3 蛋白表达水平均下降,差异均有统计学意义(均P<0.05)。此外,各组间游离的JAK2、STAT3 蛋白表达水平比较差异均无统计学意义(均P>0.05),见图7-8。
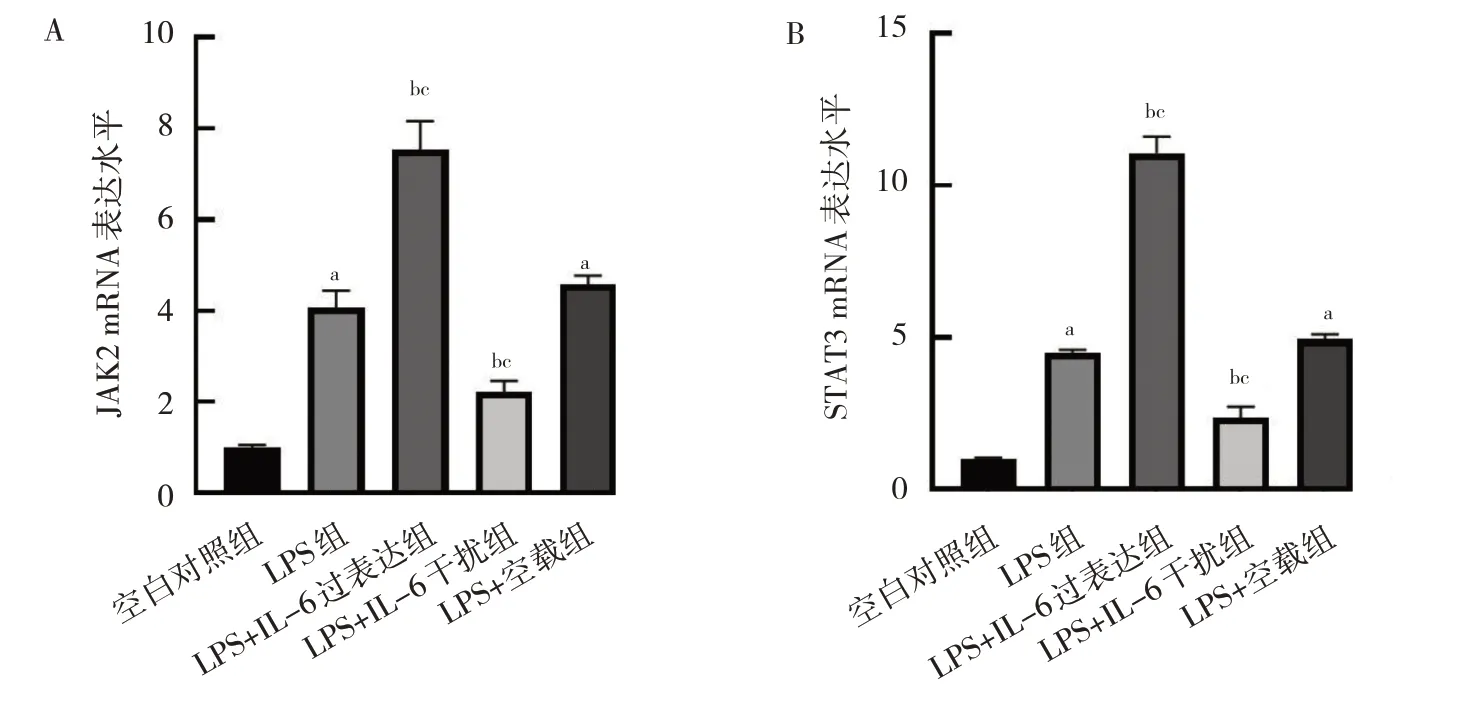
图7 IL-6 过表达及干扰处理后细胞JAK2、STAT3 mRNA 表达水平的比较(A:各组细胞JAK2 mRNA 表达水平的比较;B:各组细胞STAT3 mRNA 表达水平的比较)
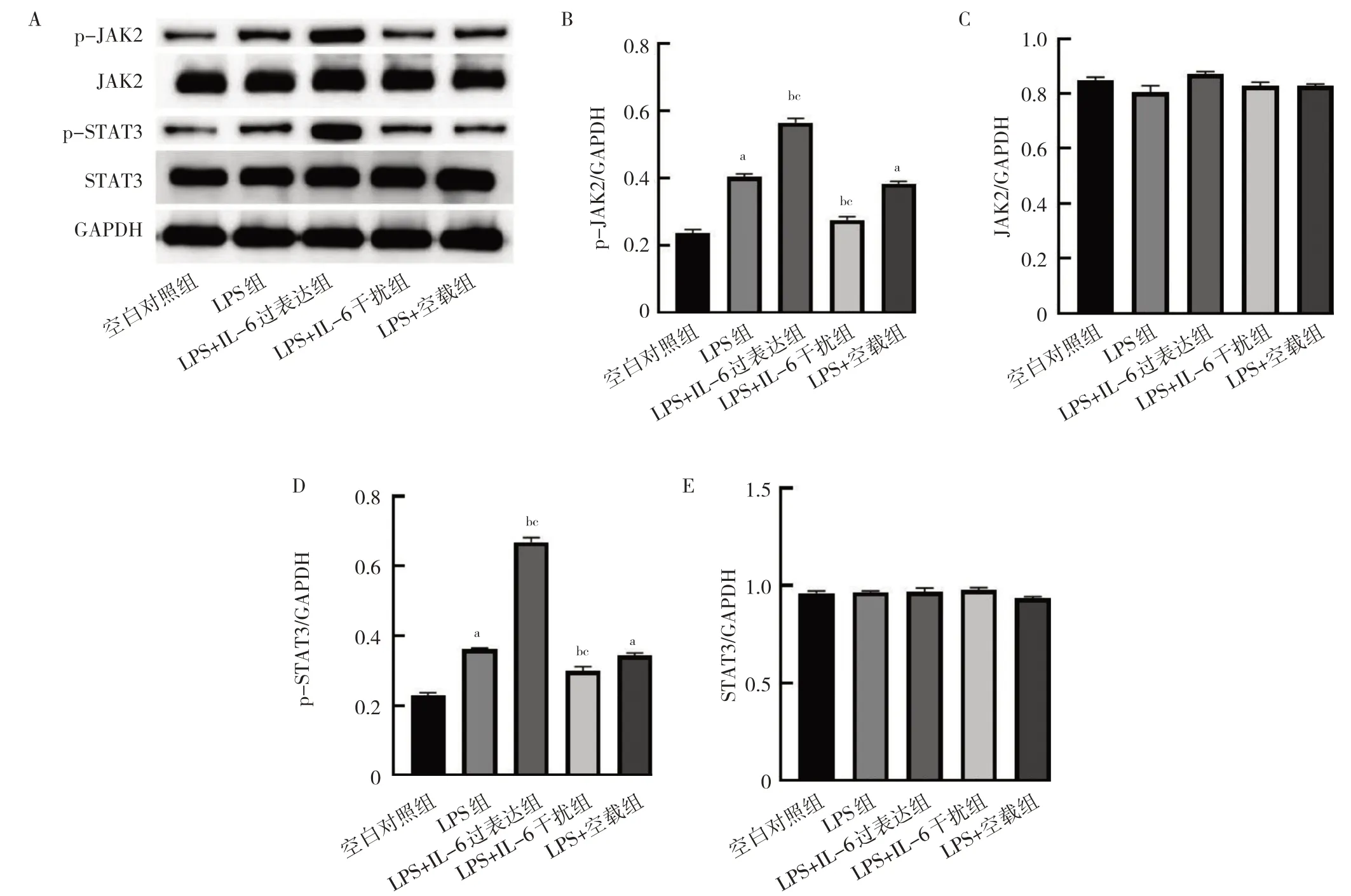
图8 IL-6 过表达及干扰处理后细胞JAK2、STAT3 蛋白表达水平的比较(A:各组细胞JAK2、p-JAK2、STAT3、p-STAT3 蛋白表达的电泳图;B:各组细胞p-JAK2 蛋白表达水平的比较;C:各组细胞JAK2 蛋白表达水平的比较;D:各组细胞p-STAT3 蛋白表达水平的比较;E:各组细胞STAT3 蛋白表达水平的比较)
3 讨论
临床上多种疾病均可能引起ALI。ALI 的主要病理生理特征为肺容积减少、肺泡-毛细血管膜通透性增加、肺顺应性降低等,临床表现为呼吸窘迫、进行性低氧血症[9]。ALI 的发病机制非常复杂,目前主要认为与氧化应激和炎症反应有关,但尚无明确的治疗措施[10]。IL 是由白细胞产生又在白细胞间起调节作用的细胞因子,目前已发现38 种IL 因子,功能复杂。其中IL-6 是一种多功能细胞因子,在免疫稳态、造血、炎症、发育和代谢中发挥重要作用[4]。研究表明,ALI 患者IL-6 蛋白表达水平高于健康者,且重度ALI 组患者IL-6 蛋白表达水平高于轻微-中度ALI 组患者[11]。IL-6 也可作为输血所致ALI 的预测靶点之一[12]。本研究证明了,过表达IL-6 后,LPS 诱导的ALI 模型细胞增殖率下降,凋亡率上升,而干扰IL-6 则相反。结果表明IL-6 与ALI 关系密切,IL-6 低表达可对ALI 产生保护作用。
ROS 指泛含氧的化学物质,具有很高的化学反应活性。SOD 具有抗氧化作用,可清除对机体有害的超氧离子。MDA 是常见的膜脂过氧化指标。当组织、细胞中氧化应激增加时,ROS 和MDA 被大量产生,SOD则会减少。IL-6、TNF-α 和IL-1β 是重要的促炎细胞因子,在脓毒症诱导的ALI 中加速其进展,形成肺水肿[13]。有研究表明,IL-6 与胰腺炎诱导的肺损伤中氧化应激和炎症反应关系密切[13-14]。本研究发现,过表达IL-6 可以使LPS 诱导的ALI 模型细胞ROS 和MDA水平上升、SOD 水平下降,促炎因子IL-6、TNF-α 和IL-1β 水平上升,而干扰IL-6 则出现相反现象,表明IL-6 可以减轻LPS 诱导的ALI 模型细胞中的氧化应激和炎症反应。
IL-6 的进一步信号传递是由JAK/STAT 和丝裂原激活的蛋白激酶/磷脂酰肌醇-3-羟激酶两种途径进行的[15]。JAK/STAT 是一种由细胞因子刺激的信号通路,参与机体多种生理过程,在先天免疫和适应性免疫反应及抑制炎症反应中起关键作用,是许多疾病的研究靶点之一[16]。JAK 可激活STAT 的磷酸化,进而调控下游基因的表达。研究表明,JAK2 参与细胞的信号转导,而STAT3 与细胞生长、分化和凋亡有关[17]。JAK2/STAT3 信号通路参与免疫反应与炎症因子的表达,可双向调节以维持机体的免疫稳定[18]。有研究发现,JAK2/STAT3 信号通路与呼吸系统疾病关系密切。SOCS3 可以通过抑制JAK2/STAT3 信号通路的激活,刺激抗炎因子、抑制炎性因子,保护细胞,抵抗大鼠严重急性胰腺炎引起的肺部炎症[19]。Kim 等[20]发现,薄荷油可降低暴露于PM10 哮喘小鼠IL-6 的水平,且JAK2/STAT3 的磷酸化降低。研究发现乌司他丁可通过抑制JAK2/STAT3 信号通路保护脓毒症诱导的ALI[21]。本研究发现,过表达IL-6 后,LPS 诱导的ALI 模型细胞中JAK2 和STAT3 mRNA 表达水平均上升;在蛋白水平检测中发现,JAK2 和STAT3 蛋白磷酸化水平上升。而干扰IL-6 后,发现细胞中JAK2 和STAT3 mRNA 表达水平和蛋白磷酸化水平均下降。这提示,IL-6 通过激活JAK2/STAT3 的磷酸化从而减轻LPS 诱导的ALI。
综上所述,IL-6 可以通过JAK2/STAT3 信号通路降低LPS 诱导的ALI 模型细胞的氧化应激和炎症反应,从而提高细胞的增殖率并降低细胞的凋亡率,减轻细胞ALI,对细胞产生保护作用。本研究完善了IL-6 保护ALI 的机制研究,为ALI 的治疗提供了一个新的治疗靶点。

