预测浸润性乳腺癌无病生存期的临床影像融合模型研究
曹婷婷 丁雪委 郑皓 葛敏 王世威
乳腺癌是女性发病率最高的肿瘤之一,也是全世界妇女癌症死亡最常见的原因[1-3]。乳腺癌相关的死亡主要是由转移性疾病而不是原发肿瘤本身导致的,局部乳腺癌患者的存活率为90%,转移性乳腺癌患者的存活率仅为20%[4]。因此,需要可靠的预后标志物来识别这些高危复发患者,使更个性化的治疗方案和监测决策成为可能。雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)、p53 和Ki-67 等临床病理因素已被证实与术后复发相关[5-8]。然而,这些因素取决于术后的病理组织学检查,但这些检查结果存在观察者间的变异,因此常常无法指导术前的临床决策。近年来,影像组学研究在肿瘤学领域取得了很大的进展[9-12],已被积极地应用于乳腺癌诊断、分期和治疗反应评估[13-15],但影像组学预测浸润性乳腺癌复发的研究仍较少。本研究旨在构建影像组学特征与临床病理风险因素相结合的融合模型,预测浸润性乳腺癌无病生存期,从而为乳腺癌的预后监测和个性化治疗提供依据。
1 对象和方法
1.1 对象 收集2015 年7 月至2017 年5 月在浙江中医药大学附属第一医院接受治疗的乳腺癌患者131例。纳入标准:(1)≥18 岁的成年女性;(2)术前接受乳腺动态增强MRI(dynamic enhancement magnetic resonance imaging,DCE-MRI);(3)无其他部位原发肿瘤;(4)病理证实为浸润性乳腺癌;(5)具有完整的临床、病理与影像资料。排除标准:(1)MRI 检查前接受过术前活检、手术或新辅助化疗等治疗;(2)合并其他系统严重疾病;(3)有MRI 检查禁忌证;(4)患有双侧乳腺癌。本研究经本院医学伦理委员会审查通过(批准文号:2021-KL-073-02)。
1.2 MRI 检查方法 患者术前均接受乳腺DCE-MRI检查,采用德国西门子3.0 T MRI 扫描仪(型号:Magnetom Verio)和16 通道乳腺专用相控阵线圈。患者取俯卧位,双侧乳房自然悬垂于线圈的双孔内,头先进。采用如下序列扫描:(1)常规三平面定位序列。(2)轴位Tirm:重复时间(repetition time,TR)4 000.00 ms,回波时间(echo time,TE)70.00 ms,翻转时间(inversion time,TI)230.00 ms,矩阵448×448,视野34 cm×34 cm,层厚4 mm,激励次数2。(3)轴位扩散加权成像:TR 8 400 ms,TE 84 ms,矩阵90×220,视野260 mm×221 mm,层厚4.0 mm,激励次数2,b 值选择0、400 和800 s/mm2,扫描结束后自动重建出表观扩散系数(apparent diffusion coefficient,ADC)图。(4)DCE-MRI:TR 4.5 ms,TE 1.6 ms,反转角12°,矩阵448×448,视野340 mm×340 mm,层厚1.0 mm,无间距扫描,采集矩阵448×448,激励次数1,单次扫描时间为59 s,对比剂注入前扫描1 次,注入后连续扫描5 次,共连续重复扫描6 个时相。对比剂采用钆喷酸葡胺注射液(北京北陆药业股份有限公司),使用双筒高压注射器,以0.1 mmol/kg 的剂量,2 mL/s 的速率注入肘静脉,注射完毕后追加10 mL 0.9%氯化钠注射液(同样高压注射器注射)。
1.3 临床病理资料及随访情况 收集患者的临床病理资料,包括年龄、病理组织学分级、肿块大小(直径)、ER 状态、PR 状态、Ki-67 状态、HER-2 状态、p53状态、手术方式、各种治疗方式情况(放疗、化疗、内分泌治疗)、乳头凹陷情况、皮肤增厚情况。所有患者术后均按照中国临床肿瘤学会乳腺癌诊疗指南进行辅助治疗。为监测复发转移,术后嘱患者定期随访,术后2 年内每3~6 个月复查1 次,3~5 年内每半年复查1 次,5 年后每年复查1 次。无病生存期指患者进行乳腺癌手术至复发转移事件发生的时间,复发转移事件由影像学检查或病理检查证实。有关患者随访和复发状态的信息从患者病历获得。最后1 次随访截至2022 年8 月。
1.4 肿瘤分割与影像组学特征提取
1.4.1 图像选择 从影像归档和通信系统中导出选定患者MRI 图像,采用Radiant 软件显示序列名称。由具有10 余年乳腺影像诊断经验的放射科医师对所有图像进行评阅,以DCE-MRI 动态增强第3 期(组织强化接近最大值)横断面图像为基准,选出病灶最大层面的图像,明确动态各期图像在同一层面。
1.4.2 肿瘤及瘤周区域勾画 由2 位乳腺疾病诊断医师(年资分别为15 和8 年),利用3D Slicer 软件进行逐层病灶勾画,同时勾画出病灶区域外轮廓和边界框。勾画以DCE-MRI 为基准,在DCE-MRI 动态增强第3期上勾画感兴趣区域,避开瘤内的囊变、坏死、出血区,尽量包全病变实质部分,较清楚地勾画出理想区域。瘤周区域选择瘤体向外扩5 mm 进行自动勾画,然后手动调整确认勾画范围。对具有多发性肿块的乳腺,只勾画最大的病灶。
1.4.3 影像组学特征提取与组学模型的构建 将131例浸润性乳腺癌患者按照7∶3 的比例随机分为训练集91 例(复发13 例、未复发78 例)和内部验证集40 例(复发6 例、未复发34 例)。运用F检验及logistic 回归分析对影像组学特征进行筛选和降维处理,用优化的特征集分别建立原始肿块影像组学模型、瘤内加瘤周影像组学模型。并根据影像组学特征及对应的权重,分别计算出两个模型的影像组学评分(Radscore)。
1.4.4 融合模型的构建 采用多因素Cox 比例风险模型筛选出有意义的临床病理风险因素,采用ROC 曲线比较原始肿块影像组学模型、瘤内加瘤周影像组学模型的辨别力。进一步将最优的影像组学模型的Radscore 与筛选后的独立临床病理风险因素相结合构建融合模型。
1.5 统计学处理 采用SPSS 22.0 和R 3.4.1 统计软件。符合正态分布的计量资料以表示,不符合正态分布的计量资料以M(P25,P75)表示。计数资料组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 临床特征选择 131 例训练集患者中,复发19 例(复发组),未复发112 例(未复发组)。所有患者穿刺/手术活检和术前MRI 检查的间隔时间为0~13 d,中位间隔时间为3(1,7)d;随访时间为4 ~83(61.8±15.1)个月。两组患者PR 状态、HER-2 状态、手术方式、内分泌治疗情况、乳头凹陷情况、皮肤增厚情况比较,差异均有统计学意义(均P<0.05),见表1。经多因素Cox 回归分析显示,HER-2 阳性、未进行内分泌治疗、乳头凹陷、皮肤增厚均是浸润性乳腺癌患者复发的独立临床病理风险因素(均P<0.05),因此筛选出以上临床特征建立临床模型,见表2。

表1 复发与未复发的患者临床特征比较[例(%)]

表2 多因素Cox 比例风险模型结果汇总
2.2 影像组学特征提取 原始肿块、瘤内加瘤周分别提取了1 781 个影像组学特征,经过降维处理,分别筛选出10 个影像组学特征用于构建各自的影像组学模型,建立的模型所选特征贡献度见表3。
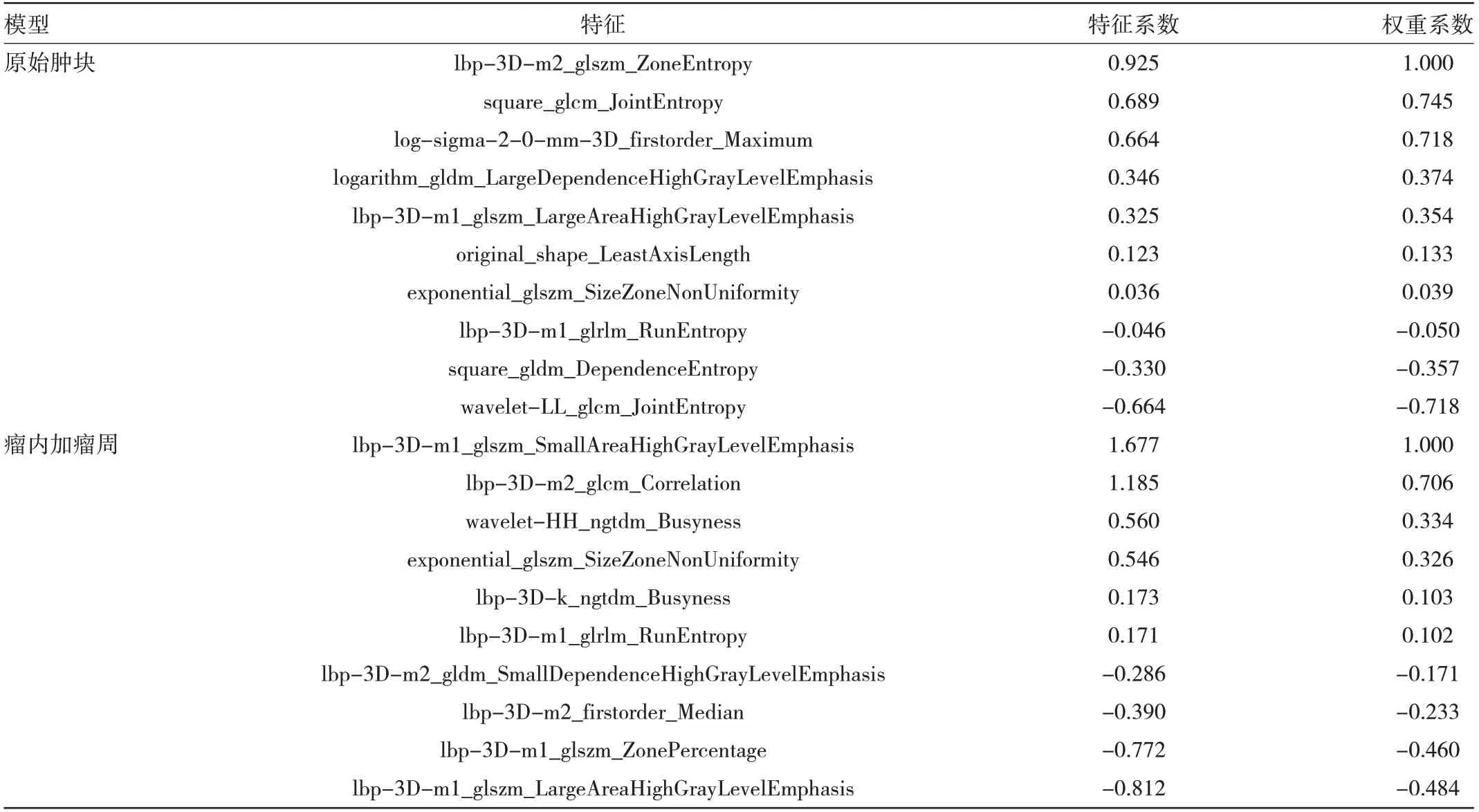
表3 原始肿块影像组学模型、瘤内加瘤周影像组学模型所选影像组学特征及权重系数
2.3 融合模型的构建及模型预测效果 原始肿块影像组学模型、瘤内加瘤周影像组学模型在内部验证集中的AUC(95%CI)分别为0.898(0.839~0.956)、0.930(0.878~0.983),提示瘤内加瘤周影像组学模型在预测复发风险上相对较好。进一步将筛选出的临床病理风险因素与瘤内加瘤周的Radscore 相结合构建融合模型。
ROC 曲线显示,在验证集中融合模型的AUC 为0.969,其预测效能优于临床模型(AUC=0.791)、原始肿块影像组学模型(AUC=0.898)及瘤内加瘤周影像组学模型(AUC=0.930)。另外,临床模型、原始肿块影像组学模型、瘤内加瘤周影像组学模型及融合模型的灵敏度分别为0.789、0.895、0.842、0.947;特异度分别为0.714、0.821、0.857、0.938,准确度为0.725、0.832、0.855、0.939,4 种模型的验证集效能比较见表4 和图1。可以看出,与临床模型和影像组学模型相比,融合模型有更好的特异度、准确度、灵敏度。
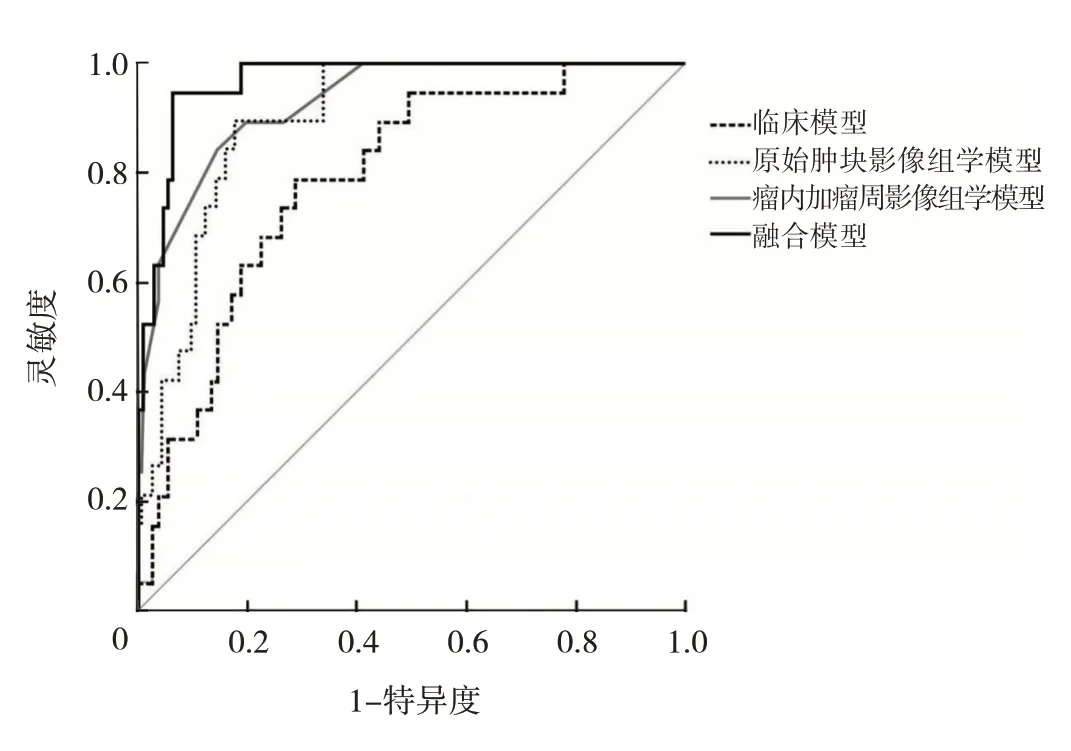
图1 4 种模型在验证集中的ROC 曲线
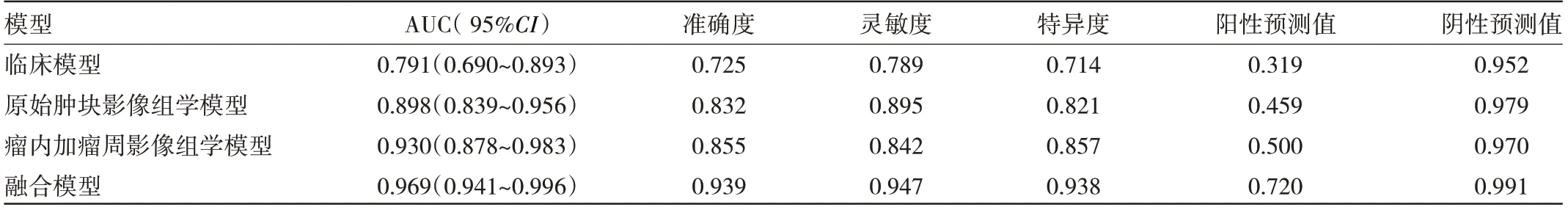
表4 4 种模型验证集效果汇总
3 讨论
乳腺癌患者的预后以及如何更早地识别易复发转移的乳腺癌患者一直是临床医生关心的问题。近年来,影像组学对于疾病的复发转移预测成为研究热点。本研究将术前乳腺DCE-MRI 影像组学特征和临床病理风险因素相结合,建立一个预测浸润性乳腺癌全身复发的临床影像融合模型,结果发现在预测浸润性乳腺癌的复发风险上,融合模型比单独的影像组学模型表现更好,对治疗方案的制定有一定的参考价值。
有研究显示,影像组学特征有助于预测肿瘤患者的生存期,帮助识别高危复发患者,从而筛选出需要个体化辅助化疗的患者[16-18]。一项研究表明,乳腺联合DCE-MRI 瘤内及瘤周影像组学特征有助于提高对三阴性乳腺癌的诊断能力[19]。此外,一项病例对照研究发现,病灶边缘增强和瘤周水肿的形态学特征与乳腺癌患者更差的无远处转移生存率有关[20]。迄今为止,大多数对于乳腺癌无转移生存期的研究都集中在瘤内[21-22],瘤周情况没有得到相对的重视,从瘤周组织提取的影像组学特征可能有助于对肿瘤侵袭性作出预测。因此,本研究加上了对于瘤周影像组学特征的提取,结果显示,原始肿块影像组学模型验证集AUC为0.898,而瘤内加瘤周影像组学模型验证集AUC 为0.930,提示加上瘤周的影像组学模型可能有助于提高浸润性乳腺癌复发的预测能力,对浸润性乳腺癌患者无病生存期有一定的预测价值。
Yu 等[23]的一项多中心回顾性研究发现,由腋窝淋巴结和肿瘤影像组学特征组成的腋窝淋巴结-肿瘤影像组学标签对腋窝淋巴结状态预测效能较高。另外,最近的一项研究也发现,当MRI 指标结合临床病理数据时,在预测接受新辅助化疗患者的乳腺癌复发方面存在附加价值的潜力[24]。而本研究采用F检验及logistic 回归分析将获得的1 781 个影像组学特征进行筛选和降维,选择优化的10 个特征构建组学模型,把Radscore 与临床病理风险因素相结合建立融合模型。结果显示融合模型的AUC 为0.969,高于瘤内加瘤周影像组学模型的0.930,前者的模型效能优于后者。因此,融合模型比仅由瘤内加瘤周影像组学特征组成的模型更能预测全身复发。
但本研究也存在一定的局限:首先,只选取了DCE-MRI 第3 期图像,可能会导致影像组学建模以及结果的偏倚。第二,本研究是回顾性分析,样本量相对较小,需要在更大的人群中对各种情况的研究参与者进行进一步的研究。第三,由于不同亚型乳腺癌远端转移患者数量有限,本研究无法探究不同亚型乳腺癌结果可能存在的差异。因此,笔者后续将进行大样本、更长随访期的前瞻性研究。
综上所述,影像组学特征有可能作为浸润性乳腺癌患者远处无病生存风险分层的标志物,而整合DCE-MRI 瘤内加瘤周影像组学特征和临床病理风险因素建立的融合模型更有助于预测浸润性乳腺癌无病生存期,可用于乳腺癌患者术前的个体化复发预测,使更个性化的治疗方案和监测决策成为可能。

