谷氨酰胺酶1抑制剂对四氯化碳诱导的小鼠肝纤维化的影响
王晓,张聪聪,张燕红,洪诗瑶,杜杰
1.山西医科大学第一医院核医学科,山西太原 030001;
2.首都医科大学附属北京安贞医院北京市心肺血管疾病研究所血管生物学研究室,北京 100029
肝纤维化是肝脏对各种慢性刺激损伤的修复反应,同时也是发展成肝硬化甚至肝癌的必经途径[1-2]。肝纤维化主要由肝脏微环境改变引起细胞外基质的合成及降解失衡导致,具有渐进性及一定的可逆性,在适当阶段加以治疗和干预,可有效阻止甚至逆转肝纤维化进程[3]。因此明确调控肝纤维化发生的分子机制,有助于寻找新的干预靶点。
介导谷氨酰胺代谢的谷氨酰胺酶(glutaminase,GLS)主要有2 种活性形式:一种是由谷氨酰胺酶1(GLS1)编码的肾型谷氨酰胺酶(kidney-type glutaminase,KGA),正常情况下主要在肾脏表达;另一种是由GLS2 编码的肝脏型谷氨酰胺酶(liver-type glutaminase,LGA),两者在不同组织中分解谷氨酰胺产生谷氨酸并释放氨用于尿素合成[4-5]。研究显示,在正常肝组织中不表达GLS1,但在肝纤维化患者肝脏组织中GLS1 蛋白表达水平和活性显著增加,而且主要在活化的肝星状细胞(hepatic stellate cells,HSCs)中表达[6-7]。GLS1表达水平与肝硬化程度呈正比。体外使用GLS1 抑制剂可显著抑制HSCs 增殖及活化[7]。在胆碱缺乏加1%甲硫氨酸饮食诱导的非酒精性肝硬化小鼠模型中使用siRNA 法抑制GLS1 活性,可显著减轻肝纤维化程度[8]。为进一步验证GLS1 作为肝纤维化干预靶点的临床转化潜能,本研究探讨了GLS1特异性抑制剂BPTES[bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide]处理对四氯化碳(carbon tetrachloride,CCl4)诱导的小鼠肝脏纤维化模型肝纤维化相关表型的影响。
1 材料与方法
1.1实验动物 SPF 级雄性C57BL/6J 小鼠,30 只,8 ~10 周龄,体质量20 ~25 g,购自北京唯尚立德生物科技有限公司,动物许可证号:SCXK(京)2021-0010。本实验均以科研为目的进行小鼠养殖和使用,且按照《北京市实验动物福利伦理审查指南》相关规定进行(35892-2018)。
1.2主要试剂及仪器 CCl4、橄榄油购自美国Sigma公司;天狼猩红染色液购自北京索莱宝科技有限公司;内源性过氧化物酶阻断剂、羊血清封闭液、酶标山羊抗兔IgG 聚合物、DAB 显色液购自北京中杉金桥生物技术有限公司;兔抗GLS1 单克隆抗体购自美国Abcam 公司;BPTES 购自美国Abmole 公司;Trizol总RNA 提取试剂购自美国Invitrogen 公司;mRNA 反转录试剂盒购自美国Promega 公司;2×SYBR Green qPCR Mix 购自日本TaKaRa 公司;Bio-RAD CFX Connect PCR仪购自美国Bio-RAD公司。
1.3肝纤维化动物模型的制备 参考文献[9]方法进行。将小鼠随机分为对照、模型、处理组,每组10只。对照组给予200µL 橄榄油,模型和处理组给予200 µL 10% CCl4(CCl4∶橄榄油= 1∶9),均经腹腔注射,每周2 次,共4 周,构建肝纤维化模型。BPTES处理组在建模基础上按照10 mg/kg 剂量经小鼠腹腔注射BPTES,每周2 次,末次注射48 h 后,处死小鼠,采用心脏灌流方式去除血液,收集肝脏组织,部分用甲醛溶液固定用于制备组织切片进行病理学分析,部分冻存于液氮中用于后续RNA提取。
1.4肝脏组织天狼猩红染色 将肝脏组织石蜡切片脱蜡至水后,1×PBS缓冲液洗涤3次,滴加天狼猩红染色液覆盖组织,室温孵育30 min;75%乙醇洗涤2次,无水乙醇10 min;二甲苯透明5 min;中性树胶封片。用尼康ECLIPSE 90i显微镜采集图像,采用NISElement软件对阳性染色面积的比例进行统计分析。
1.5肝脏组织免疫组织化学染色 将肝脏组织石蜡切片脱蜡至水,1×PBS缓冲液洗涤3次,加入抗原修复液煮沸10 min;待切片变凉,1 × PBS 缓冲液洗涤3 次,加入内源性过氧化物酶阻断剂处理20 min;1×PBS缓冲液洗涤3次,加入羊血清封闭液处理30 min;加入兔抗GLS1 单克隆抗体(1∶400 稀释)覆盖组织后,置4 ℃过夜;室温平衡30 min;1×PBS缓冲液洗涤3次,加入酶标山羊抗兔IgG聚合物,20 ℃孵育30 min;1×PBS 缓冲液洗涤3 次,DAB 显色,苏木素染核,二甲苯透明,中性树胶封片。用尼康ECLIPSE 90i显微镜采集图像,采用NIS-Element 软件对阳性染色面积的比例进行统计分析。
1.6纤维化相关基因表达水平检测 采用qRT-PCR法检测肌动蛋白2(actin alpha 2,Acta2)、Ⅰ型胶原α1(collagen typeⅠalpha1,Col1α1)及GLS1基因mRNA表达水平。用Trizol试剂提取肝脏组织总RNA,Nanodrop2000检测RNA浓度后,取5µg,反转录合成cDNA,以其为模板,利用引物(GLS上游引物序列:5′-CTACAGGATTGCGAACATCTGAT-3′,下游引物序列:5′-ACACCATCTGACGTT GTCTGA-3′;Col1α1上游引物序列:5′-GCTCCTCTTAGGGGCCACT-3′,下游引物序列:5′-CCACGTCTCACCATTGGGG-3′;Acta2上游引物序列:5′-GTCCCAGACATCAGGGAGTAA-3′,下游引物序列:5′-TCGGATACTTCAGCGTCAGGA-3′;GAPDH上游引物序列:5′-AGGTCGGTGTGAACGGATTTG-3′,下游引物序列:5′-TGTAGACCATGTAGTTGAGGTCA-3′。引物由北京诺赛基因有限公司合成)进行qRT-PCR检测。PCR反应条件为:95 ℃预变性3 min;95 ℃15 s,60 ℃45 s,共45 个循环。以GAPDH为内参,基因表达水平采用2-ΔΔCt法计算。
1.7统计学分析 应用GraphPad Prism 7.00 软件对实验数据进行统计学分析。计量数据以均值±标准差(±s)表示,率以百分比表示。符合正态分布的两组间比较采用非配对t检验,非正态分布的两组间比较采用非参数检验。以P<0.05 为差异有统计学意义。
2 结果
2.1CCl4诱导小鼠肝纤维化模型的建立 腹腔注射橄榄油或CCl44周后,大体观察可见对照组小鼠肝脏组织表面光滑,质地软,而模型组小鼠肝脏组织体积较对照组稍增大,表面不光滑,呈颗粒状,质地稍韧。对照和模型组小鼠肝脏质量与胫骨长度的比值分别为0.078±0.005 和0.095±0.003,模型组比对照组显著增加(t= 2.979,P= 0.031)。天狼猩红染色结果显示,对照和模型组小鼠肝脏组织中阳性面积分别为(0.62±0.09)%和(2.41±0.22)%,模型组小鼠肝脏组织中胶原含量比对照组显著增加(t= 7.661,P<0.01),并从汇管区向四周放射延伸,部分形成大小不一的假小叶结构。见图1。表明小鼠肝纤维化模型制备成功。
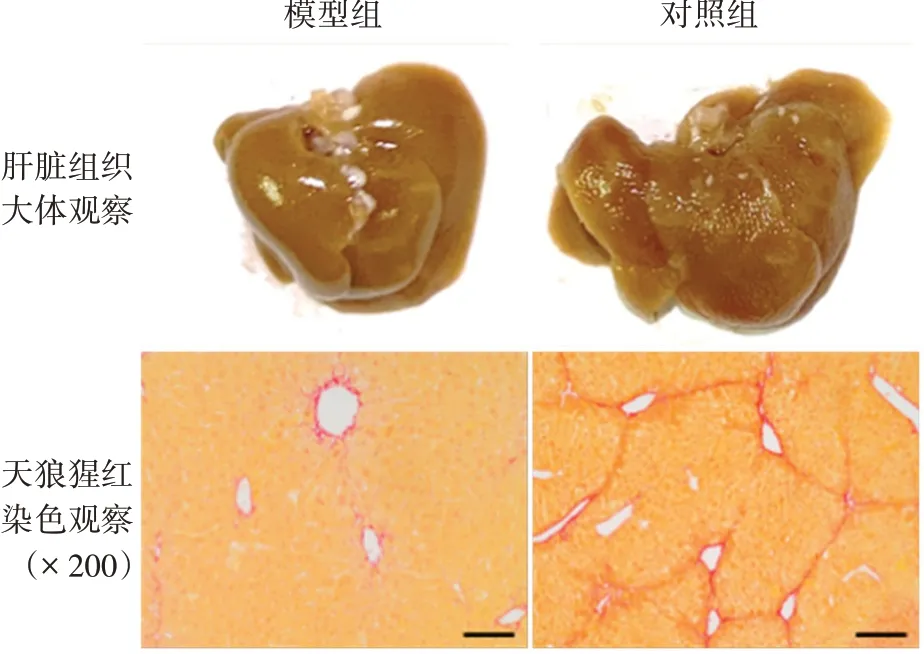
图1 CCl4诱导小鼠肝纤维化模型的建立Fig.1 Establishmentofliverfibrosismodelinduced byCCl4 in mice
2.2肝纤维化模型组织中胶原相关基因的表达水平对照和模型组小鼠肝脏组织中Atca2基因相对表达量分别为0.0008±0.0001、0.0024±0.0003,Col1α1基因相对表达量分别为0.0036 ± 0.0005、0.0237 ±0.0028;与对照组相比,模型组Atca2和Col1α1基因相对表达量均显著增加,差异有统计学意义(t分别为4.335和5.319,P均<0.01)。
2.3肝纤维化模型组织中GLS1表达水平对照组和模型组小鼠肝脏组织中GLS1基因相对表达量分别为0.000 2 ± 0.000 01、0.000 34 ± 0.000 03,与对照组相比,模型组显著增加,差异有统计学意义(t=5.319,P<0.01)。免疫组织化学染色结果显示,与对照组相比,模型组小鼠肝脏组织中GLS1 蛋白的表达水平显著增加,差异有统计学意义(t=9.725,P<0.01),且主要表达在纤维化区域。见图2。
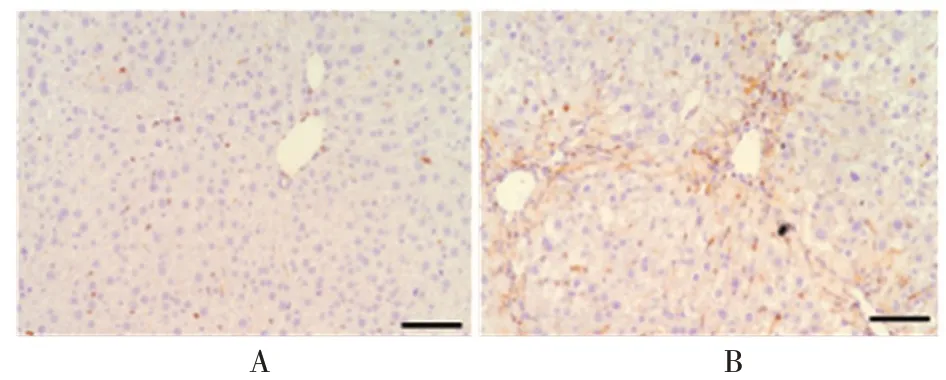
图2 免疫组织化学染色法检测肝脏组织中GLS1蛋白的表达水平(×200)Fig.2 Detection of expression level of GLS1 protein in liver tissue by immunohistochemical staining(×200)
2.4BPTES 处理对肝纤维化的影响 BPTES 处理组小鼠肝脏组织体积较模型组稍减小。天狼猩红染色结果显示,模型和BPTES 处理组小鼠肝脏组织中阳性面积分别为(2.85 ± 0.21)%和(1.17 ± 0.09)%,BPTES 处理组小鼠肝脏组织中胶原含量比模型组显著减少,差异有统计学意义(t=7.427,P<0.01)。见图3。模型和BPTES 处理组小鼠肝脏组织中Atca2基因相对表达量分别为0.008 9±0.000 9、0.004 9±0.000 5,Col1α1基因相对表达量分别为0.51±0.07、0.31±0.04;与模型组相比,BPTES 处理组小鼠肝脏组织中Atca2和Col1α1基因相对表达量均显著降低,差异有统计学意义(t分别为3.713 和2.628,P均<0.05)。
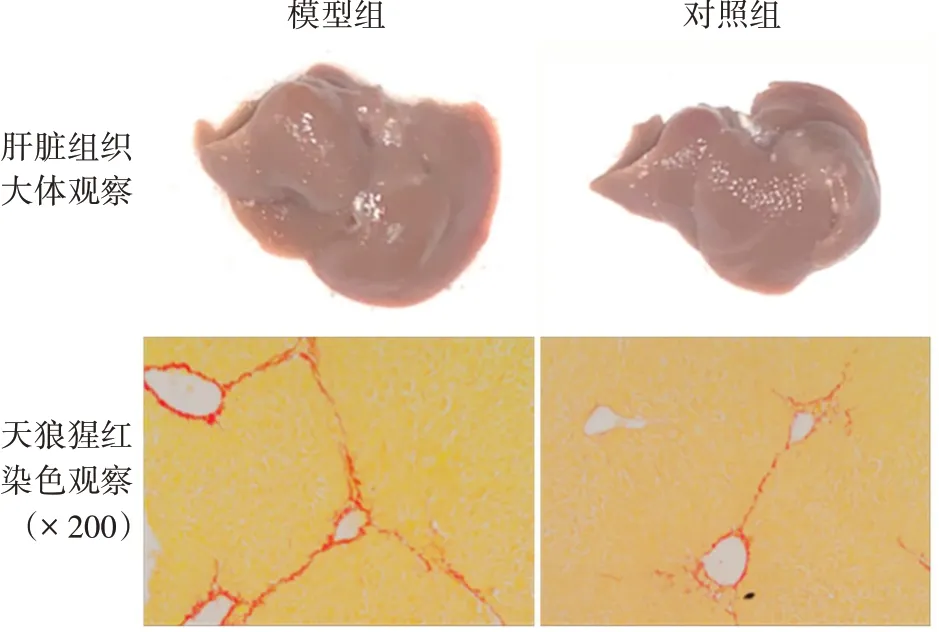
图3 BPTES处理对CCl4诱导的小鼠肝纤维化的影响Fig.3 Effect of BPTES treatment on liver fibrosis induced by CCl4 in mice
3 讨论
肝纤维化是由各种致病因子引起肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉积的病理过程,可发展为肝硬化、肝癌。明确其发病的分子机制有助于提供新的治疗靶点。
HSCs 的激活是肝纤维化发展过程中的核心环节[10-11]。在静息状态下,HSCs 的主要功能为贮存和代谢维生素A、储存脂滴与甘油三酯、分泌载脂蛋白A 等。当肝脏受到急性或慢性损伤时,HSCs 邻近的肝细胞、内皮细胞、血小板以及免疫细胞等产生一系列细胞因子刺激HSCs 活化[12-13]。活化的HSCs 内脂滴减少或消失,并表达具有收缩功能的α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),转分化为具有较强增殖、迁移和分泌能力的肌成纤维细胞,合成更多细胞外基质沉积于肝组织间隙中,同时分泌抑制细胞外基质降解的基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)导致肝纤维化发生[14]。大量研究表明,抑制HSCs活化可延缓肝纤维化进程[15-17]。
本研究发现,CCl4诱导的小鼠肝纤维化模型肝脏组织中GLS1 表达水平显著增加,而且集中在肝纤维化区域,与既往在人肝硬化肝脏组织中研究发现的上调GLS1 主要定位在活化的HSCs 的结果一致,同时体外培养的人HSCs 在活化后表达GLS1 的水平显著增加,用GLS1 抑制剂可显著抑制HSCs 的增殖及分化[7]。后续有研究显示,用siRNA的方式抑制非酒精性肝硬化模型中上调的GLS1,可显著改善纤维化相关表型,提示GLS1 可作为肝纤维化治疗的潜在靶点[8]。因此,本研究进一步使用GLS1 特异性抑制剂BPTES 在CCl4诱导的小鼠肝纤维化模型中进行干预后检测纤维化相关表型,结果显示,抑制GLS1 可显著减轻肝纤维化程度。
GLS1 作为抑制肝纤维化靶点的可能作用机制如下:①抑制HSCs 的增殖及活化。HSCs 转分化为产生胶原的肌成纤维细胞的过程受谷氨酰胺代谢的调控。谷氨酰胺代谢的终产物α-酮戊二酸通过增强三羧酸循环的活性,从而满足高增殖率的肌成纤维细胞用于生物合成所需ATP。抑制HSCs 的谷氨酰胺代谢活性可抑制线粒体氧化呼吸速率,以及细胞增殖、迁移和胶原合成[6]。②清除肝脏中累积的衰老细胞。有研究显示,非酒精性肝硬化组织中富含衰老的肝细胞[18]。衰老的肝细胞可通过旁分泌细胞因子进一步促进HSCs向肌成纤维细胞的转分化[19],同时衰老细胞释放的细胞因子IL-1β、IL-6、CXCL1 等大部分对各类炎性细胞具有招募和激活的作用[20-21]。浸润在肝脏组织中的炎性细胞可与HSCs 通过旁分泌细胞因子的方式相互作用,加剧肝损伤及放大炎性反应,从而进一步促进肝纤维化进程[22-23]。有研究显示,使用通过靶向激活半胱天冬酶的INK相关凋亡(INK-linked apoptosis through targeted activation caspase,INK-ATTAC)小鼠,诱导P16(p16Ink4a)阳性的衰老细胞死亡或者使用衰老细胞清除剂达沙替尼+槲皮素的组合,可显著减轻肝硬化程度[19]。使用嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T cell)靶向诱导尿激酶型纤溶酶原激活剂受体(urokinase-type plasminogen activator receptor,uPAR)阳性的衰老细胞死亡,同样可减轻肝纤维化程度[24]。最新研究表明,衰老细胞中GLS1表达上调,从而通过产生氨中和细胞内酸碱平衡来维持衰老细胞存活。使用GLS1 特异性抑制剂BPTES 处理时可诱导衰老细胞死亡。体内给予BPTES 可清除累积的衰老细胞,从而达到延长寿命的作用,表明GLS1 特异性抑制剂BPTES是新的衰老细胞清除剂[25]。
综上所述,使用GLS1特异性抑制剂BPTES 可显著减轻CCl4诱导的小鼠肝纤维化程度,为肝纤维化的治疗提供了新思路。

