重组腺病毒5型-诺如病毒GⅡ.4型-VP1病毒样颗粒的表达及鉴定
汪梦俊,孙楠,裴捷,刘睿伦,邹文琪,熊宇,王文辉,于代冠,申硕
武汉生物制品研究所有限责任公司病毒性疫苗研究一室,湖北武汉 430207
诺如病毒(Norovirus,NoV)为杯状病毒科(Caliciviridae family)诺如病毒属(Norovirusgenus)的单股正链RNA 病毒[1],根据其编码主要衣壳蛋白VP1 的开放阅读框2(open reading frame 2,ORF2)基因序列的差异可将其分为GⅠ~GⅦ7个基因型[2-3]。GⅠ、GⅡ、GⅣ基因型在人群中具有较强的传播能力,感染人体后可引起腹泻、呕吐等症状,是全球范围引起急性肠胃炎的主要病原体之一[4-6],目前,GⅡ.4 基因型是优势流行株[7-9]。针对NoV 的疫苗主要包括重组病毒样颗粒(virus-like particle,VLP)疫苗、P 蛋白颗粒疫苗及腺病毒载体疫苗等[10-12]。其中表达NoV VP1 的腺病毒载体疫苗可诱导强烈的体液和细胞免疫反应,是具有较大潜力的候选NoV 疫苗之一[13-15]。NoV VLP 是由NoV 主要结构蛋白VP1 通过自主装配而成[16]。VP1的相对分子质量约为58 900,包括S和P 2 个结构域,S 结构域由其前端225 个氨基酸组成,对二十面体的形成至关重要[17];P 结构域可进一步分为P1 和P2 两个结构域,P1 主要负责VP1 二聚体的形成,P2 负责颗粒与细胞受体的结合[18],含有主要的中和抗原表位。有研究表明,VP1 通过90 个二聚体分子,共180 个亚基形成1 个直径约40 nm 的二十面体VLP[19],其形态及免疫原性与具有传染性的病毒类似[20]。
本研究基于E1 缺陷的腺病毒Ad5,利用Recombineering 技术[21-22],将GⅡ.4 基因型NoV 主要结构蛋白VP1基因的ORF2 插入至Ad5 原基因组的E1 部位,获得复制缺陷型的重组腺病毒载体pAd5-NoVGⅡ.4-VP1,感染293T细胞后获得含有NoVVP1基因的重组病毒rAd5-NoV-GⅡ.4-VP1,采用氯化铯密度梯度离心法纯化VP1 组装的VLP,并进行鉴定,以期为研发安全高效基于腺病毒载体Ad5 的口服黏膜免疫NoV疫苗奠定基础。
1 材料与方法
1.1菌株、质粒及细胞E.coliDY380、重组质粒pAd5-eGFP、pAd5-NoV-GⅡ.4-VP1-1-6和pAd5-NoV-GⅡ.4-VP1-3-6 均由武汉生物制品研究所有限责任公司病毒性疫苗研究一室保存;239T 细胞购自武汉普诺赛生命科技有限公司。
1.2样本 14 份唾液标本(编号1~14)源自武汉生物制品研究所有限责任公司的志愿者。志愿者于采集样本前5 min 漱口,吐去一部分唾液,采集未经刺激的唾液5~10 mL,置干净的试管内,于100 ℃煮沸10 min,11 000×g离心5 min,取透明上清,于-80 ℃保存。
1.3主要试剂 兔抗NoV-GⅡ.4-VP1 血清及A、B 液均由武汉生物制品研究所有限责任公司病毒性疫苗研究一室制备;2×Phanta Max Master Mix(Dye Plus)购自南京诺唯赞生物科技有限公司;多聚赖氨酸购自北京碧云天生物技术有限公司;IPTG和X-gal溶液购自生工生物工程(上海)股份有限公司;限制性内切酶PacⅠ购自美国NEB公司;胎牛血清购自浙江天杭生物科技股份有限公司;DMEM 培养基、PageRuler Plus 预染蛋白marker(26619)及LipofectamineTM2000 均购自美国Thermo Fisher 公司;4 × Laemmli Sample Buffer 购自美国BIO-RAD 公司;HRP 标记的羊抗兔IgG购自武汉博士德生物工程有限公司。
1.4rAd5的拯救
1.4.1rAd5-eGFP 将20 µg 质粒pAd5-eGFP进行PacⅠ单酶切,经NaCl沉淀法沉淀、风干后,得到线性化质粒,用10µL opti-MEM溶解,在LipofectamineTM2000的介导下转染293T 细胞,转染6 h;更换含1%胎牛血清的DMEM维持液,于37 ℃,5%CO2细胞培养箱中培养10 d,-20 ℃反复冻融3次后,6 500×g离心5 min,收集上清,标记为P0 代rAd5-eGFP,于293T 细胞上连续传3 代,各代细胞均于37 ℃培养48 h,收获病毒液,分别记为P1、P2、P3。荧光显微镜下观察荧光表达情况。
1.4.2rAd5-NoV-GⅡ.4-VP1 将重组质粒pAd5-NoVGⅡ.4-VP1-1-6 和pAd5-NoV-GⅡ.4-VP1-3-6 经PacⅠ单酶切后,按1.4.1 项方法转染293T 细胞,获得P0代rAd5-NoV-GⅡ.4-VP1-1-6和rAd5-NoV-GⅡ.4-VP1-3-6,连续传3 代,收获病毒液,分别记为P1、P2、P3。取各代病毒收获液15 µL,经4% ~20% SDS-PAGE分离后,转移至NC 膜,用含2% BSA 的PBST 于37 ℃封闭1 h;加入兔抗NoV-GⅡ.4 血清(1∶5 000 稀释),于37 ℃作用1 h;PBST洗涤5次,每次5 min,加入HRP标记的羊抗兔IgG(1∶10 000稀释),37 ℃孵育45 min;PBST洗涤5次,每次5 min,ECL法显色。
1.5rAd5-NoV-GⅡ.4-VP1的扩大表达 将2×108个293T细胞接种至10层细胞工厂中,用DMEM 培养基于37 ℃,5% CO2细胞培养箱中培养,待细胞融合度约达80%时,用灭菌PBS 洗涤3 次;将P3 代rAd5-NoV-GⅡ.4-VP1-3-6按MOI=0.01加至2 L的无血清DMEM维持液中,混匀,再接种至细胞工厂中;待细胞病变达80%时,置-80 ℃反复冻融3次,使细胞破碎。
1.6NoV-GⅡ.4-VLP的提取及纯化 将冻融破碎后的病毒收获液于10 000×g离心1 h;取上清,经100 Kd膜浓缩,采用25%(w/v)蔗糖垫底方式进行初步纯化,于4 ℃,100 000×g离心3 h;取沉淀,PBS复溶后,用氯化铯(总密度为1.32 g/mL)进行密度梯度离心,于4 ℃,210 000×g离心20 h;根据蛋白浊光收集VLP(密度为1.313 1 g/mL)条带和NoV-GⅡ.4-VP1(密度为1.344 9 g/mL)条带,分别加至100 Kd Ultra-15超滤管中,加入6 mL GT101 buffer[5 mmol/L Tris,50 mmol/L NaCl,1 mmol/L MgCl2,6.8%(w/v)、0.005%PS-80],于4 ℃,6 500×g离心30 min,弃流穿液,该步骤反复3 次,去除样品中的氯化铯,即获得NoV-GⅡ.4-VLP,按50µL/管分装,于-80 ℃冻存。
1.7NoV-GⅡ.4-VLP的鉴定
1.7.1Western blot 检测 Lowry 法检测纯化NoVGⅡ.4-VLP 的蛋白浓度,调节浓度为300 ng/µL,按1.4.2 项进行Western blot 检测。分别以P3 代rAd5-NoV-GⅡ.4-VP1 及rAd5-eGFP 收获液为阳性及阴性对照,同时设细胞对照(仅加入293T细胞)。
1.7.2ELISA 检测 用0.05 mol/L 碳酸盐缓冲液(pH 9.6)按1∶1 000 的体积分数稀释唾液样本,加至96孔板,100µL/孔,每个样品设3个平行孔,4 ℃包被过夜;用含1%BSA 的PBST 于37 ℃封闭1 h;加入2µg/mL的NoV-GⅡ.4-VLP,100µL/孔,同时以BSA为阴性对照,以NoV-GⅡ.4-VLP包被的孔为阳性对照,37 ℃孵育1 h;PBST洗涤5次,加入兔抗NoV-GⅡ.4-VP1血清(1∶5 000稀释),37 ℃孵育1 h;PBST洗涤5次,加入HRP标记的羊抗兔IgG(1∶10 000稀释),100µL/孔,37 ℃孵育1 h;PBST洗涤5 次,依次加入A 和B 液,各50µL/孔,37 ℃水浴15 min,加入2 mol/L H2SO4终止反应,用酶标仪检测A450。
1.7.3电镜观察 将去除氯化铯后的NoV-GⅡ.4-VLP及NoV-GⅡ.4-VP1 稀释至300 ng/µL,取20 µL,滴加至预先用0.3% formvar-氯仿镀膜的铜网上,室温孵育5 min;吸干样品,滴加2%磷钨酸染液,染色5 min;弃染液,用去离子水充分冲洗,干燥,置透射电镜下观察。
1.8数据采集及分析 应用GraphPad Prism 9软件进行数据采集、分析及作图。
2 结果
2.1rAd5的鉴定
2.1.1rAd5-eGFP 荧光显微镜下观察,P1、P2、P3代rAd5-eGFP均可见绿色荧光,且亮度随着代次的增加而增强,P0代未见绿色荧光,见图1。表明在293T细胞中可成功拯救rAd5,且可正常表达插入的外源片段。
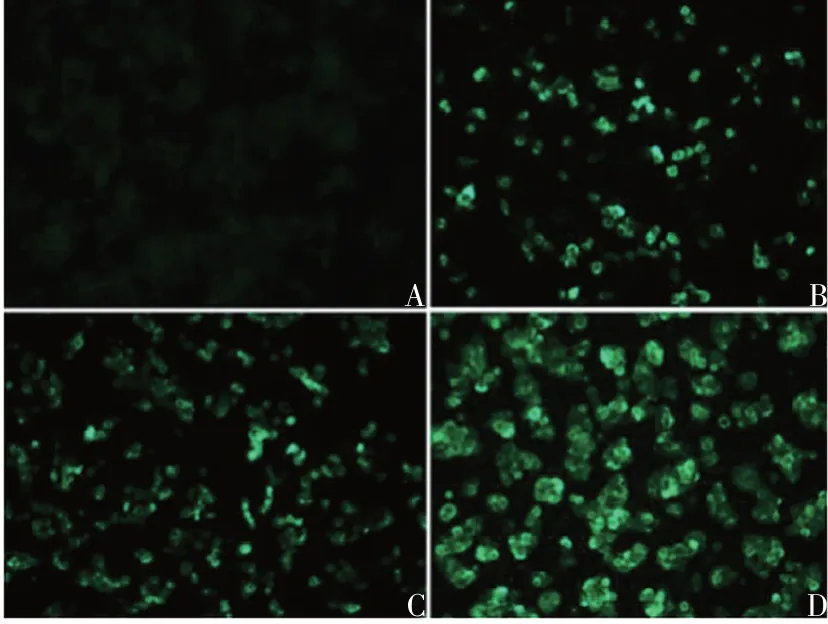
图1 各代rAd5-eGFP的镜下观察(×100)Fig. 1 Microscopic observation of recombinant adenovirus rAd5-eGFP of various generations(×100)
2.1.2rAd5-NoV-GⅡ.4-VP1 rAd5-NoV-GⅡ.4-VP1-1-6 和rAd5-NoV-GⅡ.4-VP1-3-6 的P0、P1、P2、P3 代病毒收获液中均可见NoV-GⅡ.4-VP1 蛋白表达,相对分子质量约58 900,大小与预期相符,见图2。表明转染拯救获得了具有感染性的病毒颗粒,均可正常表达VP1蛋白。
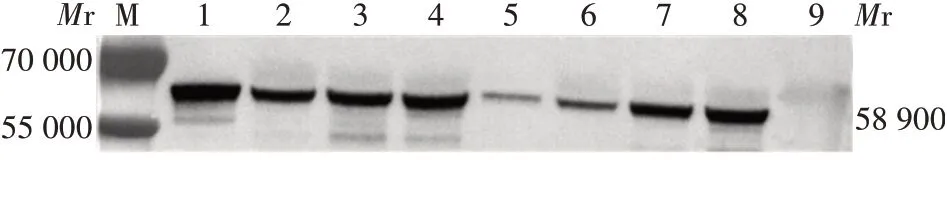
图2 rAd5-NoV-GⅡ.4-VP1感染293T细胞后VP1的表达Fig.2 Expression of VP1 in 293T cells infected with recombinant adenovirus rAd5-NoV-GⅡ.4-VP1
2.2NoV-GⅡ.4-VLP的鉴定
2.2.1Western bot 检测 NoV-GⅡ.4-VLP 及阳性对照均可与兔抗NoV-GⅡ.4-VP1 血清发生特异性结合,且于相对分子质量约58 900 处可见特异性结合条带,阴性对照及细胞对照未见该结合条带,见图3。阴、阳性对照及细胞对照于相对分子质量约70 000处可见1 条较浅色条带,可能是由于细胞培养基中添加胎牛血清导致的。

图3 rAd5-NoV-GⅡ.4-VLP的Western blot鉴定Fig.3 Western blotting of rAd5-NoV-GⅡ.4-VLP
2.2.2ELISA检测 14份唾液样本与阳性对照A450高于阴性对照,见图4。表明制备的NoV-GⅡ.4-VLP具有与天然的NoV 病毒颗粒相似构象,能有效识别唾液样本中的NoV 受体,即组织血型抗原(histo-blood group antigens,HBGA),可用于NoV VLP 疫苗的相关研究。
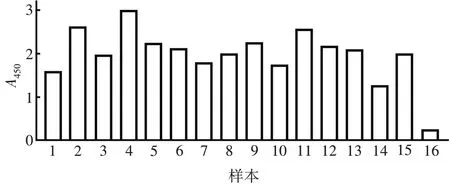
图4 rAd5-NoV-GⅡ.4-VLP与NoV受体的结合能力Fig.4 Binding ability of rAd5-NoV-GⅡ.4-VLP to NoV receptors
2.2.3电镜观察 NoV-GⅡ.4-VLP形态完整,呈球状,直径为43.5~58.3 nm,平均直径为(50.6±4.63)nm,颗粒表面有少数突起,可能为VP1 自组装时暴露于颗粒表面的P结构域。NoV-GⅡ.4-VP1直径为(84.5±5.35)nm,形态较为完整。见图5。
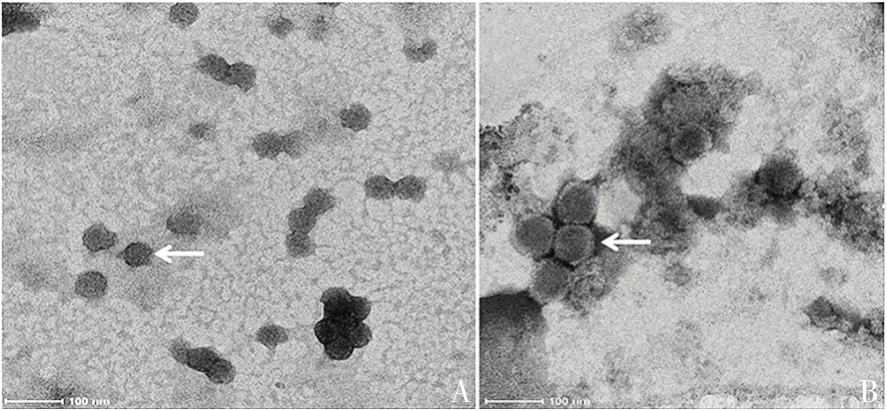
图5 NoV-GⅡ.4-VLP形态的镜下观察(标尺:100 nm)Fig.5 ElectronmicroscopicobservationforrAd5-NoV-GⅡ.4-VLP(scale:100 nm)
3 讨 论
阻碍NoV 疫苗研发的主要因素包括缺乏经济有效的人类NoV体外细胞培养方法及动物保护模型[10],因此,传统的灭活疫苗或减毒活疫苗策略不适用于NoV 疫苗的研发。目前,NoV 疫苗的研发策略主要包括VLP、P 颗粒及重组腺病毒载体疫苗等[23]。以流感病毒HA 为抗原重组腺病毒载体口服黏膜免疫疫苗已进入临床试验阶段[24],表明以NoV VP1 为抗原的重组腺病毒口服疫苗也具有较强的临床研究潜能。
前期研究主要依赖昆虫杆状、大肠埃希菌、毕赤酵母等系统表达VLP,如采用昆虫细胞表达NoV VP1 时,受体结合部位的氨基酸存在O-连接的糖基化修饰,表明糖基化可能对NoV VLP 的免疫原性存在一定影响[25]。而采用哺乳动物细胞系统表达NoV VLP 却鲜有报道。本研究将质粒pAd5-NoV-GⅡ.4-VP1-1-6和pAd5-NoV-GⅡ.4-VP1-3-6转染293T细胞,拯救获得2 株带有NoV-GⅡ.4-VP1基因的复制缺陷型rAd5-NoV-GⅡ.4-VP1,将二者转染293T 细胞后,由于带有CMV 启动子的VP1基因在rAd 的基因组中,因此二者在细胞中均可表达NoV-GⅡ.4-VP1蛋白,VP1于293T细胞中以自组装的方式形成相应的NoVGⅡ.4-VLP。本研究结果还表明,rAd5 表达的NoVGⅡ.4-VLP 能与NoV 的HBGA受体相互作用,可用于NoV疫苗体外效力的评价。电镜观察结果表明,拯救得到的复制缺陷型腺病毒NoV-GⅡ.4-VP1颗粒直径为(84.5±5.35)nm,NoV-GⅡ.4-VLP 直径为(50.6±4.63)nm,有别于大肠埃希菌、酵母或昆虫细胞系统所表达的NoV VLP[19],可能是由于哺乳动物细胞表达系统所进行的糖基化修饰有别有酵母及昆虫表达系统,修饰后的VP1 蛋白在自组装过程中改变了病毒颗粒的形态。。
综上所述,本研究获得的NoV-GⅡ.4-VLP 具有正确的颗粒构象、形态完整,且与NoV HBGA 受体的结合能力较高,为后续NoV 腺病毒载体口服黏膜免疫疫苗的研发奠定了基础。

