重组人白细胞介素-1受体拮抗剂免疫大鼠ELISA抗体阳性血清中和抗体活性检测方法的建立及验证
彭炳淮,刘景会,刘玉林,孙中涛,孙基伟,梁冠桥,俞露
长春生物制品研究所有限责任公司,吉林长春 130062
重组人白细胞介素-1 受体拮抗剂(recombinant human interleukin-1 receptor antagonist,rhIL-1Ra)可与IL-1 特异性结合,抑制IL-1 介导的各种炎性反应[1]。重组蛋白类药物在临床应用过程中需多次、长时间给药,可诱发免疫应答,产生中和抗体,影响药物的有效性[2-4],甚至可改变药物的药代动力学和药效学特性[5]。因此,对中和抗体的检测和分析是了解患者潜在免疫反应的有效方法[6]。在重组蛋白临床前研究阶段的动物安全评价中,动物血清中和抗体与重组蛋白活性位点的相互作用可干扰药物的活性和生物学功能,进而影响药物的毒理学研究[7-8]。因此,需要开发有效方法用于检测重组蛋白重复给药动物血清中的中和抗体。
抗体的检测方法包括ELISA 法、乳胶微球双色免疫层析法、快速侧流检测法、高通量成像细胞术等[9-12],但生物学活性试验可更直观地反映抗体对药物药效的抑制作用[13]。本研究以SD 大鼠为研究对象,采用基于D10G4·1 细胞的生物学活性试验对经ELISA 筛选为rhIL-1Ra 抗体阳性血清进行中和抗体活性确证,并对验证方法的专属性、灵敏度及精密性,以期建立一种灵敏、高效的用于rhIL-1Ra 重复免疫大鼠血清中和抗体检测的方法。
1 材料与方法
1.1细胞 D10G4·1 细胞购自中国食品药品检定研究院。
1.2主要试剂及仪器 rhIL-1Ra 标准品购自上海百迈博制药有限公司;rhIL-1Ra 注射剂、rhIL-2、兔抗rIFN-2b 单抗、兔抗rhIL-1Ra 单抗均由长春生物制品研究所有限责任公司提供;RPMI1640 培养基购自美国Gibco 公司;胎牛血清购自浙江天航生物科技公司;IL-1β 购自美国R&D 公司;β-巯基乙醇购自美国Sigma 公司;其他试剂均为国产分析纯;Protein A 层析柱购自博格隆生物技术有限公司;荧光素酶检测系统购自美国Promega 公司;96 孔带盖透明细胞培养板购自美国Corning 公司;96 孔白色底透酶标板购自上海晶安生物科技有限公司。
1.3实验动物 SPF级SD大鼠,12 ~13日龄,体质量20~36 g,共440 只,雌雄各半,购自北京维通利华实验动物技术有限公司,动物质量合格证号为:11001-1211109385542、11001121107563746、11001121110-8684445。本实验均以科研为目的进行动物的养殖和使用,并获得北京市科学技术委员会批准[文件号为:SYXK(京)2019-0006]。
1.4细胞培养 将D10G4·1 细胞用完全培养基(含10%胎牛血清、100 U rhIL-2、0.05 mmol/L β-巯基乙醇、100µg/mL Hygromycin B 的RPMI1640),于37 ℃培养至融合度达80%,按1∶3的比例进行细胞传代,2 d后选择对数生长期细胞用于后续试验。
1.5阳性血清的筛选 采用ELISA 法。将rhIL-1Ra注射液分别按3、20、100 mg/kg经皮下注射SD 大鼠(低、中、高剂量组),同时设空白对照组(不给药),每组10 只,雌雄各半,每天给药2 次,间隔至少4 h,连续给药13 周。于给药2 周(D15)、4 周(D29)、8 周(D57)、13周(D92)及恢复期2 周(D106)、恢复期结束(D120)时,经大鼠颈静脉采血,分离血清,送北京昭衍新药研究中心股份有限公司采用ELISA 法检测抗体滴度,将筛选的阳性抗体血清样本经13 201×g离心30 min,取上清,经Protein A层析柱纯化,用PBS调节pH为7.0~7.5,浓缩至初始体积,于-80 ℃保存。
1.6中和抗体活性检测方法的建立 采用D10G4·1细胞生物学活性试验。将浓度为2µg/mL的rhIL-1Ra注射剂及rhIL-1Ra标准品(以20µg/mL为起始浓度,进行4 倍系列稀释,共8 个稀释度)加入96 孔带盖透明细胞培养板,30 µL/孔,再加入等体积分数的血清,同时设细胞对照(完全培养基)、PBS 对照(仅含PBS)、阴性对照(仅含血清)、阳性对照(4µg/mL的兔抗rhIL-1Ra单抗)、rhIL-1Ra对照(5µg/mL的rhIL-1Ra注射剂),60µL/孔,于37 ℃,5%CO2细胞培养箱孵育1 h;各孔样品取50µL,转移至96孔白色底透酶标板。调节对数生长期D10G4·1 细胞浓度至(2.0~2.5)×105个/mL,加入IL-1β至终浓度为3 ng/mL,混匀,同时设无IL-1β的空白对照,100µL/孔,37 ℃,5%CO2细胞培养箱培养20~24 h;加入荧光素底物,80µL/孔,避光振荡2 min,用酶标仪测定荧光值(RLU)。以rhIL-1Ra 标准品浓度为横坐标,RLU为纵坐标绘制标准曲线。阴性对照与1µg/mL rhIL-1Ra标准品RLU偏差应≤20%;无IL-1β 的细胞对照组应与阴性对照一致,有IL-1β的细胞对照及PBS对照RLU与rhIL-1Ra标准品第8个稀释孔RLU的均值偏差应≤20%;rhIL-1Ra对照与rhIL-1Ra 标准品第1 个稀释孔RLU 的均值偏差应≤20%。满足上述条件判定试验成立。以阴性对照组RLU 的均值作为阴阳性判定临界值,若高于临界值,判为中和反应呈阳性,即对应血清样本中含有rhIL-1Ra中和抗体。
1.7方法的验证
1.7.1专属性分别取兔抗rIFN-2b单抗(4µg/mL)及其与rhIL-1Ra标准品(20µg/mL)混合物(37 ℃孵育1 h),另取兔抗rhIL-1Ra单抗,按1.6项方法检测,并与rhIL-1Ra标准品的四参数回归曲线进行对比。
1.7.2灵敏度将兔抗rhIL-1Ra 单抗稀释为12 000、2 400、1 200、800、600、480、400、342.86 µg/mL,分别与浓度为2µg/mL 的rhIL-1Ra 标准品进行孵育,每个浓度设8个复孔,按1.6项方法进行检测。以抗体浓度对数为横坐标,RLU 均值对数为纵坐标,建立四参数回归曲线,获得回归方程。将浓度为1µg/mL rhIL-1Ra标准品的RLU 作为临界值代入回归方程,得到的阳性抗体浓度即为方法灵敏度。
1.7.3精密性 将兔抗rhIL-1Ra 单抗稀释为1 200、600、300µg/mL,分别与浓度为2µg/mL的rhIL-1Ra标准品进行孵育,按1.6项方法进行检测,每个浓度设5个复孔,由2名实验人员于3 d进行3次重复检测,计算每名实验员重复检测3次RLU的CV及2名实验员对每个浓度重复检测6次RLU的CV,CV均应≤20%。
1.8方法的应用 采用建立的方法检测经ELISA 筛选为rhIL-1Ra抗体阳性大鼠血清的中和抗体,同时设阴性对照(未免疫小鼠血清)及阳性对照(兔抗rhIL-1Ra单抗),并按下式计算抗体中和率。
抗体中和率(%)=(样品RLU-阴性对照RLU)/(阳性对照RLU-阴性对照RLU)×100%
1.9数据采集及分析 应用Gen5 GHS 3.08 软件进行数据采集、分析及作图。
2 结果
2.1大鼠血清的筛选 给药13 周后,空白对照组血清抗体大部分为阴性,个别动物检测到阳性抗体(<1∶100),可能与基质中存在非特异性干扰有关;低、中、高剂量组大鼠对rhIL-1Ra 注射液均产生了免疫反应,且性别差异较小。给药后D15,随着给药次数的增加,抗体滴度逐渐增强,至恢复期D106 和D120仍有抗体存在,且滴度较高。高、中剂量组的抗体滴度略低于低剂量组。见表1和表2。

表1 雄性大鼠血清抗体的检测结果Tab.1 Detection results of serum antibody in male rats

表2 雌性大鼠血清抗体的检测结果Tab.2 Detection results of serum antibody in female rats
2.2方法的验证
2.2.1专属性 兔抗rIFN-2b单抗+rhIL-1Ra标准品及rhIL-1Ra标准品的四参数回归曲线均呈倒S形,上下平台完整,具有明显的剂量效应关系,二者曲线基本重合。兔抗rIFN-2b 单抗的曲线不呈倒S 形,无上下平台,无剂量效应关系,表明该抗体无中和效应。兔抗rhIL-1Ra 单抗曲线与rhIL-1Ra 标准品曲线基本平行,且曲线明显右移,表明兔抗rhIL-1Ra单抗对IL-1Ra 有明显的中和作用,见图1。表明该方法具有良好的专属性。

图1 专属性验证结果Fig.1 Verification for specificity
2.2.2灵敏度 兔抗rhIL-1Ra单抗浓度为12 000、2 400、1 200 µg/mL 的RLU 相似,因此选择1 200 µg/mL为曲线模拟的起始点,将临界值代入曲线方程获得灵敏度为171.93µg/mL,见图2。
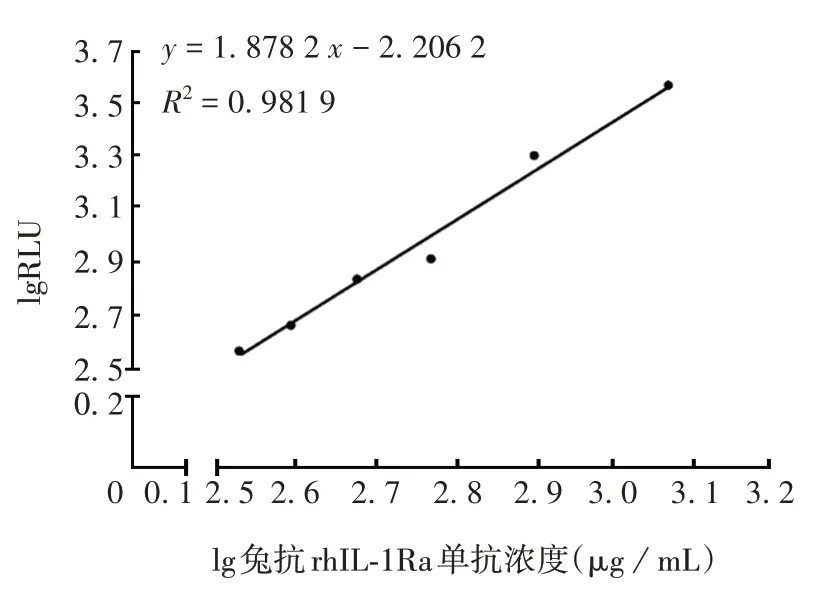
图2 灵敏度验证结果Fig.2 Verification for sensitivity
2.2.3精密性 每名实验员重复检测3次1 200、600、300µg/mL兔抗rhIL-1Ra单抗RLU的CV为2.56%~18.1%,均≤20%,见表3。2名实验员对各浓度(1 200、600、300µg/mL)兔抗rhIL-1Ra单抗重复检测6次RLU的均值分别为3 828.56、986.44、408.68,SD分别为151.06、63.11、29.07,CV分别为3.95%、6.40%、7.11%,均≤20%。表明该方法具有良好的精密性。
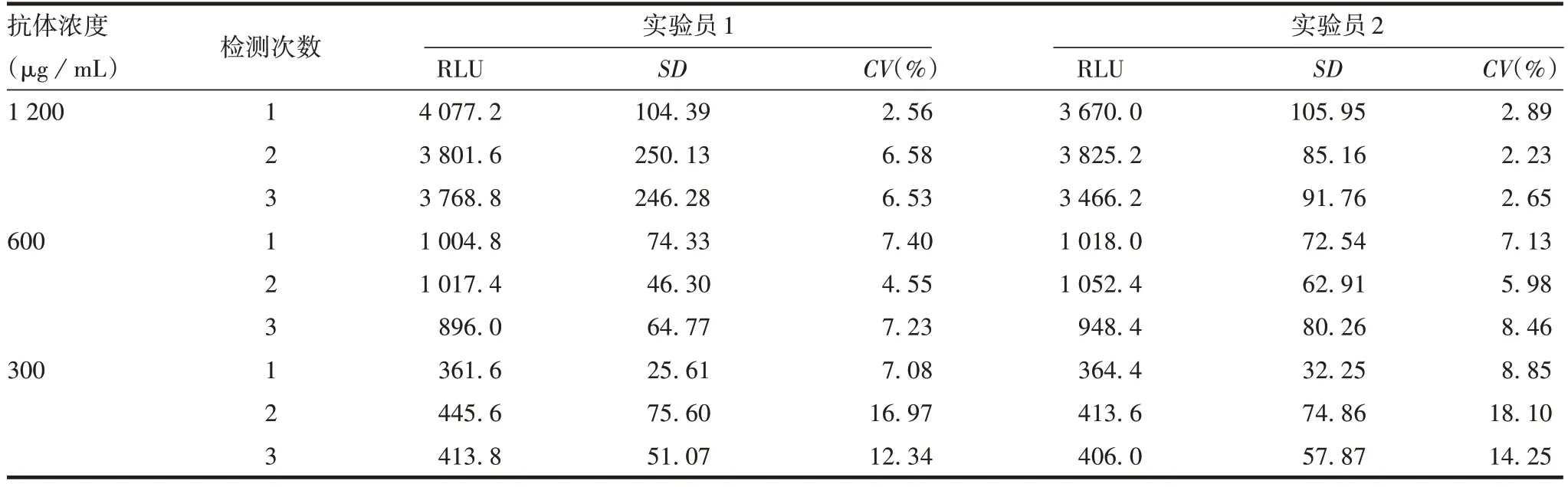
表3 精密性验证结果Tab.3 Verification for precision
2.3方法的应用 经检测,ELISA 筛选的阳性抗体血清对rhIL-1Ra 注射液均可产生中和效应,与ELISA检测结果相符。见表4和表5。

表4 雄性SD大鼠血清中和抗体检测结果Tab. 4 Detection results of neutralizing antibody in serum of male SD rats

表5 雌性SD大鼠血清中和抗体检测结果Tab. 5 Detection results of neutralizing antibody in serum of female SD rats
3 讨论
本研究参考FDA指导原则中关于治疗性蛋白药物免疫原性检测方法,采用抗体筛选和确证的分层式方法对rhIL-1Ra 重复给药大鼠血清中和抗体进行分析[14]。动物重复给药毒性试验的血清样本数量较大,本研究建立的方法能够对样品进行较高通量的快速检测[15-16]。预试验结果显示,血清成分对检测细胞的生长有影响,会对rhIL-1Ra 的生物学检测造成干扰。为减少血清样本的干扰,一般会对样品进行前处理,处理方法包括单独酸解离法、药物靶标法、亲和捕获洗脱法、酸解离固相萃取法、沉淀结合酸解离法及生物素化药物提取结合酸解离法等[17-18]。本研究参考MCCUTCHEON 等[19]提出的Protein A 层析柱纯化血清预处理方法,将血清中的抗体成分纯化后再进行检测。
本研究在报告基因法检测rhIL-1Ra 活性模型的基础上建立中和抗体活性确证的方法,并进行了验证。报告基因法由于灵敏度较高,操作简便、周期短、成本低、高通量、变异度小、且可模拟制品的生物学作用等优点已逐渐发展为平台化技术[20-22]。本研究确立了临界点的范围和评判标准,可快速高效对结果进行判定,并确定该方法灵敏度为171.93µg/mL。专属性验证结果显示,建立的方法对其他药物抗体不产生中和反应,仅对兔抗rhIL-1Ra 单抗产生中和反应,表明该方法具有良好的专属性。精密性验证结果显示,不同实验员不同时间检测结果的CV均<20%。
综上所述,本研究建立的rhIL-1Ra 免疫大鼠血清中和抗体活性检测方法具有良好的专属性、精密性及较高的灵敏度,且操作简单、可行性强,可用于rhIL-1Ra 重复给药动物血清中和抗体活性的检测。

