Hib荚膜多糖在疫苗制备周期中的结构稳定性
张腾腾,秦春君,尹珊珊,刘翠,刘建凯,尹健,佟巍
1.北京民海生物科技有限公司,北京 102600;
2.江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡 214122
b 型流感嗜血杆菌(Haemophilus influenzaetype b,Hib)是引起儿童侵袭性细菌感染的主要原因之一[1]。儿童感染后会引起脑膜炎、肺炎、败血症、化脓性关节炎、骨髓炎、心包炎、蜂窝织炎、会厌炎等疾病[2-3]。Hib的主要毒力因子为荚膜多糖(capsular polysaccharide,CPS),其基本单元为聚核糖基核糖醇磷酸酯(polyribosylribitol phosphate,PRP),具有较好的免疫原性,能在人体中诱导产生保护性抗体[4-5]。预防和控制Hib 传染病的有效措施是接种Hib 疫苗[6-7]。由于多糖疫苗不能引发T 细胞依赖型免疫反应,在婴幼儿中保护效果较差,现已被结合疫苗取代[8-9]。Hib 结合疫苗是将多糖PRP 与载体蛋白通过共价键连接,使其由非T 细胞依赖性抗原转变成T 细胞依赖性抗原,从而激发细胞免疫,产生免疫记忆[7,10-11]。Hib荚膜多糖PRP重复单元的结构见图1[12]。
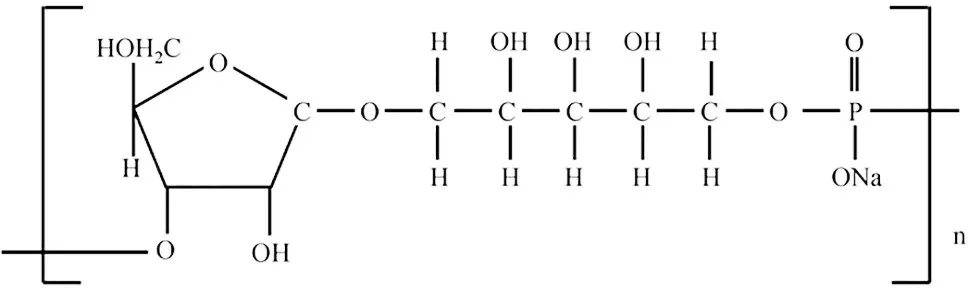
图1 Hib荚膜多糖PRP重复单元结构图Fig.1 Structure diagram of Hib capsular polysaccharide PRP repeat unit
核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)技术是研究原子核对射频辐射的吸收,类似红外或紫外光谱,在适当的磁场条件下,样品能够吸收射频区的电辐射,而且所吸收的辐射频率取决于样品特性,用吸收峰频率对吸收峰强度绘图构成NMR谱图[13]。NMR是对各种有机物、无机物的成分或结构进行定性或定量分析的最有效工具之一,其在分析化学、生命科学、材料检测等领域广泛应用[14-18]。特别是2D NMR 的出现和发展,使NMR成为糖类物质结构解析的主要工具[19]。
结构是多糖活性的基础,不同化学结构的多糖具有不同的生物活性,解析多糖的结构是揭示其构效关系的关键环节[20-21]。Hib 结合疫苗制备过程中存在剧烈的化学反应。为探讨Hib 结合疫苗制备过程中PRP 的结构变化情况,本研究采用1H-NMR、13CNMR、31P-NMR及1H-1H COSY、1H-13C HSQC等2D-NMR技术,探讨Hib PRP 在疫苗制备周期中的结构变化,以期评价Hib PRP在疫苗制备周期中的稳定性。
1 材料与方法
1.1菌株 Hib菌种源自常州市第二人民医院3月龄重症肺炎患儿,编号:MH200201[22]。本研究获得江南大学医学伦理委员会批准(JNU20020104IRB09)。
1.2主要试剂及仪器 胰蛋白胨购自美国Thermo Fisher公司;酵母浸出粉购自德国MERCK公司;破伤风类毒素购自北京民海生物科技有限公司;十六烷基三甲基溴化铵购自美国VWR Chemicals LLC;酪蛋白胨、氯化血红素、辅酶、溴化氰、己二酰肼(ADH)、碳二亚胺、乙腈购自美国SIGMA-ALDRICH 公司;Sepharose 4 Fast Flow 购自美国Cytiva 公司;600 L 发酵罐购自上海高机生物工程有限公司;pH 计购自瑞士梅特勒托利多;层析系统购自美国GE公司;400 MHz核磁共振谱仪和DRX 600 MHz核磁共振波谱仪购自德国Bruker公司。
1.3Hib 精制多糖的制备 将Hib 菌种于35 ~38 ℃条件下培养14 ~20 h,传2代后,于36 ~38 ℃条件下培养2 ~5 h,再传2代,按A550为0.05 ~0.3时的接种密度接种至600 L发酵罐,控制pH为7 ~7.2、温度为36 ~38 ℃,进行发酵培养,并适时补充500 g/L葡糖糖,6 h后停止发酵,加入1%甲醛溶液灭活。将灭活的发酵液(12 000 ~20 000)×g连续流去菌体后,采用十六烷基三甲基溴化铵沉淀收集复合多糖,再经乙醇、丙酮、苯酚进一步提取,得到Hib精制多糖。试验重复2 次。获得3 批(34-20011001、34-20011002、34-20031003)Hib 精制多糖。按照《中国药典》三部(2020版)[23]要求进行相关检测。
1.4Hib多糖衍生物的制备 参考尹珊珊[24]方法,使用氯化钠溶液分别溶解34-20011001、34-20011002、34-20031003 批Hib 精制多糖,并调节pH 至10 ~11,按照(0.5 ~1.0)mg 溴化氰/mg 多糖的比例,加入溴化氰溶液,活化多糖;多糖活化后,再次调节pH 至8.5 ~9.5,按照3.5 mg ADH/mg 多糖的比例,加入ADH 溶液衍生多糖,使ADH 与多糖共价连接;用氯化钠溶液从衍生后多糖溶液中置换出残留溴化氰、ADH 等杂质,获得Hib 多糖衍生物。试验重复2 次。获得3 批(34-20123038、34-20123041、34-20123044)Hib 多糖衍生物。按照《中国药典》三部(2020 版)[23]要求进行相关检测。
1.5Hib 多糖蛋白结合物的制备将Hib 多糖衍生物的pH 调节至5.7±0.3,参考孙晓东等[22]方法,按照破伤风类毒素∶多糖质量比为0.8∶1 ~1∶1,向多糖衍生物中加入破伤风类毒素。同时向上述反应体系中加入碳二亚胺至终浓度为20 ~60 mg/mL,并维持pH 为5.8±0.3,于2 ~8 ℃反应2 ~6 h,以便破伤风类毒素通过ADH 与多糖共价连接;结合物经氯化钠溶液透析后,用Sepharose 4 Fast Flow 层析柱纯化,流动相为氯化钠溶液,监测波长为280 nm,收集V0附近洗脱液,获得Hib多糖蛋白结合物。试验重复2次。获得3 批(34-20123038、34-20123041、34-20123044)Hib 多糖蛋白结合物,按照《中国药典》三部(2020版)[23]要求进行相关检测。
1.6核磁方法 参考QIN等[16]方法进行1H-NMR、31PNMR扫描;13C-NMR、1H-1H COSY、1H-13C HSQC、HMBC的参数设置见表1。
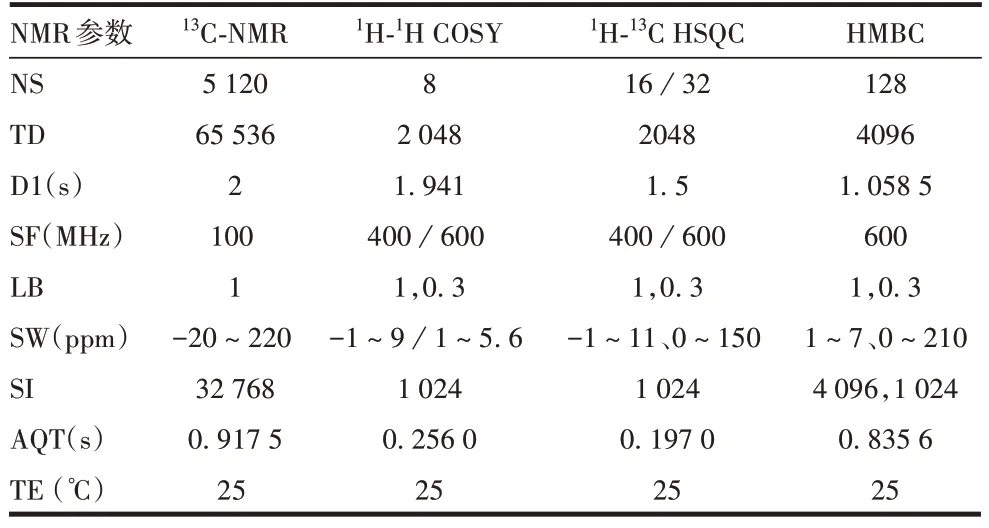
表1 NMR参数设置Tab.1 NMR parameter setting
2 结果
2.1Hib精制多糖的鉴定Hib精制多糖的各项检查结果均符合标准要求,且3批精制多糖检测结果基本一致,见表2。表明Hib精制多糖的制备工艺稳定性良好。

表2 Hib精制多糖鉴定结果Tab.2 Identification results of Hib capsular polysaccharides
3批Hib 精制多糖的1H-NMR、13C-NMR、31P-NMR谱图具有良好的一致性,见图2。表明3 批Hib 精制多糖品质良好且稳定,精制多糖制备工艺稳定。
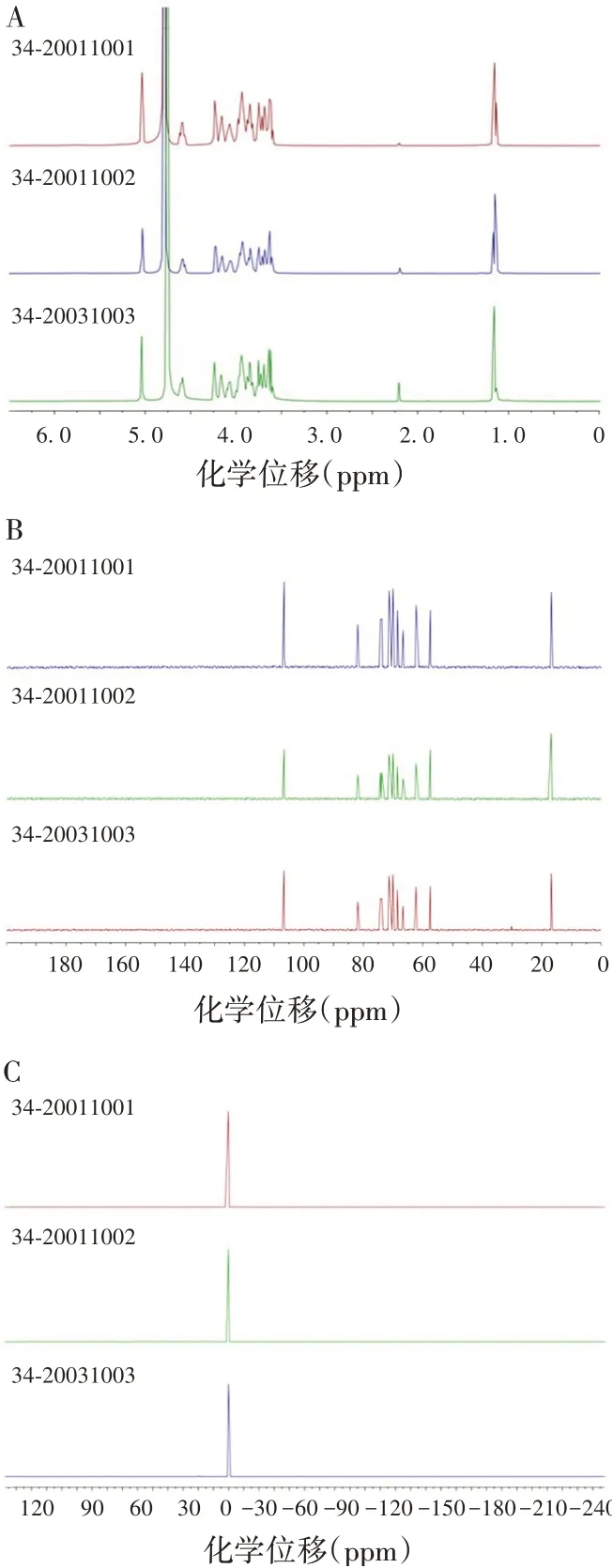
图2 3批Hib精制多糖的NMR谱图Fig.2 NMR spectroscopy of three batches of Hib capsular polysaccharides
3批精制多糖的NMR谱图均具有良好的一致性,因此选择34-20011001 批精制多糖作为研究对象,其1H-NMR报告:δ=5.04、4.59、4.23、4.16、4.16、4.08、3.99 ~3.90、3.88 ~3.82、3.75、3.73 ~3.64、3.61、2.20、1.15 ppm,13C-NMR 报告:δ = 106.64、81.90、74.25、73.70、73.67、71.33、70.88、70.05、68.55、66.68、62.26、57.41、16.79 ppm,31P-NMR报告:δ=0.17 ppm。根据PRP的化学结构结合Hib精制多糖的1H-13C HSQC、1H-1H COSY 谱图分析,可知1H-NMR 中3.61 ppm 附近为乙醇的亚甲基(-CH2)中H 信号,2.20 ppm 附近为丙酮的甲基(-CH3)中H 信号,1.15 ppm 附近为乙醇的甲基(-CH3)中H信号,其余均为Hib荚膜多糖相关H 信号;13C-NMR 图谱中57.41 ppm 附近为乙醇的亚甲基(-CH2)中C 信号,16.79 ppm 附近为乙醇的甲基(-CH3)中C 信号,其余均为Hib 荚膜多糖相关C 信号;31P-NMR在0.17 ppm附近有磷酸酯中P信号。在1HNMR、13C-NMR、31P-NMR、1H-13C HSQC、1H-1H COSY谱图中,将每个峰进行归属。见图3。
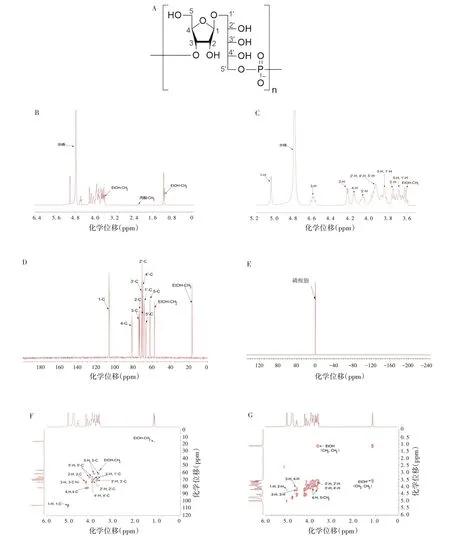
图3 Hib荚膜多糖的NMR谱图Fig.3 NMR spectroscopy of Hib capsular polysaccharides
2.2Hib多糖衍生物的鉴定 Hib多糖衍生物各项检测结果均符合标准要求,且3 批多糖衍生物检测结果一致,见表3。表明Hib 多糖衍生物的制备工艺稳定性良好。
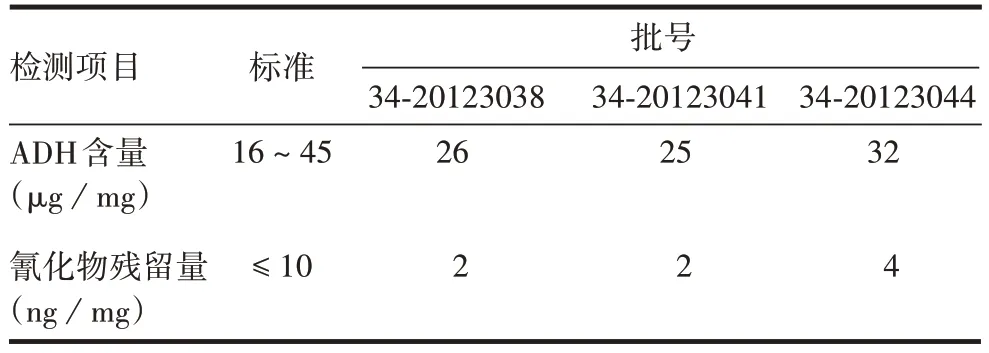
表3 多糖衍生物的鉴定结果Tab.3 Identification results of polysaccharide derivatives
3 批Hib 多糖衍生物的1H-NMR、13C-NMR、31PNMR 谱图具有良好的一致性,见图4。表明3 批Hib多糖衍生物品质良好且稳定,多糖衍生物的制备工艺稳定。
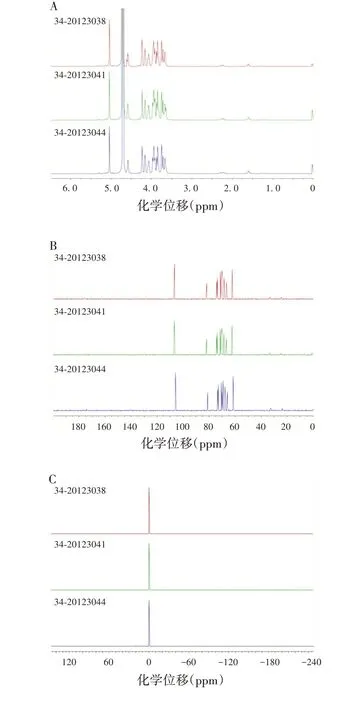
图4 3批Hib多糖衍生物的NMR谱图Fig.4 NMR spectroscopy of three batches of Hib polysaccharide derivatives
3 批Hib 多糖衍生物的NMR 谱图均具有良好的一致性,因此选择34-20123038 批多糖衍生物作为研究对象,在其1H-NMR 谱图1.60、2.26 ppm 附近,发现与ADH 相关的H 信号;在13C-NMR 谱图24.5、33.28、175.3 ppm 附近,发现ADH 的C 信号;同时在1H-13C HSQC、1H-1H COSY、HMBC 谱图中,均发现了与ADH 相关的信号。见图5。表明Hib 多糖衍生物已连接ADH。

图5 Hib多糖衍生物的NMR谱图Fig.5 NMR spectroscopy of Hib polysaccharide derivatives
2.3Hib多糖蛋白结合物的鉴定 Hib多糖蛋白结合物各项检测结果均符合标准要求,且3 批多糖蛋白结合物检测结果一致,见表4。表明Hib 多糖蛋白结合物的制备工艺稳定性良好。
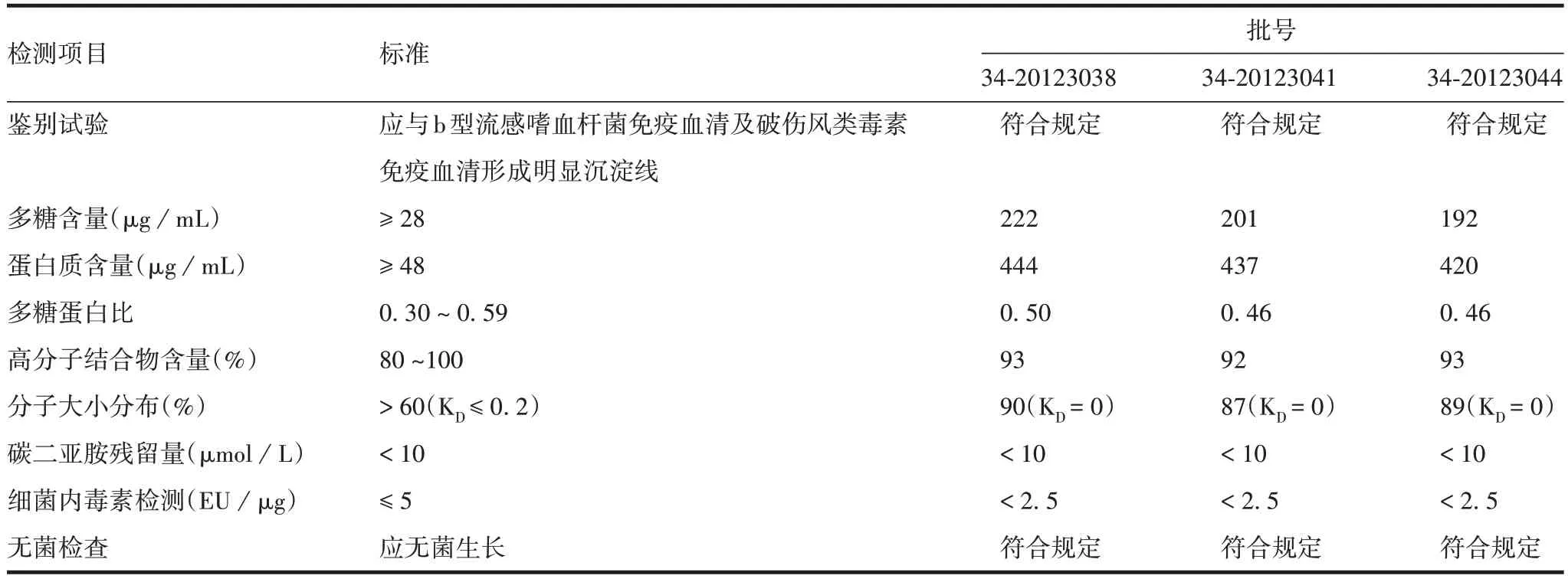
表4 多糖蛋白结合物的鉴定结果Tab.4 Identification results of protein-conjugated polysaccharides
3 批Hib 多糖蛋白结合物的1H-NMR、13C-NMR、31P-NMR 谱图具有良好的一致性,见图6。表明3 批Hib多糖蛋白结合物品质良好且稳定,多糖蛋白结合物的制备工艺稳定。
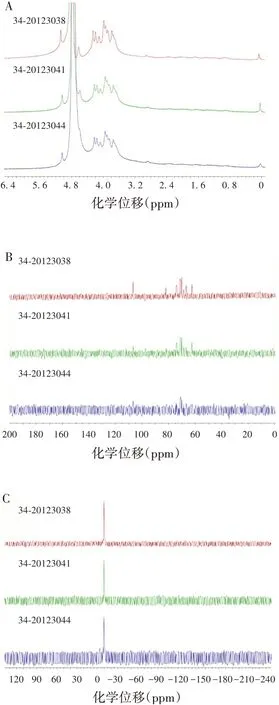
图6 3批Hib多糖蛋白结合物NMR谱图Fig.6 NMR spectroscopy of three batches of protein-conjugated polysaccharides
3 批Hib 多糖蛋白结合物NMR 谱图均具有良好的一致性,因此选择34-20123038批多糖蛋白结合物作为研究对象,在其1H-NMR谱图0.75 ~3.0 ppm处,有相应H信号,有别于Hib精制多糖和多糖衍生物1HNMR谱图,推测为ADH和蛋白质上的相关H信号;在13C-NMR谱图24.5、33.28、175.3 ppm附近,ADH相关C信号不明显,可能是连接上载体蛋白后,ADH 相对含量较低导致未能体现在谱图中;同时在1H-13C HSQC、1H-1H COSY 谱图,发现与Hib 精制多糖相似的信号,表明Hib多糖已连接上了蛋白质。见图7。
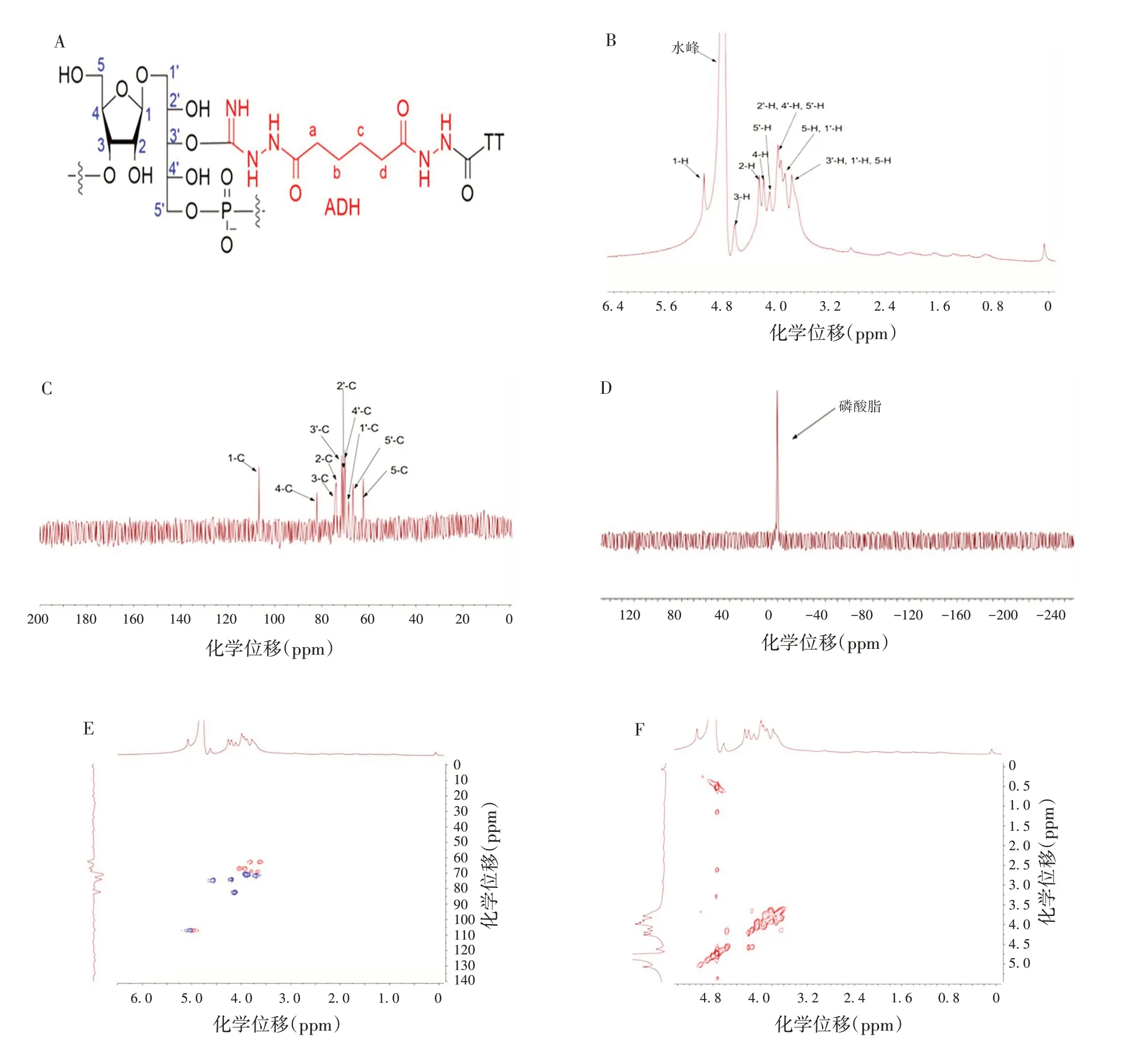
图7 Hib多糖蛋白结合物的NMR谱图Fig.7 NMR spectroscopy of Hib protein-conjugated polysaccharides
2.4PRP 结构的变化情况 为探讨PRP 在疫苗制备全生命周期中结构的变化情况,将Hib 精制多糖、多糖衍生物、多糖蛋白结合物的1H-NMR、13C-NMR、31PNMR 谱图分别进行叠加对比,可以看出除乙醇、丙酮、ADH相关信号峰的差异外,与PRP结构相关的信号峰基本一致,见图8。表明PRP 结构在Hib 精制多糖、多糖衍生物、多糖蛋白结合物中的谱图均未发生明显变化。
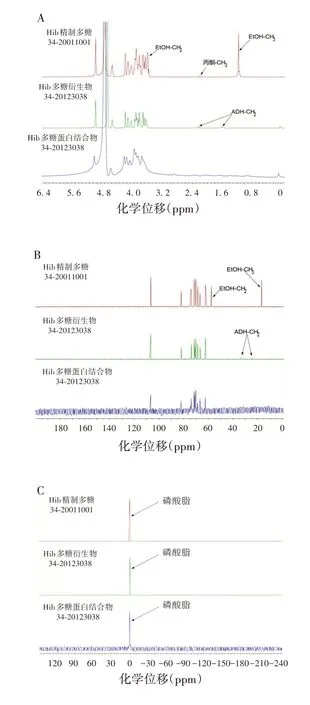
图8 Hib精制多糖、多糖衍生物、多糖蛋白结合物的谱图对比图Fig.8 Comparison of spectroscopy of Hib capsular polysaccharides,derivatives and protein-conjugated polysaccharides
3 讨论
Hib 荚膜多糖是由多个聚核糖基核糖醇磷酸酯重复单元组成,是Hib 结合疫苗中的免疫原[25]。结构是多糖活性的基础[26],研究多糖结构的变化情况有重要意义。Hib 结合疫苗制备过程中Hib 荚膜多糖经过化学反应(活化、衍生),再与载体蛋白进行偶联,该过程中涉及剧烈的化学反应,Hib PRP 的结构是否发生变化是值得探讨的问题。本研究依托Hib PRP 的基本结构,利用核磁谱图进行解析,在1HNMR、13C-NMR、31P-NMR 谱图中,将Hib PRP 基本单元中的H、C、P 一一归属,并与已报道的Hib 多糖1HNMR 谱图[27]经对比基本一致。Hib 荚膜多糖的1HNMR、13C-NMR 谱图中具有乙醇和丙酮相关信号,表明Hib 精制多糖中残留一定的乙醇和丙酮,但在Hib多糖衍生物和多糖蛋白结合物的1H-NMR、13C-NMR谱图中并未发现与乙醇和丙酮相关信号,表明后续工艺可显著降低乙醇和丙酮的残留水平。Hib 多糖衍生物的1H-NMR、13C-NMR 谱图可明显看出ADH 相关信号,表明已将ADH 连接至Hib 多糖上。而Hib多糖蛋白结合物1H-NMR 谱图中的0.75 ~3.0 ppm处具有与蛋白相关的H 信号,但不能清晰归属;13CNMR 谱图ADH 相关信号峰也未能在谱图中很好体现,均与Hib 多糖衍生物连接上蛋白载体后,导致多糖和ADH相对浓度较低相关。
本研究通过NMR 技术研究Hib 荚膜多糖、多糖衍生物、结合物的结构,结果显示,Hib荚膜多糖到多糖衍生物再到结合物,其基本结构并未发生变化,表明作为Hib 结合疫苗主要抗原的PRP 结构,在疫苗制备的全生命周期内,具有良好的稳定性,即Hib 结合疫苗主要抗原基本结构在疫苗制备周期内具有良好的稳定性。

