Ⅰ型人免疫缺陷病毒调控蛋白顺式转录激活因子的功能及其与疾病的相关性
李远航,陈睿鑫 综述,杜娟 审校
吉林大学白求恩第一医院转化医学研究院艾滋病与病毒研究所,吉林长春 130021
获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS),又称艾滋病,自1981 年首次被报道以来[1],人免疫缺陷病毒(human immunodeficiency virus,HIV)的传播一直是全球公共卫生难题之一。我国国家卫生健康委员会发布的《2021 年全国法定传染病疫情概况》显示,2021年全国因HIV感染死亡的人数为19 623 人,占2021 年全国因甲乙丙类传染病死亡总人数的88.40%。因此,防治HIV 感染依然是我国传染病疫情防控的重点之一。
HIV 属于逆转录病毒科慢病毒属(RetroviridaLentivirus),是一类RNA 病毒,其包膜的病毒颗粒中包含2 条正链RNA 基因组[2-3]。按照病毒基因组编码的蛋白,将HIV 分为Ⅰ型人免疫缺陷病毒(human immunodeficiency virus type 1,HIV-1)和HIV-2,其中HIV-1 在全球范围内广泛流行。HIV-1 的单条RNA基因组平均长度约9 400 nt,编码3 种结构蛋白和6种非结构蛋白。其中结构蛋白是组装成子代病毒颗粒所必需的,而非结构蛋白则更主要是在被感染的细胞中发挥功能,起到抑制细胞抗病毒机能以及促进病毒感染和复制的作用,而顺式转录激活因子(trans-activator of transcription,Tat)正是这种非结构蛋白。本文主要综述了HIV-1中重要的调控蛋白Tat的功能,以及其与HIV-1复制及HIV-1相关的神经认知紊乱症(HIV-associated neurocognitive disorder,HAND)的相关性,以明确研发靶向Tat 蛋白的抗AIDS 药物的重要性。
1 Tat简介
在HIV-1 基因组包含的9 种基因中,Tat是比较特殊的存在,与其他单外显子形式的病毒基因不同,Tat基因由2 个外显子(exon1和exon2)组成,在病毒RNA转录后需进一步通过剪接来形成完整的开放阅读框,以实现Tat蛋白的表达[4-5]。exon1编码了Tat蛋白的前72 个氨基酸(有时也被称为Exon1),其中包含了Tat蛋白发挥所有已知功能的全部结构域,包括1 ~20 位的酸性结构域、21 ~40 位的锌指结构域、41 ~48 位的核心结构域、49 ~57 位的碱性结构域及58 ~72 位的富含谷氨酰胺的结构域(见图1)[6]。其中前3个结构域负责结合顺式转录调控相关因子[即正转录延伸因子b(positive transcription elongation factor b,P-TEFb)复合物];碱性结构域负责Tat 蛋白的核定位及与RNA 结合,同时还与11位色氨酸一起负责Tat 蛋白的分泌。由于宿主细胞内存在修饰HIV基因组的细胞因子(如APOBEC3 家族等)及病毒在感染过程中受到宿主免疫系统的筛选压力等原因,导致HIV-1成为一种突变比较频繁的病毒。然而,在此前提下,Exon1 的蛋白序列仍然是HIV-1 中最保守的病毒蛋白序列之一,这是由于Tat蛋白的功能对于HIV-1 的复制至关重要,因此该段蛋白序列,特别是负责顺式转录激活功能的前57 个氨基酸,无法承受突变带来的影响。

图1 Tat蛋白结构及功能示意图Fig.1 Structure and function diagram of Tat protein
在不同的HIV-1 毒株中,Tat 蛋白的长度分为2种(86 或101 个氨基酸),而长度的不同由exon2决定。学术界普遍将exon2编码的区域称为Exon2。一般认为,Exon2 并不决定Tat 蛋白的功能,或者说Exon2 并非Tat 蛋白发挥功能所必需的结构域。因此,与Exon1 相比,Exon2 区域的蛋白序列保守性相对较差。研究表明,Exon2 可影响HIV-1 在巨噬细胞中的复制能力[7],因此推测Exon2 可能对Tat 蛋白的功能产生影响。此外,对于长度为101个氨基酸的Tat蛋白来说,其Exon2包含1段与核转录因子-κB(nuclear transcription factor-κB,NF-κB)结合的区域,因此可能参与NF-κB相关的基因转录调控。
2 Tat蛋白的功能
Tat 蛋白虽然仅由86 或101 个氨基酸组成,但其却可发挥多种生物学功能,包括劫持宿主细胞内转录调控机制、调控宿主细胞内基因表达、劫持宿主细胞内蛋白降解机制等。以下对这3种功能进行介绍。
2.1Tat 可劫持宿主细胞内转录调控复合物P-TEFb作为逆转录病毒,HIV-1 在感染细胞后,需将自身逆转录产生的DNA 整合至宿主细胞基因组,再利用宿主转录机制合成新的病毒RNA。但宿主细胞是利用多重机制来抑制HIV-1 RNA的转录,特别是阻断RNA转录的延伸过程(见图2),同时,由于宿主细胞内RNA剪接机制的存在,HIV-1 RNA 在被完全剪接前不会被释放至细胞质中。因此,在病毒DNA 整合后的初期,病毒RNA产量很低,且几乎无法形成完整的病毒基因组RNA。

图2 Tat蛋白激活HIV-1转录的机制Fig.2 Mechanism of activation of HIV-1 transcription by Tat protein
上文提到,tat是HIV-1基因组上为数不多的由2个外显子组成的病毒基因。相应的,宿主细胞对HIV-1 RNA的完整剪切确保了Tat蛋白是HIV-1基因组整合后表达的第1 批蛋白之一。当Tat 蛋白表达后,一方面利用自身的碱性结构域与刚开始转录形成的HIV-1 RNA的5′端形成相互作用[8],该段可结合Tat蛋白的序列被称为顺式激活响应元件(trans-activation response,TAR)(见图2);另一方面,Tat 通过自身的1 ~49 位氨基酸结合由细胞周期蛋白T1(cyclin T1)和细胞周期蛋白依赖性激酶9(cyclin-dependent kinase 9,CDK9)组成的P-TEFb[9]。这两种结合相互独立,无先后顺序。但当Tat-TAR-P-TEFb 三者共同形成复合物时,CDK9作为一种介导蛋白磷酸化的激酶就可作用至与HIV-1 DNA和RNA结合的转录复合物及调控因子上,而其中最重要的是Ⅱ型RNA 聚合酶(RNA polymeraseⅡ,PolⅡ)(见图2)[10-11]。人细胞内PolⅡ蛋白在C-末端结构域(C-terminal domain,CTD)存在1个7氨基酸重复序列,其中每段重复序列的第2 和5 位丝氨酸(serine,S)的磷酸化程度会影响RNA转录的起始和延伸。Tat-TAR-P-TEFb 复合物的形成在物理上增加了P-TEFb与PolⅡ接触的几率,从而PTEFb 组分CDK9 通过激酶活性将PolⅡ的磷酸化方式从促进转录起始的S2 磷酸化修改为促进转录延伸的S5 磷酸化,从而实现全长HIV-1 RNA 的合成。只有全长HIV-1 RNA合成后,再利用宿主细胞的RNA剪接机制,才能实现所有HIV-1蛋白的表达。
借由这种方式,Tat可极大地促进HIV-1 RNA 的转录效率,进而实现病毒蛋白的表达和子代病毒颗粒的产生。因此,Tat蛋白对于HIV-1的有效复制至关重要,而释放的病毒颗粒进一步感染其他以CD4+T细胞为主的免疫细胞,在抑制细胞分裂的同时诱导这些细胞死亡,降低感染者的免疫力,进而导致AIDS。因此,通过抑制Tat 促进病毒转录功能来阻断HIV-1的复制一直是领域内的研究热点,也是众多学者急于攻克的难题。
2.2Tat蛋白影响细胞转录因子NF-κB的活性 Tat与P-TEFb 间的相互作用主要是调控HIV-1 本身RNA的转录,而Tat还可通过多种方式调控宿主细胞内其他基因的表达[12]。其中研究比较深入的为Tat 蛋白可影响宿主细胞转录因子NF-κB 的活性,并借此改变下游基因的转录水平(见图3)。NF-κB 是由多个不同种类蛋白组成的二聚体,其中由p65和p60组成的异源二聚体被认为是人体细胞中NF-κB 的主要功能形式。在人体细胞中,NF-κB 是重要的转录调控因子之一,其活性受多种信号传导通路的调节,并作用在多种不同基因上,对细胞的多种生物学活性均至关重要。有研究表明,Tat蛋白可特异性地结合NFκB 的抑制因子-α(NF-κB inhibitor-α,IκB-α),使后者从NF-κB 上脱离,从而导致NF-κB 进入细胞核并发挥转录调控的功能[13-15]。此外,在长度为101个氨基酸的Tat 蛋白上,其Exon2 区域存在相对保守的序列片段(85ESKKKVE91),该片段可特异性地识别NF-κB本身,使Tat可直接调控NF-κB的功能[16]。Tat对NFκB 功能的调控可引起细胞内多种基因表达水平的变化,其中包括HIV-1 感染所需的辅助受体,如趋化因子受体4(chemokine receptor 4,CXCR4)和趋化性细胞因子受体5(cemotactic cytokine receptor 5,CCR5),以及多种炎性相关因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、趋化因子配体2(chemokine ligand 2,CCL2)、白细胞介素-4(interleukin-4,IL-4)和IL-10 等[17]。与此同时,NF-κB 同样也可识别整合后的HIV-1 的基因组DNA[18]。因此,Tat 也可通过调控NF-κB活性来促进HIV-1 RNA的表达。
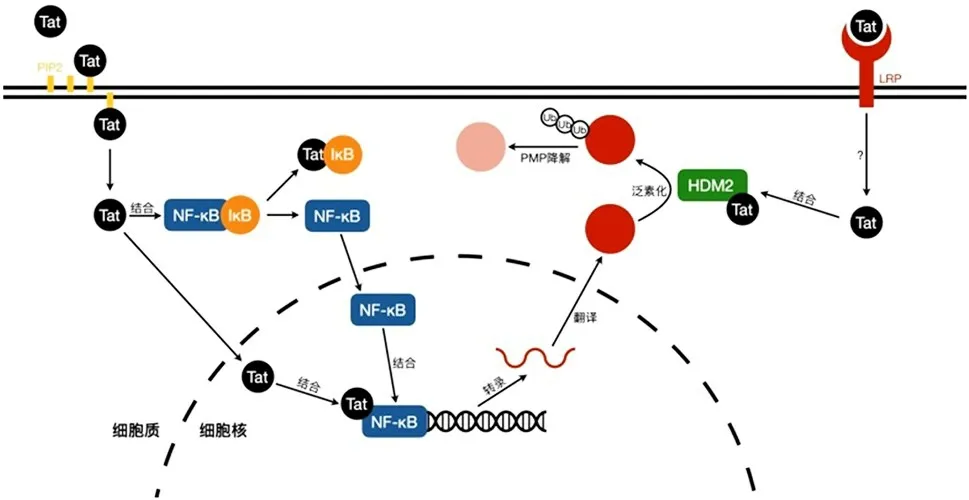
图3 Tat蛋白可能参与HAND发生发展的功能Fig.3 Possible function of participating in HAND development for Tat protein
2.3Tat 蛋白可利用宿主细胞内的泛素-蛋白酶体降解途径 泛素-蛋白酶体降解途径是细胞介导蛋白降解的主要通路之一。其通过泛素活化酶(ubiquitinactivating enzyme,E1)、泛素转移酶(ubiquitin-transferase,E2)及泛素连接酶(ubiquitin-protein ligase,E3)将泛素活化,并以多聚体的形式连接至靶蛋白上;被多聚泛素化的蛋白随后被运输至蛋白酶体进行水解[即蛋白酶体介导的蛋白水解(proteasome-mediated proteolysis,PMP)][19-21]。研究表明,Tat可与多种泛素-蛋白酶体降解途径的通路蛋白和调控蛋白发生相互作用[22-24]。这种相互作用一方面导致Tat本身被PMP途径水解,另一方面也使Tat可介导其他蛋白通过PMP降解。如Tat 被证实通过PMP 途径下调细胞周期蛋白B1(cyclin B1)、受体酪氨酸激酶(receptor tyrosine kinase,RON)、乙酰基转移酶(tat interactive protein60 kDa,Tip60)等蛋白的水平[25-27]。更为重要的是,Tat 在结合E3 蛋白HDM2 后可介导干扰素调控因子-1(interferon regulatory factor-1,IRF-1)的降解(见图3)[28]。IRF-1是细胞内干扰素活化通路中非常关键的一个枢纽蛋白,其活化受到上游包括RNA 识别通路和DNA识别通路在内的多种病原体识别通路的调控[29-30]。一旦活化,IRF-1 会直接结合干扰素基因的启动子,调控干扰素表达水平。因此,Tat介导IRF-1的降解可抑制细胞天然免疫系统的活化,从而促进HIV-1 的感染和复制。
3 Tat介导HAND的发生
Tat 蛋白的上述3 种功能均可直接或间接影响HIV-1 的感染和复制能力。但除诱导AIDS 发生外,近半数的HIV-1感染者还会出现认知缓慢、注意力无法集中、记忆力减弱等症状[31],该病被称为HAND。HAND患者在神经心理测验中会出现认知上欠缺。有证据表明,HIV-1在感染人体后很快就可穿过血脑屏障进入中枢神经系统(central neural system,CNS)[32-34],随后在CNS 引发的炎性反应被认为是诱发HAND 的原因之一[16]。但早在上世纪90 年代,HIV-1 感染者即使持续使用抗逆转录病毒药物且HIV-1 在患者体内的复制也确实得到抑制,但HAND 的发病几率却并未显著降低,其中轻症人数甚至有缓慢升高的趋势[32-35]。表明HAND 的发生虽与HIV-1感染相关,但并不依赖于病毒的复制水平。后续研究表明,HAND的发生与HIV-1 中可被释放至细胞外的4 种蛋白,即Tat、病毒包膜蛋白(envelop protein,Env)、负效应因子(negative factor,Nef)、病毒蛋白U(virion pro-tein U,Vpu)存在关联[36]。
3.1Tat 蛋白可被神经细胞吸收 Tat 蛋白可被分泌至细胞外,与此同时,细胞外的Tat 蛋白也可重新进入细胞内[37]。Tat 作为分泌蛋白的这一特性与细胞内一种名为磷脂酰肌醇二磷酸(phosphatidyl-inositol-4,5-bisphosphate,PIP2)的膜分子有关[38]。Tat 蛋白在表达后,可与PIP2 发生相互作用。研究表明,Tat蛋白上第11 位酪氨酸及48 ~57 位碱性结构域是识别PIP2 必不可少的部分[37-39]。但PIP2 如何介导Tat的分泌尚无法确定。在细胞膜上,每个PIP2 仅占据磷脂双分子层的一侧,但与其他膜磷脂一样,PIP2也会发生翻转运动,即从膜的一侧翻转至另一侧[40]。鉴于Tat蛋白较小且结构具有多变性(以实现不同的功能),因此很可能在结合PIP2 后,随着PIP2 的翻转从膜内转位至膜外,从而脱离并实现释放。而由于翻转运动,PIP2 也会出现在细胞膜的外层上[38]。那么细胞外的Tat 就同样可结合外层的PIP2,再利用PIP2 的翻转运动重新进入细胞。这一假说解释了Tat 的分泌及吸收在不同细胞种类中具有普遍性这一现象。因此,虽然由于技术原因缺乏直观证据,但依然被学术界广泛接受。
该过程在神经系统中也相同。AIDS 感染后的数小时至数天内,患者脑部已可检测到HIV-1,推测是被HIV-1 感染的免疫细胞携带进来的[32-34]。而由于血脑屏障的存在,抗AIDS 药物却难以进入,使得CNS 成为1 个HIV-1 的储藏库,可不断的有新表达的Tat 蛋白被释放至周围的神经细胞中。而除了上述由PIP2 介导Tat 再吸收的机制外,人神经元细胞表面还存在低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LRP)。有研究表明,Tat 可利用自身的核心结构域结合LRP,进一步增强神经元对Tat 蛋白的吸收速度[41]。相关现象已在活体动物及人胚胎神经元细胞上得到证实。
3.2Tat蛋白可在神经细胞中诱发炎性反应 HAND的本质是HIV-1 在CNS 的感染引发了神经元细胞的死亡。目前认为造成神经细胞毒性的原因之一是HIV 感染后产生的病毒蛋白刺激各细胞释放多种细胞因子造成炎性反应。但值得注意的是,HIV-1本身却并不会在神经元细胞中感染和复制,因此产生并释放炎性因子的往往是周围其他细胞。
以星状细胞为例。人脑部的细胞中超过50%的细胞均为星状细胞,而这些细胞实际上极难被HIV-1感染,即使利用细胞间接触的方式,其感染率仅有5%[42]。但Tat 蛋白却可通过释放和再吸收的方式进入星状细胞。Tat 一旦进入星状细胞内部,会激活星状细胞释放大量炎性相关因子,包括TNF-α、CCL5、干扰素诱导蛋白10(interferon inducible protein 10,CXCL10)、IL-1β、IL-6 及IL-8 等[17]。而星状细胞的一个重要功能就是为周围的神经元细胞提供各类信号分子,调控神经元细胞的活性[43]。因此,一旦星状细胞释放出大量炎性分子,其周围神经元细胞会明细受到影响。已有研究表明,C6 星状细胞在Tat 蛋白的存在下,其培养物上清就足以诱导神经元细胞发生死亡[44],证明Tat蛋白确实可通过影响星状细胞来诱发神经细胞毒性。
以巨噬细胞为例。由于巨噬细胞具有可穿过血脑屏障及被HIV-1感染的双重特性,被认为是将HIV-1带入CNS 的主要原因之一。此外,脑部本身就存在很多小胶质细胞,其本质也是单核巨噬细胞[45]。与星状细胞类似,这些巨噬细胞也是造成神经细胞毒性的原因之一。体外试验表明,HIV-1 的感染或Tat 蛋白的吸收均可在巨噬细胞中诱导TNF-α的表达,与C6星状细胞类似,表达Tat蛋白的巨噬细胞培养液上清同样可诱导神经细胞毒性的产生;而如果在培养液上清中添加足量TNF-α中和抗体,则会消除上清的神经细胞毒性[46]。表明造成神经元细胞死亡的是巨噬细胞产生的TNF-α 而非其分泌的Tat。值得注意的是,该现象也间接说明,在被吸收后通过调控NF-κB来诱导细胞死亡并不是Tat 蛋白引起神经细胞毒性的主要原因。
综合以上现象,Tat 被神经细胞再吸收并调控细胞炎性因子的表达可在一定程度上解释诱发HAND的神经毒效应。如Tat 可被脑部的小神经胶质细胞和星状细胞吸收,而这些细胞在吸收Tat后会释放多种神经毒性因子,其中绝大部分均为炎性相关的细胞因子,如TNF-α、IL-6、IL-8、IL-1β 和CXCL1 等[17]。在高水平下,这些因子可引起强烈的炎性反应,并进一步诱发细胞的凋亡和自嗜,从而解释了HAND中所观察到的神经毒效应。
3.3Tat 蛋白可调控神经细胞的物质代谢 并非说诱发炎性因子的释放是Tat 诱发细胞毒性的唯一方式,有研究表明,使用还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的抑制剂可有效减轻Tat诱导神经毒性的能力[47]。同时,有研究也表明,小神经胶质细胞在吸收Tat 后,其分泌谷氨酸的水平显著提高,且这一现象同样可被NADPH 氧化酶抑制剂所抑制[48-49];谷氨酸可通过N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体依赖的途径诱导神经兴奋性毒性[50]。以上证据表明,Tat在进入神经细胞后也可通过影响细胞内物质代谢及氧化还原反应来诱发HAND。
然而,Tat究竟如何影响物质代谢仍然无法确证。一种原因可能依然是Tat 蛋白对宿主细胞基因表达的调控改变了代谢通路上特定蛋白的表达水平,从而引起神经细胞内物质代谢的紊乱,进而产生神经细胞毒性;另一种原因可能是Tat蛋白通过PMP降解的机制靶向细胞内参与物质代谢过程或相关调控蛋白,并诱导后者发生降解,以此来干扰细胞内各代谢产物的水平。
有研究发现,Tat-PMP 途径与HAND 相关,但并非直接作用[51]。上文提到,Tat上调细胞中谷氨酸水平,后者通过NMDA 受体依赖的途径诱导神经兴奋性毒性。实际上,Tat 本身即可结合并增强NMDA 受体的功能,增强后的NMAD 受体会激活AKT 激酶,AKT 激酶随后激活E3 蛋白HDM2,进而引起突触后致密物-95(postsynaptic density-95,PSD-95)的泛素化和水解[51]。PSD-95 作为一种蛋白分子伴侣会结合NMDA 受体,对于NMDA 受体的亚细胞定位至关重要[52]。而PSD-95的缺失引发了NMDA受体相关信号通路的紊乱,导致神经元突触减少,削弱了神经兴奋的传递过程,形成了诱发HAND的潜在诱因之一[51]。
4 小结及展望
作为HIV 编码的最小蛋白,Tat 是HIV-1 蛋白中为数不多已实现原核表达的病毒蛋白,但至今依然没有Tat蛋白自身形成单一结构晶体的相关报道,而是需要使用其他已知的结合蛋白来帮助稳定Tat 的结构。表明Tat蛋白在结构上具有多变性,也解释了Tat所表现出的与自身大小不符的多功能性。本文重点介绍了其中3种,即Tat促进HIV RNA转录、调控细胞内基因表达及诱导细胞内蛋白降解。对于HIV-1来说,这3种功能均可促进病毒复制:Tat可通过结合NF-κB 调控基因启动子的活性,而NF-κB 同时也是HIV-1 基因组DNA 启动转录的调控因子之一;Tat 可通过PMP 途径介导IRF-1 的降解,而IRF-1 是细胞内激活干扰素表达的重要蛋白之一;与此同时,Tat的顺式转录激活功能原本就是HIV-1 合成大量完整病毒RNA的必要前提条件。
然而,除了促进病毒感染和复制外,Tat 蛋白的多种功能还会造成细胞的其他生物学活性发生变化,虽然具体机制尚需要进一步解析,但目前已明确Tat蛋白可通过分泌与再吸收的方式进入神经细胞,一方面通过刺激神经细胞分泌炎性相关因子,引发局部炎性反应,引起神经细胞的凋亡与自嗜;另一方面则改变细胞内物质代谢的能力,增强谷氨酸的释放水平,后者则进一步通过NMDA 受体通路诱发神经细胞产生毒性,诱发HAND 的发生。然而,HAND 也并非Tat(可能还要与Env、Nef、Vpu 等其他病毒蛋白协作)能诱发的唯一一种非AIDS 的疾病。事实上,人们还发现Tat蛋白可能是HIV-1感染者易患心血管疾病的主要原因[53]。Tat 蛋白可通过调控基因转录水平的方式增加心肌细胞中间隙连接蛋白43(connexin 43,Cx43)mRNA及相关蛋白的水平,而Cx43是一种已被确认的心脏衰老的生物标记物。因此,推测Tat可诱发心肌细胞的老化和凋亡,最终导致相关疾病的发生。
综上所述,无论从抑制HIV-1 感染和复制还是从避免HAND 等疾病发生的角度来看,Tat 蛋白均是一个非常高效的药物作用靶点。但针对Tat 蛋白的药物研发一直进展缓慢。一方面是因为病毒自身的高突变性和高适应性。曾有团队发现一种名为双脱氢皮质抑素A(didehydro-cortistatin A,dCA)的Tat 抑制剂,可有效抑制Tat对HIV-1转录的调控作用,避免HIV 潜伏感染的再激活[54]。但4 年后,该团队发现,在dCA的筛选压力下,HIV-1很快进化出转录水平更高的毒株,后者可有效突破dCA的抑制[55],且这种变化与Tat和TAR无关,而是病毒自身整体调整的结果。另一方面研发靶向Tat 的抗AIDS 药物面临的另一个困境则可能是Tat 蛋白结构上的多变性。既然如此小的蛋白表现出如此多的功能,那么Tat蛋白可能并非维持单一结构,而是在不同且各有功能的结构间不断切换。以往研究发现的Tat 可顺利原核表达却无法形成有效晶体的现象也从侧面佐证了这一点。但即使存在上述问题,考虑到Tat 蛋白对HIV-1 正常复制的必要性,尤其是其Exon1 具有序列保守、功能众多的特性,Tat 蛋白未来仍会是HIV 研究领域的点。人们仍需进一步揭示Tat蛋白在理化、生物等方面的特性,为最终成功研发出有效的Tat蛋白抑制剂提供更有价值的信息。

