SRT1720对对乙酰氨基酚诱导小鼠急性肝损伤的保护作用及其机制
邹巧玲,袁秋林,宋银宏
1.三峡大学肿瘤微环境与免疫治疗湖北省重点实验室,湖北宜昌 443002;
2.三峡大学感染与炎症损伤研究所,湖北宜昌 443002;3.三峡大学医学院,湖北宜昌 443002
药物性肝损伤(drug induced liver injury,DILI)是临床常见的药物不良反应之一,也是新药撤市的主要原因[1]。药物超剂量服用可能会在机体内激活严重的氧化应激反应,引起肝细胞凋亡/坏死,导致DILI,诊断治疗不及时甚至会诱发急性肝衰竭(acute liver failure,ALF)[2]。目前,关于药物诱发肝损伤的机制尚未明确,由于个体差异较明显且无剂量相关性,使其检测和预测难度极大[3-4]。据报道,多数DILI患者预后较好,但药物引起的ALF病死率较高[5]。
沉默信息调节因子2-相关酶1(silent information regulator 2-related enzymes 1,SIRT1)是Sirtuins 家族成员之一,其可通过对底物进行去乙酰化,参与机体多种生物学活动,如基因沉默、细胞寿命调节、细胞应激反应及代谢调节等[6]。多项研究表明,激活SIRT1在多种因素诱发的肝损伤中具有保护作用,如胆汁淤积性肝损伤、缺血再灌注性肝损伤、酒精性肝损伤、微生物败血症所致肝损伤等[7-10]。另有研究表明,内质网应激(endoplasmic reticulum stress,ERS)在药物诱导细胞死亡过程中发挥重要作用[11]。但SIRT1 在药物诱发肝损伤中的保护作用与抑制ERS信号通路的相关性尚未明确。SRT1720 是SIRT1 的特异性激活剂,其药理作用远高于白藜芦醇[12]。对乙酰氨基酚(acetaminophen,APAP)是临床诱发急性肝损伤的常见药物,因此,本研究以APAP 诱导小鼠急性肝损伤模型为研究对象,探讨SRT1720在APAP诱发小鼠急性肝损伤中的作用及其与ERS中的PERKeIF2α-CHOP 信号通路的相关性,以期为研发治疗APAP诱发肝损伤的新药提供实验依据。
1 材料与方法
1.1药物 APAP和SRT1720购自美国Sigma-AIdrich公司。
1.2主要试剂 RNA 逆转录酶购自中国Toyobo 公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)及门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒均购自南京建成生物工程有限公司;HE 染液购自上海碧云天生物技术有限公司;Trizol试剂购自美国Invitrogen公司;鼠抗葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)、蛋白激酶样内质网激酶(protein kinase RNA-like ER kinase,PERK)、真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)、转录激活因子4(activating transcription factor 4,ATF4)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、Caspase12和β-actin 单克隆抗体均购自美国Santa Cruz公司;HRP标记的羊抗鼠IgG、BCA 蛋白质测定试剂盒及超敏型化学发光底物试剂盒均购自美国Pierce公司。
1.3实验动物 SPF 级C57BL/6J 小鼠,雄性,8 周龄,体质量18~20 g,购自三峡大学SPF 级动物实验中心,动物质量合格证号为:42010200001613。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照湖北三峡大学实验动物管理委员会动物伦理相关规定进行[文件号为:SCXK(鄂)2017-0012]。
1.4动物分组及处理 将C57BL/6J小鼠随机分为对照、APAP、SRT1720 和APAP + SRT1720 组,每组10只。SRT1720和APAP+SRT1720组小鼠经灌胃给予SRT1720(30 mg/kg体质量),对照和APAP组经灌胃给予等体积生理盐水,均每天给药1 次,连续给药5 d;第6 天,APAP 和APAP + SRT1720 组小鼠分别经腹腔注射APAP(325 mg/kg 体质量),对照和SRT1720组小鼠经腹腔注射等体积生理盐水。24 h 后,将小鼠麻醉,摘除眼球取外周全血,分离血清;随后将小鼠断颈处死,无菌取肝脏组织,取部分肝脏组织固定于4%多聚甲醛中,剩余肝脏组织置-80 ℃保存。
1.5血清中AST和ALT水平的检测 采用ALT及AST检测试剂盒检测小鼠血清中AST和ALT水平。
1.6组织病理学观察 将4%多聚甲醛固定过夜的小鼠肝组织经脱水、包埋、切片处理后,进行HE 染色,于显微镜下观察小鼠肝组织的病理改变情况,并拍照。
1.7ERS信号通路相关分子基因mRNA转录水平的检测 采用RT-qPCR法。根据GenBank中登录的GRP-78、PERK、eIF2α、ATF4、CHOP、GAPDH基因序列(登录号分别为:AK004578、AK003226、AK009934、AK003001、AK028120、AK002273),应用Primer-BLAST 软件设计引物,引物序列见表1,由生工生物工程(上海)股份有限公司合成。用Trizol试剂提取各组小鼠肝细胞总RNA,逆转录合成cDNA,以其为模板进行PCR反应。PCR 反应条件为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸30 s,共40 个循环。以GAPDH为内参,采用2-△△CT法计算各基因mRNA的转录水平。

表1 引物序列Tab.1 Primer sequences
1.8ERS信号通路相关分子蛋白相对表达水平的检测采用Western blot 法。用RIPA 裂解液提取各组小鼠肝组织总蛋白,BCA 试剂盒测定蛋白浓度。取0.2 g蛋白,经10%SDS-PAGE 分离后,转移至PVDF 膜上,用5%脱脂牛奶于室温封闭1 h;加入鼠抗GRP78、PERK、eIF2α、ATF4、CHOP、Caspase12 和β-actin 单克隆抗体(均1∶2 000稀释),4 ℃孵育过夜;TBST 洗涤3次,加入HRP标记的羊抗鼠IgG(1∶5 000稀释),室温孵育1 h;PBS洗涤3次,ECL法显影。应用Image Pro Plus 6.0软件分析条带积分光密度(integral optical density,IOD)值,以β-actin 为内参蛋白,计算蛋白相对表达水平。
1.9统计学分析 应用GraphPad Prism 8.02 软件进行统计学分析,所有数据均采用均值±标准差(x±s)表示,两组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1血清中AST 和ALT 水平 与对照组比较,APAP组小鼠血清中ALT 和AST 水平均明显上升(t分别为55.21 和34.29,P均<0.01),SRT1720 组差异无统计学意义(t分别为2.78 和1.17,P>0.05);与APAP组比较,APAP + SRT1720 组小鼠血清中ALT 和AST水平均明显降低(t分别为42.92和18.02,P均<0.01)。见表2。表明SRT1720 可有效降低APAP 诱发急性肝损伤过程中转氨酶的活性。
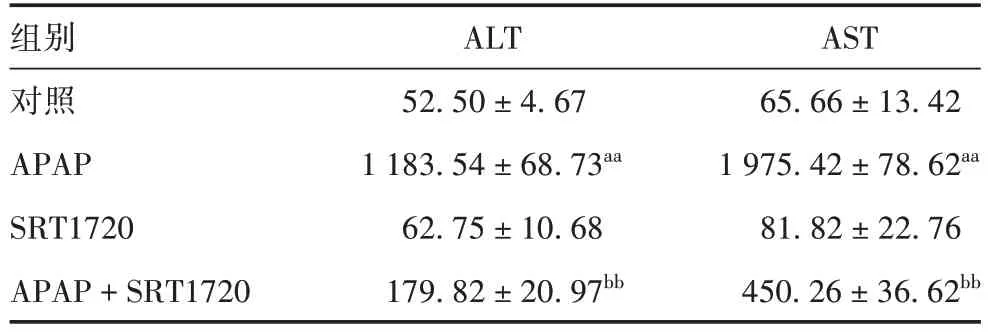
表2 SRT1720对APAP诱导肝损伤小鼠血清中ALT和AST水平的影响(IU/L,x±s,n=10)Tab. 2 Effect of SRT1720 on serum ALT and AST levels in APAP-induced liver injury mice(IU/L,x±s,n=10)
2.2组织病理学观察 对照和SRT1720 组小鼠肝组织中肝细胞在中央静脉周围呈放射状,排列整齐,肝小叶组织形态结构正常,未见明显病理改变;APAP组小鼠肝组织中可见明显大片状肝细胞坏死,且肝小叶结构发生显著改变,部分区域肝细胞发生肿胀变形较严重;APAP+SRT1720 组小鼠的肝细胞损伤程度则明显减轻,发生肿胀变形的细胞也显著减少。见图1。
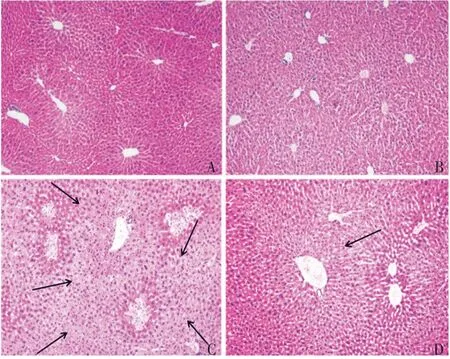
图1 各组小鼠肝组织的病理变化情况(HE,×100)Fig. 1 Pathological changes of liver tissues of mice in each group(HE staining,×100)
2.3ERS 信号通路相关分子基因mRNA 转录和蛋白相对表达水平 与对照组比较,APAP 组GRP78、PERK、eIF2α、ATF4和CHOP基因mRNA 转录及蛋白相对表达水平均明显增高(t =9.85~33.89,P均<0.05),SRT1720 组差异均无统计学意义(t= 0.10~2.95,P>0.05);与APAP 组比较,APAP + SRT1720组GRP78、PERK、eIF2α、ATF4、CHOP基因mRNA 转录和蛋白相对表达水平均明显下降(t=6.19~22.43,P均<0.05)。见图2、表3 和表4。表明APAP 可诱发肝细胞中ERS 反应,SRT1720 可有效降低PERKeIF2α-CHOP 轴中各分子的转录及蛋白翻译水平,抑制APAP诱发肝细胞中的ERS。
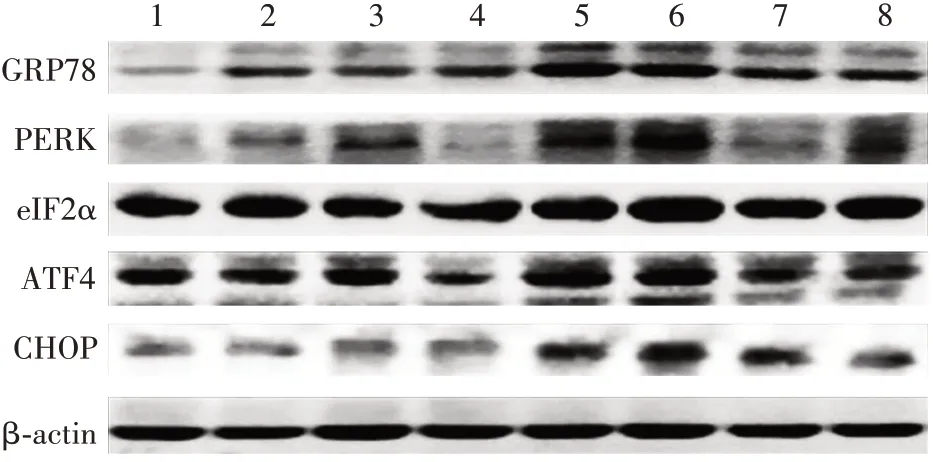
图2 Western blot 法检测各组小鼠肝组织中ERS 信号通路相关分子蛋白的表达Fig. 2 Western blotting of protein expression of ERS signaling pathway related molecules in liver tissues of mice in each group
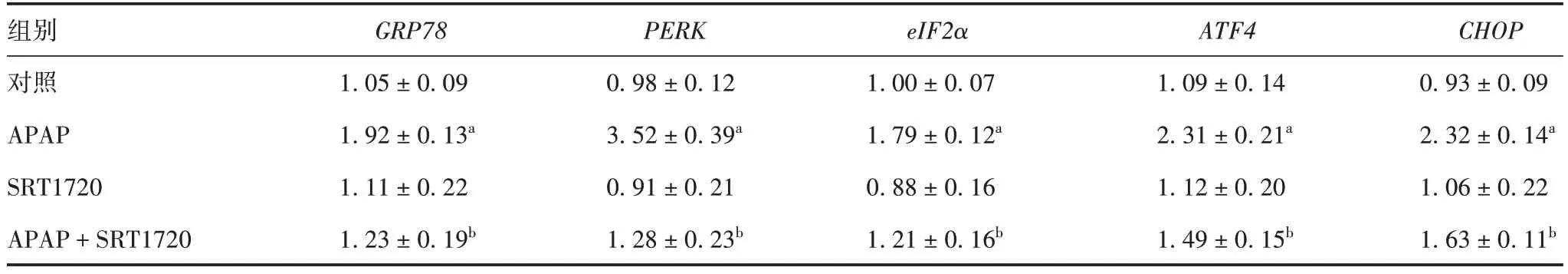
表3 各组小鼠肝组织中ERS信号通路相关分子基因mRNA的转录水平(x±s,n=10)Tab.3 Gene mRNA transcription level of ERS signaling pathway related molecules in liver tissues of mice in each group(x±s,n=10)
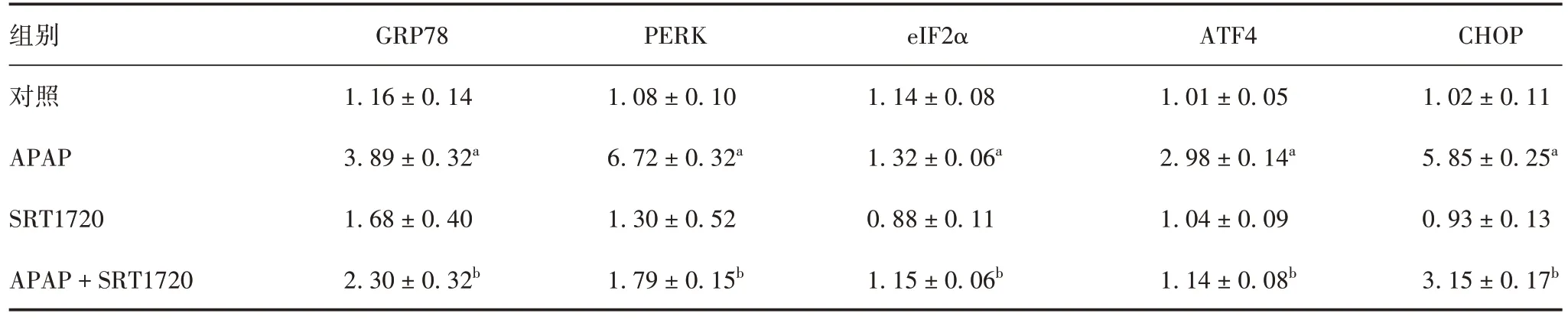
表4 各组小鼠肝组织中ERS信号通路相关分子蛋白的相对表达水平(x±s,n=10)Tab. 4 Relative protein expression level of ERS signaling pathway related molecules in liver tissues of mice in each group(x ± s,n=10)
2.4ERS信号通路中Caspase12蛋白的相对表达水平对照、SRT1720、APAP、APAP+SRT1720 组小鼠肝组织中Caspase12 蛋白相对表达水平分别为(0.91 ±0.11)、(1.06±0.22)、(2.69±0.25)、(2.80±0.33)。与对照组比较,APAP 组小鼠肝组织中Caspase12 蛋白相对表达水平显著升高(t= 11.78,P<0.01),SRT1720 组差异无统计学意义(t=0.33,P>0.05);与APAP 组比较,APAP+SRT1720 组Caspase12 蛋白相对表达水平未发生明显下降,差异无统计学意义(t=0.34,P>0.05)。见图3。
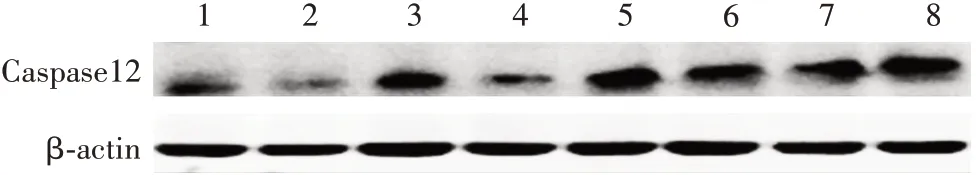
图3 Western blot法检测小鼠肝组织中Caspase12蛋白的表达Fig. 3 Western blotting of expression of Caspase12 protein in liver tissues of mice
3 讨论
药物引起的急性肝损伤是遗传、非遗传和环境因素相互作用的复杂结果,药物过量引发的健康与安全问题是长期困扰临床医生的难题[13]。多项研究表明,除了药物及其中间代谢产物的直接毒理作用外,其对肝细胞的损伤机制是多重因素、多条途径共同作用的动态发展过程,如ERS信号、肝细胞凋亡和坏死、线粒体自噬等因素有关[14-16]。APAP 是临床常用的解热镇痛药物,有研究证明,细胞过度死亡是APAP 诱导肝损伤的核心机制[17]。除死亡受体途径与线粒体死亡途径外,ERS 反应是诱导细胞凋亡的另一重要途径,该途径在APAP诱发的肝损伤中具有重要作用。研究表明,过量APAP可导致内质网管腔的氧化还原位移,激活内质网依赖的信号转导和细胞凋亡,减弱ERS 信号通路,可缓解APAP 引发的小鼠肝细胞损伤[18-19]。
内质网是真核生物维持细胞内环境稳态的重要膜细胞器,细胞内外多种不良刺激,如缺血、缺氧、各种病毒感染及钙离子水平降低等均可引发细胞内质网内环境稳态失衡,诱发ERS,为维持内环境稳定,细胞会通过激活未折叠蛋白反应(unfolded protein response,UPR)减少蛋白质沉积[20]。当ERS 持续存在时,UPR 将启动其分支PERK-eIF2α 通路,大量未折叠蛋白与GRP78结合,导致PERK 与GRP78解离,从而激活PERK 信号传导通路。发生ERS 时,PERK自身发生磷酸化,激活eIF2α,促进ATF4的选择性翻译和表达,使ATF4 靶蛋白CHOP 表达增高,最终导致细胞调亡[21]。有研究证明,ERS 和UPR 信号途径的激活是APAP 诱发肝毒性反应中的后期事件[18],其中GRP78 表达上调可作为UPR 被激活的标志[22]。有研究发现,从细胞中敲除PERK基因或采用PERK-/-细胞,不能引起eIF2α 磷酸化,证明缺失PERK基因的细胞对ERS 呈高反应性[23]。CHOP 是ERS 反应过程中特异的促凋亡因子[24],正常情况下几乎不表达,其表达升高是发生ERS的标志,也是UPR激活PERKeIF2α轴的后期事件[25]。因此,抑制ERS可降低细胞凋亡,从而达到保护肝细胞的作用。研究表明,SIRT1可抑制ERS 反应的PERK-eIF2α-CHOP 轴,改善体内心力衰竭的发展[26];在生长板软骨形成和纵向骨生长中也发挥重要作用[27]。
ALT 及AST 是反应肝功能最特异、敏感的指标,检测小鼠血清中ALT 和AST 水平可有效评估肝细胞损伤的程度。本研究结果显示,大剂量APAP可引发小鼠肝小叶大片的肝细胞凋亡/坏死,并导致小鼠血清中ALT及AST水平明显升高(P<0.05),同时可明显提高GRP78、PERK、eIF2α、ATF4、CHOP基因mRNA转录和蛋白相对表达水平(P<0.05);经SRT1720处理后,可显著降低小鼠血清中的ALT 及AST 水平(P<0.05),并减轻小鼠肝组织中肝细胞的坏死/凋亡程度。为阐明SRT1720 在APAP 诱发小鼠肝损伤中的保护机制与ERS 信号通路的相关性,本实验采用RT-qPCR 和Western blot 法检测各组小鼠肝细胞中ERS 信号通路PERK-eIF2α-CHOP 轴中GRP78、PERK、eIF2α、ATF4、CHOP基因mRNA转录和蛋白相对表达水平,结果显示,SRT1720可明显抑制PERK、GRP78、eIF2α、ATF4和CHOP基因mRNA 转录和蛋白翻译水平(P<0.05)。上述结果表明,PERK-eIF2α-ATF4-CHOP 通路参与了APAP 诱导的毒性反应,而SRT1720 对APAP 诱导小鼠肝损伤的保护作用部分机制是通过抑制PERK-eIF2α-CHOP信号通路,减少CHOP 促凋亡蛋白的表达水平实现的。Caspase12是发生ERS 信号反应中特有的凋亡蛋白,其仅与ERS 信号反应诱导的细胞凋亡相关,在外源性死亡受体通路和内源性线粒体凋亡通路中不被活化,ERS 的持续能够激活Caspase12,活化的Caspase12可激活后续一系列的效应Caspases,进而引起细胞凋亡[28]。本研究结果表明,SRT1720 未能显著降低其蛋白表达水平(P>0.05),推测其可能通过降低其他Caspase 蛋白的表达影响Caspase 凋亡级联反应,该推测仍需深入研究。PERK-eIF2α-CHOP 信号通路介导的细胞凋亡在多种物质诱导肝损伤中发挥着作用[29-30],本研究结果表明,SIRT1 激活剂SRT1720 对APAP 所致的肝毒性的保护机制可能是通过抑制APAP 毒性代谢产物激活ERS 中的PERKeIF2α-CHOP 信号通道相关分子的转录和翻译,从而保护肝细胞。
综上所述,SRT1720 可能是改善APAP 诱导肝细胞凋亡/坏死的有效药物,激活SIRT1 抑制ERS可能成为治疗APAP 诱发肝损伤的一种有效的新方法。

