人白细胞介素-26慢病毒表达质粒与基因敲除质粒的构建及其在HEK293T细胞中的活性验证
周海金,吴珊,刘丽媛,蒋丹,许涛,蓝华滔,舒纬童,徐广贤,
1.广东医科大学医学技术学院医学检验系,广东东莞 523000;
2.宁夏医科大学临床医学院,宁夏银川 750004
白细胞介素(interleukin,IL)-26 又称AK155,最早在疱疹病毒感染的人类T 细胞过表达产物中发现[1]。其在染色体上定位于12q15,位于IL-22和干扰素γ(interferon γ,IFNγ)基因之间,包含5 个外显子;IL-26基因全长516 bp,编码171 个氨基酸,相对分子质量为19 842.7,与IL-10 有24.7%的同源氨基酸序列,47.0%的相似性,是IL-10 细胞因子家族成员[2]。
作为一种新兴的细胞因子,IL-26 因其独特的氨基酸组成和空间结构,具有常规和非常规细胞因子的特征[3]。一方面,IL-26 通过结合相应的受体复合物(IL-20R1、IL-10R2 形成的异二聚体)参与下游信号转导,使STAT效应蛋白(STATI和STAT3)磷酸化,诱导下游靶基因(IL-10、IL-8、CD54等)的转录,从而启动一系列生理反应[4-5]。尽管IL-10R2 广泛表达于各类细胞中,但IL-20R1却仅限于上皮细胞[6],在免疫细胞中并不存在IL-20R1受体,但研究表明,IL-26仍可调控免疫细胞发挥功能[7]。另一方面,IL-26具有非常规阳离子和两亲性的特性,能直接作为抗菌肽与病原微生物表面的阴离子物质发生作用,进而杀死细胞外细菌[8],甚者与受损细胞释放到细胞外的DNA或病原体DNA形成复合物,实现免疫防御作用[9]。
目前,对于IL-26在疾病包括感染性疾病和自身免疫性疾病等方面的作用已有部分研究[10],但其作用机制仍不明确。自噬(autophagy)是真核细胞存在的一种高度保守的代谢过程,是细胞内的一种“自食(self-eating)”现象[11]。作为细胞内的主要降解途径,该过程将胞内物质运输到溶酶体内降解。已有研究表明[8],IL-26 通过IFN基因的细胞质DNA 受体刺激因子(stimulator of interferon genes,STING)诱导自噬,进一步促进吞噬溶酶体的融合,从而降低细菌的生存能力。
自噬在结核分枝杆菌胞内存活及其固有免疫中起重要作用[12],本课题组前期研究发现,结核病患者血清中IL-26 浓度较健康者显著降低,而结核患者外周血单核细胞IL-26mRNA 水平较健康者反而升高。这与此前GUERRA-LASO 等[13]发现结核分枝杆菌感染的单核细胞中IL-26mRNA 和血清中IL-26 水平均显著降低的结果有所出入,也表明IL-26 在结核病中的作用机制不很明确。为了探究IL-26 通过调控细胞信号通路对细胞自噬的作用及其机制,本研究旨在构建人IL-26基因的过表达及敲除载体,并初步预测分析其结构、功能和亚细胞定位,为后续具体研究IL-26 蛋白的功能和机制奠定实验和理论基础。
1 材料与方法
1.1质粒及细胞株 pCDH-CMV-MCS-EF1-copGFP和lentiCRISPRv2 质粒购自美国Addgene 公司;人胚胎肾细胞(HEK293T)购自美国ATCC 细胞库;大肠埃希菌DH5α 感受态细胞购自天根生化科技(北京)有限公司。
1.2主要试剂 限制性核酸内切酶BsmBⅠ购自美国NEB 公司;限制性核酸内切酶EcoRⅠ和NotⅠ、T4连接酶及退火缓冲液均购自北京宝日医生物技术公司;质粒小提试剂盒和胶回收试剂盒购自天根生化科技(北京)有限公司;质粒转染试剂PEI(polyethylenimine linear)购自上海翌圣生物科技公司;Trizol总RNA提取试剂盒和逆转录试剂盒购自美国Thermo公司;SYBR Green PCR Kit 荧光定量试剂盒购自德国QIAGEN 公司;全蛋白提取试剂盒、SDS-PAGE 上样缓冲液、BCA 蛋白浓度测定试剂盒、4%多聚甲醛和BSA 购自上海碧云天生物技术有限公司;兔抗人IL-26 多克隆抗体购自美国SAB 公司;鼠源抗β-actin单克隆抗体、HRP 标记的山羊抗兔和山羊抗鼠IgG购自美国CST公司;Alexa Flour 594标记的羊抗兔lgG购自美国Proteintech公司。
1.3引物设计及合成 根据GenBank中登录的人IL-26基因(NM_018402.2)中编码区(sequence coding for aminoacids in protein,CDS)及pCDH-CMV-MCS-EF1-copGFP 的多克隆位点,选择合适的酶切位点,利用SnapGene 4.24 软件设计2 对引物,见表1。其中,内侧上游引物在其5′端引入EcoRⅠ酶切位点和保护碱基CCG,内侧下游引物5′端引入NotⅠ酶切位点和保护碱基AAGGAAAAAA。引物由通用生物(安徽)股份有限公司合成。
表1 IL-26表达质粒引物Tab.1 Primers for IL-26 expression plasmid
1.4sgRNA 设计及合成 利用NCBI 数据库获取IL-26的序列,IL-26基因位于12 号染色体上,具有5 个外显子区。针对其1号外显子和3号外显子区序列,利用sgRNA 在线设计网站(http://crispor.tefor.net/)分别设计2 对靶向敲除IL-26基因序列sgRNA,并选择评分最高的2 条sgRNA 序列,见图1。其正义链模板的5′端引入CACC,反义链模板的5′端引入AAAC,使BsmBⅠ酶切后能形成黏性末端互补,见表2。

图1 IL-26 sgRNA的设计Fig.1 Design of IL-26 sgRNAs

表2 IL-26 sgRNA引物Tab.2 Primers for IL-26 sgRNAs
1.5IL-26基因过表达质粒的构建
1.5.1目的基因的扩增 抽取健康人5 mL 新鲜外周血于EDTA 抗凝管中,密度梯度离心法分离人外周单个核细胞,Trizol 法提取细胞总RNA,以逆转录试剂盒中的随机引物合成cDNA,以其为模板,巢式PCR扩增目的基因。外侧引物扩增,反应条件:95 ℃3 min;95 ℃15 s,60 ℃15 s,72 ℃40 s,共40 个循环;72 ℃5 min。PCR 产物稀释500 倍,以此为模板进行内侧引物扩增,反应条件:95 ℃3 min;95 ℃15 s,58 ℃15 s,72 ℃40 s,共35 个循环;72 ℃5 min。1.5%琼脂糖凝胶电泳分离PCR 产物,胶回收试剂盒对目的片段进行纯化。
1.5.2过表达质粒的构建 将2µg质粒pCDH-CMVMCS-EF1-copGFP 和纯化的PCR 片段分别用EcoRⅠ和NotⅠ双酶切4 h,胶回收纯化。纯化后的PCR 片段与线性质粒pCDH-CMV-MCS-EF1-copGFP 按摩尔数10∶1 的体系16 ℃过夜连接,连接产物转化大肠埃希菌DH5α 感受态细胞,接种于含150 µg/mL 氨苄青霉素的LB 固体培养基中,37 ℃过夜培养。次日挑取单菌落的一半用于菌落PCR 初步筛选,阳性菌挑另一半菌落过夜培养并小提质粒。提取的质粒经EcoRⅠ和NotⅠ双酶切鉴定后,送通用生物(安徽)股份有限公司测序验证。
1.5.3细胞转染及荧光显微镜观察 将状态良好的HEK293T 细胞接种于12 孔板中,置于37 ℃,5%CO2细胞培养箱中培养过夜,待细胞密度达70%以上时,按照PEI 转染试剂说明书操作转染2 µg 过表达质粒,24 h后显微镜下观察荧光表达情况。
1.5.4转染细胞中IL-26mRNA 表达的检测 采用qRT-PCR 法。质粒转染效率达60% ~70%后,继续培养24 h,收集细胞,Trizol 法提取细胞总RNA,逆转录成cDNA,以其为模板进行PCR 扩增。反应体系:cDNA 1 µL,上下游引物各1.4 µL,SYBR green Super Mix 10 µL,ROX 2 µL,DEPC Water 4.2 µL。反应条件:95 ℃5 min;95 ℃30 s,60 ℃30 s,72 ℃30 s,共40 个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s,熔解曲线形成。IL-26及GAPDH引物见表3。以正常HEK-293T 细胞为对照,每组设3 个复孔,重复3 次。根据扩增曲线得到相应的Ct值,采用2-ΔΔCt相对定量法计算相应的mRNA表达水平。
1.5.5转染细胞中IL-26蛋白表达的检测 采用Western blot 法。质粒转染细胞48 h 后,收集细胞总蛋白,BCA 法测定蛋白浓度后,经12%SDS-PAGE 分离蛋白,转移至PVDF 膜上。用5% BSA 室温封闭1 h;TBST 洗涤3 次,每次5 min,加入兔抗人IL-26 多克隆抗体(1∶2 000 稀释)和鼠源抗β-actin 单克隆抗体(1∶1 000稀释),4 ℃过夜孵育;TBST洗涤3次,每次10 min,加入山羊抗兔IgG和山羊抗鼠IgG(均1∶5 000稀释),室温孵育1 h;TBST 洗涤3 次,每次10 min,进行ECL 发光试剂反应并成像。试验重复3 次,使用ImageJ分析灰度值。
1.6IL-26基因敲除质粒的构建
1.6.1sgRNA Oligo 退火 合成的sgRNA Oligo 序列退火成双链DNA,退火体系:Oligo1(100 µmol/L)10µL,Oligo2(100µmol/L)10µL,5×Annealing buffer 10µL,ddH2O 20µL。退火条件:37 ℃30 min→95 ℃10 min→95 ℃以2 ℃/min 降至25 ℃,将退火后的产物用水按1∶100稀释,-20 ℃保存备用。
1.6.2sgRNA-Cas9 质粒的构建 将2 µg lentiCRISPRv2 质粒用BsmBⅠ限制酶酶切线性化,胶回收产物,与稀释的退火Oligo 引物按摩尔比1∶5 16 ℃过夜连接;连接产物转化至大肠埃希菌DH5α 感受态细胞中,接种于含150 µg/mL 氨苄青霉素的LB 固体培养基中,37 ℃过夜培养;次日挑取单菌落的一半用于菌落PCR 初步筛选,阳性菌液送通用生物(安徽)股份有限公司测序,阳性菌挑另一半菌落过夜培养并小提质粒。在载体U6 启动子附近设计引物,检测引物序列Vector F:5′-AGGGACAGCAGAGATCCAGT-3′;Vector R:5′-ACGGCGACTACTGCACTTAT-3′。由于BsmBⅠ限制酶酶切掉了载体1 885 bp 片段,以重组载体作为模板的扩增产物大小为618 bp。
1.6.3sgRNA 敲除验证 将状态良好的HEK293T 细胞提前1天接种至12孔细胞板中,24 h后细胞密度达70%以上后,将构建好的敲除载体sgRNA1-1、sgRNA1-2、sgRNA3-1、sgRNA3-2 和lentiCRISPRv2(阴性对照)进行转染。转染48 h后收集细胞,BCA法测定总蛋白浓度,Western blot 法检测sgRNAs 对IL-26 的敲除效果(具体方法参考1.5.5)。试验重复3次。
1.7IL-26 蛋白的氨基酸序列分析及结构预测 从NCBI 数据库获取IL-26 的氨基酸序列,利用在线工具EXPASY、SWISS-MODEL、TMHMM、PSI-BLAST,SignalP 4.0 Server 等分析IL-26 的氨基酸构成、信号肽、跨膜结构以及蛋白的二、三级结构预测等。
1.8IL-26蛋白的亚细胞定位观察 将1×105个状态良好的HEK293T 细胞接种于含爬片的24 孔板中,第2天待细胞贴壁后,PEI 转染1 µgIL-26过表达质粒。转染24 h 后,将24 孔板置于水平离心机中,550 ×g离心30 min使细胞完全贴壁,弃上清,PBS洗涤3次,每次3 min,加入4%多聚甲醛,固定15 min;PBS 洗涤3 次,每次5 min,0.2% TritonX-100 的PBS 透化细胞膜10 min;PBS 洗涤3 次,加入免疫荧光封闭液,200 µL/孔,室温封闭1 h;PBS 洗涤3 次,加入兔抗人IL-26多克隆抗体(1∶250稀释),200µL/孔,4 ℃过夜孵育;PBS洗涤3次,每次5 min,加入Alexa Flour 594 标记的羊抗兔IgG(1∶100 稀释),200 µL/孔,室温避光孵育1 h;PBS 洗涤3 次,每次10 min,滴加200 µL DAPI 染液,室温避光孵育15 min;PBS 洗涤4 次,每次10 min,用抗荧光淬灭剂封片,于激光共聚焦显微镜下观察IL-26蛋白的定位情况。
1.9统计学分析 应用SPSS Statistics 26.0 软件进行统计学分析,实验数据均以均数± 标准差(±s)表示。组间比较用独立样本t检验,以α=0.05 为检验标准,P<0.05 为差异有统计学意义。应用Graph-Pad Prism 8.02作图。
2 结 果
2.1IL-26基因过表达质粒的鉴定
2.1.1IL-26基因扩增产物的鉴定 1.5%琼脂糖凝胶电泳分析显示,第1 次外侧引物扩增出671 bp 的片段,第2 次内侧引物扩增出516 bp 的条带,大小均与预期一致。见图2。
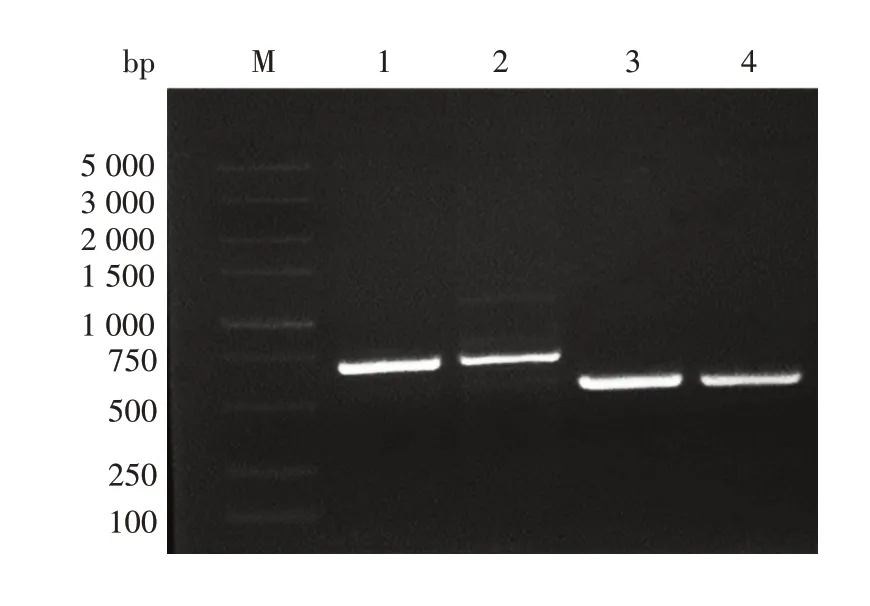
图2 IL-26基因PCR扩增产物电泳图Fig.2 Electrophoretic profile of PCR products of IL-26 gene
2.1.2过表达质粒的菌落PCR、酶切及测序鉴定 1%琼脂糖凝胶电泳分析显示,菌落PCR 产物可见大小约500 bp的目的条带,见图3。阳性菌提取的质粒经EcoRⅠ和NotⅠ双酶切,可见7 367 bp 的载体条带和516 bp 的目的基因条带,见图4。测序结果显示,IL-26序列正确插入载体中,过表达质粒构建正确,见图5。
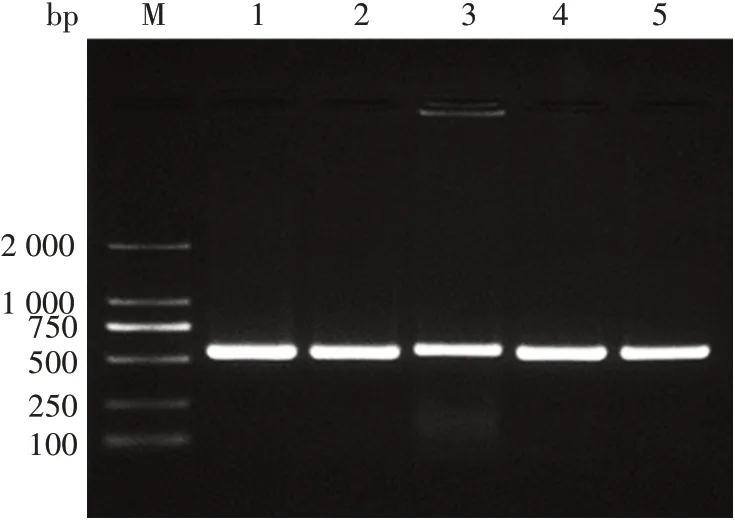
图3 过表达质粒的菌落PCR鉴定Fig.3 Colony PCR identification of overexpression plasmid

图4 过表达质粒的双酶切(EcoRⅠ/NotⅠ)鉴定Fig.4 Restriction map of overexpression plasmid(EcoRⅠ/NotⅠ)

图5 IL-26过表达质粒部分测序结果Fig.5 Partial sequencing results of IL-26 overexpression plasmid
2.1.3转染细胞的荧光显微镜观察 过表达质粒转染HEK293T 细胞48 h 后,荧光显微镜下观察到绿色荧光,见图6,表明转染成功。

图6 过表达质粒转染细胞的荧光显微镜观察Fig.6 Fluorescence microscopy of cells transfected with overexpression plasmid
2.1.4转染细胞中IL-26mRNA的表达 RT-PCR结果显示,过表达组IL-26基因mRNA相对表达量(656.789)较正常对照组(1.000)升高了656.789 倍,差异有统计学意义(t=17.976,P<0.000 1)。
2.1.5转染细胞中IL-26蛋白的表达 Western blot结果显示,过表达组IL-26 蛋白的相对表达量(0.977)较正常对照组(0.494)增加了1.978 倍,差异有统计学意义(t=7.859,P<0.001),见图7。

图7 过表达质粒转染细胞的Western blot鉴定Fig.7 Western blot identification of cells transfected with overexpression plasmid
2.2IL-26基因敲除质粒的鉴定 单菌落PCR 产物经1.5%琼脂糖凝胶电泳分析,可见约600 bp的特异性片段,见图8;阳性菌液测序结果进一步表明sgRNA序列及其位置和方向均正确,4个基因敲除质粒均构建成功,见图9。Western blott分析显示,sgRNA1-1和sgRNA1-2 的敲除效果不佳,敲除倍数分别为0.930和0.980倍,其原因可能与敲除靶点的选择或sgRNA的脱靶效应有关;而sgRNA3-1 和sgRNA3-2 有一定的敲除效果,敲除倍数分别为0.523 3和0.316 9倍,其中sgRNA3-2 的敲除效率差异有统计学意义(t=7.440,P<0.001),敲除效果最好。见图10和11。

图8 IL-26基因敲除质粒的菌落PCR鉴定Fig.8 Colony PCR identification of IL-26 gene knockout plasmid

图9 IL-26基因敲除质粒的测序结果Fig.9 Sequencing results of IL-26 gene knockout plasmid

图10 基因敲除质粒转染细胞的Western blot鉴定Fig.10 Western blot identification of cells transfected with gene knockout plasmid

图11 灰度值分析Fig.11 Analysis of gray value
2.3IL-26 蛋白的氨基酸序列分析 ExPASy 在线软件分析显示,IL-26编码171个氨基酸,预测分子量为19 842.7,预测理论等电点为10.00,正电荷残基总数为31,负电荷残基总数为12,原子组成为C、H、N、O、S,分子式为C898H1469N245O237S11,原子总数为2 860,其疏水指数为100.99,总平均亲水性为-0.083。SignalP 4.0 Server软件分析显示,剪切位点评分(C-score)、信号肽区域评分(S-score)及C-score 和S-score 的几何平均数(Y-score)评分均在阈值之上,标准值(D)为0.847,大于阈值0.450,推测IL-26蛋白存在信号肽,见图12。经CBS 网站的在线软件分析表明,前22 个氨基酸有明显的跨膜功能,其N-端预测的跨膜螺旋是其信号肽结构,见图13。

图12 IL-26蛋白的信号肽预测Fig.12 Prediction of IL-26 protein signal peptide

图13 IL-26蛋白的跨膜区预测Fig.13 Prediction of transmembrane region of IL-26 protein
2.4IL-26蛋白结构的预测 通过SOPMA 预测IL-26蛋白的二级结构显示,α-螺旋(Hh)134个,占78.36%;β-转角(Tt)7个,占4.09%;无规则卷曲(Cc)30个,占17.54%。见图14。氨基酸相似域曲线分析结果表明,IL-26 蛋白主要为异亮氨酸、赖氨酸,其次为丝氨酸、谷氨酰胺、丙氨酸、精氨酸和苯丙氨酸。通过在线工具Swiss-Model构建出IL-26蛋白的三维结构,见图15。

图14 IL-26蛋白的二级结构预测Fig.14 Prediction of secondary structure of IL-26 protein

图15 IL-26蛋白的三级结构预测Fig.15 Prediction of tertiary structure of IL-26 protein
2.5IL-26蛋白的亚细胞定位 经PSI-BLAST在线分析IL-26 蛋白的亚细胞定位,预测结果表明,IL-26 主要存在于细胞质中(79.58%)。激光共聚焦结果进一步表明,IL-26存在于细胞质中,见图16。

图16 IL-26蛋白亚细胞定位的激光共聚焦显微镜观察Fig.16 Laser confocal microscopy of subcellular localization of IL-26 protein
3 讨论
近年来,IL-26 在自身免疫性疾病和慢性炎症疾病中受到越来越多的关注[14]。BRILLAND 等[15]研究发现,系统性红斑狼疮(systemic lupus erythematosus,SLE)患者血清IL-26水平显著高于健康组,而且活动性SLE疾病患者IL-26水平也显著高于非活动性SLE疾病患者,提示IL-26 水平变化可能作为一种SLE 患者活动性疾病识别的潜在生物标志物。NIU 等[16]发现,恶性胸腔积液(malignant pleural effusion,MPE)患者胸腔积液IL-26 水平相比同源外周血(peripheral blood,PB)显著升高,MPE 患者生存曲线预测结果表明,IL-26蛋白累积越多的患者,其生存率越低。ITOH等[17]研究发现,IL-26 与新鉴定的受体EphA3 相互作用,激活EGFR-TKI 旁路通路的AKT 和JNK 信号通路,抑制EGFR-TKI 诱导的内质网应激,进一步导致了三阴性乳腺癌(triple-negative breast cancer,TNBC)的发展,揭示了TNBC 中EGFR-TKI 耐药(吉非替尼)的新机制。既往研究表明,类风湿性关节炎[18]、银屑病[19]、克罗恩病[20]、慢性HCV 感染[21]等疾病患者中均出现了IL-26因子上调,这些研究均表明IL-26是自身免疫疾病和慢性感染炎症疾病的重要调节因子。
本研究采用分子克隆技术成功构建了IL-26基因真核过表达质粒,转染HEK293T细胞后,IL-26mRNA和蛋白表达水平均明显升高。同时利用CRIPSR/Cas9技术针对IL-261 号和3 号外显子区各设计了2 条sgRNA,构建了IL-26基因敲除质粒。HEK293T 细胞源于人胚胎肾细胞[22],自身能够表达内源性IL-26蛋白,因此直接转染293T 细胞进行敲除验证。在敲除验证过程中,Western blot鉴定IL-26蛋白敲除结果较顺利,但采用RT-qPCR 检测IL-26mRNA 变化水平时发现,敲除组和对照组差异不大。考虑到CRISPR/Cas9 的敲除机理基于sgRNA 的靶向和Cas9 的剪切引起DNA 断裂[23],进而导致细胞的非同源重组修复的发生,仅仅是导致其mRNA 发生移码突变,引起蛋白翻译和功能发挥错误,其mRNA 水平存在变化不大的情况[24]。在构建的4个敲除质粒中,Exon1sgRNA1和Exon1sgRNA2 并未表现出敲除效果,而Exon3 sgRNA1 和Exon3sgRNA2 表现出较好的敲除效果,其中Exon3sgRNA2敲除效率最佳。敲除靶点的选择或sgRNA 脱靶效应可能是导致无明显敲除效果的原因。因此,本研究中人IL-26基因过表达和敲除质粒的成功构建,为后续IL-26的机制研究奠定了基础。
同时,通过一系列生物信息学软件分析表明,IL-26 蛋白由171 个氨基酸组成,分子量为19 842.7,理论等电点为10.00,正电荷残基总数为31,负电荷残基总数为12,IL-26 含有带正电的氨基酸(赖氨酸或精氨酸),赋予IL-26不同寻常的物理化学性质,能够直接结合病原微生物表面的阴离子物质,从而破坏细胞膜的完整性。IL-26 蛋白信号肽的预测和跨膜结构分析,互相佐证了IL-26蛋白的前22个氨基酸存在信号肽结构,且具有一定的跨膜功能,提示前端结构与IL-26 亚细胞定位密切相关,维持着IL-26 蛋白完整的空间结构。IL-26 蛋白的二级结构分析显示,α-螺旋(Hh)134 个,占78.36%;β-转角(Tt)7 个,占4.09%;无规则卷曲(Cc)30 个,占17.54%,同时三维建模揭示了分子结构6 个螺旋体和4 个保守的半胱氨酸残基;分子结构表面上的静电势为全局正电,更重要的是,其螺旋结构表现出两亲性,具有亲水表面和由带正电残基组成的亲水表面,带正电的氨基酸结构赋予了IL-26 结合DNA 特性[25]。结合间接免疫荧光结果显示,IL-26 蛋白亚细胞定位于细胞质中,表明IL-26蛋白能直接参与细胞内的功能活动。
综上所述,本研究成功构建和验证了人IL-26基因真核过表达质粒和敲除质粒,并通过生物信息学分析了蛋白的特性,亚细胞定位研究表明其分布在细胞质中,为后续其作用机制的研究奠定了基础。

