骨髓间充质干细胞来源的微颗粒对心肌肥厚的作用及其机制
曹茜倩,李俊虎,崔欣欣,郭晨梦,庞敏,刘键灿,白晓洁,封启龙
1.山西医科大学基础医学院生理学系细胞生理学教育部重点实验室细胞生理学山西省重点实验室,山西太原 030001;2.西安宝石花长庆医院,陕西西安 710200;3.上海大学医学院,上海 200000
关键字:心肌细胞肥大;微颗粒;L-型钙通道;钙调蛋白依赖性蛋白激酶Ⅱ;全细胞膜片钳技术;心功能
心肌肥厚是心脏在长时间和异常负荷条件下,发生的结构改变并可伴随心脏各种功能紊乱,如收缩障碍,能量代谢紊乱以及基因表达异常等生理功能失调,最终会导致心力衰竭和心源性猝死[1-2]。目前,临床上主要通过利尿剂、钙通道阻滞剂(calcium channel blocker,CCB)等药物治疗改善心功能[3]。目前尚无较好的治疗方法可有效逆转或根治心肌肥厚性疾病,对其治疗主要还处于对症治疗阶段。因此,如何逆转心肌重构,在心肌肥厚阶段采取措施后有效预防心力衰竭成为当前心肌肥厚研究的重点。有研究表明,间充质干细胞(mesenchymal stem cells,MSCs)改善心功能除通过干细胞的直接分化作用外,其所具备的一些治疗作用也是通过旁分泌实现的[4-5]。MSCs 通过旁分泌作用分泌一些包含生长因子、细胞因子、趋化因子等细胞外囊泡作用于靶细胞,改善受损部位微环境,达到修复目的[5-6]。MSCs具有多种生物学效应,如多能分化、抗炎、免疫调节以及神经保护等,已被证明可用于治疗心力衰竭[7-8]。最新研究表明,MSCs 介导的治疗作用不是直接作用的方式,而是以旁分泌方式分泌微颗粒(microparticles,MPs)来起作用[9]。MPs 已逐渐被认为是细胞间通讯的关键介质[10]。MPs 为细胞外囊泡结构,直径0.1 ~1.0µm,可使细胞内丰富的内容物,如蛋白、核糖核酸、micRNA 等转移至细胞外来介导细胞间的信号传递[11]。尽管已经有研究表明,MSC-MPs 可在心肌缺血和缺血再灌注损伤模型中保持细胞活力和减轻心肌重构[12-13],但在心肌肥大中的具体作用尚不清楚。本研究采用异丙肾上腺素(isoprenaline,ISO)诱导SD大鼠心肌肥厚,全骨髓贴壁法分离并培养MSCs,差速离心法获取高纯度MPs,观察其对大鼠心肌细胞肥大的影响。同时,采用全细胞膜片钳技术,观察MSCMPs对心肌肥厚大鼠单个心肌细胞L-型钙电流(LCa-L)的影响,并进一步探讨其对LCa-L作用的可能机制。
1 材料与方法
1.1实验动物 SPF 级SD(Sprague-Dawley)大鼠,雌雄不限,体质量(250 ± 50)g,由山西医科大学实验动物中心提供,动物许可证号:SCXK-(晋)2015-0001。本实验均以科研为目的进行SD 大鼠的养殖和使用,且按照山西医科大学动物伦理相关规定进行[SCXK(晋)2015-0001]。
1.2主要试剂及仪器 RNA 提取液、反转录试剂盒、2×SYBR Green qPCR Master Mix(none ROX)购自中国Servicebio公司;HyPure TMMolecular Biology Grade Water 购自美国HyClone 公司;ELISA 试剂盒购自上海酶免生物科技有限公司;ISO、胶原酶P、5′-三磷酸腺苷二钠、HEPES、牛磺酸、L-谷氨酸、氢氧化铯(CsOH)、氯化钾(KCl)、氯化钠(NaCl)氯化四乙胺(TEA-Cl)、氯化铯(CsCl)、乙二胺四乙酸购自美国Sigma 公司;成骨成脂诱导分化培养基购自美国赛业生物科技有限公司;荧光定量PCR 仪购自美国Bio-Rad 公司;荧光酶标仪(MP6)购自美国Molecular Devices 公司;超声诊断仪(vivid7/dimension)购自美国GE公司;Langendorff灌流装置购自上海ADinstrumentS公司。
1.3MSCs 成骨成脂诱导分化 将成骨成脂所需试剂融化后,各个成分加入培养基中混匀待用。待骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)长至第4 代时,按2 × 105个/mL 接种6 孔板,板孔提前用明胶包被,待细胞密度达60%时,每孔加入2 mL 成骨诱导培养基诱导其成骨分化,21 d后,用茜素红染色,显微镜下观察。
成脂诱导分化与成骨相似,待BMSCs 长至第4代时,按2×105个/mL接种6孔板,板孔提前用明胶包被,待细胞长至100%时,诱导其成脂分化。按说明书要求将培养基A、B 配制好后进行诱导分化,先用培养基A 培养3 d,换培养基B 培养1 d,再换为培养基A,如此循环4 次后,换为培养基B 持续诱导培养7 d,进行油红O染色,显微镜下观察。
1.4MSC-MPs的分离及纯化 参考本课题组前期采用的分离方法[14]分离大鼠BMSCs,待第5 代细胞密度达90%时,加入无血清培养基饥饿处理48 h;收集上清液,差速离心法分离提取MSC-MPs。具体操作如下:将饥饿处理收集的上清液300×g离心10 min;收集上清液,2 500×g离心20 min;收集上清液,18 000×g离心1 h;沉淀(即为MSC-MPs)加入PBS重悬,18 000×g离心1h;弃上清液,加入PBS重悬,即为高纯度MSC-MPs。
1.5MSC-MPs 的透射电镜观察 将MSC-MPs 滴加至碳覆膜铜网上,滴加时使其形成水滴状,待样品吸附90 s 后,吸干多余水分并晾干,加入10µL 醋酸铀染色液,避光染色30 s,晾干,透射电镜下观察并拍照记录。
1.6MSC-MPs表面抗原的鉴定 取纯化的MSC-MPs 10µL,加入190µL PBS,混匀,再分别加入PE anti-rat CD34、FITC anti-rat CD29、PE anti-rat CD45、FITC antirat CD90,混匀,避光孵育30 min;无菌PBS 洗去未结合抗体,加入150µL PBS 重悬,上流式细胞仪检测,检测1.0×105个MPs计算流式结果。
1.7ISO诱发大鼠心肌肥厚模型的建立 参考KELLAR等[15]方法,每天经SD大鼠腹腔注射5 mg/kg ISO,持续1 周完成模型制备。将SD 大鼠随机分为对照(Control)、ISO 肥大(ISO)组,每组6 只。所有大鼠每天称量体质量并记录,按体质量腹腔注射给药。其中ISO 组每天按5 mg/kg 的剂量给予ISO,Control 组每天按5 mg/kg剂量给予生理盐水。严格控制大鼠水粮,尽量使每只大鼠获取食物量保持一致,减少体质量增长方面的误差,生长环境控制在20 ~25 ℃,1周后造模完成,禁食12 h开始进行后续试验。
1.8大鼠超声心动图检测 最后1次给药12 h,将SD大鼠经10%水合氯醛麻醉后充分暴露心脏部位,采用超声诊断仪进行心功能检测。测量指标包括左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心室后壁舒张末期厚度(left ventricular posterior wall dimension,LVPWd)、室间隔舒张末期厚度(interventricular septum end-diastolic dimension,IVSd)。
1.9大鼠心肌肥大指数的检测 测完心功能后,迅速剪开大鼠胸腔取出心脏,置于冰冻生理盐水中,洗涤净心脏内血液后,进行心脏及分离的左心室的各项指标检测。剪开大鼠腿部毛皮和肌肉,充分暴露胫骨,测量长度。可用心肌肥大指数心重-体重比(heart weight to body weight ratio,HW/BW)表示,考虑到大鼠体质量增长的差异,而大鼠胫骨随年龄变化相对差异较小,再进一步测量心重-胫骨长度比(heart weight to tibial length ratio,HW/Tibia),左心重-胫骨长度比(left heart weight to tibial length ratio,LV/Tibia)显示大鼠心肌肥厚的变化。
1.10大鼠单个心肌细胞的急性分离 将SD大鼠断颈后取心脏,于4 ℃用体积分数为1的氧气充灌的无钙台式液中修剪掉多余组织,置Langendorff 灌流装置上,恒压(75 Kpa)、恒温(37 ℃)逆流灌注10 min,待流出液体从血色变为无色并充盈后,换为酶液继续灌注约20 min,待心脏充盈、变白、变软、循环酶液变浑浊后,取心室及组织置KB 液中,剪碎,吹打5 min,经滤网(150µm)过滤得到单个心肌细胞,置KB液中室温稳定3 h进行后续试验[16]。
1.11心肌细胞中心房利钠肽(atrial natriuretic peptide,ANP)、脑利钠肽(B-type natriuretic peptide,BNP)mRNA表达量的检测 采用qRT-PCR法。试验分为对照(Control)、心肌细胞肥大(ISO)、MPs、MPs 上清液(Supernatant)组。其中Control 和ISO 组是各模型组在急性分离的心肌细胞静置3 h后进行试验。根据课题组前期摸索结果,确定MSC-MPs 给药浓度为48µg/mL,MPs 和Supernatant 组是在ISO 组急性分离的心肌细胞静置3 h 后,分别用48 µg/mL MSC-MPs 及等量MPs 上清液共同孵育48 h;按照PCR 试剂盒说明书进行检测。ANP上游引物:5′-TTCCTCTTCCTGGCCTTTTG-3′,下游引物:5′-TCTAGCAGGTTCTTGAAATCCATC-3′;BNP上游引物:5′-AGCCAGTCTCCAGAACAATCCA-3′,下游引物:5′-CCGGTCTATCTTCTGCCCAAA-3′;GAPDH上游引物:5′-CAAGGTCATCCATGACAACTTTG-3′,下游引物:5′-GGGCCATCCACAGTCTTCTG-3′。引物由广州赛百盛生物科技有限公司合成。反应条件为:95 ℃10 min;95 ℃15 s,60 ℃30 s,反复循环40 次,65 ℃升温至95 ℃,每15 s 升温0.3 ℃形成溶解曲线。
1.12大鼠肥大心肌细胞磷酸化钙调蛋白依赖性蛋白激酶Ⅱ(phosphorylated calmodulin-dependent protein kinaseⅡ,p-CaMKⅡ)及非磷酸化CaMKⅡ的检测 采用ELISA 法。分离获得的心肌细胞数量应达100万/mL 左右。将细胞反复冻融破坏并释放其内部成分,(400 ~800)×g离心20 min,收集上清,按ELISA试剂盒说明书检测A450值,计算样品中CaMKⅡ和p-CaMKⅡ含量。
1.13大鼠单个心肌细胞L-型钙电流(LCa-L)电压钳模式记录 在电压钳模式下,钳制在-40 mV,以持续500 ms、阶跃40 mV、从-40 ~0 mV 的去极化脉冲刺激激活LCa-L,各组LCa-L峰值电压均在0 mV。分别用CsCl、TEA-Cl 代替KCl、NaCl 排除INa、IK对LCa-L的影响。给予细胞去极化刺激激活LCa-L,即可产生在0 mV的内向电流。在全细胞记录模式形成5 ~20 min 内记录,避免LCa-L衰减现象的发生。膜电流大小用单细胞电流值(single cell current value,pA)/细胞膜电容值(membrane capacitance,pF),即电流密度表示。
1.14统计学分析 采用SPSS 16.0 软件处理数据。以均数±标准差(±s)表示。多个样本间比较采用单因素方差分析(ANOVA)。以P<0.05 为差异有统计学意义。
2 结果
2.1原代培养大鼠BMSCs的形态特征 倒置显微镜下观察可见,BMSCs刚分离时呈圆形,夹杂多种杂细胞,贴壁生长后,呈三角形、梭形及多角形。经长时间培养及传代后,除BMSCs外,其余杂细胞均脱离瓶壁,并在多次换液中去除,逐渐获得较高纯度的BMSCs。见图1。
图1 原代培养BMSCs形态特征的显微镜观察(×8)Fig.1 Microscopic observation of morphological characteristics of primary cultured BMSCs(×8)
2.2BMSCs 成骨成脂诱导分化 镜下观察可见,成骨分化骨结节经茜素红染色后变成红色,成脂分化脂滴经油红O染色后变成红色,见图2。

图2 MSCs成骨、成脂诱导分化的显微镜观察(×100)Fig.2 Microscopic observation of osteogenic and adipogenic differentiation of MSCs(×100)
2.3MSC-MPs 的透射电镜观察 差速离心法提取的MPs 粒径为200 nm ~1 µm,具有杯托状形态,符合MPs 形态特征。透射电镜下可见,MPs 膜结构完整,轮廓清晰,直径约200 nm,见图3。

图3 MSC-MPs的透射电镜观察Fig.3 Observation of MSC-MPs under transmission electron microscope
2.4MSC-MPs表面抗原的鉴定 流式细胞术结果显示,MPs 表面标记物CD29 和CD90 表达阳性率分别为(98.24 ± 0.82)%和(97.69 ± 1.83)%,而CD45 和CD34 表达阳性率分别为(1.56 ± 0.28)%和(0.67 ±0.44)%,见图4。

图4 MSC-MPs表面抗原的鉴定Fig.4 Identification of surface antigens of MSC-MPs
2.5ISO诱导心肌肥厚大鼠的超声心动图与Control组相比,ISO 组大鼠LVEDD 明显减少(t=5.065,P<0.05),IVSD 和LVPWd 均显著增加(t分别为4.013、2.368,P均<0.05),见图5 和表1。表明ISO 组大鼠心室腔狭窄,室壁增厚,呈现向心性肥厚。
表1 各组大鼠超声心动图检测结果(mm,±s,n=6)Tab.1 Echocardiogram detection results of rats in various groups(mm,±s,n=6)

表1 各组大鼠超声心动图检测结果(mm,±s,n=6)Tab.1 Echocardiogram detection results of rats in various groups(mm,±s,n=6)
注:a表示与Control组相比,P <0.05。
?

图5 大鼠超声心动图检测Fig.5 Echocardiogram detection in rats
2.6ISO诱导的心肌肥厚大鼠心肌肥厚指数与Control组相比,ISO 组大鼠HW/BW、HW/Tibia、LV/Tibia均显著升高(t分别为4.392、5.043、6.120,P均<0.05),见图6。表明ISO 的刺激造成大鼠明显的全心性肥大,以左心室肥大较为明显。
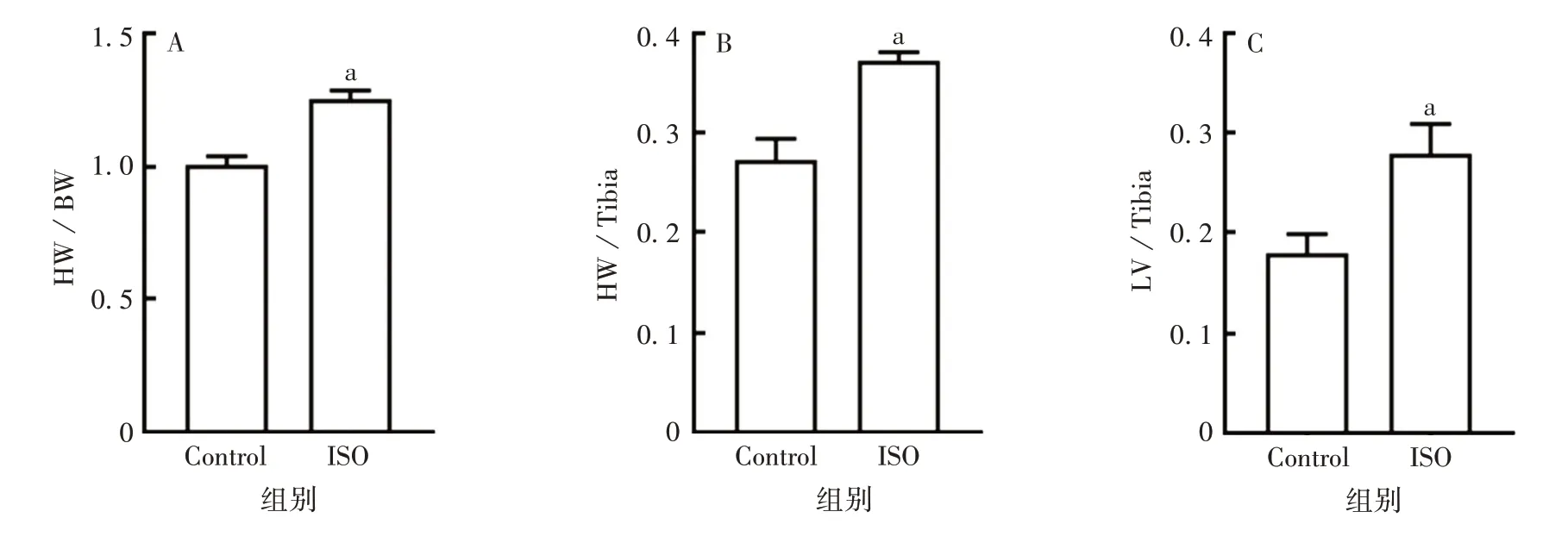
图6 ISO诱导大鼠心肌肥厚指数的改变Fig.6 ISO-induced changes of myocardial hypertrophy index in rats
2.7MSC-MPs 对ISO 诱导大鼠肥大心肌细胞ANP、BNPmRNA表达量的影响 qRT-PCR结果显示,ISO组大鼠肥大心肌细胞ANP、BNPmRNA 表达量显著增加,分别为Control 组的2.19 和1.90 倍(t分别为25.120、18.261,P均<0.01);48µg/mL MSC-MPs处理肥大心肌细胞48 h 后,MPs 组大鼠肥大心肌细胞ANP、BNPmRNA 表达量分别降至ISO 组的0.77(t=12.11,P<0.01)和0.59 倍(t=3.526,P<0.05),而Supernatant组未见明显变化。见图7。

图7 大鼠心肌细胞ANP(A)、BNP(B)mRNA表达量的qRT-PCR检测Fig.7 Detection of ANP(A)and BNP(B)mRNA expression in rat cardiomyocytes by qRT-PCR
2.8MSC-MPs对ISO诱导大鼠肥大心肌细胞p-CaMKⅡ和CaMKⅡ蛋白表达水平的影响 ELISA 结果显示,与Control组相比,ISO组大鼠肥大心肌细胞CaMKⅡ和p-CaMKⅡ蛋白表达水平均显著升高(t分别为3.278、4.181,P均<0.05);与ISO 组相比,MPs 组大鼠肥大心肌细胞CaMKⅡ蛋白表达水未见明显改变(t=1.752,P >0.05),p-CaMKⅡ蛋白表达水平显著下降(t= 5.420,P<0.05);Supernatant 组大鼠肥大心肌细胞CaMKⅡ和p-CaMKⅡ蛋白表达水平均未见明显改变。见图8。

图8 MSC-MPs对心肌细胞CaMKⅡ(A)和p-CaMKⅡ(B)蛋白表达水平的影响Fig.8 Effect of MSC-MPs on CaMKⅡ(A)and p-CaMKⅡ(B)protein expression in cardiomyocytes
2.9MSC-MPs 对ISO 诱导大鼠肥大心肌细胞LCa-L的影响 与Control组(7.25±1.85)相比,ISO组大鼠肥大心肌细胞钙电流密度(18.82 ± 5.63)显著升高(t= 15.261,P<0.01);与ISO 组(18.82 ± 5.63)相比,MPs 组钙电流密度(8.29 ± 1.63)显著降低(t=6.216,P<0.05),抑制率为56%;Supernatant 组钙电流密度与ISO 组无明显差异(t= 1.191,P >0.05),表明MSC-MPs 可拮抗ISO 对心肌LCa-L的增强作用。见图9和图10。

图9 各组大鼠单个心肌细胞LCa-L记录Fig.9 LCa-L records of single ventricular myocytes of rats in various groups

图10 MSC-MPs对大鼠单个心肌细胞LCa-L的影响Fig.10 Effect of MSC-MPs on LCa-L in single ventricular myocytes of rats
3 讨论
ISO具有加快心率、扩张动脉等正性肌力作用,具有较强的非选择性β 肾上腺素受体激动效果[17]。但过量使用ISO 可增加心肌细胞耗氧量,使其过负荷,最终导致功能障碍[18-19]。动物实验表明,过量ISO 可诱发心肌炎症和心肌细胞肥大,常用于构建心肌肥厚动物模型[20]。本研究利用ISO 诱发了大鼠心肌肥厚,超声结果显示,ISO 组大鼠心肌肥大指数HW/BW、HW/Tibia、LV/Tibia 均显著增高,表明成功建立了大鼠心肌肥大模型。48µg/mL MPs 处理大鼠肥大心肌细胞48 h后,心肌细胞表面积和蛋白含量均显著增加;qRT-PCR 结果显示,心肌细胞ANP、BNPmRNA 表达显著,表明MSC-MPs 可保护ISO 诱导引起的心肌细胞肥大;膜片钳结果显示,MSC-MPs可降低ISO 组大鼠肥大心肌细胞LCa-L密度;ELISA 结果显示,MSC-MPs 可降低p-CaMKⅡ蛋白表达量。表明MSC-MPs 可通过调低p-CaMKⅡ蛋白表达量来降低肥大心肌细胞LCa-L密度以保护心肌细胞。与H9c2等心肌细胞株相比,原代心肌细胞虽然在分离及培养方面操作难度增加,但由于其基因组未经任何编辑及修饰,因此所得实验结果更为可靠,同时也使有关研究结果更具临床参考价值。
CaMKs 作为丝氨酸/苏氨酸蛋白激酶的一员,对心血管系统具有重要作用,可诱导调控细胞对钙离子的信号转导。已有研究发现,CaMKⅡ参与心肌肥大的发生发展,心肌肥大的发展与L-型钙通道的数量及功能减少密切相关[21]。用BMSCs来源的MPs治疗ISO诱导的心肌肥厚,可使心肌肥大细胞恢复至一定的正常水平,通过CaMKⅡ激酶逆转了ISO对LCa-L的影响。以往研究发现,MSCs 对心肌肥厚具有一定治疗作用,但干细胞移植本身具有较大不可逆性和复杂性,最常见的不良反应为肿瘤以及异常组织形成[22]。许多研究也表明,MSCs 主要通过旁分泌作用起到治疗效果[23-24]。有研究者认为,利用MSC-MPs对细胞功能进行干预,有可能是克服干细胞治疗缺陷的有效选择,有望以更加精准的方式来对相关疾病进行治疗[25]。本研究结果显示,MSC-MPs 对ISO诱导的大鼠心肌细胞肥大表现出显著抑制效应,进一步支持MPs 可作为细胞之间传递信息的重要载体。有关MSC-MPs中发挥心肌保护效应的确切有效成分,将是下一步研究的重点。
综上所述,本研究证实MSC-MPs可显著抑制ISO诱导的大鼠心肌细胞肥大,这一效应与其下调心肌细胞CaMKⅡ、抑制L-型钙通道有关。本研究结果为临床靶向CaMKⅡ和L-型钙通道治疗心肌肥厚提供了新证据,有望为今后治疗提供新思路。

