基于上转换信标探针构建信号放大近红外激发荧光生物传感器用于microRNA检测
周学敏 吕姝臻 张国芳 崔竹梅* 毕 赛*
(1青岛大学附属医院, 青岛 266061)
(2青岛大学化学化工学院, 青岛 266071)
microRNA(miRNA)作为一种高度保守的非编码单链RNA[1],在多种恶性肿瘤中高表达,并在基因调控、细胞增殖分化、凋亡和癌变过程中发挥重要作用[2-3]。目前,已发展多种miRNA 的检测方法,如Northern印迹法[4]、微阵列法[5]和实时定量聚合酶链式反应[6]等,但这些方法多数存在灵敏度低、耗时长、易受环境影响和设备要求高等缺点[7-9]。近年来,随着生物传感技术的快速发展,已建立多种新的miRNA 的检测方法,如电致化学发光生物传感器[10]、光电化学生物传感器[11]和荧光生物传感器[12]等,具有成本低、灵敏度高等优点。其中,荧光生物传感器由于其重复性好、响应速度快和设备简单等优点而受到关注。然而,传统的荧光生物传感器多采用有机染料、量子点和贵金属纳米簇等荧光材料作为信号源,存在发光稳定性差、光漂白阈值低等问题[9,13-14]。此外,大多数荧光生物传感器以及荧光材料多采用紫外-可见光作为激发光源。然而,紫外-可见光具有较高的能量,会对生物样品造成光损伤,且穿透力较差,从而限制了其在生物传感领域中的应用[15]。
上转换纳米颗粒(Upconversion nanoparticles, UCNPs)作为一种特殊的纳米发光材料,可在低能量的近红外光(Near-infrared, NIR)激发下,发射出能量更高的紫外及可见光,具有反斯托克斯发光特性[16-17]。由于UCNPs的激发光为近红外光(通常为808 nm或980 nm),其不仅能够有效避免紫外及可见光激发引起的光损伤,还能够降低自发荧光背景的干扰[18]。因此,UCNPs 在荧光生物传感领域具有广阔的应用前景。例如,Liu 等[19]利用UCNPs独特的上转换发光特性,基于荧光共振能量转移构建了一种荧光生物传感器用于次氯酸盐的高灵敏检测。Rong 等[20]基于内滤效应和UCNPs 构建荧光生物传感器应用于食品中糠醛的检测,具有较高的灵敏性与特异性。
核酸等温扩增技术凭借其分析效率高、反应速度快和特异性好等优点已用于构建多种荧光生物传感器[21]。核酸等温扩增技术主要包括酶辅助扩增法和无酶扩增法两大类,其中酶辅助扩增法依赖于酶的活性,反应条件受到严格限制,并且存在成本高和储存困难等缺点,从而限制了其应用[22-24]。相比于酶辅助扩增法,无酶的toehold 区域介导的链取代反应(Toehold-mediated strand displacement, TMSD)具有稳定性高、简单、反应迅速和成本低等优点。TMSD 反应是通过互补的单链toehold 区域介导三链迁移,将短双链DNA 置换为热力学更稳定的长双链DNA。催化发夹组装技术(Catalytic hairpin reaction,CHA)是一种典型的TMSD 反应,通过可编程的杂交反应实现靶标的等温循环利用,进而实现信号放大[24]。近年来,将CHA信号扩增技术与新型纳米材料相结合,已开发出多种生物分析与疾病诊断新策略,用于体内外生物标志物的检测[25-26]。
本研究通过UCNPs 与CHA 信号放大策略结合,构建了一种NIR 激发的荧光生物传感器,用于miRNA-21 的高灵敏检测。信标探针H2-UCNPs 的逐步构建过程如图1A 所示,首先通过高温共沉淀法合成核心NaYF4∶Yb3+,Tm3+UCNPs,并采用壳层外延生长法合成核壳NaYF4∶Yb3+,Tm3+@NaYF4UCNPs。接下来除去核壳UCNPs 表面的油酸适配体后通过DNA 磷酸基团与UCNPs 中镧系元素间的配位与静电作用合成H2-UCNPs 信标探针。CHA 的工作原理如图1B 所示,当miRNA-21 存在时,可通过TMSD 与MBs 表面的H1 杂交形成miRNA-21/H1 复合物。被打开的发夹H1 暴露出新的toehold 区域可与连接在UCNPs 表面的发夹H2 杂交,形成H1/H2 复合物并将miRNA-21 置换下来打开新的发夹H1,从而实现信号放大。借助miRNA-21 的循环利用,大量UCNPs 被连接于MBs 表面,在808 nm NIR 激发下产生UCL miRNA-21 的浓度越高,荧光信号越强,从而实现miRNA-21 的荧光检测。总之,本工作提出一种近红外光激发的信号放大荧光生物传感器,具有灵敏度高、操作简单和反应速度快等优点,为miRNA的检测提供了新方法和新思路。
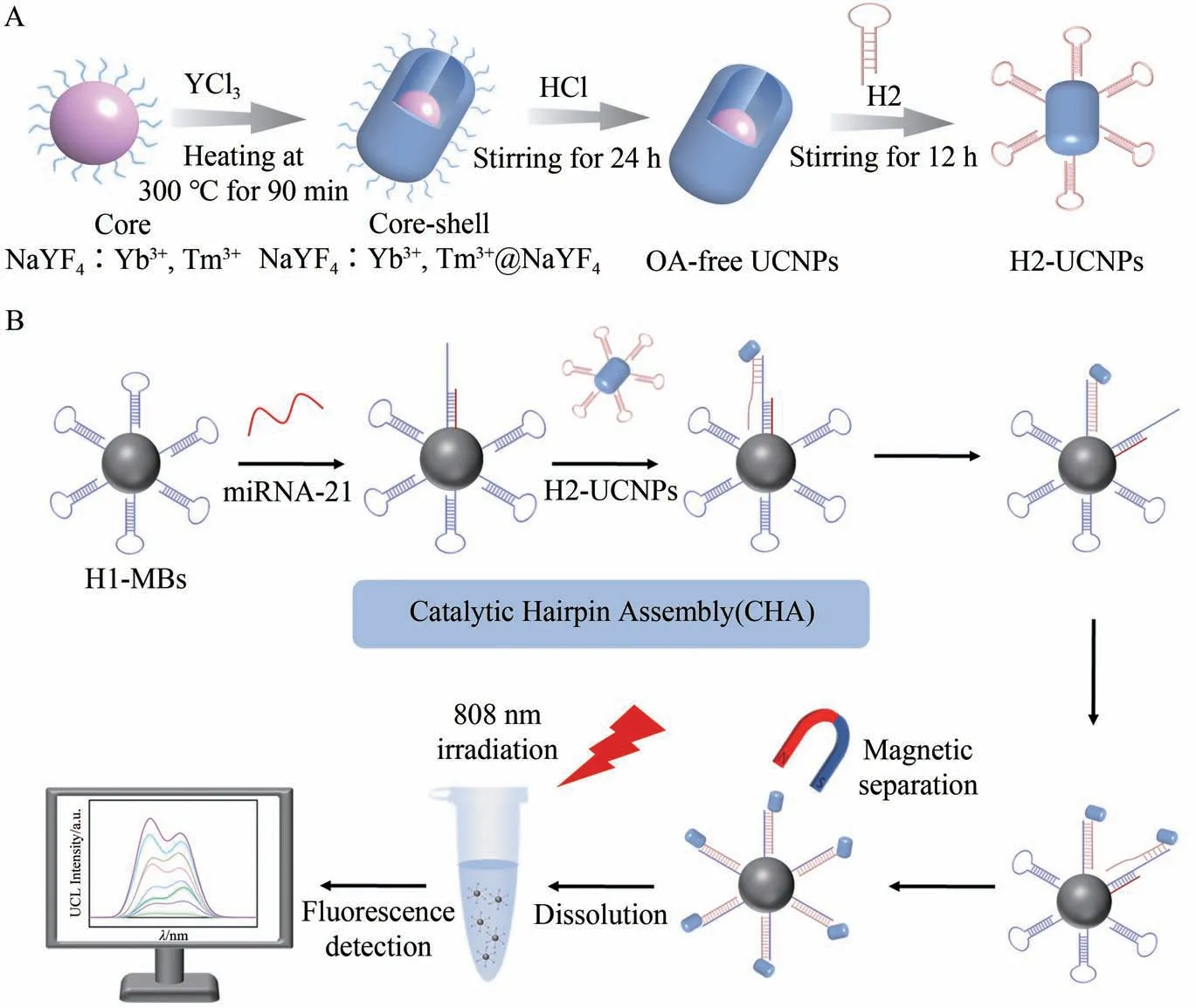
图1 基于UCNPs和CHA信号放大策略的荧光生物感器检测miRNA-21示意图Fig.1 Schematic of fluorescence biosensor based on UCNPs and CHA amplification strategy for the detection of miRNA-21
1 实验部分
1.1 仪器和试剂
ME104E/02 型电子天平(上海梅特勤-托利多仪器有限公司);TGW16 型台式高速微量离心机(济南普纳仪器设备有限公司);Mimi1620 型基因扩增仪(杭州朗基科学仪器有限公司);Tanon 2500R 型凝胶成像仪(上海天能科技有限公司);NanoBrook 90PlusZeta 型高灵敏Zeta 电位及粒度分析仪(美国布鲁克海文仪器公司);F-7000 型荧光分光光度计(日本日立高新技术公司);SZCL 型电热套(上海力辰仪器科技有限公司);HT7700型透射电子显微镜(TEM,日本日立高新技术公司);Regulus8100型场发射扫描电子显微镜(SEM,日本日立高新技术公司);ESCALAB Xi+型X 射线光电子能谱仪(XPS,捷克赛默飞世尔科技(中国)有限公司);JEM 2100F 型高分辨透射电子显微镜(HETEM,日本电子株式会社);Smart Lab 3KW型X射线衍射仪(XRD,日本理学公司)。
氢氧化钠(NaOH,分析纯)、油酸(OA,分析纯)、甲醇(分析纯)、乙醇(分析纯)、环己烷(分析纯)、盐酸(HCl,分析纯)购自国药集团化学试剂;氯化钇(YCl3,99.99%)、氯化镱(YbCl3,99.99%)、氯化铥(TmCl3,99.99%)、十八烯(色谱纯)和氟化氢铵(NH4HF2,分析纯)购自上海麦克林生化科技有限公司。羧基修饰的磁珠购自天津倍思乐色谱技术开发中心。1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC,98%)与N-羟基丁二酰亚胺(NHS,分析纯)购自阿拉丁试剂(上海)有限公司。Tris+EDTA(TE)缓冲液(1×,pH=8)与2-(N-吗啉代)乙烷磺酸(MES)购自上海生工生物工程股份有限公司。MES缓冲液的配置方法为称取2.1325 g MES溶于100 mL纯水中,并调节pH值至5.5。整个实验使用的去离子水来自Millipore水净化系统(18.2 MΩ/cm)。实验中所用DNA 链均由上海生工生物工程股份有限公司提供。DNA 序列如表1 所示。所有的DNA 链在使用前进行退火处理(将DNA 链加热到95 ℃保持5 min,然后冷却至25 ℃保持2 h,冷却速度为0.1 ℃/s)。
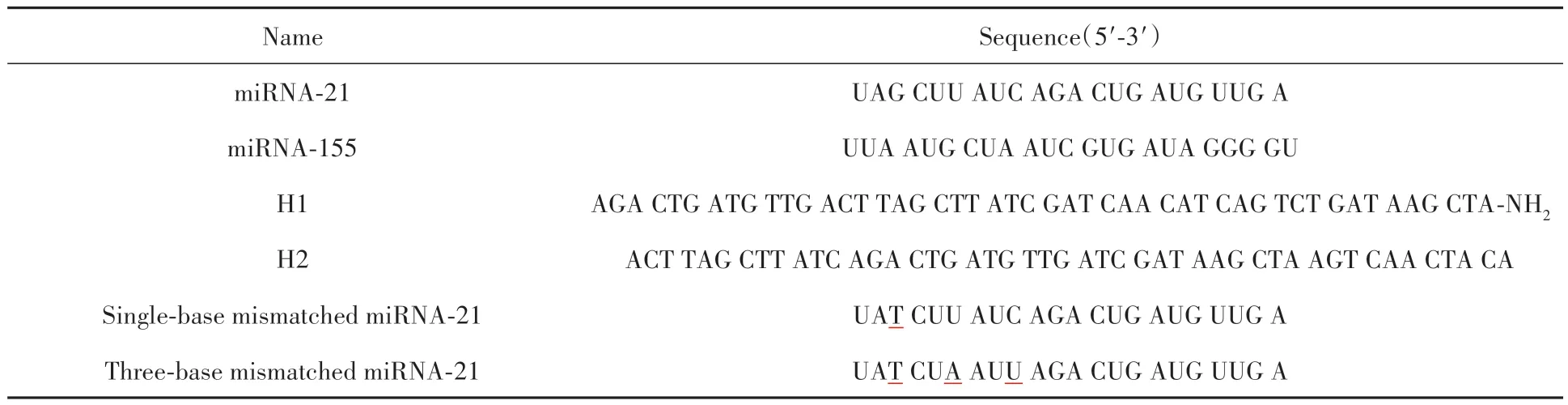
表1 工作中用到的核苷酸序列Table 1 Sequences of oligonucleotides used in this study
1.2 实验方法
1.2.1 NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs的合成
采用高温共沉淀的方法合成核壳NaYF4∶Yb3+,Tm3+@NaYF4UCNPs[27-28]。首先,将0.795 mmol YCl3、0.2 mmol YbCl3、0.005 mmol TmCl3、15 mL十八烯和6 mL OA加入三口烧瓶中,升温至160 ℃,保持30 min,得到淡黄色溶液。待溶液冷却至室温后,将4 mmol NaOH、2.5 mmol NH4HF2和10 mL甲醇混匀后加入三口烧瓶中。将反应体系加热至70 ℃,保持40 min以除去甲醇,随即升温至290 ℃,保持90 min,得到核心NaYF4∶Yb3+,Tm3+UCNPs。将所得悬浊液离心,收集白色沉淀,用环己烷洗涤3 次后,再次分散于环己烷中,以备下一步使用。
接下来将1 mmol YCl3、30 mL十八烯和6 mL OA加入三口烧瓶中,加热至160 ℃,反应30 min得到淡黄色溶液。待溶液冷却至室温后,将上一步反应所得的NaYF4∶Yb3+,Tm3+环己烷分散液缓慢加入三口烧瓶中,随即将4 mmol NaOH、2.5 mmol NH4HF2和10 mL 甲醇混匀后加入,并加热至120 ℃反应60 min 以去除环己烷和甲醇。接下来将溶液迅速加热至300 ℃保持90 min,得到棕褐色溶液。最后,将所得溶液离心,得到的白色沉淀用环己烷和乙醇分别洗涤3次,得到核壳NaYF4∶Yb3+,Tm3+@NaYF4UCNPs,分散在纯水中备用。上述所有步骤均在N2气保护下进行。
1.2.2 H2-UCNPs信标探针的制备
首先,将制备好的UCNPs 分散于10 mL HCl 溶液(1 mmol/L)中,搅拌24 h 除去OA。将除去OA 的UCNPs 以12000 r/min 的转速离心30 min,并用乙醇和纯水分别洗涤分散于TE 缓冲液中。最后,将发夹H2加入去除油酸的UCNPs悬浊液中,搅拌12 h制备得到H2-UCNPs复合物,将其作为信标探针备用。
1.2.3 H1-MBs捕获探针的构建
将60 μL羧基修饰的MBs(1 mg/mL)用200 μL MES缓冲液(pH=5.5)通过磁性分离的方法洗涤3次,并重新分散于150 μL MES 缓冲液中。接下来加入500 μL 含有EDC(0.1 mol/L)和NHS(0.01 mol/L)的水溶液,在37 ℃下反应30 min 以活化MBs 表面的羧基。活化后的MBs 用TE 缓冲液洗涤2 次后分散于150 μL TE 缓冲液中。取300 μL 氨基修饰的发夹H1(2 μmol/L)与活化的MBs 于37 ℃下反应12 h 得到H1-MBs,将H1-MBs洗涤3次后分散于TE缓冲液中备用。
1.2.4 近红外荧光生物传感器的构建
将20 μL 不同浓度的miRNA-21、50 μL H1-MBs 和50 μL H2-UCNPs 于离心管中混匀,在25 ℃下反应2 h。磁分离后,将所得沉淀用纯水洗涤2 次后重新溶解于120 μL 纯水中,使用荧光分光光度计检测UCL强度。
2 结果与讨论
2.1 材料表征
首先,对羧基修饰的MBs进行SEM 表征。如图2A 所示,羧基修饰MBs为球形,形貌均一,平均直径约为230 nm。接下来对合成的UCNPs 进行TEM 表征。如图2B 所示,核心NaYF4∶Yb3+,Tm3+UCNPs 为球形,分散性好,平均粒径约为24 nm。为了增强UCNPs 的UCL 性能,采用介导壳层外延生长法,以NaYF4∶Yb3+,Tm3+为种子,在其表面生长一层惰性NaYF4外壳,合成NaYF4∶Yb3+,Tm3+@NaYF4UCNPs。TEM 结果显示,所合成的核壳UCNPs 为椭圆形,长径约为38 nm,短径约为28 nm,大小均匀,分散性好(图2C)。进一步,利用XPS对NaYF4∶Yb3+,Tm3+@NaYF4UCNPs进行元素表征(图2D)。结果表明,Na、F、Y、Yb 和Tm 这5 种元素均存在于UCNPs 的XPS 全谱中。Y3d和F1s的高分辨 XPS 谱图如图2E 和2F 所示。158.35和160.35 eV处的峰分别归属于Y3d5/2和Y3d3/2[27]; 685.2 eV处的峰归属于F1s[29]。通过TEM和XPS分析,证明了核壳NaYF4∶Yb3+,Tm3+@NaYF4UCNPs的成功制备。
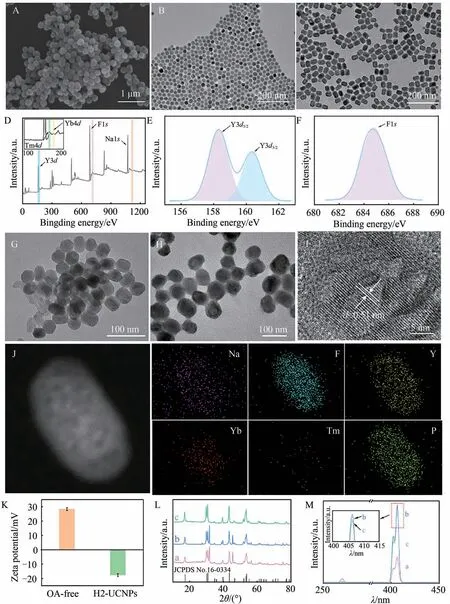
图2 (A)MBs 的SEM 图。(B)NaYF4∶Yb3+,Tm3+ UCNPs 和(C)NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs 的TEM 图。(D) NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs的XPS表征。 (E) Y3d和(F)F1s轨道的高分辨XPS图谱。 (G)去除OA的UCNPs 和(H) H2-UCNPs 的TEM 图。H2-UCNPs 的(I)HRTEM 和(J)EDS 表征。(K)去除OA 的 UCNPs 和H2-UCNP的Zeta电位表征。 (L) NaYF4∶Yb3+,Tm3+ UCNPs(a)、NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs(b)和H2-UCNPs(c)的XRD 表征。 (M) 808 nm NIR 激发下NaYF4∶Yb3+,Tm3+ UCNPs(a)、NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs(b)和H2-UCNPs(c)的UCL光谱Fig.2 (A) SEM image of MBs. TEM images of (B) NaYF4∶Yb3+,Tm3+ UCNPs and (C) NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs. (D) XPS survey spectrum of NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs. High-resolution XPS spectra of(E) Y3d and (F) F1s. TEM images of (G) OA-free UCNPs and (H) H2-UCNPs. (I) HRTEM and (J) EDS elemental mapping of H2-UCNPs. (K) Zeta potential of OA-free UCNPs and H2-UCNPs. (L) XRD spectrum of NaYF4∶Yb3+,Tm3+UCNPs (a), NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs(b) and H2-UCNPs(c). (M) UCL spectra of NaYF4∶Yb3+,Tm3+UCNPs (a), NaYF4∶Yb3+,Tm3+@NaYF4 UCNPs (b) and H2-UCNPs (c) under 808 nm NIR
在UCNPs的合成过程中,以疏水性OA作为稳定剂,可有效阻止UCNPs的聚集,但同时也阻止了UCNPs与DNA的连接,因此本研究使用HCl除去UCNPs表面的OA。如图2G所示,去除OA后的UCNPs的形貌和粒径均未发生明显变化,但分散性变差。进一步,利用DNA磷酸基团与UCNPs中镧系元素(Ln3+)间的配位与静电作用[30],制备得到H2-UCNPs 信标探针。如图2H 所示,UCNPs 连接发夹DNA 发夹H2 后,其分散性较去除OA 后增强。同时,对所制备的H2-UCNPs 进行HRTEM 表征(图2I),晶格条纹宽度为0.51 nm,与NaYF4的(100)晶面参数一致。采用能量色散X 射线光谱(EDS)对H2-UCNPs 信标探针进行进一步表征。如图2J 所示,Na、F、Y、Yb、Tm 和P 等元素均匀分布于UCNPs 中,其中P 元素来源于DNA,表明H2-UCNPs 信标探针的成功制备。接下来采用Zeta 电位分析仪对连接发夹H2前后UCNPs的电位进行测定。由于DNA带负电,其连接到去除OA的UCNPs后,电位从28.37 mV下降至-17.6 mV(图2K),表明H2 成功连接于UCNPs 表面。为验证晶型变化,采用XRD 同时对NaYF4∶Yb3+,Tm3+UCNPs、NaYF4∶Yb3+,Tm3+@NaYF4UCNPs 和H2-UCNPs 进行表征。三者在17.12、30.70、31.70、43.36 和53.58(°)处均有相同的衍射峰,分别归属于NaYF4的(100)、(110)、(101)、(201)和(211)晶面(图2L),表明H2 的修饰未对UCNPs的晶格产生影响。
UCNPs具有优越的发光性能,其中Yb3+作为敏化剂吸收808 nm近红外光,Tm3+作为激发剂产生紫外UCL(UCLUV)和可见UCL(UCLVis)。对核心NaYF4∶Yb3+,Tm3+和核壳NaYF4∶Yb3+,Tm3+@NaYF4UCNPs的UCL特性进行了对比。如图2M所示,NaYF4∶Yb3+,Tm3+UCNPs在270.0 nm和406.4 nm处产生UCL峰(图2M曲线a)。包覆NaYF4外壳后,由于NaYF4∶Yb3+,Tm3+UCNPs的表面缺陷减少,NaYF4∶Yb3+,Tm3+@NaYF4UCNPs的UCL 明显增强(图2M 曲线b)。在UCNPs 表面连接DNA 后,由于颗粒表面的水结合状态发生改变,H2-UCNPs 的UCL 强度略有下降[30](图2M 曲线c)。位于406.4 nm 处的UCL 明显强于270.0 nm 处,因此,使用406.4 nm处的UCL作为荧光生物传感平台的检测信号。
2.2 可行性分析
为了验证本研究的可行性,采用非变性聚丙烯凝胶电泳(PAGE)对miRNA-21触发的CHA过程进行分析。如图3 所示,泳道1 与泳道2 中的条带分别代表miRNA-21 和H1。当miRNA-21 与H1 孵育后,通过TMSD 反应打开发夹H1,形成miRNA-21/H1 复合物(泳道3)。当miRNA-21 与H1 与H2 共同孵育后,泳道4 出现H1/H2 复合物的条带,迁移速率较miRNA-21/H1 复合物进一步减慢,并在泳道4 的下方出现miRNA-21 的条带,表明miRNA-21 的释放以及其触发CHA 过程的成功进行。在无miRNA-21 时,H1 与H2 不发生反应,保持稳定状态(泳道5)。
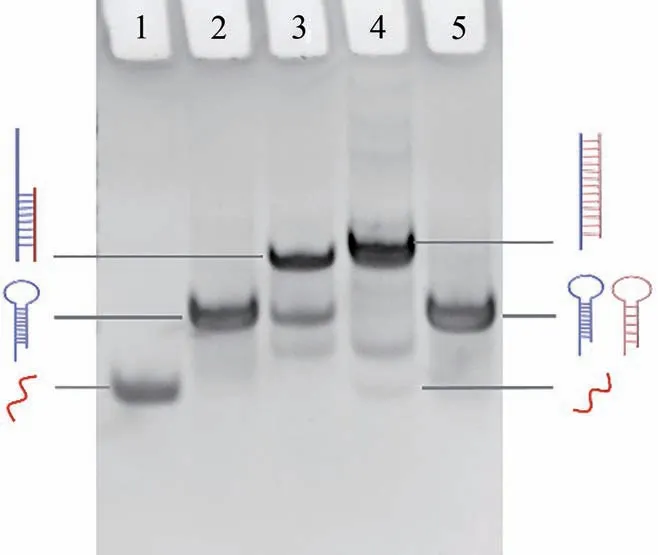
图3 非变性聚丙烯凝胶电泳表征CHA 反应过程。泳道1: miRNA-21; 泳道2: H1; 泳道3:miRNA-21+H1; 泳道4: miRNA-21+H1+H2; 泳道5: H1+H2Fig. 3 Native PAGE for the characterization of CHA process. Lane 1: miRNA-21; lane 2: H1;lane 3: miRNA-21+H1; lane 4:miRNA-21+H1+H2; lane 5: H1+H2
2.3 实验条件优化
MBs 上固载H1 的数量对所构建的荧光生物传感器的灵敏度具有重要影响。H1 浓度过低将导致固定的UCNPs 减少; 而H1 饱和后,继续增大浓度并不会增强UCL。因此,首先对H1 的浓度进行优化,此时选定miRNA-21 的浓度为10 nmol/L。如图4A 所示,当H1 的浓度较低时,随着其浓度的增大荧光信号逐渐增强; 当H1 的浓度达到2 μmol/L 后,荧光强度达到平台,继续加大浓度对荧光强度无影响。因此,选择2 μmol/L 作为H1 的最佳浓度。此外,CHA 的反应时间对传感器的灵敏度也会产生较大影响。如图4B 所示,当miRNA-21 为10 nmol/L 时,随着CHA反应时间的延长,荧光强度增强,并在2.0 h达到最大值,之后荧光信号基本保持不变。因此,选择2.0 h作为CHA反应的最佳反应时间。
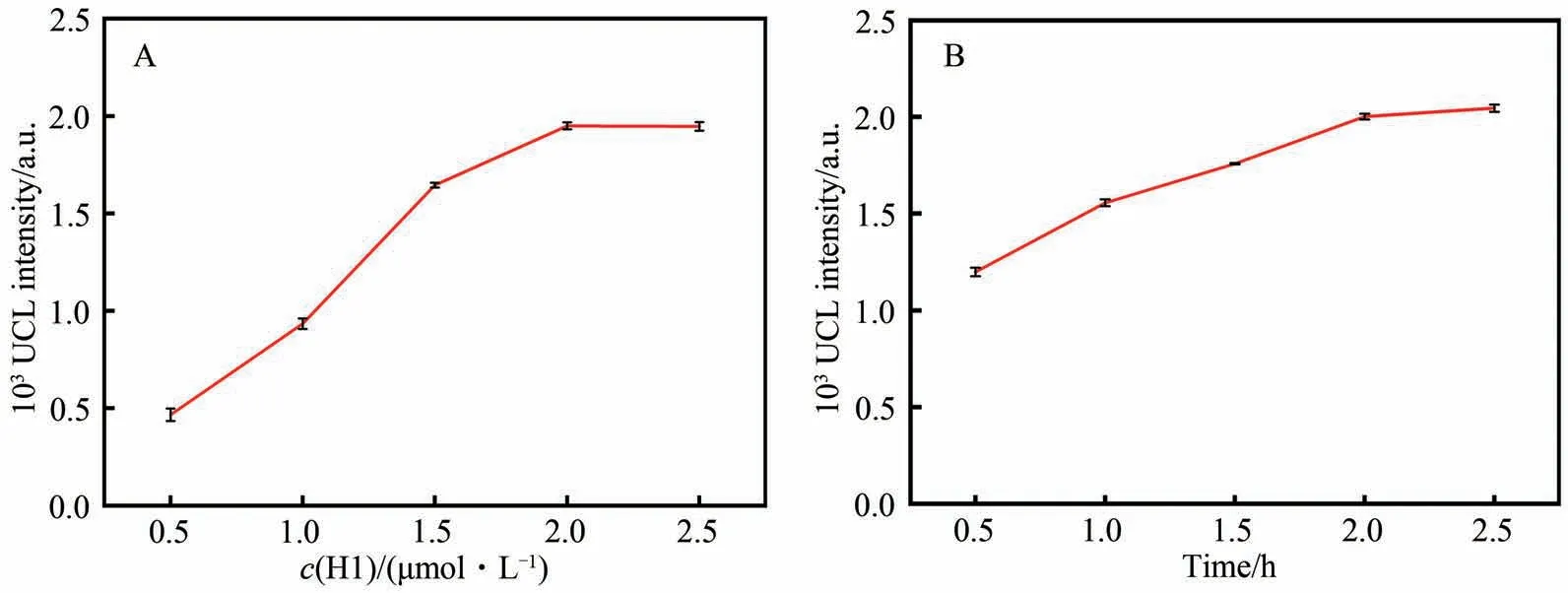
图4 (A) MBs上H1浓度优化和(B) CHA反应时间优化Fig.4 (A) Optimization of H1 concentrations on MBs and (B) reaction time of CHA reaction
2.4 近红外荧光生物传感器检测miRNA
在最佳实验条件下,采用所构建的近红外荧光生物传感器对不同浓度的miRNA-21 进行检测。如图5A 所示,随着miRNA-21 浓度的增大,UCL 信号逐渐升高。在0.1~100 nmol/L 范围内,UCL 强度与miRNA-21 浓度的对数值(lgcmiRNA-21)呈线性关系,线性方程为F=918.53×lgcmiRNA-21+1050.68,R2=0.998(图5B),检出限为11.3 pmol/L(3S/N,S为5次空白试验测得的标准偏差,N为线性方程的斜率)。与已报道的miRNA 检测方法相比,本研究所构建的近红外荧光生物传感具有相对较宽的检测范围和较低的检出限(表2)。

表2 不同传感体系的检测性能比较Table 2 Comparison of performance of different sensing system
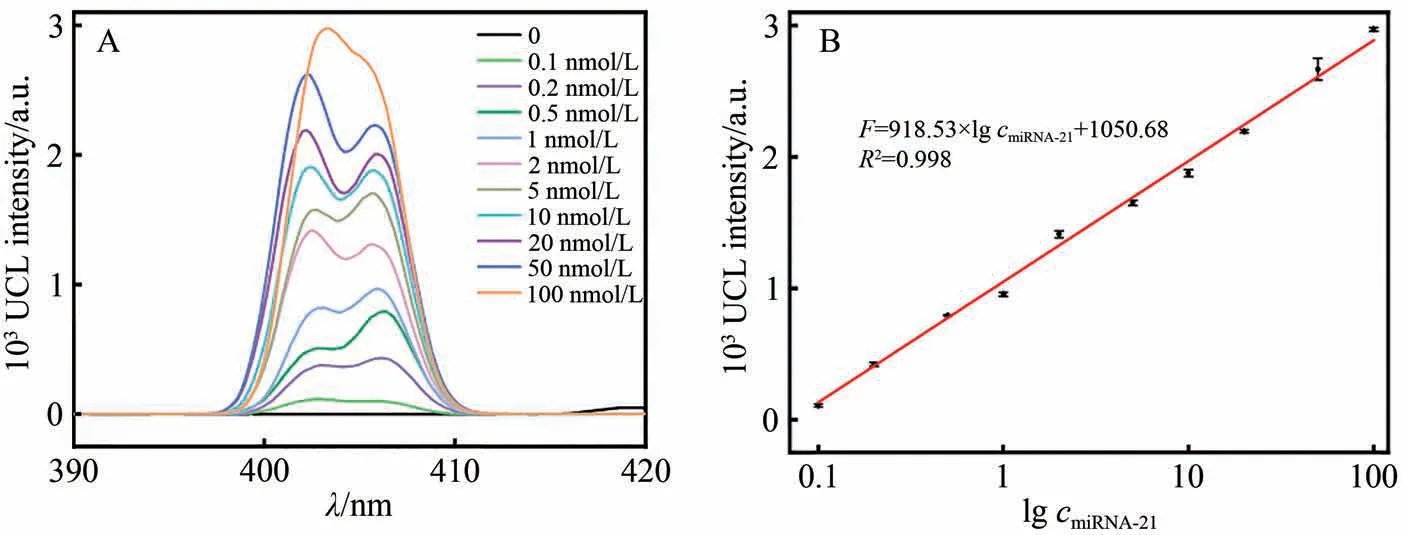
图5 (A)采用所构建的近红外荧光生物传感检测不同浓度miRNA-21的UCL光谱。 (B) UCL强度与miRNA-21浓度对数的线性关系图Fig. 5 (A) UCL spectra toward miRNA-21 with different concentrations using the proposed NIR fluorescence biosensor. (B) Corresponding linear relationship between UCL intensity and logarithm of miRNA-21 concentration
为验证该荧光生物传感器的特异性,分别对单碱基错配miRNA-21(SM)、三碱基错配miRNA-21(TM)和miRNA-155 等3 种干扰物进行检测(图6A)。在相同实验条件下,与目标物miRNA-21 相比,干扰物未引起明显的UCL 信号变化,表明所构建的近红外荧光生物传感器对miRNA-21 的检测具有良好的特异性。为验证该荧光生物传感器的储存稳定性,对10 nmol/L 的miRNA-21 进行检测,并记录分别于4 ℃保存1、3、5和7 d后的荧光信号(图6B)。在储存1、3、5和7 d后,检测到的平均荧光强度分别为初始值的99.34%、99.11%、96.65%和97.56%,表明该近红外荧光生物传感体系具有良好的储存稳定性。
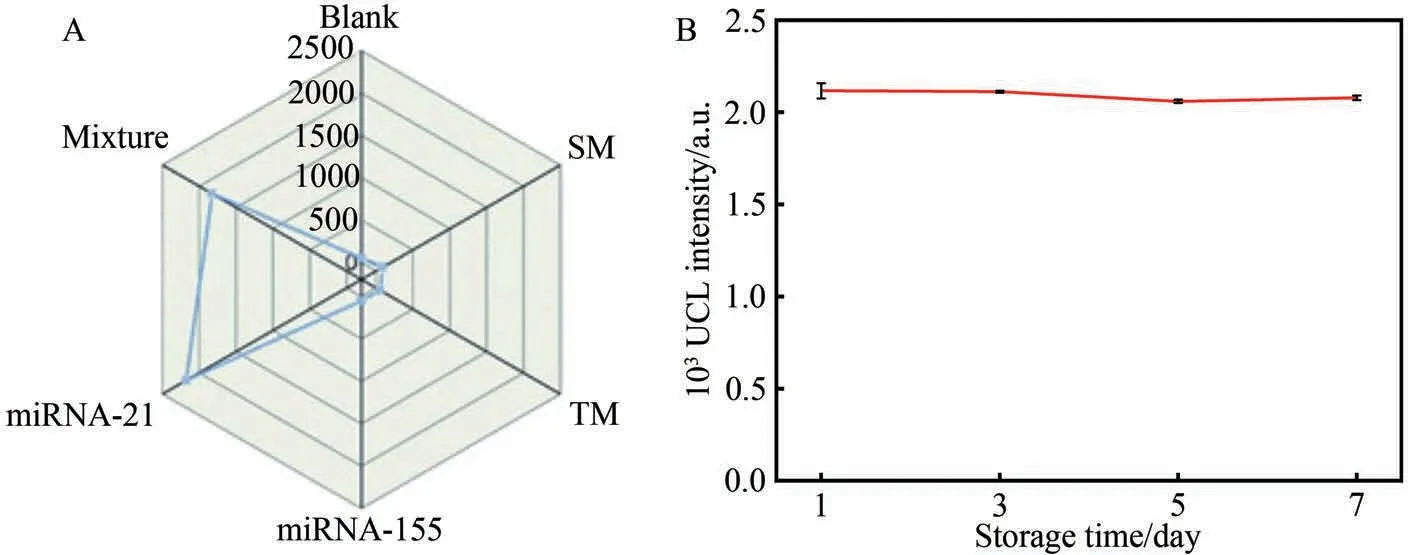
图6 所构建近红外荧光生物传感器的(A)特异性和(B)储存稳定性Fig.6 (A) Specificity and (B) storage stability of the constructed NIR fluorescence biosensor
2.5 实际样本分析
为了验证该近红外荧光生物传感器的实用性,对血清中的miRNA-21进行检测。在稀释100倍的健康人血清中分别加入不同浓度的miRNA-21(0、0.7、7 和70 nmol/L),并对其进行加样回收率实验,结果如表3 所示。血清中miRNA-21 的回收率为101.14%~103.41%,相对标准偏差均小于1.02%,表明所构建的荧光生物传感器可实现血清等复杂生理条件中miRNA-21的准确检测,具有良好的实用性。
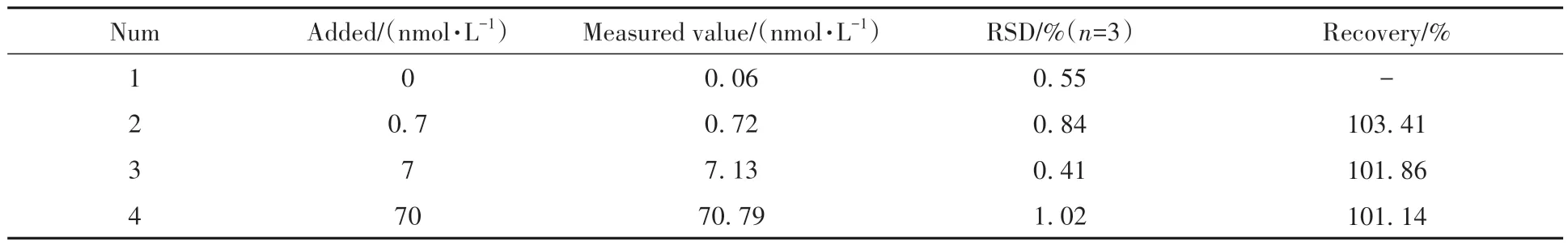
表3 采用所构建的近红外荧光传感器检测血清中miRNA-21Table 3 Detection of miRNA-21 in human serum by NIR-driven fluorescence biosensor
3 结 论
本研究基于UCNPs的上转换发光特性,结合CHA信号放大策略构建了一种NIR荧光生物传感器用于miRNA-21 的灵敏检测。在miRNA-21 的触发下,发夹HI 与H2 发生CHA 反应,将UCNPs 固定于MBs表面,实现了信号的转导与放大; 同时,反应在恒温无酶的条件下进行,可有效抵抗外界环境的干扰,增强传感体系的稳定性。MBs表面的UCNPs在NIR的激发下产生UCL,实现对miRNA-21检测。本工作采用NIR 作为UCNPs 的激发光,可有效避免自发荧光的干扰以及对生物样品的光损伤,且UCNPs 在检测过程中表现出较高的荧光稳定性。将CHA信号放大策略与荧光传感方法相结合,实现信号放大的同时兼具响应速度快、检测成本低和设备简单等优点,在miRNA-21 的检测中表现出良好的选择性和稳定性,并实现了血清样本中miRNA-21的准确检测,表现出较高的实用性。总之,所构建的NIR荧光生物传感体系为临床肿瘤标志物的检测提供了新的研究思路,在肿瘤早期诊断中具有广阔的应用前景。

