基于microRNA‑21响应的Zn2+/DNA自组装体用于肿瘤的检测和氧化应激治疗
徐 昕 李 烨 王 敏 傅章程 齐国敏 卢春华
(福州大学化学学院, 福州 350116)
MicroRNAs是一类长度约为20个核苷酸的内源性非编码RNA,具备多种生物学功能,在细胞的损伤和凋亡过程中发挥着重要作用[1]。 其中,microRNA-21(miR-21)已被发现在多种肿瘤中的表达水平高于正常组织,这意味着其与肿瘤的发生和发展密切相关,这也让miR-21成为一种代表性的肿瘤标志物,因此,基于miR-21的肿瘤检测和响应性的药物释放对于肿瘤的诊断和治疗有着重要的意义[2]。 目前,已有多种microRNAs 的检测技术被提出,如定量逆转录-聚合酶链反应(RT-PCR)[3]和环介导等温扩增技术(LAMP)[4]等。 然而,部分检测方法的灵敏度低,仅适用于细胞裂解液或缓冲液,而无法反映活细胞内microRNAs的变化。 因此,迫切需要开发一种高选择性、高效率的策略用于肿瘤细胞内miR-21的检测。
DNA发卡结构是由DNA单链通过自身折叠,使得碱基对相互靠近、发生互补配对,从而形成的一种DNA二级结构[5-6]。 由于DNA发卡具有灵敏的碱基特异性的响应能力,因此其常被设计成分子探针,用于单链核酸的检测[7-8]。 目前,DNA 发卡已被广泛应用在肿瘤相关的核酸检测中,也包括构建基于microRNAs的生物传感器[9-10]。
近年来,DNA 纳米材料因为具有良好的生物相容性、可调节的粒子尺寸以及特异性的分子识别能力,已经成为一种新型的肿瘤诊疗工具[10-11]。 而基于DNA 的无载体自组装纳米平台,更是因为制备简单、药物利用率高,而在靶向肿瘤的药物输送和传感中体现了巨大优势[12-14]。 DNA 具有良好的金属离子配位性能[15],由于核酸结构中的碱基基团(具有富含孤对电子的氮原子)和磷酸根骨架(具有负电性)为金属离子提供了结合位点,使得DNA 可以作为金属离子的一种有效配体[16-17]。 因此,本研究开发了一种基于Zn2+/DNA 自组装的无载体纳米材料(ZDNPs),并将其设计用于肿瘤标志物miR-21响应的肿瘤荧光成像和Zn2+介导的氧化应激治疗(图1)。 DNA 发卡和Zn2+通过静电作用和配位作用形成尺寸均匀的纳米粒子,其中的DNA 发卡能与肿瘤细胞内高水平表达的miR-21 发生特异性结合,从而恢复自身的荧光信号,起到肿瘤成像的作用。 同时,包载的Zn2+在肿瘤细胞内释放,引起细胞内ROS 含量的上调,使肿瘤细胞发生氧化应激从而凋亡[18-20]。 ZDNPs 的细胞和动物实验均显示其是一种作用效果良好、具有miR-21响应性的肿瘤诊疗一体化系统,体现了其在生物医药中的应用前景。
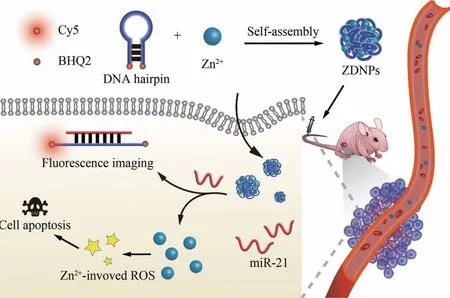
图1 ZDNPs的合成示意图以及在肿瘤中的miR-21响应性荧光成像和氧化应激治疗Fig.1 Schematic illustration of ZDNPs synthesis process and miR-21 responsive fluorescence imaging and oxidative stress therapy of ZDNPs in tumor
1 实验部分
1.1 仪器和试剂
Acculab 型电子分析天平(北京赛多利斯科学仪器有限公司);Cary Eclipse 型荧光分光光度计(美国Agilent 公司);CHB-202 型恒温金属浴(杭州博日科技有限公司);Hitachi HT7700 型透射电子显微镜(TEM,日本日立高新技术公司);Zetasizer Nano ZS 型 DLS 纳米粒度电位分析仪(英国Malvern 公司);SH-1000 型酶标仪(日本Corona 公司);Nikon A1 型共聚焦激光扫描显微镜(CLSM,日本Nikon 公司);IVIS Lumina XRMS Series III小动物成像系统(美国PerkinElmer仪器有限公司)。
本实验中所有试剂均为市售分析纯,未做进一步纯化。 ZnCl2购自默克化工技术(上海)有限公司。 本实验所用的DNA 引物(表1)均购自生工生物工程(上海)股份有限公司。 Hoechst 33342、Cell Counting Kit-8(CCK-8)和活性氧检测试剂盒(DCFH-DA)均购自东仁化学科技(上海)有限公司。 异氟烷购自瑞沃德生命科技(深圳)有限公司。 人类正常肝脏细胞系(L02细胞)和人类乳腺癌细胞系(MCF-7细胞)购自ATCC(美国)细胞资源中心,细胞系在温度为37 ℃,空气浓度为95%,CO2浓度为5%的二氧化碳恒温培养箱中培养。 BALB/c 小鼠(雌性,六周龄)购自吴氏实验动物。 小鼠组织的苏木精和伊红(H&E)染色切片由赛维尔生物科技(武汉)有限公司制作。 本实验中使用的超纯水(18.25 MΩ/cm)均通过美国Millipore公司的Milli-Qwater净化系统获得。

表1 实验中所用的DNA序列Table 1 DNA sequences in this study
1.2 实验方法
1.2.1 DNA发卡对miR‑21的响应性验证
将Hairpin-FL 放在95 ℃的金属浴中加热5 min,然后自然冷却2.5 h 至室温完成退火,使DNA 形成发卡结构。 将160 nmol/L DNA 发卡与不同浓度的miR-21(0、40、80、120、160、320和800 nmol/L)进行混合,用PBS缓冲液加至总体积为100 μL。 将样品置于37 ℃的金属浴中恒温反应1.5 h后,设置激发波长为630 nm,检测发射波长范围为640~750 nm,测量各溶液的荧光信号,进行数据分析。
1.2.2 ZDNPs的制备
将ZnCl2(2.5 μL,10 mmol/L)和DNA发卡(2.5 μL,100 μmol/L)进行混合,用超纯水将溶液总体积加至25 μL。 溶液混匀后,放置于37 ℃的金属浴中恒温反应4 h。 产物在11000 r/min离心,15 min,将得到的沉淀置于4 ℃条件下保存。 合成ZDNPs 后,使用电感耦合等离子体质谱(ICP-MS)计算ZDNPs 对Zn2+的包封率,计算公式为: 包封率Zn2+=((总浓度Zn2+-清液浓度Zn2+)/总浓度Zn2+)×100%。
1.2.3 ZDNPs对miR‑21的响应性与选择性验证
将160 nmol/L 的ZDNPs 与不同浓度的miR-21(0、5、10、20、40、80、120、160、320 和800 nmol/L)进行混合,用PBS缓冲液加至总体积为100 μL。 将样品置于37 ℃的金属浴中恒温反应1.5 h后,设置激发波长为630 nm,检测发射波长范围为640~750 nm,测量各溶液的荧光信号,进行数据分析。
将160 nmol/L 的ZDNPs 与160 nmol/L 不同种类的microRNAs(let-7a、miR-429、miR-144、miR-155 和miR-21)进行混合,并设置PBS 空白对照组。 之后,用PBS 缓冲液将溶液加至总体积为100 μL,置于37 ℃的金属浴中恒温反应1.5 h 后,设置激发波长为630 nm,检测发射波长范围为640~750 nm,测量各溶液的荧光信号并进行数据分析。
1.2.4 ZDNPs的细胞内荧光成像
根据不同细胞的miR-21 表达含量的不同,选择MCF-7 作为miR-21 阳性细胞,L02 作为阴性细胞。将MCF-7细胞和L02细胞以5×104个/孔的密度分别接种于荧光培养皿中培养24 h后,加入500 nmol/L的ZDNPs 与细胞孵育4 h。 弃去培养液,使用核染料Hoechst 33342 对细胞核进行染色,再次更换培养液,使用CLSM对细胞进行荧光成像。
1.2.5 ZDNPs对细胞的杀伤性验证
将MCF-7细胞和L02细胞以1×104个/孔的密度分别接种于96孔板中,培养24 h。 之后,将2种细胞与不同浓度的ZDNPs(0、60、120、180、300、480、600、720和900 nmol/L)继续孵育24 h。 使用CCK-8试剂盒测试孔板中细胞的活性,并用酶标仪测量其在450 nm处的吸收值,以对ZDNPs的细胞毒性进行评估。
1.2.6 ZDNPs在肿瘤细胞内产生Zn2+相关的ROS验证
将600 nmol/L DNA 发卡和不同浓度的ZDNPs(0、60、300、480、600和900 nmol/L)分别与MCF-7细胞孵育4 h。 使用ROS探针DCFH-DA对细胞进行染色后,使用CLSM对细胞进行荧光成像。
1.2.7 ZDNPs对肿瘤中miR‑21的活体成像
本研究所有动物实验均经福州大学机构动物伦理与使用委员会批准,实验均按照国家科技部颁布的《实验动物护理与使用指南》(2006 年修订)执行。 使用雌性BALB/c 小鼠(六周龄)进行MCF-7 细胞(100 μL,1×107cell/mL)的皮下注射,建立乳腺癌移植瘤模型。肿瘤体积达到100 mm3时进行成像实验。 使用异氟烷将小鼠麻醉后,将ZDNPs 和由随机序列(random DNA)合成的纳米粒子(Random)通过尾静脉注射(100 μL,600 nmol/L)进入荷瘤小鼠体内,使用小动物成像仪观测小鼠的Cy5 荧光信号。
1.2.8 ZDNPs的活体抗肿瘤效果及安全性评估
将乳腺癌荷瘤小鼠分为5组并每2 d注射一次样品: (a)DNA hairpin 组(100 μL,900 nmol/L); (b)Zn2+组(100 μL,15 μmol/L); (c)Random 组(100 μL,900 nmol/L); (d)ZDNPs 治疗组(100 μL,900 nmol/L);(e)PBS 组(100 μL)。 肿瘤治疗的实验周期为14 d,共注射7 次,期间每2 d 测量一次小鼠的肿瘤体积。14 d后,处死并解剖小鼠,取出肿瘤,获取肿瘤照片和切片,用来评估ZDNPs的抗肿瘤效果。
对于ZDNPs 的活体治疗安全性评估,则通过治疗期间每2 d 记录一次小鼠的体重变化和治疗结束后小鼠的主要器官切片进行分析。
2 结果与讨论
2.1 材料合成及性质表征
2.1.1 DNA发卡对miR‑21的响应性
为了验证设计的DNA 发卡对miR-21 具有响应,将160 nmol/L 的DNA 发卡与不同浓度的miR-21 混合反应,并通过检测溶液的荧光变化进行评估。 由于DNA 发卡与miR-21 序列互补区域的碱基个数大于其自身形成发卡的碱基个数,因此,这2种结合自由能的差异使得DNA发卡结构在miR-21的存在下,能够从单链发卡结构转变成与miR-21 的双链互补,从而使Cy5 的荧光信号得以恢复。 如图2A 所示,随着溶液中miR-21 浓度增加,Cy5 的荧光信号逐渐增强,同时,通过对图2A 中荧光曲线的发射峰值进行函数拟合,得到了一条相关性较强的直线方程(图2B),说明在40~160 nmol/L 的miR-21 浓度范围内,DNA发卡对miR-21具有良好的线性响应性。
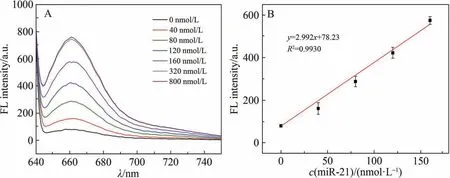
图2 DNA发卡对不同浓度miR-21的响应性(A); 不同浓度的miR-21与荧光强度的线性关系(B)Fig. 2 Responsiveness of DNA hairpin to different concentrations of miR-21 (A); Linear relationship between different concentrations of miR-21 and fluorescence intensity (B)
2.1.2 ZDNPs的合成与表征
将Zn2+和DNA 发卡进行自组装,并对合成的产物ZDNPs 进行基本性质的表征。 如图3A 所示,ZDNPs 的TEM 数据显示其组装成了尺寸较为均一、分散性较好的球形颗粒,通过DLS 测得的ZDNPs 的平均粒径为187 nm。 此外,通过ICP-MS测得ZDNPs对Zn2+的包封率为17.3%。
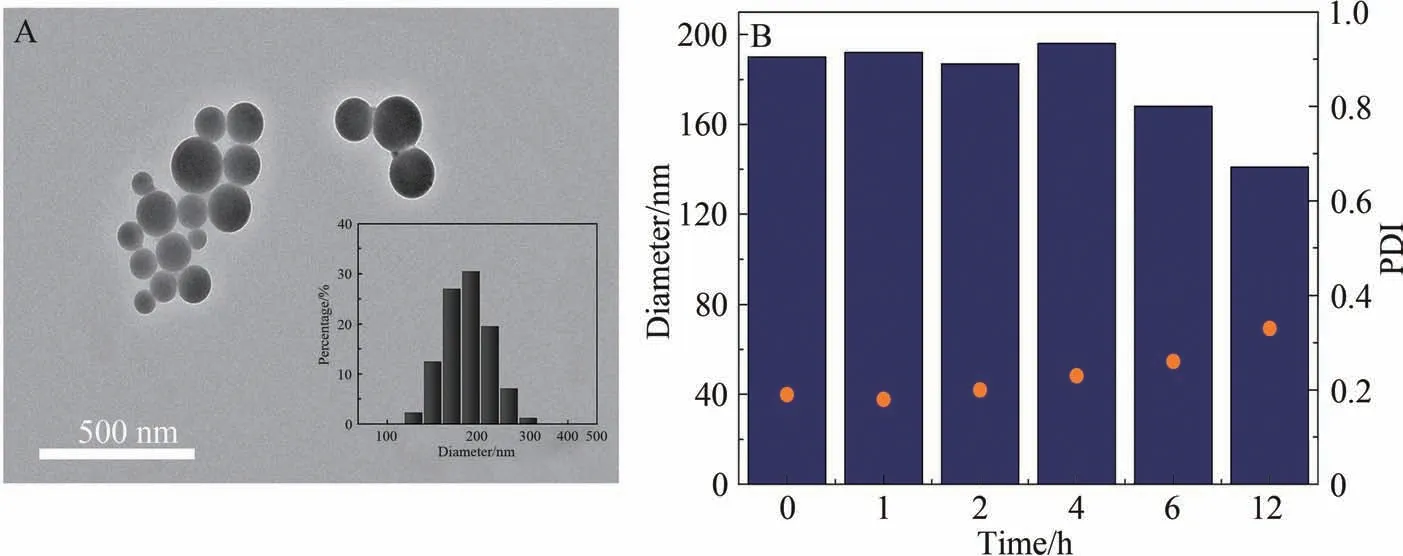
图3 ZDNPs的TEM图像和粒径分布图(A)及ZDNPs在PBS中的粒径变化(B)Fig.3 TEM image and particle size distribution of ZDNPs (A) and particle size changes of ZDNPs in PBS (B)
为确保ZDNPs 能在细胞及动物实验中有效发挥作用,考察了ZDNPs 在模拟生理环境中的稳定性,即根据ZDNPs在37 ℃、PBS的环境中的不同时间下的粒径数据来进行评估。 如图3B所示,在前4 h内,ZDNPs的粒径分布基本没有变化,说明这段时间其在PBS中的形貌变化较小,能保持较好的稳定性; 在孵育了6 h后,ZDNPs的粒径逐渐变小,但总体变化不大; 而在12 h后,ZDNPs的粒径分布发生了明显变化,平均粒径由初始的190 nm 变为141 nm,说明此时ZDNPs已出现了部分降解。 以上实验结果表明了ZDNPs在模拟生理环境下能维持较长时间的结构稳定性。
2.1.3 ZDNPs对miR‑21的响应性和选择性
为了探究粒子组装对DNA 发卡结构的miR-21 响应能力的影响,将ZDNPs 与不同浓度的miR-21 进行反应并表征其荧光信号。 如图4A所示,将不同浓度的miR-21与160 nmol/L ZDNPs进行孵育,并对溶液荧光进行检测,结果显示ZDNPs 的Cy5荧光随着miR-21浓度的增大逐渐开始恢复,通过将图4A 中荧光曲线的发射峰值与miR-21浓度进行函数拟合,得到一条呈正相关的线性曲线(图4B),表明ZDNPs 与miR-21 浓度的线性响应范围为5~160 nmol/L,且检测限为5 nmol/L。 以上实验结果说明,ZDNPs 具有良好的miR-21响应性质,可以作为一种检测肿瘤标志物的荧光探针。
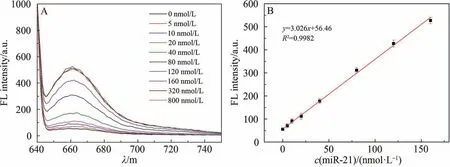
图4 ZDNPs对不同浓度miR-21的响应性(A); 不同浓度的miR-21与荧光强度的线性关系(B)Fig. 4 Responsiveness of ZDNPs to different concentrations of miR-21 (A); Linear relationship between different concentrations of miR-21 and fluorescence intensity (B)
由于肿瘤细胞中存在多种microRNA 且微环境复杂,因此,为评估ZDNPs对miR-21的特异性识别能力,另选了4 种microRNA 作为对照组,PBS 作为空白组,通过与ZDNPs 共孵育后溶液中恢复的Cy5 荧光强度来考察ZDNPs 的选择性。 如图5 所示,除了miR-21 组外,其它4 个microRNA 组和空白组均无明显的荧光信号产生,这证明了ZDNPS对miR-21具有良好的选择性。
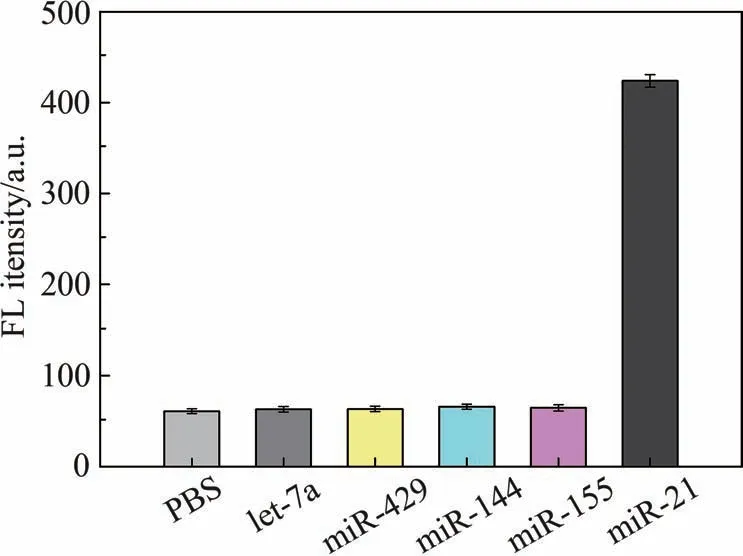
图5 ZDNPs对miR-21的选择性Fig.5 Selectivity of ZDNPs to miR-21
2.1.4 ZDNPs的细胞内miR‑21响应性成像
为了验证ZDNPs 在细胞内能产生miR-21 响应性的荧光信号,使用PBS 作为实验空白组,随机序列random DNA 与Zn2+合成的自组装体(Random)作为对照组,ZDNPs 作为实验组,并选择人乳腺肿瘤细胞MCF-7作为miR-21阳性细胞组,选择人肝细胞L02 作为miR-21 阴性细胞组,从而考察不同样品在不同细胞内的miR-21 响应性荧光信号。 如图6 所示,红色和蓝色通道分别代表Cy5 荧光和细胞核,2 种细胞与ZDNPs共孵育4 h后,MCF-7组显示出很强的Cy5荧光信号,而L02组的Cy5信号微弱。 基于MCF-7和L02细胞中的miR-21含量差异,这种现象证实了ZDNPs在MCF-7细胞中发生了miR-21响应性的荧光成像。 此外,对于Random 组,2 种细胞均未表现出明显的Cy5 荧光信号,这是因为细胞内不存在与Random组纳米粒子中的DNA发卡互补的目标序列,导致DNA发卡结构无法打开,荧光无法恢复。

图6 ZDNPs对L02和MCF-7的miR-21响应性成像Fig.6 MiR-21 response imaging of ZDNPs in L02 and MCF-7
2.1.5 ZDNPs对肿瘤细胞的治疗效果
验证完ZDNPs具备miR-21响应性荧光成像后,为进一步说明ZDNPs对肿瘤细胞具有一定的选择性杀伤效果,考察了ZDNPs 对MCF-7 细胞和L02 细胞的杀伤能力。 如图7 所示,随着ZDNPs 浓度的增加,MCF-7 和L02 的细胞存活率逐渐降低,并且MCF-7 的死亡率增速明显比L02 的更快,在ZDNPs 浓度为900 nmol/L时,其死亡率达到90%,这证明了ZDNPs对于肿瘤细胞具有选择性的杀伤能力,在一定程度上体现了其具有miR-21相关的响应性治疗效果。
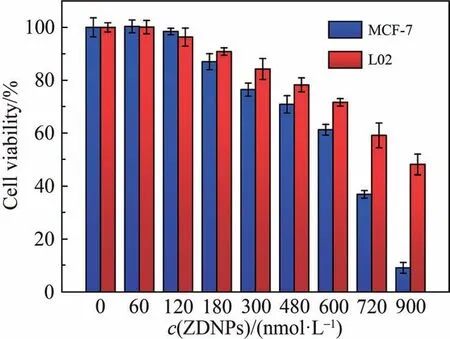
图7 ZDNPs对L02和MCF-7的细胞毒性实验Fig.7 Cytotoxicity assay of ZDNPs to L02 and MCF-7
2.1.6 ZDNPs对肿瘤细胞的杀伤机理验证
目前,已有文献[19-20]证实了锌离子能在多个层面上影响细胞中氧化还原的平衡,并主要通过结合还原性的硫醇类蛋白,阻止其参与氧化还原进程,从而上调细胞内氧化应激水平。
为了证明本研究中ZDNPs导致的细胞凋亡与DNA发卡结构无关,而是通过在肿瘤细胞内上调了Zn2+相关的ROS而导致细胞发生氧化应激型凋亡,使用DCFH-DA探针对肿瘤细胞内的ROS进行了检测。 在MCF-7细胞分别与PBS、DNA发卡(600 nmol/L)和不同浓度的ZDNPs孵育4 h后,其细胞内的ROS产生情况如图8所示,DNA发卡组的ROS荧光信号微弱、细胞形态正常,未观察出与PBS空白组的差别,这说明DNA发卡并不能刺激MCF-7细胞产生大量ROS。 相比之下,60 nmol/L的ZDNPs即可在细胞内上调ROS水平,并且当浓度增加至480 nmol/L时,细胞内的ROS逐渐累积,荧光信号出现大幅增长,但是此时细胞尚能维持正常形态,这是因为肿瘤细胞内存在高含量的还原性谷胱甘肽,其还有一大部分未与Zn2+结合,因此能在一定程度上还原细胞内的氧化性物质,缓解氧化应激水平。 当ZDNPs 浓度增加到600 nmol/L时,大部分MCF-7细胞出现细胞质皱缩,细胞形态被严重破坏,说明此时细胞内的氧化还原平衡被打破,细胞失去调节ROS的能力,并在氧化应激的环境下逐渐发生凋亡。 在900 nmol/L ZDNPs的浓度下,细胞基本凋亡、内容物流出,这也是部分凋亡细胞不再显现出ROS 荧光信号的原因。 以上实验结果证明,ZDNPs导致了肿瘤细胞内ROS含量的大幅上升,并进一步使肿瘤细胞发生了氧化应激凋亡。
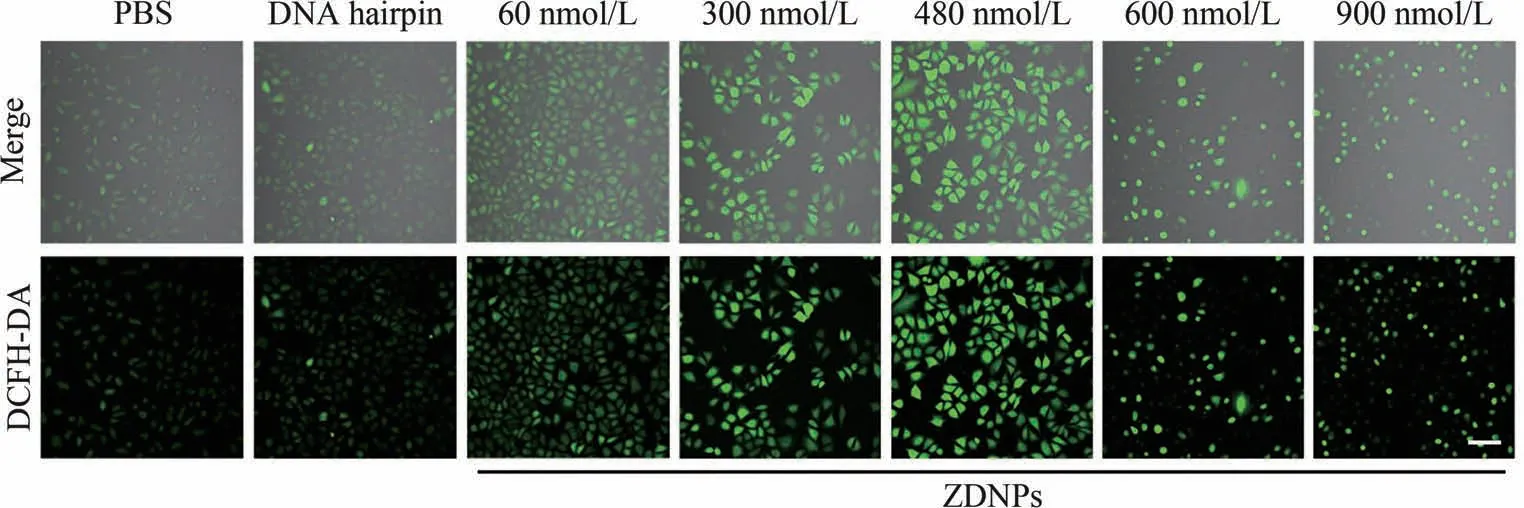
图8 ZDNPs在MCF-7细胞内产生ROS的共聚焦荧光图。比例尺为100 μmFig.8 Confocal fluorescence images of ROS production by ZDNPs in MCF-7 cells. Scale bar indicates 100 μm
2.2 ZDNPs在活体肿瘤成像和治疗中的应用
2.2.1 ZDNPs的肿瘤活体成像
为进一步验证ZDNPs在活体模型中也具有miR-21响应的荧光信号和用于肿瘤成像的潜力,将接种了MCF-7移植瘤的小鼠分成两组并进行活体成像: (a)ZDNPs组; (b)Random组。 在对两组小鼠分别通过尾静脉注射ZDNPs和Random后,监测了不同时间段小鼠体内的Cy5荧光分布。 如图9所示,注射2 h后,在ZDNPs组小鼠肿瘤部位观察到了Cy5荧光信号的积累,并且在8 h后也仍然能显示出明显的荧光信号。而Random组的小组在整个观察过程中均未在肿瘤部位显示出荧光信号的富集。 这表明ZDNPs在活体肿瘤成像中依旧具备miR-21响应性,并且能够作为一种肿瘤标志物响应的荧光探针用于肿瘤部位的示踪。
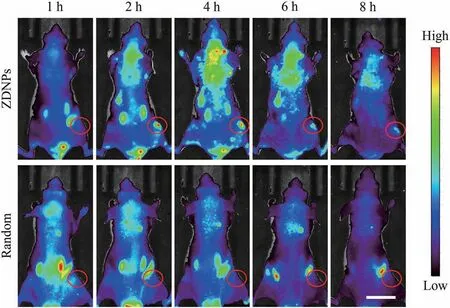
图9 ZDNPs和Random在荷瘤小鼠体内不同时刻的荧光成像。比例尺为15 mmFig.9 Fluorescence imaging of ZDNPs and Random at different time in tumor-bearing mice.Scale bar indicates 15 mm
2.2.2 ZDNPs 的活体抗肿瘤效果
ZDNPs 已被证实具有miR-21 响应的肿瘤细胞杀伤能力,因此,为考察ZDNPs 在活体模型中的抗肿瘤效果,将接种了MCF-7 移植瘤的小鼠分成5 组:(a)DNA hairpin 组; (b)Zn2+组; (c)Random 组;(d)ZDNPs 组; (e)PBS 组,并进行周期为14 d 的肿瘤治疗实验。 治疗过程中,每2 d 测量小鼠肿瘤的体积并绘制肿瘤生长曲线(图10),并在治疗结束后将小鼠的肿瘤取出(图11)。 从实验结果得出,相较于其它几组对照组,ZDNPs 组小鼠的肿瘤生长受到了明显地抑制,治疗前后肿瘤的相对体积比为1.25 左右; 而(a)、(b)、(c)和(e)组的肿瘤体积则出现了显著的增大,体积比分别为4.91、4.98、3.94 和4.75,需要说明的是,Random 组在实验过程中体现了一定的抑制肿瘤生长的效果,这说明纳米粒子的运载有利于Zn2+进入肿瘤区域进行富集,但由于Random 组的粒子不具备miR-21 响应性,无法在肿瘤细胞中大量释放Zn2+,因此只起到了微弱的杀伤作用。 以上实验结果体现了ZDNPs 对于活体肿瘤具有良好的生长抑制和一定的响应性治疗效果。
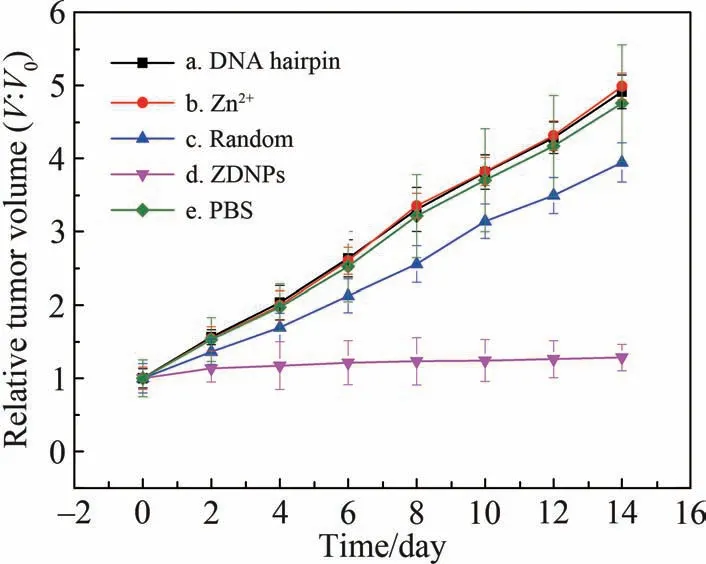
图10 不同治疗组小鼠的肿瘤生长曲线Fig.10 Tumor growth curves of mice in different treatment groups
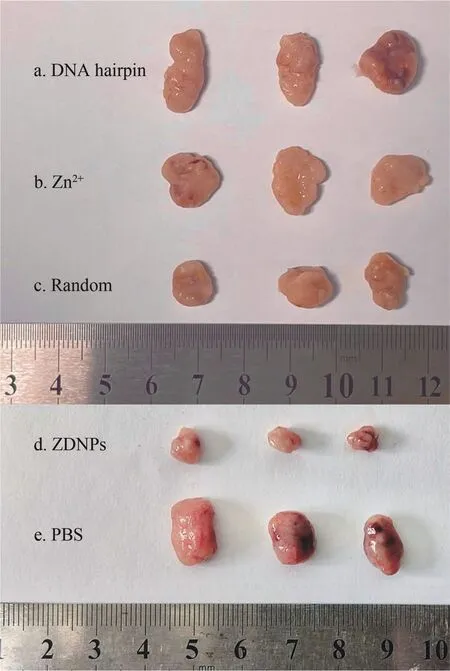
图11 不同治疗组小鼠在第14天的肿瘤图片Fig.11 Tumor photos of mice in different treatment groups at day 14
2.2.3 ZDNPs的生物安全性评估
为确保ZDNPs 在活体应用中的生物安全性,记录了治疗过程中小鼠的体重变化,并在治疗结束后对小鼠的主要器官进行切片和观察。 如图12 所示,在治疗周期内,ZDNPs 组与其它对照组的小鼠体重均保持稳定,并无明显的减轻现象,说明ZDNPs对小鼠的生命活动和健康未产生较大影响。

图12 不同治疗组小鼠的体重变化曲线Fig.12 Body weight curves of mice in different treatment groups
此外,对两组小鼠的主要器官和肿瘤进行组织切片,并用H&E 进行染色,进一步考察ZDNPs 的生物安全性(图13)。 染色结果显示,各组小鼠的主要器官细胞结构完整、形态正常,均未出现病变情况。 此外,相较于其它几组对照组,ZDNPs 组肿瘤切片的细胞表现出细胞形体增大、细胞质空泡化、细胞核位置及大小异常等现象,这说明了ZDNPs 对肿瘤具有较好的杀伤效果; 同时,Random 组的肿瘤切片也出现了一定程度的细胞凋亡,这说明Random 组对肿瘤具有较微弱的杀伤作用。 以上结果表明,ZDNPs 在抑制肿瘤生长的同时,对活体的毒副作用很小,生物安全性较高。
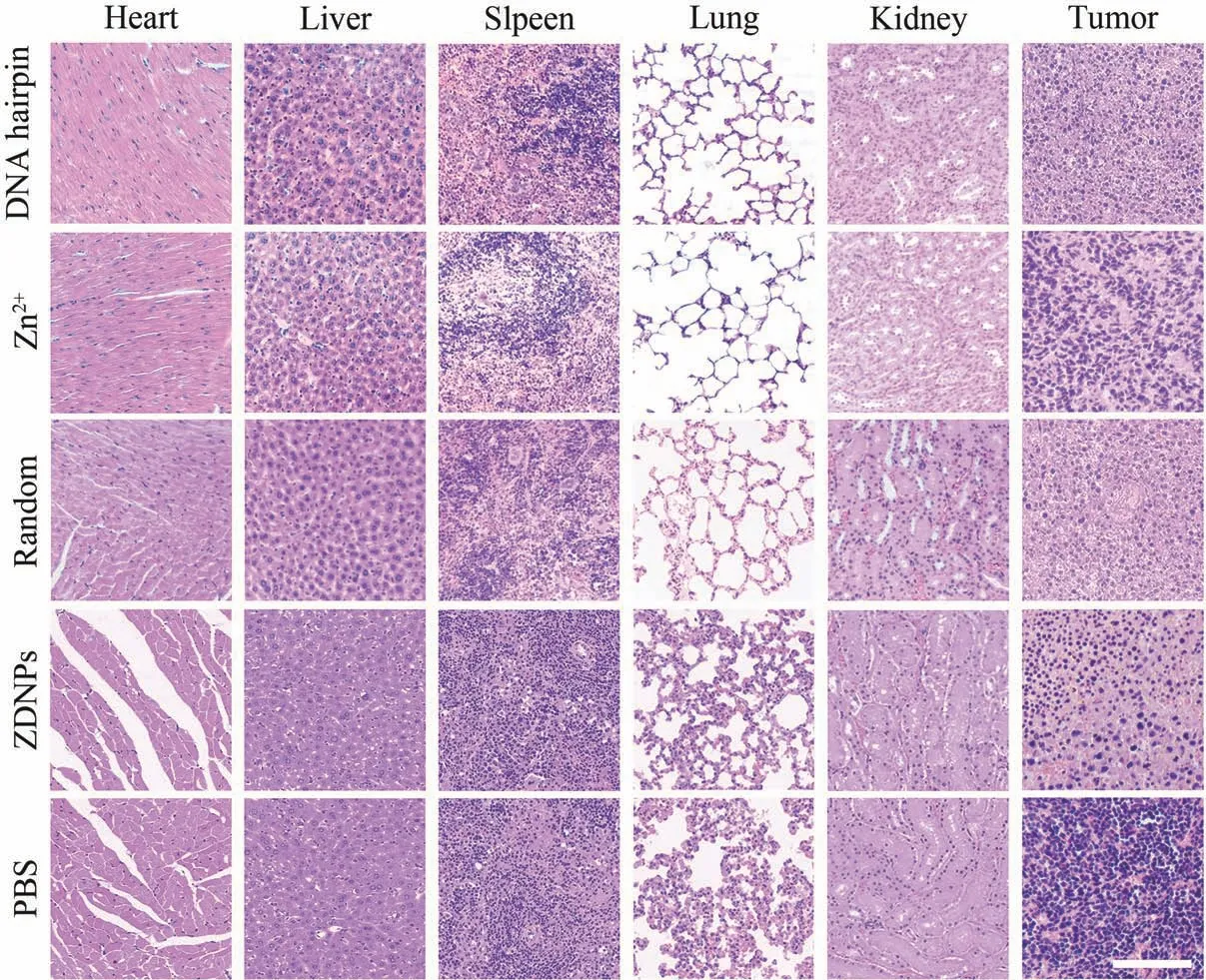
图13 不同治疗组小鼠在第14天的主要器官和肿瘤切片。 比例尺为200 μmFig.13 Major organs and tumor sections of mice in different treatment groups at day 14. Scale bar indicates 200 μm
3 结 论
本工作开发的ZDNPs 自组装纳米系统,通过与肿瘤标志物miR-21 响应产生荧光信号,从而实现了对肿瘤的成像和治疗。 实验首先证实了ZDNPs 对miR-21 具有良好的响应性和选择性,响应的线性范围在5~160 nmol/L; 其次,通过细胞实验,证明了ZDNPs对肿瘤细胞具有良好的基于miR-21响应的荧光成像效果和杀伤效果; 最后,通过构建乳腺癌移植瘤的小鼠模型,验证了ZDNPs良好的肿瘤荧光监测能力和肿瘤生长抑制能力。 综上所述,本研究为基于功能核酸的无载体自组装纳米材料在miR-21响应型的肿瘤成像和治疗中的应用提供了参考。

