三维葡萄糖电化学传感器与胶原水凝胶集成实时监测细胞代谢
姚春莹 朱晓艳 刘艳玲*
(1武汉大学化学与分子科学学院, 武汉 430072)
(2武汉商学院食品科技学院, 武汉 430056)
葡萄糖作为最主要供能物质在大部分细胞中通过有氧途径进行代谢[1],即葡萄糖在细胞质中被转化为丙酮酸,丙酮酸完全降解成水和二氧化碳,并释放出大量三磷酸腺苷(ATP)[2]; 在缺氧条件下,丙酮酸则会在乳酸脱氢酶的作用下生成乳酸并释放较少的ATP,该过程也被称为糖酵解。 细胞代谢活动越旺盛,葡萄糖消耗量越多,因此,葡萄糖消耗已经成为评价细胞生长代谢的重要指标,异常的葡萄糖代谢与多种疾病的发生密切相关。 在血液中,葡萄糖浓度的偏高或偏低均会引起机体代谢紊乱,诱导糖尿病、心血管疾病等病症的发生[3-4]。 在神经退行性疾病中,神经元对葡萄糖的摄取降低造成代谢产生的能量减少,长时间的能量供应不足导致突触丢失和神经元死亡[5-7]。肿瘤细胞即使在氧气充足条件下,仍然以糖酵解的代谢方式获取能量,这种反常的低产能糖代谢模式为肿瘤细胞的生长、增殖和转移提供物质基础[8-9]。因此,细胞葡萄糖代谢活动的实时连续监测,对细胞代谢机制的理解、药物筛选研究和疾病临床治疗均具有重要意义。
目前,已经发展了多种分析方法用于细胞葡萄糖浓度的测定,包括荧光光谱法[10]、比色法[11]、色谱-质谱联用法[12]、拉曼散射法[13]和电化学方法[14]等。 其中,电化学生物传感器具有操作简单、可微型化和响应速度快等优势,在细胞[15]、血液[16和活体组织[17]葡萄糖含量分析中广泛应用。 生物酶催化作用的高效率和特异性使其被广泛应用于电化学传感器构建,目前葡萄糖酶型传感器主要利用高稳定性的葡萄糖氧化酶(Glucose oxidase, GOD),并借助电子媒介体或者导电材料将酶活性中心的电子传递到电极表面,实现对葡萄糖的高灵敏、选择性检测。 近些年,纳米科技的飞速发展为新型葡萄糖电化学传感器构建提供了更多选择,例如纳米颗粒[18]、导电聚合物[19]、碳材料[20]和复合纳米材料[21-23]等引入电极界面,大大地提高了葡萄糖酶电极的灵敏度。 尽管如此,目前所报道的传感器对细胞葡萄糖代谢水平实时监测仍然面临挑战,这是由于传统平面培养的细胞在结构和功能方面与体内三维基质环境自然生长的细胞相差甚远,而现有的传感器大多是基于二维电化学传感器,很难与细胞三维培养体系集成并进行细胞代谢活动实时监测。
在前期工作中[24],通过静电吸附和电化学沉积等技术,依次在三维多孔聚二甲基硅氧烷(PDMS)支架表面组装导电聚合物聚(3,4-乙烯二氧噻吩)(PEDOT)、碳纳米管(CNTs)和普鲁士蓝纳米颗粒(PB NPs),制备了对H2O2电化学还原反应具有催化作用的三维电极(PCP)。 本研究工作在该电极表面进一步固定GOD,构建了三维葡萄糖电化学传感器GOD/PCP,将包裹了肿瘤细胞(MCF-7)的胶原水凝胶填充到传感器的孔隙,搭建了兼具三维细胞培养和电化学检测功能的集成平台。 细胞培养过程中,电极表面的GOD能够催化氧化环境中的葡萄糖,产生葡萄糖酸和电活性分子H2O2,H2O2发生电化学还原反应时产生的电子通过媒介分子普鲁士蓝传递电极表面,从而实现传感器对三维细胞培养体系葡萄糖消耗水平的实时动态监测(图1)。
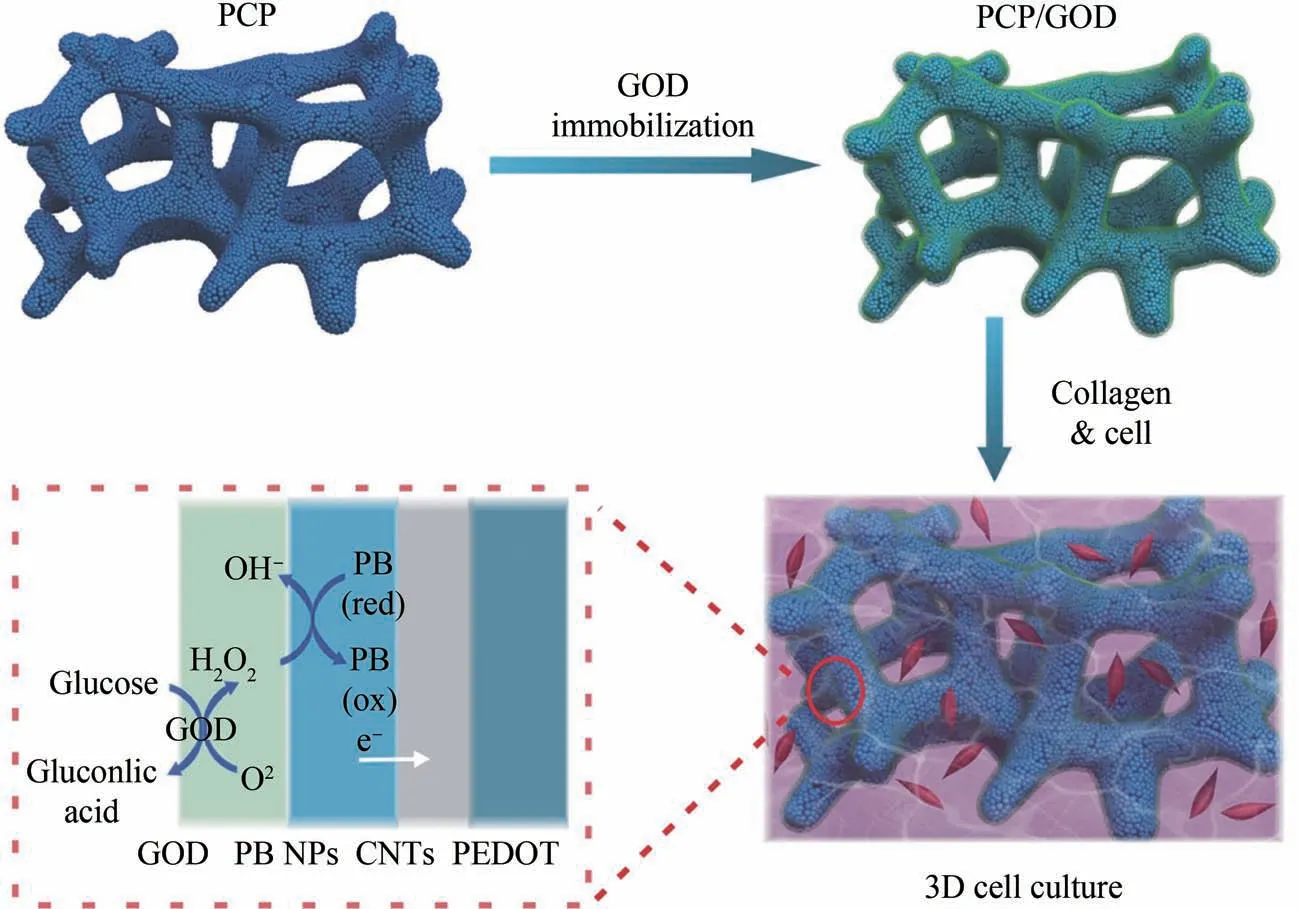
图1 三维葡萄糖电化学传感器构建及细胞代谢检测原理示意图Fig.1 Schematic illustration of the fabrication of 3D glucose electrochemical sensor and the detection principle of glucose metabolism in 3D cell culture
1 实验部分
1.1 仪器和试剂
CHI660A 型电化学工作站(上海辰华有限公司);GeminiSEM 500 型场发射扫描电子显微镜(FESEM,德国Zeiss 公司);Nicolet-6700 型傅里叶变换红外光谱仪(FT-IR,美国Thermo Fisher 公司);LSM 900 型激光共聚焦荧光显微镜(德国Zeiss 公司);PDC-002 型等离子体清洁机(美国Herrick 公司);HC-2062 型高速离心机(安徽中科中佳科学仪器有限公司);Direct-Q3 型超纯水仪(美国Millipore公司)。
导电聚合物聚(3,4-乙烯二氧噻吩)∶ 聚(苯乙烯磺酸盐)(PEDOT∶PSS, Clevios PH1000)分散液购自武汉卓鑫科技有限公司。 单壁碳纳米管(SWCNTs,外径<2 nm,长度5~30 μm)购自南京先丰纳米材料科技有限公司。 PDMS交联剂及预聚体购自美国 Momentive Performance Materials公司。 泡沫镍模板(厚度1.0 mm)购自昆山嘉亿盛电子新型材料有限公司。 丙酮(CH3CHOCH3)、无水乙醇(CH3CH2OH)、硝酸(HNO3)、盐酸(HCl)、氯化钾(KCl)、二甲基亚砜(DMSO)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、铁氰化钾(K3[Fe(CN)6])、磷酸二氢钾(KH2PO4)和氯化钠(NaCl)购自国药集团化工试剂有限公司。 羧甲基纤维素钠(CMC)、氯化铁(FeCl3)、聚乙二醇二缩水甘油醚(PEGDE)和葡萄糖购自上海阿拉丁生化科技股份有限公司。 尿酸(Uric acid)购自东京化成工业株式会社(日本)。 GOD、聚二烯丙基二甲基氯化铵、多巴胺(Dopamine)、抗坏血酸(Ascorbic acid)、乙酰胆碱(Acetylcholine)、牛血清白蛋白、聚乙烯亚胺、乳酸(Lactate)、果糖(Fructose)和半乳糖(Galactose)均购自美国 Sigma-Aldrich公司。 实验中所使用的试剂均为分析纯,所有实验用水为超纯水(电阻率18.2 MΩ·cm)。
1.2 实验方法
1.2.1 三维葡萄糖电化学传感器构建
三维多孔PCP 电极根据前期发表工作[24]制备,步骤简单概括为: 首先,采用PDMS 预聚体复制泡沫镍多孔结构,通过离心、固化和刻蚀等步骤制备三维多孔PDMS 支架; 然后,通过静电组装、疏水作用和化学沉积方式,在PDMS 支架表面依次固定PEDOT、CNTs 和PB NPs,得到多孔PB NPs/CNTs/PEDOT(PCP)电极。 在此基础上,通过交联剂PEGDE 将GOD 固定在三维电极表面,形成酶型三维葡萄糖电化学传感器GOD/PCP。
1.2.2 传感器与细胞三维培养体系集成
将胶原溶液与DMEM 完全培养基混合均匀并调节pH 值至中性,加入2×105cell/mL 的MCF-7 细胞悬浮液,使得混合液中胶原的终浓度为1.0 mg/mL,并立即将混合液灌注到三维GOD/PCP 传感器孔隙中,并确保液体浸没整个传感器。 然后,将传感器放置于恒温培养箱中,使胶原溶液在传感器孔隙中完全凝胶化。 MCF-7 细胞在胶原水凝胶中培养一定时间后,进行活性染色和显微成像。
1.2.3 细胞葡萄糖代谢实时监测
MCF-7细胞与胶原溶液混合以及注入GOD/PCP 骨架过程与上部分步骤一致,待细胞稳定2 h后,吸出培养基,并使用无菌PBS 缓冲溶液静置清洗。 以GOD/PCP 电极为工作电极,Ag/AgCl 电极为参比电极,Pt 电极为对电极,在恒定电压为0.0 V 条件下,通过安培计时电流法进行检测。 检测过程中PBS 缓冲液中加入紫杉醇抗癌药物,使得紫杉醇药物的最终浓度为10和100 μmol/L。 而对照组则是加入相同体积PBS缓冲液或没有细胞存在的条件下加入相同体积紫杉醇溶液。
2 结果与讨论
2.1 GOD/PCP电极的制备与表征
PCP电极按照文献[24]方法制备,图2A为PCP电极的SEM图片,结果显示其为三维多孔支架结构,孔径尺寸在200 μm 左右。 图2B 进一步显示其表面粗糙、分布有纳米颗粒聚集物,为PB NPs。 PCP 电极修饰葡萄糖酶GOD后,依然保持清晰、连续和贯通的多孔结构(图2C),有利于后续胶原水凝胶灌入及细胞三维培养。 同时,相较于PCP电极高倍数SEM 结果,GOD/PCP 电极的PB NPs颗粒表面附着一层薄膜(图2D),可能是GOD被固定在电极表面所形成的蛋白膜。

图2 (A、B)三维PCP电极和(C、D)GOD/PCP电极在不同放大倍数下的扫描电子显微成像图片Fig.2 SEM images at different magnifications for (A, B) PCP electrode and (C, D) GOD/PCP electrode
接着,通过傅里叶变换红外光谱仪对GOD/PCP 电极的特征官能团进行表征(图3)。 PCP 电极在2082 cm-1处出现的吸收峰(黑线),对应于普鲁士蓝中Fe2+-CN-Fe3+的C≡N 伸缩振动峰; GOD/PCP 电极(红线)在1652、1542和1108 cm-1处的吸收峰,分别对应于葡萄糖氧化酶中酰胺基团的“C= = O”伸缩振动峰、“N—H”弯曲振动峰,以及可能归属于PEGDE 上的“C—O—C”伸缩振动峰。 以上结果充分证明了GOD成功修饰在三维PCP电极表面。
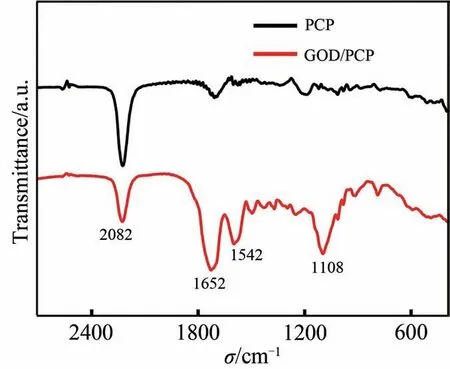
图3 PCP电极和GOD/PCP电极的FT-IR谱图Fig.3 FT-IR spectra of PCP electrode and GOD/PCP electrode
为考察GOD/PCP传感器对目标分子的电化学响应能力,采用循环伏安法记录了PCP、GOD/PCP电极在2 mmol/L葡萄糖溶液的循环伏安(Cyclic voltammetry, CV)曲线。 如图4A所示,PCP电极表面没有固定葡萄糖氧化酶时,电极在PBS溶液和2 mmol/L葡萄糖溶液中的循环伏安行为几乎一致,仅在0~0.2 V之间出现普鲁士蓝的典型氧化还原峰。 而修饰了葡萄糖氧化酶的GOD/PCP 电极,在2 mmol/L 葡萄糖溶液中0 V 处普鲁士蓝的还原峰电流显著增加(图4B)。 以上电化学结果再次证明,葡萄糖氧化酶已成功修饰在PCP电极表面,且对葡萄糖具有良好的电化学响应性能。
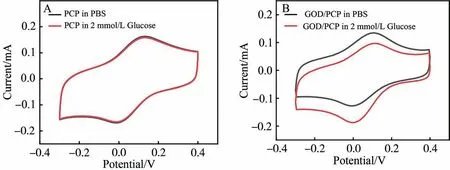
图4 (A) PCP电极和(B) GOD/PCP电极分别在PBS和2 mmol/L葡萄糖溶液中的CV曲线,扫速均为10 mV/sFig.4 CVs of (A) PCP electrode and (B) GOD/PCP electrode in PBS (black) and 2 mmol/L glucose (red) solution with a scan rate of 10 mV/s
2.2 GOD/PCP电极的电化学传感性能
为了进一步考察GOD/PCP 电极对葡萄糖的传感性能,采用计时电流法表征了GOD/PCP 电极对一系列浓度梯度葡萄糖的安培响应。 在搅拌条件下,通过连续加入不同浓度的葡萄糖标准溶液,得到图5A 中所示计时电流响应曲线。 GOD/PCP 电极对葡萄糖的响应速度较快,约在3 s 内便达到电流稳态,且在0.05~5.0 mmol/L 浓度范围内表现出灵敏电流响应。 另外,根据图5B 线性方程相关系数R2=0.998 推断,传感器对葡萄糖的响应在0.05~5.0 mmol/L 浓度范围内呈良好线性关系,计算得到的检测灵敏度为10.0 μA/(mmol·L-1),检测限为0.02 mmol/L。 以上电化学结果表明,三维GOD/PCP 传感器对葡萄糖具有优良的电化学检测性能,为后期实时监测细胞葡萄糖消耗量奠定了基础。

图5 (A) GOD/PCP电极对不同浓度葡萄糖标准液的安培响应曲线,施加电位为0.0 V; (B) GOD/PCP电极对葡萄糖响应的校准曲线; (C) GOD/PCP电极对1.0 mmol/L葡萄糖和10.0 mmol/L干扰物质安培响应的统计图(n=5)Fig. 5 (A) Amperometric responses of GOD/PCP electrode to a series of increasing glucose concentrations in PBS solution at a potential of 0.0 V(vs.Ag/AgCl); (B) Corresponding calibration curve of GOD/PCP electrode to glucose;(C) Statistical results of amperometric response of GOD/PCP electrodes to 1.0 mmol/L glucose and 10.0 mmol/L potential interfering substances (n=5)
细胞在生命活动中产生的多种类型部分代谢物,可能会干扰电极对葡萄糖的检测,因此,选用了一些典型的潜在代谢物和电活性物质对GOD/PCP 电极进行了抗干扰测试,包括果糖、半乳糖、乳酸、乙酰胆碱、尿酸、多巴胺和抗坏血酸。 利用安培计时电流法比较了GOD/PCP 电极对10.0 mmol/L 干扰物质和1.0 mmol/L 葡萄糖的响应ΔI(图5C),可见即使这些干扰物质的浓度为葡萄糖的10倍,GOD/PCP电极对葡萄糖的电流响应远大于干扰物分子。 这得益于GOD对底物葡萄糖的高效选择性以及PB对产物H2O2优异的电催化性能,使得三维GOD/PCP电极在较低电位(0.0 V)下实现葡萄糖高选择性检测。
2.3 GOD/PCP电极内的细胞三维培养
体内肿瘤细胞生长在周围充满基质的三维微环境,本工作选择胶原作为肿瘤细胞培养基质。 将乳腺癌细胞MCF-7 与I 型胶原混合均匀并填充在GOD/PCP 传感器空隙,形成三维电化学传感和细胞培养体系的集成平台。 为了便于观察细胞在三维葡萄糖传感器内的分布情况和生长状态,采用交联法将Cy3标记的链霉亲和素固定在PCP支架,使其被黄色荧光分子标记。 细胞在传感器内培养24 h后,使用细胞活性染色剂钙黄绿素(Calcein-AM,绿色)和死细胞核染色剂碘化丙啶(PI,红色)对MCF-7细胞进行染色(图6A)。 共聚焦荧光成像结果显示,MCF-7 细胞在黄色支架空隙内均匀分散,且在不同高度均有分布(图6B)。 另外,荧光成像结果显示MCF-7细胞几乎全部保持高活性(绿色荧光),表明该三维传感器的存在不影响细胞自身生长状态。
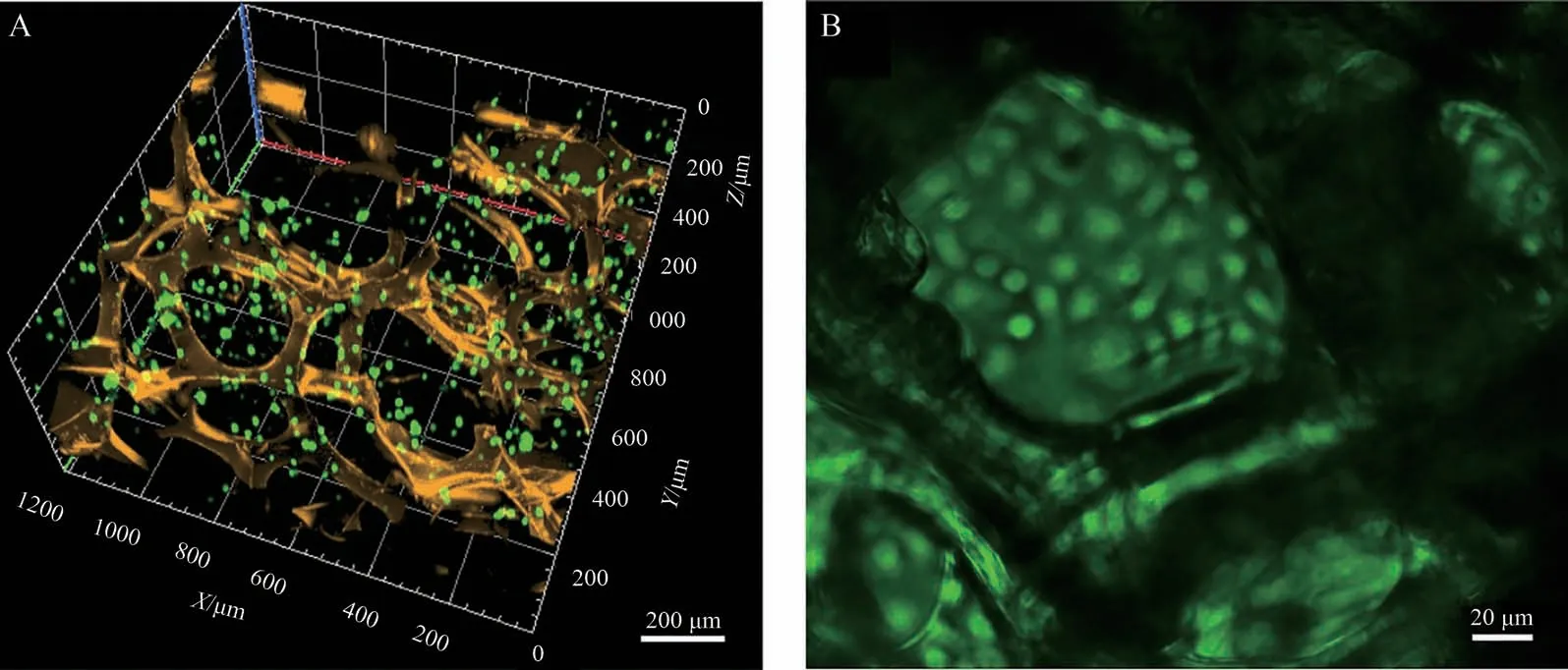
图6 (A) GOD/PCP 电极(黄色,Cy3标记)与MCF-7细胞(绿色,Calcein-AM 染色)三维培养体系集成的共聚焦成像图; (B) MCF-7细胞培养24 h后被Calcein-AM和PI染色的荧光成像图Fig. 6 (A) 3D reconstruction from confocal microscope images of MCF-7 cultured in the integrated platform and labeled with Calcein-AM(green) and PI (red) for cell and Cy3 (yellow) for GOD/PCP electrode; (B) Fluorescent image of MCF-7 cultured in the platform for 24 h and labeled with Calcein-AM and PI
2.4 MCF-7细胞葡萄糖消耗过程实时监测
在上述工作基础上,利用三维电化学传感和细胞培养集成平台实时监测了MCF-7 细胞消耗葡萄糖的代谢行为。 紫杉醇是一种常用的化疗药物,可用于治疗女性乳腺癌,主要作用机制是通过与微管结合阻止细胞分裂时染色体的分离,加速癌细胞死亡。 因此,采用抗癌药物紫杉醇作为药物刺激,考察了紫杉醇对MCF-7 细胞葡萄糖代谢活动的影响。 为了实现药物刺激下细胞葡萄糖消耗的实时监测,将MCF-7细胞和胶原混合液注入电化学传感器中,稳定2 h后,加入新培养基作为电解液,用于实时监测紫杉醇药物作用下细胞培养基中葡萄糖的消耗。 实验中向储液池中加入不同体积的紫杉醇溶液,使得紫杉醇最终浓度为10和100 μmol/L。
在本工作中,电化学生物传感器记录的电流值与胞外培养环境中葡萄糖的浓度成正比,当细胞消耗周围培养基中的葡萄糖时,引起葡萄糖浓度降低,表现为电流值下降。 即细胞消耗的葡萄糖量越多,传感器测量的电流值下降幅度越明显。 此处,将检测开始时的电流值表示为I0(葡萄糖含量最大),检测过程中某一时刻的电流值表示为I,因此I/I0或者ΔI/I0(ΔI=I0-I)可以实时反映细胞周围环境中葡萄糖的浓度变化,即MCF-7细胞对培养基中葡萄糖的消耗情况。
图7 A 和7B 分别为在没有和有MCF-7 细胞存在时GOD/PCP 电极记录的I/I0随时间变化曲线,图7C为2种情况下在0~400 s和401~3600 s时间段内ΔI/I0统计数据。 结果显示,在0~400 s时间内(绿色背景部分),当没有细胞存在时,GOD/PCP 电化学传感器的电流值下降了0.9%,这是因为传感器表面的葡萄糖氧化酶在连续检测过程中会消耗培养基中少量的葡萄糖。 当传感平台有细胞存在时,细胞代谢活动使记录到的电流值下降了1.8%。 然后,GOD/PCP 电化学传感器对三维培养环境中葡萄糖水平进行了连续较长时间(3600 s)检测。 在401~3600 s时间范围内,对于不含细胞的传感平台,传感器记录的电流值下降了6.4%; 而对于含有大量肿瘤细胞的传感平台,传感器电流值下降了13.8%。 这是由于培养基中的葡萄糖被MCF-7细胞消耗,使得培养基中葡萄糖浓度大幅下降。
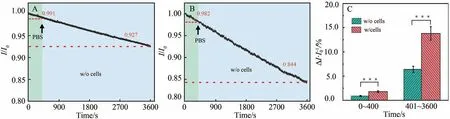
图7 GOD/PCP电极在(A)无和(B)有MCF-7细胞存在下的I/I0随时间变化曲线; (C) GOD/PCP电极在0~400 s和401~3600 s时间内的ΔI/I0变化统计, ***P<0.001Fig. 7 Amperometric response of GOD/PCP platform (A) without(w/o) and (B) with(w/) MCF-7 cells cultured therein; (C) Statistic analysis of the ΔI/I0 during the periods of 0~400 s and 401~3600 s. ***P<0.001
在此基础上,考察了抗癌药物紫杉醇对三维培养环境中MCF-7 细胞葡萄糖代谢的影响。 图8A和8B 分别为MCF-7 细胞经10 和100 μmol/L 紫杉醇孵育后,GOD/PCP 电极记录的I/I0随时间变化曲线,图8C 为两种情况下在0~400 s 和401~3600 s 时间段内ΔI/I0统计数据。 在药物处理前0~400 s时间内,电流值下降无显著性差异,表明药物刺激刺激前细胞对葡萄糖的消耗速率一致。 在经药物刺激MCF-7 细胞后的401~3600 s 时间范围内,10 μmol/L 紫杉醇处理条件下,传感器记录的电流值下降了10. 1%; 对于100 μmol/L 紫杉醇处理细胞,传感器记录的电流值下降了7. 2%。 可见,相较于正常培养的细胞(ΔI/I0值为13. 8%),药物作用后细胞对培养基中葡萄糖消耗速率下降,且药物浓度越高细胞消耗葡萄糖的速率越慢。 由于葡萄糖消耗速率可直接反映细胞糖代谢状态,这些结果表明抗癌药物对MCF-7 细胞糖代谢有较强的抑制作用,药物浓度越高抑制作用越明显。

图8 GOD/PCP 电极在MCF-7细胞经(A) 10 μmol/L 和(B) 100 μmol/L 紫杉醇处理前后的I/I0随时间变化曲线;(C) GOD/PCP电极在0~400 s和401~3600 s时间内的ΔI/I0变化统计。 ns: 无显著性差异, ***P<0.001Fig. 8 Amperometric response of GOD/PCP platform before and after MCF-7 were treated with (A) 10 μmol/L paclitaxel and( B) 100 μmol/L paclitaxel;( C) Statistic analysis of the ΔI/I0 during the periods of 0~400 s and 401~3600 s. ns: no significance, ***P<0.001
3 结 论
通过在前期发展的三维电极表面修饰葡萄糖氧化酶,构建了一种灵敏度高、选择性好的三维葡萄糖电化学生物传感器。 将含有肿瘤细胞的胶原水凝胶填充到三维生物传感器孔隙中,为肿瘤细胞提供了类似体内生长情况的三维微环境,可实时监测细胞对基质中葡萄糖的消耗,并考察了抗癌药物对肿瘤细胞能量代谢的抑制效果。 鉴于葡萄糖在细胞代谢活动中的重要作用,该传感器可作为细胞自身葡萄糖释放以及消耗环境葡萄糖行为的实时动态监测平台,在细胞代谢、药物筛选和癌症研究中具有良好应用前景。

