基于小分子识别的光电化学传感器用于组氨酸检测
杨翠翠 叶晓雪
(湖北大学健康科学与工程学院, 化学化工学院, 武汉 430062)
组氨酸(His)是组成人体蛋白质的21 种基本氨基酸之一,由于His 不能自行合成,只能从食物中摄取,是一种必需氨基酸。His 广泛参与多种生理和病理过程,如炎症、神经传递、过敏反应、血红蛋白合成和胃酸分泌等[1-2]。His 可以与β-丙氨酸缩合形成肌肽和鹅丝氨酸,在抗氧化应激反应中起重要作用[3]。它也可以脱羧形成组胺,进一步参与炎症反应。在神经系统中,His在维护保护神经元髓鞘中起着重要作用[4]。除此之外,His独特的咪唑基团使其可以在生理环境中部分质子化,进而通过质子穿梭效应参与多种酶催化反应[5]。哺乳动物血液中His浓度为70~125 μmol/L[6],血浆中His水平异常变化可能与癫痫、精神分裂症、肝硬化和His血症等多种疾病相关[7-9],因此血浆中His的检测具有重要的临床意义。
迄今为止,已发展了多种可靠的氨基酸检测方法,如高效液相色谱法(HPLC)[10]、毛细管电泳法[11]、紫外-可见光谱法[12]和串联质谱法等[13],但这些方法存在前处理步骤复杂、耗时冗长、仪器昂贵或需要衍生化等问题,难以用于临床快速检测。电化学(EC)传感技术具有简单、快速和低成本的优势,是具有潜力的临床诊断工具。His作为一种电活性氨基酸,可以采用直接电化学氧化法进行检测[14]。比如,Zhang等[15]利用功能化的多壁碳纳米管和分子印迹膜修饰电极制备了His 电化学传感器,在一定程度上提高了灵敏度和选择性。然而,由于His 在水溶液中的电活性非常弱[16],因此需要在较高的电位下才能被氧化,这导致His 的直接电化学检测面临信号重叠、所需过电位过大等问题,不利于复杂生物样品中His 的高选择性和高灵敏检测。因此,仍需发展新的检测方法以满足His在生物样品中灵敏、快速和高选择性检测的需要。光电化学(PEC)传感是一种基于电化学传感技术发展起来的分析方法,继承了电化学传感操作简单、价格低廉和易于微型化等优点[17-19]。PEC 传感器通常由光源、光电转换元件、识别元件和信号收集元件等几部分组成。当激发光照射电极表面的光电活性材料时,光能转化为电能,产生电信号。因采用光作为激发信号,电作为检测信号,二者之间互不干扰,从而使PEC 传感体系具有更低的背景噪音和更高的灵敏度[20-21]。然而,由于缺乏合适的识别机制,到目前为止PEC传感用于His检测仍未见报道。
基于以上分析,本研究提出了一种基于化学识别策略的PEC 传感方法用于His的灵敏、快速和高选择性检测。利用小分子探针对目标物的特异性识别,实现光电信号转导的特异性调控(图1)。首先,合成了一种能特异性识别His 的小分子探针2-丁基-6-(2-(4-(二乙基氨基)2-羟基亚苄基)肼基)-1H-苯并异喹啉-1,3(2H)-二酮(NCH),将其与硝酸铜共同孵育形成NCH-Cu2+。与His特异性反应后,其在395 nm处的光吸收会明显减弱。以碲化镉量子点(CdTe QDs)作为光电活性材料,其在395 nm波长的光激发下会产生较明显的光电流信号。将CdTe QDs与NCH-Cu2+共同修饰到ITO电极上,采用395 nm波长的光激发时,由于二者对该波长共同吸收,CdTe QDs 产生的光电流信号减弱。NCH-Cu2+与His 反应后,其光吸收减弱,即对395 nm激发光的吸收能力下降,从而使电极表面更多的光电活性材料(CdTe QDs)被激发,继而产生增强的光电流信号,光电流信号的增加幅度与His浓度相关。Cu2+与His的络合常数为1.58×1010,高于Cu2+与其它氨基酸的络合常数[22],这有利于生物样品中His 的特异性检测。除此之外,有机小分子探针作为一种结构灵活的小分子,通过合理设计小分子结构,该传感策略很容易拓展至其它目标物的检测,如氨基酸、活性氧、活性氮和生物硫醇等生物小分子。
1 实验部分
1.1 仪器和试剂
CHI 660E 型电化学工作站(上海辰华仪器有限公司);PEC-10W 395 nm 激光器(广州彤泰科技公司);UV-2650 型紫外-可见分光光度计(UV-Vis,日本Shimadzu 公司);ASCEND-400 型核磁共振波谱仪(NMR,德国Bruker公司)。
柠檬酸钠(C6H5Na3O7)、硝酸镉(Cd(NO3)2)、巯基丙酸、硼氢化钠(NaBH4)、亚碲酸钠(Na2TeO3)、4-肼-1,8-萘酰亚胺、4-二乙基氨基水杨酸,精氨酸(Arg)、甘氨酸(Gly)、缬氨酸(Val)、亮氨酸(Leu)、赖氨酸(Lys)、异亮氨酸(Iso)、酪氨酸(Tyr)、甲硫氨酸(Met)、谷胱甘肽(GSH)、次氯酸钠、过氧化氢、1,1-二乙基-2-羟基-二硝基肼钠盐(DEA NONOATE)钠盐、多巴胺(DA)、去甲肾上腺素(NE)、抗坏血酸、葡萄糖、硝酸镁、硝酸钾、硝酸锌、氯化钙、氯化钠、氯化铜、氯化铁、氯化亚铁和氯化锰均购自上海阿拉丁试剂有限公司; 二甲基亚砜(DMSO)、丙酮、乙二醇、无水乙醇(EtOH)、浓盐酸、冰醋酸、氢氧化钠(NaOH)、正己烷和甲苯均购自上海国药试剂有限公司,以上试剂均为分析纯; 实验用水为超纯水。
1.2 实验方法
1.2.1 ITO电极的制备
1)取ITO 导电玻璃,切割成长1.5 cm,宽0.5 cm 的尺寸,用丙酮、EtOH 和超纯水分别超声清洗15 min,放于60 ℃烘箱中烘干。
2)将铜丝裁剪成5 cm 左右的长度,蘸取合适剂量的导电银胶,粘于ITO 玻璃导电面的末端,静置使导电银胶凝固。待导电银胶凝固后,用绝缘胶水涂于导电胶表面,起绝缘和加固作用。
1.2.2 CdTe QDs的制备
CdTe QDs参照文献[23]合成,实验条件稍作修改。
1)将C6H5Na3O7100 mg、Cd(NO3)259 mg 和巯基丙酸25 μL 溶于50 mL 去离子水中,超声3 min,使其分散均匀。
2)用1 mol/L的NaOH溶液将混合溶液调节至pH=11,转移至圆底烧瓶中。
3)分别加入18.9 mg NaBH4和11.1 mg Na2TeO3,超声使其分散均匀,然后将装有混合溶液的圆底烧瓶置于100 ℃油浴锅中,搅拌回流3 h。
4)将反应后混合溶液冷却至室温,加入等量异丙醇,可以观察到圆底烧瓶中有暗红色沉淀产生,静置,待沉淀完全后离心(10000 r/min,10 min)。然后用异丙醇洗涤沉淀,重复3 次,收集沉淀,即得到CdTe QDs,放于60 ℃烘箱中真空干燥后备用。
1.2.3 探针NCH-Cu2+的制备
有机小分子NCH参照文献[24]合成,实验条件稍作修改,反应式如图2所示。
将4-溴-1,8-萘酐(277 mg,1.0 mmol)和正丁胺(88 mg,1.5 mmol)加入到含有30 mL 乙醇的双颈圆底烧瓶中。80 ℃搅拌回流2 h后,停止加热,将混合物冷却至室温,然后过滤干燥,得到化合物1(N-异丙基-4-溴-1,8-萘酐)为黄灰色固体,产率为74.3%。然后,将化合物1(96 mg,30 mmol)与2.5 mL 85%水合肼(40 mmol)在30 mL 乙醇中进行第2 步反应。将反应混合物经80 ℃回流加热4 h。冷却至室温后,过滤得到橙色沉淀产物,为化合物2(4-肼-1,8-萘酰亚胺),产率为65.6%。化合物1、2的1H NMR谱图见辅助材料图S1和S2,可证明其成功合成。
将化合物2(0.141 g,0.5 mmol)溶于20 mL 甲醇中,加入4-二乙基氨基水杨酸(0.116 g,0.6 mmol),将混合溶液加热至80 ℃回流7 h。冷却至室温后,将红色混浊液过滤,沉淀用甲醇洗涤3次,得到小分子探针NCH,产率为67.3%。
1H NMR(400 MHz, DMSO),δ:11.22(s,1H),10.22(s,1H),8.79(d,J=8.5 Hz,1H),8.62(s,1H),8.46(dt,J=8.2,2.0 Hz,1H),8.35(d,J=8.5 Hz,1H),7.75(dd,J=8.4,7.3 Hz,1H),7.49(d,J=8.8 Hz,1H),7.41(d,J=5.0 Hz,1H),6.31(dt,J=8.9,2.3 Hz,1H),6.17(d,J=2.4 Hz,1H),5.75(s,2H),4.06~4.00(m, 2H),3.37(dd,J=7.3,5.1 Hz,3H),1.35(h,J=7.5 Hz,4H),1.15~1.11(m,6H)。1H NMR 谱图见辅助材料图S3,可证明其成功制备。
将NCH溶于体积分数为1%的DMSO溶液中,配置浓度为1 mmol/L的溶液。另配置浓度为10 mmol/L的Cu(NO3)2溶液,将之与NCH溶液以1∶2的体积比混合,涡旋震荡3 min,得到His的探针NCH-Cu2+。
1.2.4 构建光电化学传感器
1)取CdTe QDs 溶于去离子水,配置浓度为0.25~1.25 g/L 的溶液,然后将该溶液与1.2.3 小节制备的NCH-Cu2+溶液等体积混合,超声混匀后备用。
2)取步骤1)混合溶液5 μL,滴涂于ITO 电极表面,在60 ℃下真空干燥。然后,将3 μL 浓度为0.1%的Nafion溶液滴涂于电极表面,得到修饰电极NCH-Cu2+/CdTe/ITO。
1.2.5 光电化学测试
所有的电化学及光电化学测试均在电化学工作站上进行,参比电极和对电极分别为银/氯化银电极和铂丝电极。电解质溶液为PBS 缓冲液(pH=7.4),激发光源为波长395 nm、功率为3 W 的LED 灯。测试模式为黑暗15 s,光照5 s,黑暗5 s,交替测试。
1.2.6 大鼠血清制取
所有动物实验均按照中国动物福利委员会实验动物护理和使用指南进行,并经中国湖北大学动物实验中心机构动物护理和使用委员会批准。
实验用成年大鼠(SD,雄性,350 g)。用酒精棉球擦拭大鼠尾部,并剪去其尖端,长度约5 mm,使用抗凝管收集大鼠血液,将收集的大鼠血液进行离心(2000 r/min, 10 min)。离心后,取上层清液,即为试验用大鼠血清。
2 结果与讨论
2.1 CdTe QDs和NCH-Cu2+探针的表征及光学性质
首先,通过X射线衍射对所合成CdTe QDs的进行表征,如图3所示。CdTe QDs晶体在24.42、40.82和47.76(°)的衍射峰与JCPDS 15-0770 标准卡一致,表明CdTe QDs成功制备。
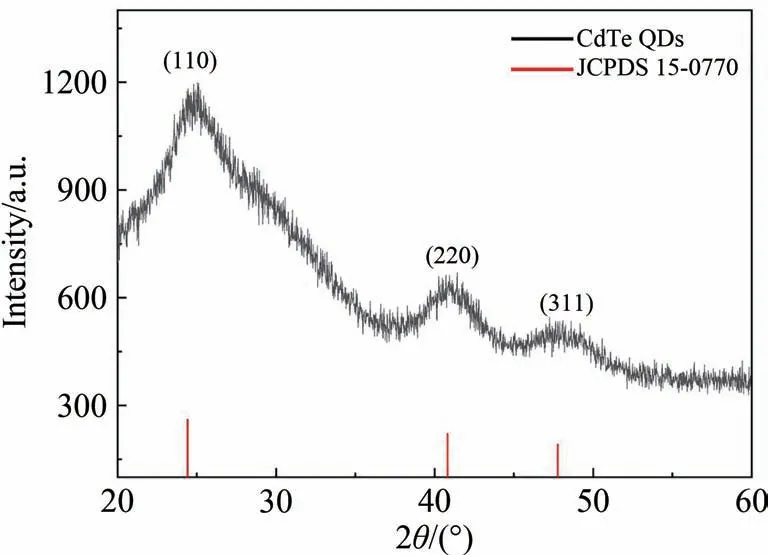
图3 CdTe QDs的XRD图谱Fig.3 XRD pattern of CdTe QDs
对制备的CdTe QDs 及探针NCH-Cu2+进行光学表征。如图4A 所示,探针NCH-Cu2+与CdTe QDs 在350~550 nm 范围内的光吸收重叠,这是二者能发生竞争吸收的基础。当探针NCH-Cu2+与目标物His 反应后,其在395 nm处的吸光度值显著下降,在500 nm处的吸收值则明显增加,此处仅在395 nm 处对传感器进行了研究。由于CdTe QDs 在395nm 处有明显的吸收,表明所合成的CdTe QDs 可以在395 nm 波长下被激发。接下来,用不同浓度的His与NCH-Cu2+探针共同孵育,再检测其光吸收值的变化,如图4B 所示。随着His 浓度的升高,探针在395 nm 处的吸收值逐渐降低,即NCH-Cu2+对光的竞争吸收能力随着His浓度的升高而减弱。目标物His可通过识别反应调控探针在395 nm 处的光吸收性质,进而影响其对光的竞争吸收能力,这为目标物调控光电流信号的大小提供了依据。
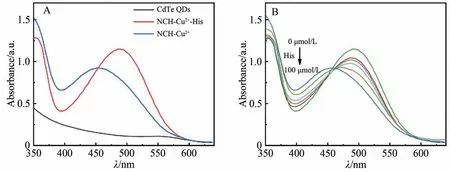
图4 (A) CdTe QDs、NCH-Cu2+及其加入His 后的UV-Vis 吸收光谱; (B) NCH-Cu2+与不同浓度His(0、10、20、40、70和100 μmol/L)孵育后的UV-Vis吸收光谱Fig.4 (A) UV-Vis absorption spectra of CdTe QDs, NCH-Cu2+ and NCH-Cu2+-His; (B) UV-Vis absorption spectra of NCH-Cu2+ in the presence of the varying amount of His(0, 10, 20, 40, 70 and 100 μmol/L)
2.2 光电化学传感器的构建过程
为了证明PEC 传感器的成功构建,对电极修饰过程进行PEC 响应和电化学阻抗谱(EIS)测试。如图5A所示,图5A曲线a为裸ITO电极,几乎没有光电流信号产生。修饰CdTe QDs后,由于其良好的光电转换效率,在395 nm 波长光的激发下,CdTe/ITO 产生明显的光电流信号(图5A曲线b)。进一步修饰探针NCH-Cu2+后,由于NCH-Cu2+与CdTe QDs之间的竞争吸收作用,NCH-Cu2+/CdTe/ITO 产生的光电流信号显著下降(图5A曲线d)。NCH-Cu2+/CdTe/ITO与60 μmol/L的His溶液共同孵育后,由于His与探针NCHCu2+发生识别反应导致探针在395 nm 处的吸收值降低,竞争吸收能力减弱,光电流信号回升(图5A 曲线e)。为了排除His 本身对光电流信号的影响,将CdTe/ITO 与60 μmol/L 的His 共同孵育5 min 后测试其光电流响应,结果如图5A曲线c所示,His对CdTe/ITO产生的光电流信号没有影响,表明只有当His探针NCH-Cu2+存在时,His才能引起光电流信号变化。
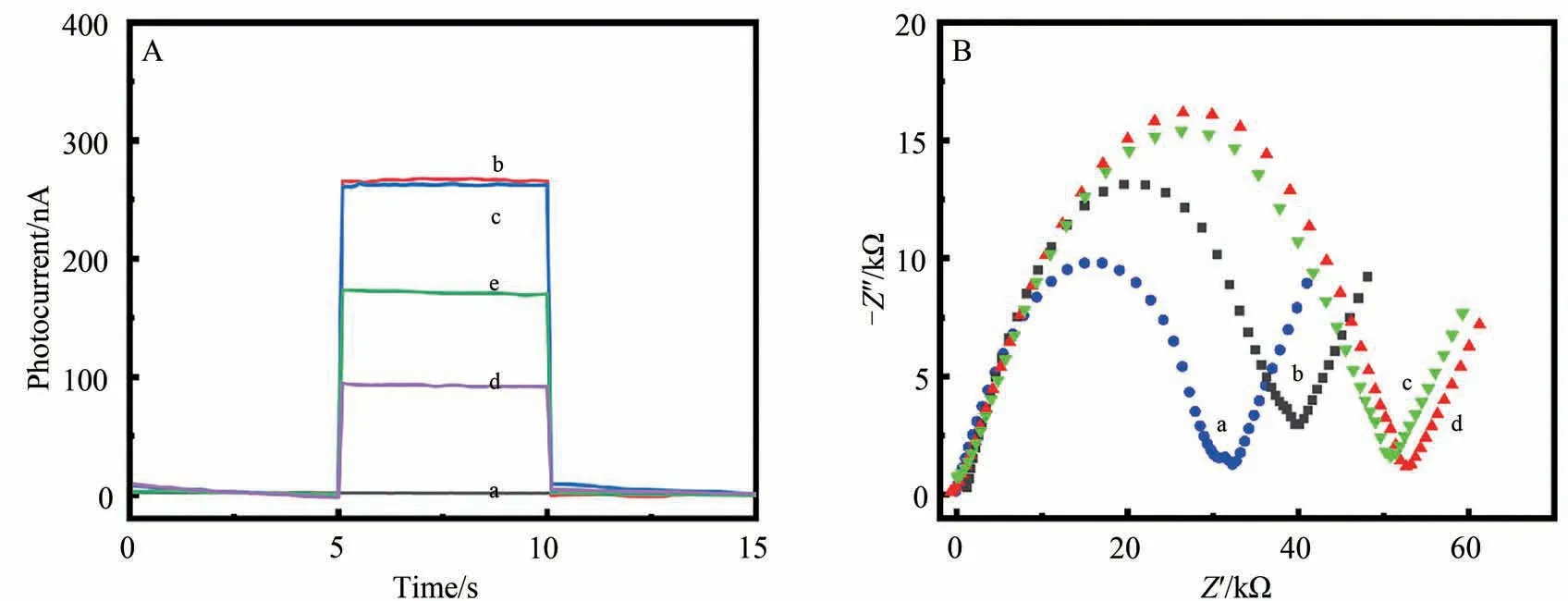
图5 PEC传感器的(A)光电流响应和(B) EIS表征Fig.5 (A) Photocurrent response and (B) EIS diagram of PEC sensor
同样用电化学阻抗谱(EIS)表征了电极的修饰过程,在EIS中,半圆弧的直径反映了电荷转移电阻的大小,因此,半圆弧越小,意味着电极的导电性越好。如图5B 曲线a 所示,ITO 电极具有良好的导电性,其阻抗值Ret最小。修饰了CdTe QDs后,Ret明显增大(图5B曲线b),这是由于CdTe QDs作为半导体其导电性能较弱,导致修饰后的电极Ret增大。修饰探针NCH-Cu2+后,导电性进一步降低(图5B曲线c)。如图5B曲线d所示,将NCH-Cu2+/CdTe/ITO 电极与60 μmol/L的His溶液共同孵育后,Ret几乎没有变化,这表明与His对修饰电极的导电性没有影响。上述结果证明,该PEC传感器的成功构建,并且可以用于检测His。
2.3 实验条件的优化
作为生理环境中常见的电子给体抗坏血酸(AA)浓度可能会对实验结果产生干扰,所以考察了AA浓度对传感器信号的影响。如图6A所示,光电流在一定范围内随着电解液中AA浓度的增加而增大,在浓度为200 μmol/L时达到最大值,所以实验采用的电解液中的AA浓度为200 μmol/L。此浓度与大鼠血清中的AA 浓度匹配[25]。图6B 是对CdTe QDs 质量浓度的优化,在其质量浓度为1 g/L 时光电流达到最大值,因此实验采用的CdTe QDs 质量浓度为1 g/L。如图 6C 所示,随着探针NCH-Cu2+浓度的增大,竞争吸收作用增加,光电流响应逐渐降低,在浓度大于2 mmol/L时,光电流降低速率趋于平缓,所以最终选择的探针浓度为2 mmol/L。如图6D 所示,随着与His 反应时间增加,NCH-Cu2+-CdTe/ITO 的光电流信号逐渐增大,在60 s时达到峰值,随后光电流不再增大,因此最终采用的反应时间为60 s。
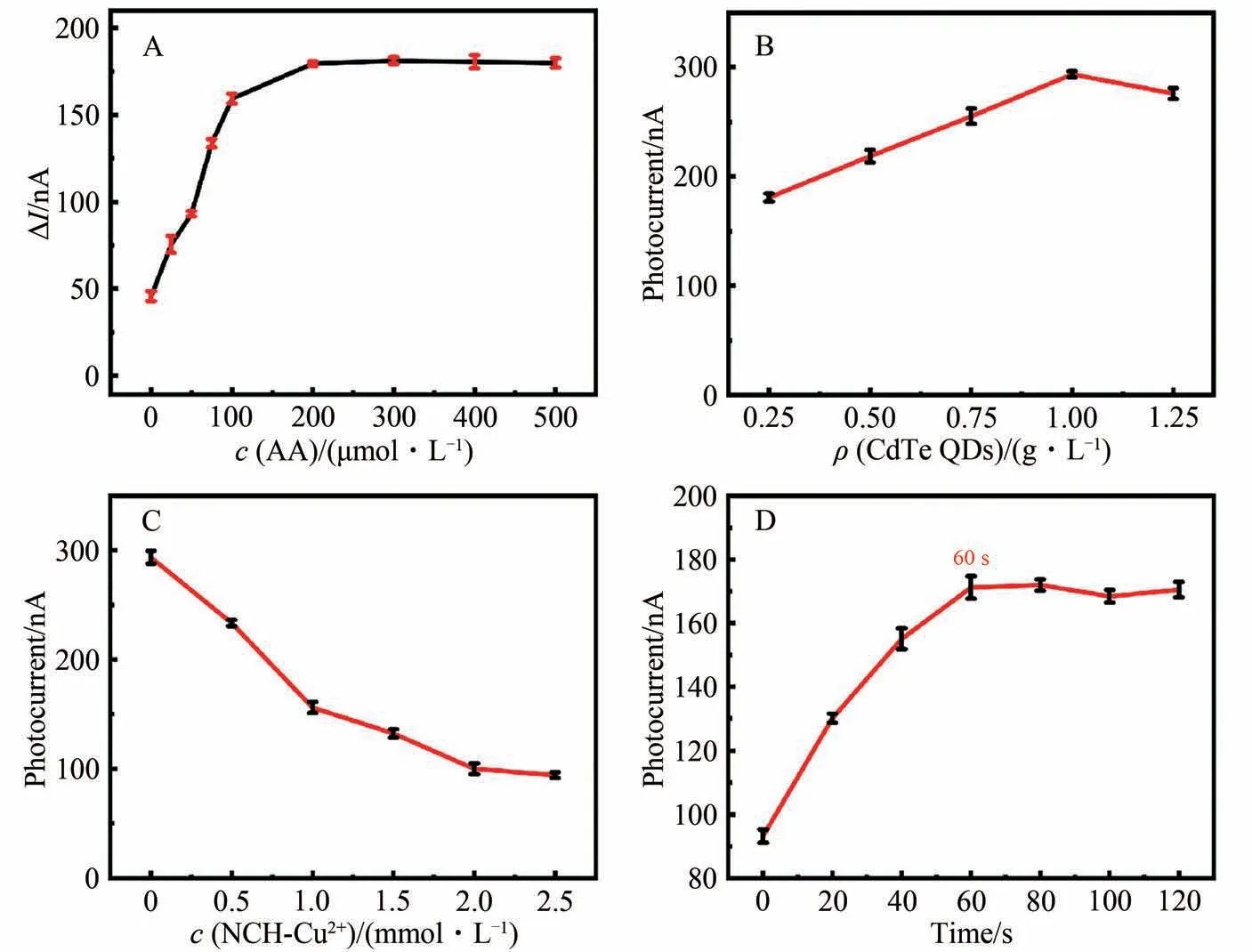
图6 电解液中AA 浓度(A)、电极修饰过程中CdTe QDs质量浓度(B)、探针 NCH-Cu2+浓度(C)和反应时间(D)对光电流的影响Fig. 6 Effects of the concentration of AA(A), CdTe QDs(B), NCH-Cu2+ (C) and the reaction time(D) on the photocurrent response
2.4 光电化学传感器对His的分析性能
对所构建的光电化学传感器的分析性能进行了测试,如图7A 和7B 所示,在His 浓度(cHis)为0~60 μmol/L 范围内,NCH-Cu2+/CdTe/ITO 所产生的光电流信号变化值(ΔI)随着cHis的增加而增加,且ΔI与cHis呈现良好的线性关系。线性回归方程为ΔI=4.20+1.36cHis(R2=0.998),检出限为4.29 μmol/L(S/N=3)。
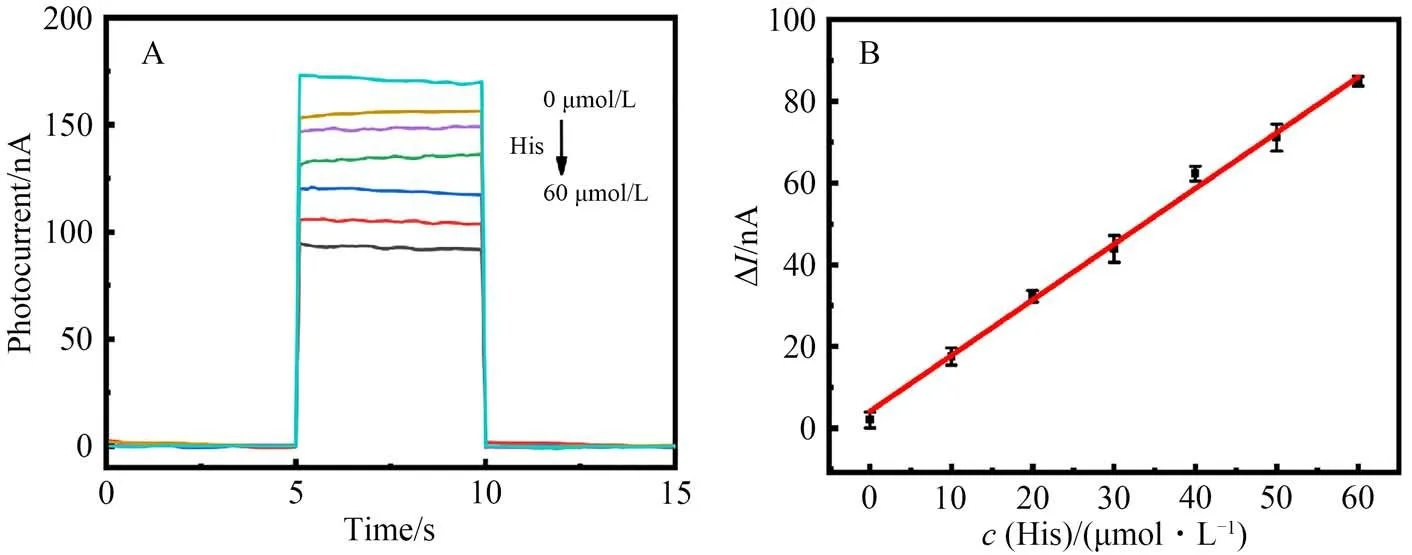
图7 PEC传感器与不同浓度组氨酸孵育后的光电流响应(A)及标准曲线图(B)Fig.7 The photocurrent responses (A) and calibration curve (B) of PEC sensor for detecting different concentrations of His cHis: 0, 10, 20, 30, 40, 50, 60 μmol/L
2.5 光电化学传感器的选择性、稳定性及重现性
为了评估该传感器的选择性,在相同实验条件下,考察了NCH-Cu2+-CdTe/ITO 与多种潜在干扰物共同孵育后,其光电流信号的变化。干扰物包括多种金属离子(K+、Ca2+、Na+、Mg2+、Cu2+、Fe2+、Fe3+、Zn2+、Mn2+)、氨基酸(Gly、Leu、Lys、Iso、Arg、Tyr、Val、Met)、活性氧(ClO-、H2O2、NO、ONOO-)、谷胱甘肽(GSH)、AA、多巴胺(DA)、去甲肾上腺素(NE)、腺嘌呤核苷三磷酸(ATP)和葡萄糖(Glu)等。如图8所示,与干扰物共同孵育后,NCH-Cu2+/CdTe/ITO 的光电流信号没有显著变化,只有His 存在时,其光电流信号才有明显变化。以上结果表明,所构建的光电化学传感器对His 具有优异的选择性,可用于复杂体系中His 的高特异性测定。

图8 PEC传感器的选择性Fig.8 Selectivity of the PEC sensor
除了选择性,重现性和稳定性也是传感器性能的重要指标。如图9A 所示,将所构建的传感器在连续10个周期的光暗循环模式下进行测试,观察到比较稳定的光电流,随着时间和循环次数增加,光电流信号几乎没有衰减,表明所构建的PEC传感器具有较好的稳定性。随后,抽取5组传感器在同一条件下进行光电信号测试,结果如图9B所示,可以看到所构建的PEC传感器具有较好的重现性。
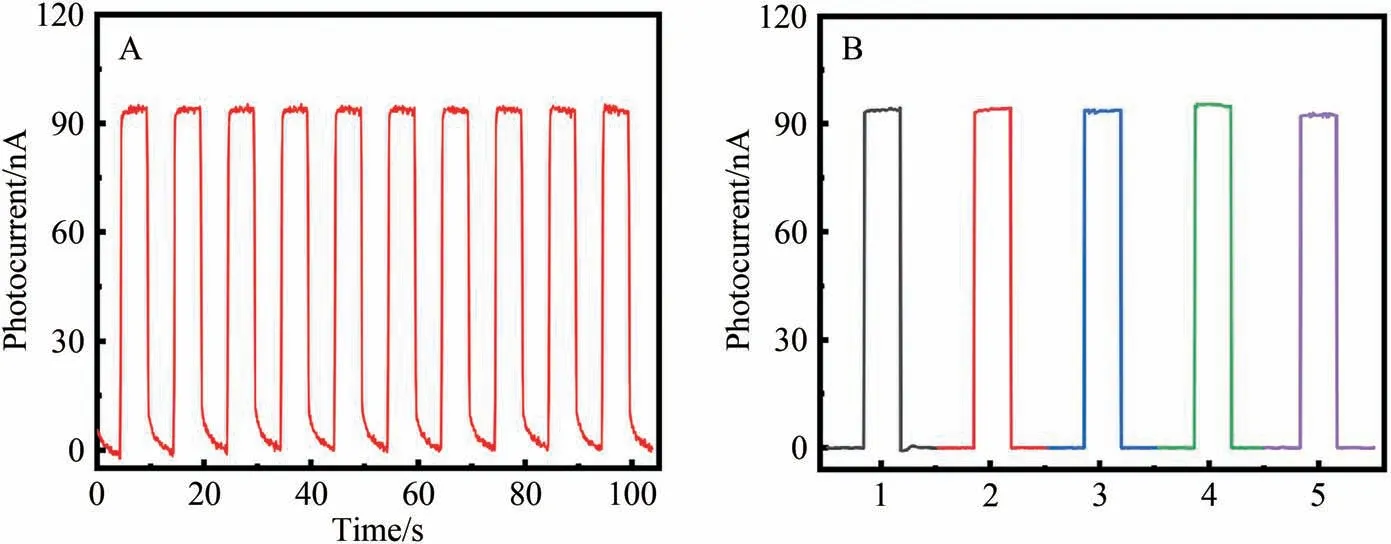
图9 PEC传感器的(A)稳定性和(B)重现性Fig.9 Stability (A) and reproducibility (B) of the constructed PEC sensor
2.6 血清中His的检测
在以上结果的基础上,进一步评估了所构建的His 传感器在真实血清样品中的分析准确性。分别取了3只SD大鼠的血液,离心制取血清,检测结果如图10所示。根据以上实验得到的线性回归方程,计算可得大鼠血清中的His 浓度为50 μmol/L,3 组样本间p<0.05,与文献[26]报道一致。图10 结果还表明,所构建的PEC传感器在血清中重现性较好,可以应用于复杂的生物环境。
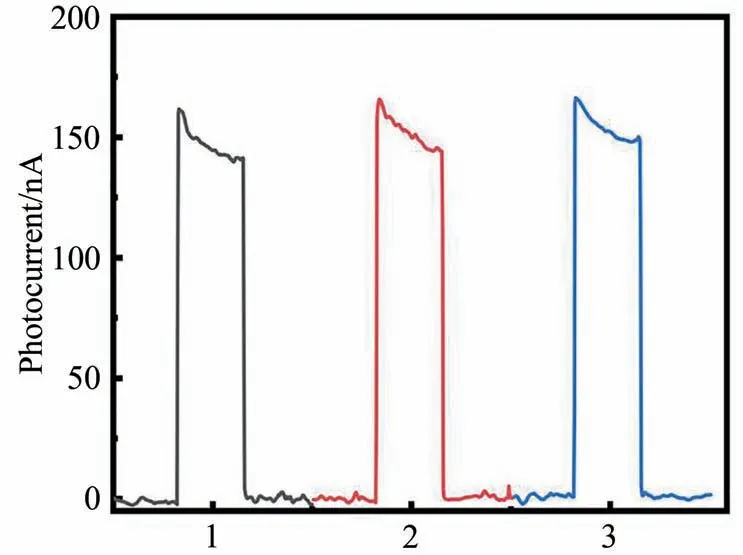
图10 PEC传感器检测大鼠血清中的His水平Fig.10 Detection of histidine in rat serum by PEC sensor
另外,为了增加实验结果的可信度,设计了加标回收实验。将处理好的大鼠血清稀释5 倍,然后在其中分别加入组氨酸,使血清稀释液中的组氨酸浓度分别增加10、15 和20 μmol/L。实验结果如表1 所示,3 组加入不同浓度His 的样品回收率在95.90%~103.20%之间,RSD 值在3.12~4.07 之间,该结果证明了所构建的PEC传感器可以应用于血清样品中组氨酸的检测。
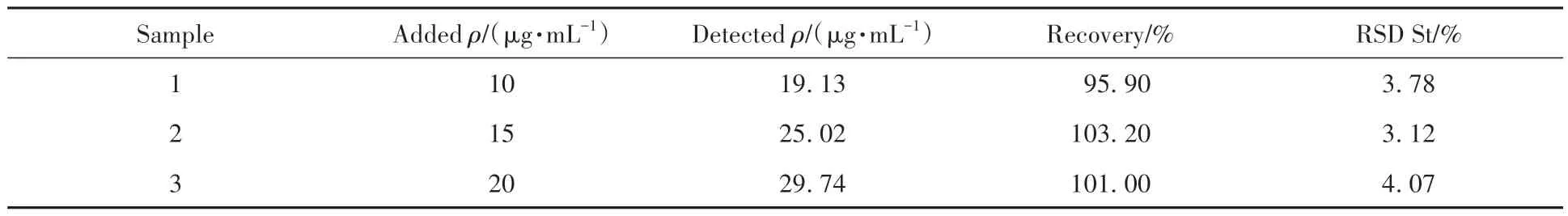
表1 加标回收法测定稀释大鼠血清中的HisTable 1 Determination of His in diluted rat serum by the standard recovery method
3 结 论
本研究成功构建了一种基于小分子识别的His光电化学传感器。该传感器通过小分子探针与目标物之间的化学识别解决了传统光电化学传感器无法检测非电化学活性物质的问题。小分子探针与目标物之间的高特异性反应保障了传感器的高选择性,具有在复杂体系中对目标物进行测定的能力。更重要的是,通过对小分子探针结构的设计,可以将该光电化学传感器的构建测量拓展至其它物质的检测,扩大了光电化学传感器的应用范围,为光电化学传感的应用提供了新的思路。
辅助材料(Supporting Information)[化合物1,2,NCH的1H NMR谱图]可以从本刊网站(http://yyhx.ciac.jl.cn/)下载。

