普通变形杆菌噬菌体裂解酶Lys66 的表达纯化及活性分析
尹红梅,侯忠余,王金丽,唐俊妮,,*
(1.西南民族大学食品科学与技术学院,四川成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川成都 610041)
普通变形杆菌(Proteus vulgaris)属肠杆菌科,变形杆菌属,是一种常见的革兰氏阴性杆菌,广泛存在于自然界[1],主要存在于水、土壤和天然肥料以及食品中,是人体肠道常见菌群之一[2-3]。变形杆菌属,特别是奇异变形杆菌和普通变形杆菌,是尿路感染[2]的主要病原菌之一。近年来,有研究发现变形杆菌除了可引起尿路感染外,还可引发多种人类疾病,如胃肠炎[4]、上消化道疾病[5]、肝胆疾病[6]尤其与克罗恩病的关联特别强[7],给医疗带来巨大压力。有研究显示在1129 件直接入口食品中检出变形杆菌117 株,检出率为10.36 %,可见其很容易污染食品[8]。此外,变形杆菌通常与食物变质有关,食用受污染的食物(尤其是肉类和蔬菜)时也可引起食源性疾病[9]。在人口众多的发展中国家,变形杆菌属仍然是导致食物中毒的主要细菌。近年来,中国报道的与变形杆菌相关的食物中毒病例也越来越多[10-13]。而且,多重耐药(multi drug resistance,MDR)和广泛耐药(extensively drug resistant,XDR)细菌菌株的迅速传播严重限制了抗生素的使用[14-15],故急需寻找新的抗生素替代物。
噬菌体是一类专门寄生在细菌中的病毒,故又称细菌病毒,最初在1916 年,由加拿大医学细菌学家Félix d’Hérel 分离得到[16]。使用噬菌体疗法防治病原菌是一种新的策略,被认为是食品工业等不同领域病原体控制剂的理想替代品,美国FDA 早在2006年已批准单核细胞增生李斯特菌特异性噬菌体作为新型食品防腐剂(ListShield™)[17]。噬菌体虽然是天然无害的生物防治剂,但随着研究的深入,人们发现细菌与噬菌体都在不断进化。由此,细菌也会对噬菌体产生一定抗性,导致噬菌体的抑菌效果并不理想。与噬菌体相比,噬菌体溶酶在用作治疗药物方面具有许多优势,包括高效杀菌[17]、更宽的宿主谱[18]、易于靶向的药物递送和低细菌耐药性[19]。裂解酶是噬菌体编码的肽聚糖水解酶,这些酶独立于噬菌体病毒粒子与相关的编码穿孔素(holin)蛋白一起积聚在宿主细胞内[20-21],要解决细菌的噬菌体抗性问题,裂解酶是较为优异的解决之策。
迄今为止,已经鉴定、表征和测试了许多裂解酶对一系列致病菌的功效。Lu 等[22]研究发现一种广谱噬菌体内溶素,其可以有效杀灭产气荚膜梭菌。Senevirathne 等[23]的研究表明,噬菌体裂解酶对水曲霉菌(一种肺炎克雷伯菌多重耐药分离株)有很好的裂解作用。Shen 等[18]克隆表达了可以有效杀灭大肠杆菌O157:H7 的噬菌体裂解酶,在温度(4.0~95.0 ℃)和pH(5.0~11.0)下表现出较高的酶活性稳定性,此外,它还揭示了对革兰氏阴性病原体(如大肠杆菌、沙门氏菌和铜绿假单胞菌)的广泛抗菌活性。王玉平[24]的研究结果表明,两种沙门氏菌有强裂解能力的噬菌体裂解酶应用到食品中对莴苣的杀菌效果最好,其次是鸭肠,对哈密瓜、猪肉和脱脂奶粉中沙门氏菌的杀菌效果均较差。王栗萍[25]发现粪肠球菌噬菌体裂解酶具有广谱抑菌作用,能有效清除金黄色葡萄球菌和粪肠球菌的生物被膜,在治疗SD 大鼠腹腔感染中表现出良好效果,且对SD 大鼠治疗后的肠道菌群多样性几乎未产生不利影响。可见,噬菌体裂解酶是一种具有应用前景的新型抗菌剂,但目前暂无普通变形杆菌噬菌体裂解酶的相关报道。本研究对一株新的普通变形杆菌噬菌体中的裂解酶进行基因克隆、蛋白表达及纯化,并探究裂解酶的抑菌活性,旨在为其在食品、农产品加工领域中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
变形杆菌 来源于牦牛屠宰场,分离后经16S rRNA 测序鉴定,一株新的裂解变形杆菌的短尾噬菌体PV66 本实验室提供(已经过纯化鉴定及全基因组测序),市售牛肉;胰蛋白胨、酵母粉、琼脂 英国Oxoid 公司;异丙基-β-D-硫代半乳糖苷(IPTG)、TMB 显色试剂盒、BL21(DE3)感受态细胞、Western Blot 一抗(His 鼠抗)、Western Blot 二抗(羊抗鼠)、蛋白定量试剂盒 上海生工生物有限公司;氨苄青霉素 上海源叶生物有限公司;咪唑(Imidazole)、甘氨酸、尿素(Urea)、丙烯酰胺、甲叉丙烯酰胺、四甲基乙二胺(TMED)、十二烷基硫酸钠(SDS)、过硫酰胺(AP)美国Oxiod Limited 公司;十二烷基肌氨酸钠(SKL)擎科梓熙生物技术有限公司;镍柱(Ni-NTA)上海帛科生物科技有限公司;聚乙二醇(PEG 20000)、EDTA、考马斯亮蓝、冰醋酸 天津市致远化学试剂有限公司;
SW-CJ-2FD 超净工作台、电子天平、恒温培养箱 苏净集团苏州安泰空气技术有限公司;HZQX160 恒温振荡培养箱 苏州培英实验设备有限公司;TGL-16K 医用离心机 湖南湘仪实验室仪器开发有限公司;MLS-3020 高压蒸汽灭菌锅、DW-86L390 超低温冰箱 日本三洋公司;AKHL-III-24 艾柯纯水机 成都康宁实验专用纯水设备厂;UV-6100 分光光度计、318cf 酶标仪 上海美普达仪器有限公司;SCIENTZ-IID 超声波细胞破碎仪 宁波新芝生物科技股份有限公司;UniversalHood Ⅱ型凝胶成像仪 天津津立仪器设备科技发展有限公司。
1.2 实验方法
1.2.1 裂解酶基因的比对 将经测序装配好的全部基因组上传至国际生物技术信息中心(National Center for Biotechnology Information,NCBI)(https://www.ncbi.nlm.nih.gov/)所提供的局部相似性比对工具(Basic Local Alignment Search Tool,BLAST)(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行比对,以确定与裂解酶具有高相似性基因序列。
1.2.2 裂解酶基因生物信息分析 利用ExPASy Bioinformatics Resource Portal(http://us.expasy.org/tools/protparam.html)研究裂解酶的分子质量、等电点和氨基酸组成等物理特性。
1.2.3 裂解酶基因的合成与重组质粒的构建 将测序得到的全基因组序列在数据库NCBI 比对得到的与其他裂解酶高度相似的基因片段进行分析,添加6 个His 标签后采用全基因合成的方式将裂解酶基因亚克隆到载体pET-32a 上,基因合成由生工生物工程(上海)股份有限公司完成,获得重组质粒pET-32a-Lys66,用XbaI 与XhoI 进行双酶切,胶回收双酶切产物进行验证。
1.2.4 蛋白的表达 将重组质粒pET-32a-Lys66 转移到大肠杆菌BL21(DE3)的感受态细胞中[22],在42 ℃下热击后均匀地涂布在含有50 μg/mL 氨苄青霉素的平板上,并在37 ℃下恒温培养。挑取单克隆菌落,在37 °C 下,在含有氨苄青霉素的液体培养基中培养。当OD600nm值达到0.6 时,加入0.5 mmol/L诱导剂IPTG 继续培养,分别在20 ℃孵育过夜、37 ℃孵育6 h。无诱导剂的为阴性对照。以4000 r/min 离心10 min,弃去上清液并收集菌体,用缓冲溶液A 悬浮。通过超声波破碎机完全溶解。离心收集上清液和沉淀物,用缓冲液B 溶解沉淀物,分别制备上清液和沉淀蛋白样品,并准备上胶检测。确定再表达的条件:在含有50 μg/mL 氨苄青霉素的培养基中培养细菌溶液,当OD600nm值达到0.6 时,加入0.5 mmol/L 诱导剂IPTG,在20 ℃下培养过夜以进行大量表达,并通过离心收集细胞菌体。
1.2.5 重组蛋白的纯化 用缓冲液C(8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,0.1% Triton X-100,pH8.0)溶解细胞菌体,超声破碎后,离心收集上清粗蛋白;取5 mL Ni-NTA,用5 倍于柱床体积的Binding buffer(8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,pH8.0)洗涤平衡柱;将粗蛋白用平衡柱填料孵育1 h,收集流出物;用Binding buffer 冲洗平衡柱;用Washing buffer(8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,20/50 mmol/L Imidazole,pH8.0)缓冲液洗涤柱子,收集流出物;用Elution buffer(8 mol/L Urea,50 mmol/L Tris,300 mmol/L NaCl,500 mmol/L Imidazole,pH8.0)缓冲液洗脱,收集流出物;将流出物分别处理,取样,制备SDS-PAGE 检测。将纯化后的组分5 透析到蛋白保存缓冲液(50 mmol/L Tris,300 mmol/L NaCl,0.1% SKL,pH7.4)中,透析后用PEG 20000 浓缩,0.45 μm 膜过滤,分装1 mL/管,-80 ℃。
1.2.6 目的蛋白的检测 将纯化后的目的蛋白用SDS-PAGE 检测和Western Blot 验证。具体方法为:
SDS-PAGE 检测:对蛋白样品进行处理,制样,12%分离胶(30%制胶液 4 mL,1.5 mol/L Tris-HCl 2.5 mL,10% SDS 100 μL,10% APS 100 μL,10%TEMD 10 μL,ddH2O 3.3 mL),5%浓缩胶(30%制胶液0.83 mL,1 mol Tris-HCl 0.625 mL,10% SDS 50 μL,10% APS 75 μL,10% TEMD 7.5 μL,ddH2O 3.42 mL),进行SDS-PAGE 电泳,检测分子量。
Western Blot 验证:对蛋白样品进行处理,制样。浓缩胶5%,分离胶12%。一抗为鼠抗His 标签,二抗为羊抗鼠,采用TMB 显色,使用标签抗体进行验证。
1.2.7 重组蛋白质量浓度的测定 采用非干扰型蛋白定量试剂盒Cat.No.C503071 对纯化好的蛋白质量浓度进行测定[26]。以吸光度为纵坐标,对应牛血清白蛋白量为横坐标,用Microsoft Excel 软件绘制蛋白标准曲线,获得标准曲线公式;将测得的待定量蛋白质样品溶液吸光度代入标准曲线公式中,计算出所对应的蛋白质样品质量浓度。
1.2.8 裂解酶溶菌活性分析 采用平板裂解实验检测裂解酶的活性[26],将菌株66 培养至对数生长期,与6 mL 融化的0.75 %琼脂LB 培养基混合,冷却后打孔。加入上述纯化的裂解酶Lys66,并设0.5 mmol/L EDTA 为阴性对照。37 ℃培养8 h 后观察是否有抑菌圈并记录。
1.2.9 裂解酶 Lys66 的裂解谱分析 参考文献[27]的方法,通过浊度法分析裂解酶Lys66 的裂解谱。将受试菌种接种于100 mL LB 肉汤液体培养基中,其中革兰氏阴性菌在培养至对数生长期后加入5%(V/V)的氯仿处理20 min 以除去其外膜,以8000 r/min 离心15 min,经无菌水多次洗涤后离心收集菌体。将沉淀用50 mmol/L Tris-HCl 缓冲液(含0.1%TritonX-100,pH8.2)重悬,调节OD600nm至0.8~1.0,向200 μL 细菌重悬液中加入50 μL 裂解酶,于室温下作用30 min 后检测OD600nm,以相同体积Tris-HCl 缓冲液(含0.1% Triton X-100)替代裂解酶Lys66作为对照。所有试验重复3 次,根据裂解率得出裂解酶的裂解谱。裂解率=[(试验组OD600nm的减小量-空白组OD600nm的减小量)/菌液初始OD600nm]×100。
1.2.10 裂解酶Lys66 与EDTA 联用的溶菌活性分析 参考文献[28]的方法,通过浊度法确定最佳EDTA 及其最适浓度。将菌株66 接种于 100 mL LB肉汤液体培养基中,培养至对数生长期后以8000 r/min 离心15 min,经无菌水多次洗涤后离心收集菌体。细菌沉淀用Tris-HCl 缓冲液(不含0.1% Triton X-100,pH8.2)重悬至OD600nm为0.8~1.0。按表1中的用量加入Lys66、不同浓度EDTA 和200 μL 细菌重悬液混匀,在室温下静置,每隔30 min 检测OD600nm,共监测2 h,重复3 次。与对照组(组别a)相比,试验组(组别b~组别r)OD600值下降的越多,说明溶菌活性越好。

表1 裂解酶Lys66 与EDTA 用量(μL)Table 1 Dosage of lysase Lys66 and EDTA (μL)
1.3 数据处理
采用Excel 2016 进行原始数据的整理、用SPSS 2019 进行方差分析、Origin 2018 进行图形绘制。
2 结果与分析
2.1 裂解酶基因的挖掘
将测序组装后的全基因组序列上传到NCBI 进行比对,找到与裂解酶相似度较高的基因序列如图1 所示,Lys66 基因序列片段大小为393 bp。序列已上传至国际生物技术信息中心数据库中,登陆号为:OR195071。

图1 裂解酶基因序列Fig.1 Sequence of Lyase gene
2.2 裂解酶的生物信息分析
利用ExPAsy Bioinformatics Resource Portal 预测裂解酶的分子质量为15.20 kDa,等电点为9.40,由130 个氨基酸组成,不稳定指数是44.61,说明该蛋白质不稳定,亲水系数为-0.591,表明该蛋白具有一定的亲水性,为利于蛋白纯化,在末端加上6 个His 标签。由图2 可知,Lys66 与Proteus phage Vb PmiP-P59 和Proteus phage Privateer 所产的裂解酶具有同源性(53%),但Lys66 处于单独分支,说明Lys66 是一种新型裂解酶。

图2 Lys66 氨基酸序列系统发育比较Fig.2 Amino acid phylogenetic comparison of the endolysin Lys66
2.3 全基因合成与质粒载体pET-32α-lys66 的构建
采用全基因合成法构建重组质粒pET-32αlys66,并亚克隆到表达载体pET-32α中。为了清楚地观察目标条带,重组质粒用XbaI 和XhoI 酶切。结果表明,酶切产物包括载体条带(约5600 bp)和目的基因条带(450 bp 左右)(图3)。同时,重组质粒的测序结果表明,裂解酶基因已正确插入到pET-32α表达载体上,表明重组质粒pET-32α-lys66 构建成功。

图3 重组质粒酶切图Fig.3 Restriction diagram of recombinant plasmid
2.4 确定重组蛋白的最佳诱导条件
将重组质粒pET-32α-lys66 转化大肠杆菌BL21(DE3)感受态细胞后,用IPTG 诱导表达,探讨不同条件下的表达效果。裂解酶融合蛋白的预测分子量为15.20 kDa。从图4 可以看出,BL21(DE3)表达的蛋白大小与预期值一致。目的蛋白主要存在于破碎上清中,目的蛋白在破碎上清液中的亮度与诱导后基本相同,表明为可溶性蛋白。目的蛋白在37 ℃上清过夜诱导浓度下表达较高,选择37 ℃过夜诱导为最佳条件。

图4 融合蛋白表达小试SDS-PAGE 分析结果Fig.4 SDS-PAGE analysis of fusion protein expression test
2.5 重组蛋白的纯化及检测
确定最佳诱导条件后,将BL21(DE3)大肠杆菌扩大培养以获得大量粗蛋白,经过镍柱亲和层析纯化,SDS-PAGE 电泳分析发现500 mmoL/L Imidazole 洗脱组分中可以获得较纯且量较多的目的蛋白(图5)。
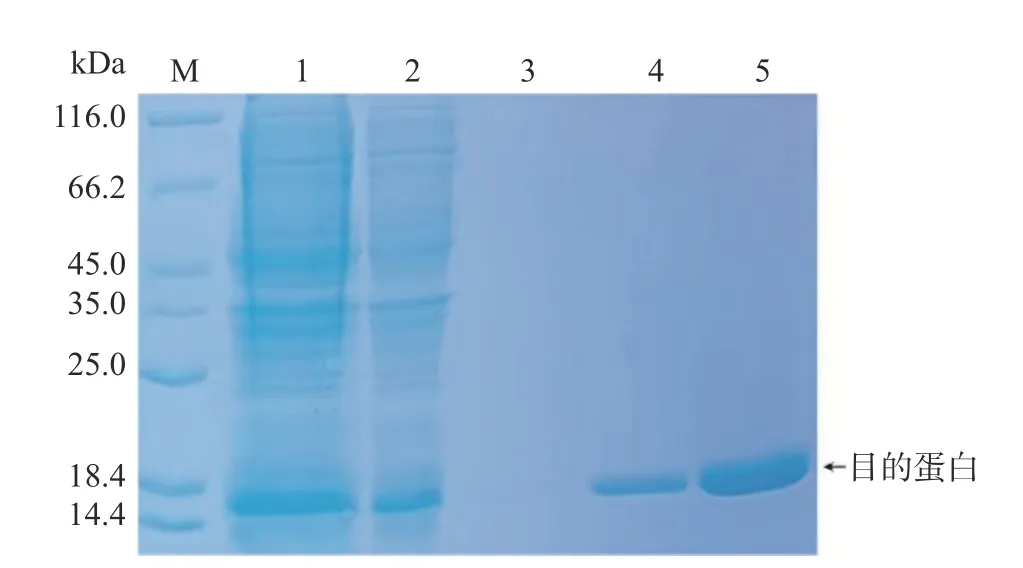
图5 纯化融合蛋白镍柱亲和层析的 SDS-PAGE 分析Fig.5 SDS-PAGE analysis of purified fusion protein nickel affinity chromatography
2.6 融合目的蛋白的验证
纯化后融合蛋白SDS-PAGE 电泳在理论分子量附近出现明显条带(图6A),初步判断融合蛋白纯化成功。为进一步确定纯化蛋白为目的蛋白,采用TMB 显色试剂盒按Western Blot 方法显色检测。结果表明,相应位置有明显条带(图6B),表明该蛋白为目的蛋白。

图6 最终纯化蛋白SDS-PAGE 分析图(A)和最终纯化蛋白Western Blot 分析图(B)Fig.6 SDS-PAGE analysis of final purified protein (A)and Western Blot analysis of final purified protein (B)
2.7 蛋白浓度的测定
将纯化得到的裂解酶Lys66 蛋白透析浓缩后,用蛋白定量试剂盒提供的方法建立蛋白标准曲线,得到标曲回归方程为y=0.0171x+0.0435,R2=0.9948。在蛋白标准曲线下用分光光度计测定蛋白Lys66 浓度为1.86 mg/mL。
2.8 裂解酶溶菌活性
通过平板裂解实验检测表达蛋白的裂解活性发现,与对照组相比,使用了裂解酶后,平板上出现直径约19.30 mm 较清晰抑菌圈(图7)。说明裂解酶可以裂解普通变形杆菌66,具有良好的溶菌活性。
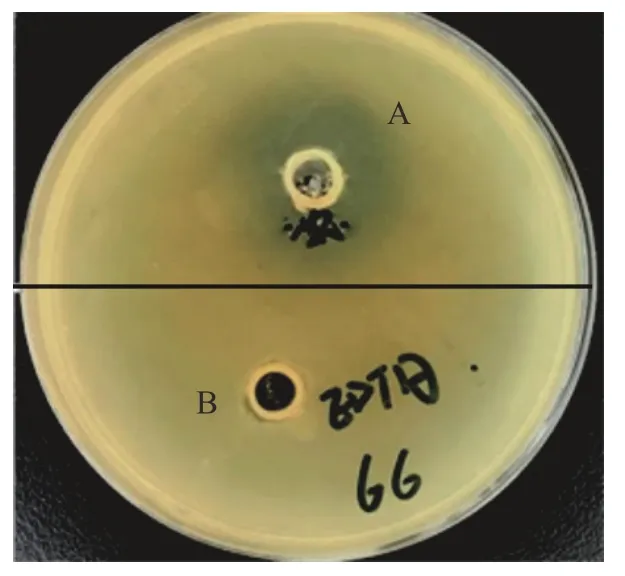
图7 平板裂解实验检测表达蛋白的裂解活性Fig.7 Plate cleavage test to detect the cleavage activity of the expressed proteins
2.9 裂解酶Lys66 的裂解谱分析
裂解酶相对噬菌体的作用具有特异性又有广谱性,用15 株菌株对Lys66 进行裂解图谱测试,结果见表2。Lys66 在很大程度上不能裂解革兰氏阳性菌Staphylococcus aureusATCC43300 和Enterococcus.faecalis,但对所有13 株氯仿处理的革兰氏阴性菌均表现出裂解活性,宿主谱较广。在供试的10 株普通变形杆菌中,Lys66 对Proteus vulgaris66的裂解率最高,为82%,因此选择Proteus vulgaris66 作为后续试验的目标菌。虽然Lys66 来源于普通变形杆菌噬菌体,但是它对Escherichia coliO157(19%)、Cronobacterspp.(5%)也表现出一定的裂解能力,这可能是由于Lys66 与Escherichia coli、Cronobacterspp.噬菌体裂解酶具有一定的同源性。Lys66 对氯仿预处理的表达菌株Proteus vulgaris66 具有较强裂解能力(82 %),说明Lys66 对普通变形杆菌的污染有较好的清除能力。

表2 裂解酶Lys66 的裂解谱Table 2 Lysis spectrum of endolysin Lys66
2.10 裂解酶Lys66 与EDTA 联用的溶菌活性分析
由于肽聚糖外膜的保护作用,裂解酶不能直接从外膜裂解革兰氏阴性菌,需要膜渗透剂来协助裂解酶穿透外膜[29]。在本研究中,将Lys66(1.89 mg/mL)与不同浓度的EDTA 结合,用浊度法探讨裂解效果。结果显示如图8 所示,当Lys66 单独应用于活菌时(组别b),2 h 后OD600nm仅下降了0.06,几乎没有裂解效果,不同浓度的EDTA 对活菌单独处理有一定的抑制作用,且当EDTA 浓度为0.50 mmol/L时达到最高(组别m),2 h 后OD600nm下降了0.29,当Lys66 与EDTA 结合使用时,可有效裂解宿主细菌,当EDTA 浓度为1 mmol/L 时Lys66 的溶菌活性最好(组别I),2 h 后OD600nm下降了0.61,且前30 min 内效果最明显,OD600nm下降了0.38。
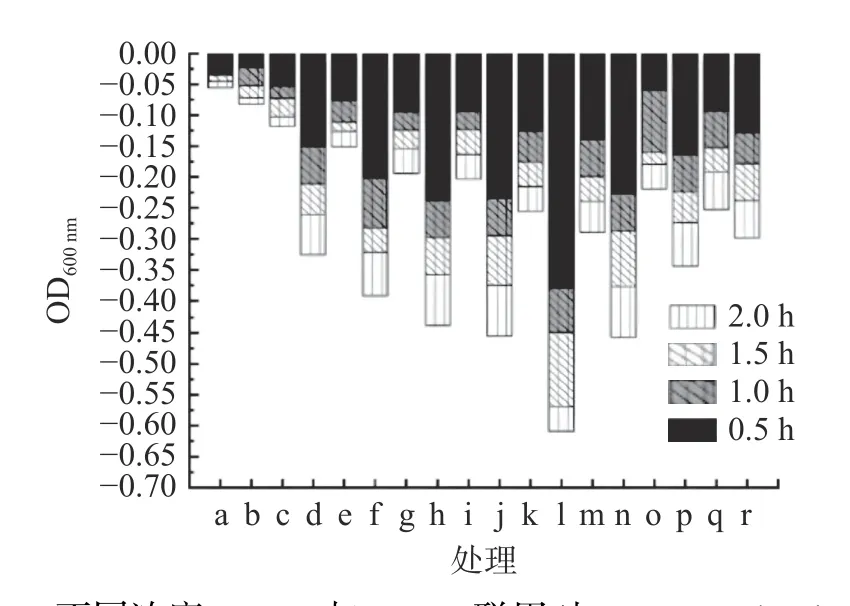
图8 不同浓度EDTA 与Lys66 联用对Proteus vulgaris 66的溶菌效果Fig.8 Lytic effect of different concentrations of EDTA and Lys66 on proteus vulgaris
3 结论
本实验将噬菌体全基因组测序获得的基因在Genbank 数据库中BLAST 比对,得到一段393 bp 与其他噬菌体裂解酶基因相似的基因序列,翻译后,通过在线软件预测显示,该蛋白分子量为15.20 kDa,等电点为9.40,由130 个氨基酸组成。将优化的基因通过合成构建到载体pET-32α中,得到重组质粒pET-32α-lys66,将重组质粒转入大肠杆菌BL21(DE3)感受态细胞后,培养,诱导表达,收集菌体,纯化蛋白,最后通过SDS-PAGE 以及Western Blot 对蛋白进行验证,获得1.86 mg/mL 的重组裂解酶Lys66 蛋白。裂解酶Lys66 在平板上有直径约为19.30 mm 清晰的抑菌圈,对15 株受试菌株中13 株氯仿处理的革兰氏阴性菌均表现出裂解活性,宿主谱较广。Lys66(1.89 mg/mL)与EDTA(1 mmol/L)联用时,2 h 后OD600nm下降0.61。以上结果表明Lys66 具有良好的抑菌效果,是一种潜在的抗菌剂。
本研究成功表达纯化出普通变形杆菌噬菌体裂解酶Lys66,并对其溶菌活性进行初步探究,为裂解酶在食品、医药等领域的开发与应用提供了理论依据。但裂解酶本身对革兰氏阴性菌的溶菌活性并不明显,且未将其应用到实际食品中,未来可通过与其他抗菌剂[30]或基因工程[31]的方式提高裂解酶在革兰氏阴性菌中杀菌效力,并将裂解酶应用到食品中,进一步探究其在食品中杀菌活性。

