不同热处理方法对元宝枫叶与花中酚类成分及抗氧化活性的影响
杨灵光,刘欣欣,邓 闯,尹培培
(宜春学院化学与生物工程学院,江西宜春 336000)
元宝枫(Acer truncatumBunge)属无患子科槭属落叶乔木,是我国重要的乡土树种。作为多功能资源植物,元宝枫集观赏、生态、工业[1-2]、食用[3-4]、药用[5]等多种价值于一身,已在全国20 多个省、市和地区人工种植,具有较高的经济价值及深入开发前景[6]。元宝枫叶被认为具有多种药理活性,是元宝枫最有开发价值的部位之一。其生物活性成分以酚类物质为主,其中黄酮类化合物和绿原酸最早被报道[7],随后其酚类图谱进一步通过液相色谱-质谱联用(LC-MS)等技术进行表征[8]。药理活性方面,元宝枫叶提取物被报道具有抗氧化、抗肿瘤细胞生长、抑制脂肪酸合酶、抑菌、抗肥胖、抗糖尿病等多种生物活性[9]。团队前期工作初步优化了其酚类提取工艺[10],明确了酚类组成[11]及季节性变化特征[12]。元宝枫叶与花具有食用属性,元宝枫叶茶(又名枫露茶)是我国食用历史悠久的珍贵茶饮之一[5,13],元宝枫叶与花在民间也以蒸制等烹饪手段进行食用。
加工处理是延长食品保质期与提升食品口感品质的常用方法,也是茶类饮品生产中的必需过程。热处理是一种重要的加工方式,它可以将食物转化为可食用状态同时能够破坏植物中不可溶的结合态酚类的共价键从而达到释放天然抗氧化物的效果[14]。截止至今,大量关于热处理对于茄子[15]、巴西黑莓[16]、蓝莓[17]、苹果[18]等食品原料中酚类成分或抗氧化活性影响的研究已经得到开展,研究结果显示不同种类热处理对于不同食品基质中的酚类组成及抗氧化活性具有不同影响。作者前期针对元宝枫叶与花酚类提取物在长时间高温环境中的降解机制进行研究,为其提取物作为抗氧化剂的工业化制备提供了参考[11]。但目前元宝枫叶与花在食品应用相关热处理方面的研究尚不深入。
过长时间的高温处理并不符合食品生产的要求与实际流程,且热处理过程中活性成分与植物基质中复杂环境发生的相互作用未能得到描述。由此,亟需对叶与花进行短时间内不同热处理方法的影响研究。综上所述,元宝枫叶与花作为具有独特风味与生物活性的食品及代用茶原料,其加工过程中涉及的短时间加热过程对于叶与花中生物活性成分的影响尚不明确。由此,本研究将探究包括蒸制、微波、烘烤在内的热处理对于元宝枫叶与花中酚类组成以及抗氧化能力的影响,从而为元宝枫叶与花作为食品的加工处理与深度开发提供理论基础。
1 材料与方法
1.1 材料与仪器
元宝枫叶与花 于4 月20 日采集自北京市海淀区八家郊野公园(GPS 坐标,40°00'57.21N,116°19'43.36E)中具有相近树龄及生长环境的元宝枫树,植株由北京林业大学刘忠华副教授鉴定为元宝枫。采样时间是元宝枫的花期,同时也是元宝枫叶的最佳采收时间之一[16]。样品带回实验室简单清理后冻干并研磨为粉末于-80 ℃保存;没食子酸(gallic acid)、没食子酸乙酯(ethyl gallate)、1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖(1,2,3,4,6-penta-O-galloyl-β-dglucose)、新绿原酸(neochlorogenic acid)、山奈酚-3-O-鼠李糖苷(kaempferol-3-O-rhamnoside)、槲皮素-3-O-阿拉伯吡喃糖苷(quercetin-3-O-arabinopyranoside)、槲皮素-3-O-半乳糖苷(quercetin-3-O-galactoside)、槲皮素-3-O-葡萄糖苷(quercetin-3-O-glucoside)、槲皮素-3-O-鼠李糖苷(quercetin-3-O-rhamnoside)、杨梅素-3-O-鼠李糖苷(myricetin-3-O-rhamnoside)等标准品 色谱级,中国国家食品药品监督管理局;福林酚、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联 氮-二(3-乙 基-苯并噻唑-6-磺酸)二铵盐(ABTS)、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、乙腈(色谱级)和甲酸(色谱级)美国西格玛奥德里奇(Sigma-Aldrich)公司;其它试剂 购自上海源叶生物科技有限公司或天津市大茂化学试剂厂等。
高效液相色谱仪(由两台LC-20AT VP 色谱泵、SPDM20A 紫外分光光度检测器、SIL-20AC TH 自动进样器、CTO-10AS VP 恒温箱构成)日本岛津公司;Tecan Infinite 200 多功能酶标仪 瑞士帝肯公司;KQ 300DE 型超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 样品热处理方法 取元宝枫叶与花样品,分别以蒸制、微波及烘烤的方式进行短时间热处理以模拟食品热加工过程,详细参数如下:
蒸制处理方法[19]:以2100 W 将容器中水煮沸,后将元宝枫样品干粉以薄层形式平铺并置放于沸腾后的蒸锅中,以1000 W 分别蒸制5、15、30 min,蒸制后样品粉末重新冷冻干燥用于后续实验。
微波处理方法[20]:将元宝枫样品干粉以薄层形式平铺于容器,以2450 MHz,1200 watts 分别微波2、5、10 min,微波后样品粉末重新冷冻干燥用于后续实验。
烘烤处理方法[21]:将元宝枫样品干粉以薄层形式平铺于容器,置于180 ℃预热后的鼓风烘箱分别放置5、15、30 min,烘烤后样品粉末重新冷冻干燥用于后续实验。
1.2.2 酚类物质提取 热处理后元宝枫叶与花干粉中酚类成分提取以前期优化的超声波辅助乙醇提取法进行[10]。提取重复三次,最终将三次提取所得上清液定容后用于后续检测。
1.2.3 总酚含量测定 总酚的测定采用优化后的福林酚法[22]。将40 μL 25%的福林酚试剂加入96 孔板,随后分别加入20 μL 的标准品(10~400 mg/L 没食子酸,R2=0.999)、不同浓度样品及空白溶液。混匀后加入140 μL 700 mmol/L Na2CO3溶液,再次混匀后40 ℃避光孵育30 min,使用多功能酶标仪在765 nm 波长下测定吸光度,以没食子酸浓度为横坐标(x),吸光度值(OD)为纵坐标(y),建立标准曲线。根据标准曲线读出被测样品溶液中没食子酸含量,结果表示为没食子酸当量,表达为mg GAE/g d.w.。
1.2.4 抗氧化活性测定
1.2.4.1 DPPH·清除能力测定 DPPH·清除实验参照Brand-Williams 等[23]的方法并稍加修改。10 μL标准品(0~400 mg/L Trolox,R2=0.998)、样品和空白溶液分别加入96 孔板,随后加入40 μL 浓度1 mmol/L的DPPH 溶液与190 μL 甲醇溶液,混匀后室温避光孵育30 min。随后以酶标仪在517 nm 处测定吸光度。自由基清除活性RSA(%)=(A0-AS)/A0×100,A0:空白溶液吸光度值,AS:样品溶液吸光度值,以Trolox 浓度为横坐标(x),自由基清除率(RSA)为纵坐标(y),建立标准曲线。根据标准曲线读出被测样品溶液中Trolox 浓度,结果表示为Trolox 当量(μmol TE/100 g d.w.)。
1.2.4.2 ABTS+·清除能力测定 ABTS+·清除实验参照文献[24]报道方法,并稍作修改。将7 mmol/L的ABTS 水溶液与2.4 mmol/L 的K2S2O8水溶液等量混合,于室温条件下,避光孵育12~16 h。随后,以甲醇溶液将上述储液稀释到波长734 nm 处吸光度为0.70±0.02 范围内,即得ABTS 工作液。将5 μL的标准品(0~800 mg/L Trolox,R2=0.999)、样品或空白溶液分别加到96 孔板中,然后各加入200 μL ABTS 工作液。在30 ℃的黑暗条件下孵育5 min后,随后以酶标仪于734 nm 处测定其吸光度。自由基清除活性RSA(%)=(A0-AS)/A0×100,A0:空白溶液吸光度值,AS:样品溶液吸光度值,以Trolox 浓度为横坐标(x),自由基清除率(RSA)为纵坐标(y),建立标准曲线。根据标准曲线读出被测样品溶液中Trolox 浓度,结果表示为Trolox 当量(μmol TE/100 g d.w.)。
1.2.4.3 氧自由基吸收能力(ORAC)测定 ORAC实验参照Ou 等[25],实验所需试剂均用75 mmol/L 的磷酸盐缓冲液(pH7.4)进行溶解,实验全程避光。将25 μL 标准品(Trolox 5~50 μmol/L,R2=0.995)、样品和空白溶液分别加入96 孔板,加入75 μL 的荧光素(0.20 μmol/L),混匀后37 ℃孵育15 min。随后,分别加入100 μL 37 ℃预热AAPH 溶液,放入37 ℃预热的多功能酶标仪中测定,激发光为530 nm,发射光为485 nm。每1.5 min 记录一次数据,共记录75 min。标准品和样品的净面积为标准品溶液或样品溶液的曲线下面积减去空白溶液的曲线下面积。以Trolox 浓度为横坐标(x),曲线下面积(AUC)为纵坐标(y),绘制标准曲线,根据标准曲线读出被测样品溶液中Trolox 浓度,结果表示为Trolox 当量(μmol TE/100 g d.w.)。
1.2.5 高效液相色谱(HPLC)测定10 种主要酚类单体含量 色谱条件:色谱柱为Dikma Diamonsil C18(5 µm,250×4.6 mm i.d.)反相色谱柱,柱温箱温度设为30 °C,流速1.0 mL/min,单次进样量为10 µL,流动相A 为含有0.4%甲酸的水溶液,流动相B 为乙腈。紫外检测器波长设定为280 nm,梯度洗脱条件见表1。

表1 元宝枫叶与花中的单体酚类化合物HPLC梯度洗脱条件Table 1 Gradient elution conditions for phenolic compounds of Acer truncatum leaves and flowers
标准品溶液制备:为了检测元宝枫叶与花内酚类单体物质的变化规律,包括没食子酸、没食子酸乙酯、1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖、新绿原酸、山奈酚-3-O-鼠李糖苷、槲皮素-3-O-阿拉伯吡喃糖苷、槲皮素-3-O-半乳糖苷、槲皮素-3-O-葡萄糖苷、槲皮素-3-O-鼠李糖苷、以及杨梅素-3-O-鼠李糖苷在内的10 种标准品混标储备液由66%乙醇配制并进行线性检测。混标溶液由上述相同HPLC 条件检测。由此高效液相法测得10 种酚类单体含量之和为液相法测定所得总酚含量(TPLC)。
1.3 数据处理
主成分分析(PCA)及聚类分析使用SIMCA 软件(版本14.0)进行。本文涉及数据以平均值±标准差(SD)表示,统计学重复至少为3 次。使用SPSS软件(版本22.0)单因素方差分析(one-way ANOVA)中的Tukey’s HSD 检验确认统计学是否存在显著差异,P<0.05 被设定为存在显著差异。
2 结果与分析
2.1 不同热处理前后总酚含量的变化
首先对热处理前后元宝枫叶与花的总酚含量分别进行测定,以观测热处理对福林酚法测得总酚含量(TPFC)的影响。如图1A 所示,未处理元宝枫叶的TPFC 为75.80±3.54 mg GAE/g,而蒸制及微波处理并未导致其含量产生显著性变化(P>0.05)。但三个烘烤时间处理均使得元宝枫叶的TPFC 相较于未处理组显著提高(82.55±2.54~87.78±1.53 mg GAE/g)(P<0.05),其中LB30 的TPFC 含量最高,为L0 的1.16 倍。而未处理元宝枫花样品的TPFC 为90.11±1.84 mg GAE/g,其中各样品组之间总酚含量均未产生显著性变化(P>0.05)。以液相色谱法测定得到各酚类单体含量,求和得到液相法总酚含量(TPLC),并与TPFC 进行比较探究其所占份额。总体而言,TPLC 构成了TPFC 含量的主体部分,在未处理及任一处理组别中均占比84%以上(图1B)。从整体含量上来看,30 min 蒸制、微波以及烘烤处理均造成元宝枫叶中TPLC 含量显著增加(图1C)(P<0.05)。而在元宝枫花中,FS10、FB5 中TPLC 含量显著提高,而FM10 中TPLC 显著降低(图1D)(P<0.05)。蒸制、微波和烘烤三种热处理都存在加剧破坏细胞壁从而利于酚类物质的释放的能力,并在高温下分子运动加快,从而形成更多游离的酚类化合物[26]。

图1 不同热处理条件下元宝枫叶(A、C)、花(B、D)的总酚含量变化Fig.1 Variation of total phenolic contents of Acer truncatum leaves (A,C)and flowers (B,D)upon different thermal treatments
2.2 不同热处理前后酚类单体化合物的变化
纵使总酚含量近似,热处理仍可能导致不同酚类单体化合物含量产生变化从而改变其酚类组成。由此,对前期工作筛选得到的元宝枫叶与花中共同存在的10 种高表达酚类单体化合物进行测定(表2),以观察主要酚类单体受热处理影响的变化趋势[11]。如表2 所示,标准曲线在检测范围内均具有较高的线性相关性(R2>0.998)。
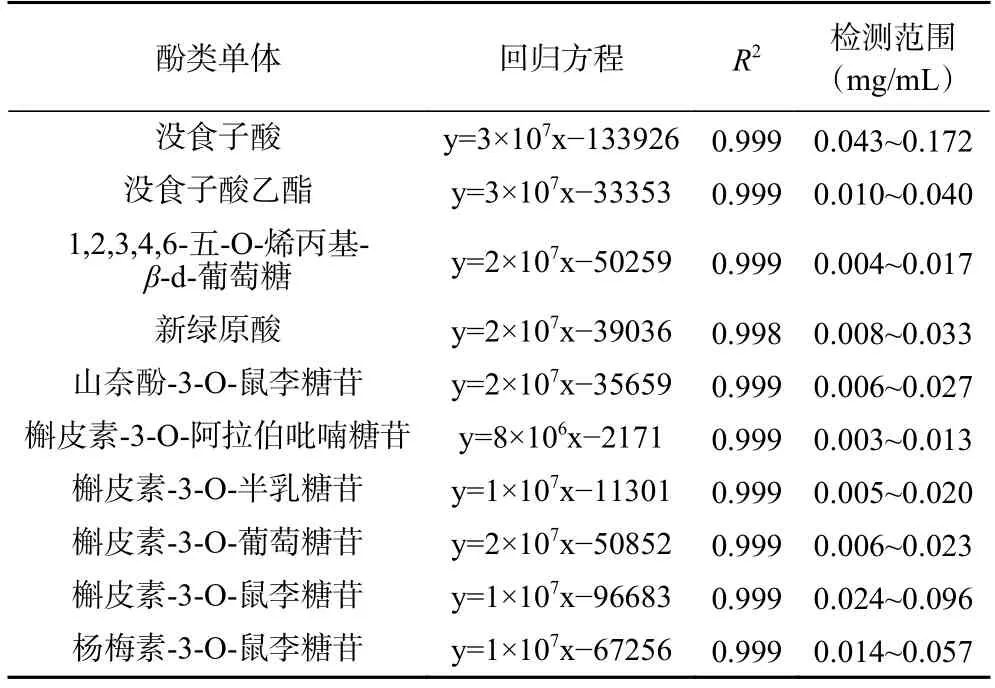
表2 元宝枫叶与花中10 种主要酚类单体高效液相色谱测定中的回归方程、模型决定系数和检测范围Table 2 Regression equations,determination coefficients and linear ranges of the ten major phenolics from Acer truncatum leaves and flowers
如图2 所示,未处理元宝枫叶中黄酮醇类化合物含量最高,其中的杨梅素-3-O-鼠李糖苷、槲皮素-3-O-鼠李糖苷、山奈酚-3-O-鼠李糖苷含量分别达到15.95±1.39、10.98±1.07、10.78±1.16 mg/g。没食子酸类物质中,1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖与没食子酸乙酯含量分别达到11.3±0.57 与7.37±0.61 mg/g,而新绿原酸含量为3.01±0.11 mg/g。包括没食子酸、没食子酸乙酯、1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖在内的没食子酸类物质含量在三种热处理方法中均有不同程度上升。具体来说,没食子酸类化合物含量随着蒸制时间增长而进一步提升(图2A 中酚类单体1~3),而较长时间的微波或烘烤处理反而导致其含量增加幅度有所降低(图2B、图2C 中酚类单体1~3)。新绿原酸除在LB30 中含量显著性下降外(P<0.05),其余加热组与未处理样品均无明显变化(图2 中酚类单体4)。黄酮醇类化合物变化趋势较为复杂,其中山奈酚-3-O-鼠李糖苷、槲皮素-3-O-阿拉伯吡喃糖苷、槲皮素-3-O-葡萄糖苷、杨梅素-3-O-鼠李糖苷含量不变或稍有下降(图2 中酚类单体5、6、8、10),而槲皮素-3-O-半乳糖苷与槲皮素-3-O-鼠李糖苷含量显著上升(图2 中酚类单体7、9)(P<0.05)。
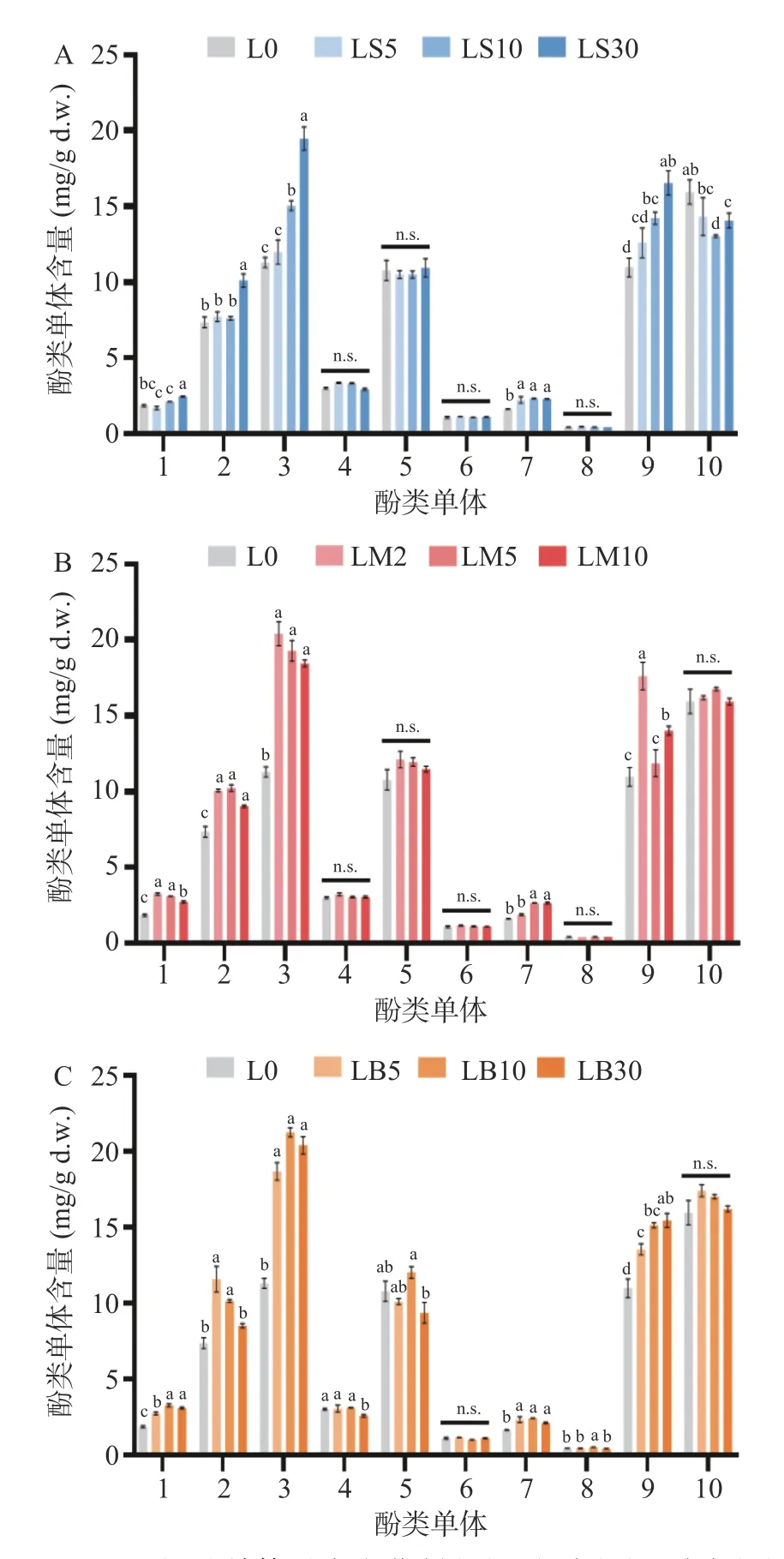
图2 元宝枫叶单体酚类在蒸制(A)、微波(B)、烘烤(C)下的含量变化Fig.2 Variation of phenolic compounds of Acer truncatum leaves upon steam (A),microwave (B),and baking (C)treatments
如图3 所示,在未处理元宝枫花中没食子酸类物质含量最高,其中1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖与没食子酸乙酯含量分别达到30.62±1.63 与13.46±1.71 mg/g。黄酮醇类含量次之,其中山奈酚-3-O-鼠李糖苷与槲皮素-3-O-半乳糖苷最高,分别为7.09±0.25 与5.58±0.76 mg/g,而新绿原酸含量仅为0.64±0.08 mg/g。元宝枫花样品中没食子酸与1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖含量同样整体呈上升趋势,但没食子酸乙酯含量几乎不变或反而有所下降(图3 中酚类单体1~3)。元宝枫花和叶中没食子酸含量的增加可能是由于加热过程中单宁酸或其它成分发生水解导致[27]。而微波热处理则显著提高了元宝枫花中的新绿原酸含量(P<0.05),且提高幅度与时间长度呈正相关(图3B 中酚类单体4)。花中多数黄酮醇单体含量呈下降趋势,仅有部分单体在特定处理时间下含量显著上升(P<0.05),如FS10、FM5、FB10 中的槲皮素-3-O-鼠李糖苷(图3 中酚类单体9)。从整体趋势上来看,元宝枫花内单体酚类变化趋势相较于元宝枫叶相对平缓。
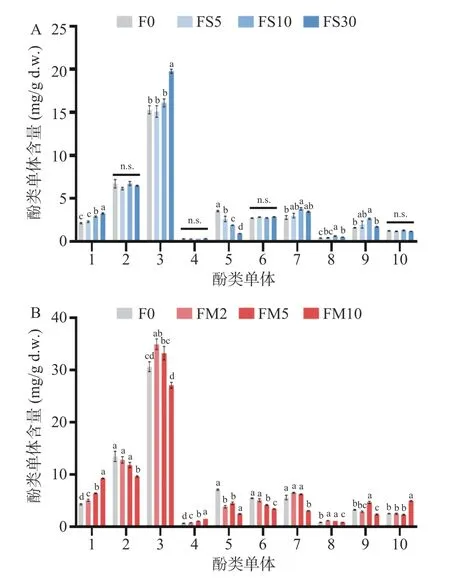
图3 元宝枫花单体酚类在蒸制(A)、微波(B)、烘烤(C)下的含量变化Fig.3 Variation of phenolic compounds of Acer truncatum flowers upon steam (A),microwave (B),and baking (C)treatments
2.3 不同热处理前后抗氧化活性的变化
自由基导致的氧化应激是细胞内的重要事件,与包括癌症、心血管疾病、帕金森病和自身免疫性疾病在内的多种退行性疾病密切相关,因此抗氧化剂在预防及干预上述疾病过程中具有重要意义[28]。抗氧化活性是酚类及黄酮类化合物的特征活性之一,为了对不同处理下元宝枫叶与花的抗氧化能力进行综合评价,以三种不同的检测方法对各热处理组样品进行测定。
如图4 所示,未处理元宝枫叶与花在DPPH、ABTS、ORAC 三组评价体系下分别具有接近的Trolox当量,具体数值为690.18±14.21~800.94±44.52 μmol TE/100 g d.w.与1065.55±22.67~1211.06±13.20 μmol TE/100 g d.w.。DPPH 法测定结果显示叶与花的DPPH 法测定结果变化趋势近似,蒸制与烘烤导致叶与花的DPPH 值整体不变或下降(图4A~图4B,图4E~图4F),但微波法整体导致DPPH 值呈不依赖于处理时间的交错上升(图4C、图4D)。然而ABTS 值的变化趋势在叶与花中并不一致,蒸制热处理导致叶的ABTS 值呈时间依赖性显著上升(图4A),但花中的ABTS 值不变或显著性下降(图4B)。与之相反,微波导致叶中ABTS 值不变或下降(图4C),而FM10 中ABTS 值显著提高(图4D)(P<0.05)。ORAC 法测定结果显示,三种热处理方法均造成了处理后样品ORAC 值的显著上升。值得注意的是,过长时间的烘烤处理(30 min)导致元宝枫叶与花中ORAC 值上升幅度相较于10 min 烘烤处理显著下降,表明抗氧化活性物质存在复杂的变化(图4E、图4F)。
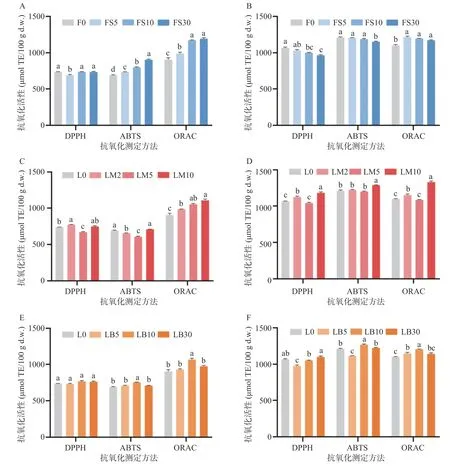
图4 不同热处理条件下元宝枫叶(A,C,E)与花(B,D,F)的抗氧化活性变化Fig.4 Variation of antioxidant capacities of Acer truncatum leaves (A,C,E)and flowers (B,D,F)upon different thermal treatments
2.4 总酚和主要单体酚类含量的主成分及聚类分析
以总酚及单体含量为观测值对不同热处理组进行主成分分析(PCA)以及聚类分析(HCA),以检验样品之间差异情况并直观评价样品分类合理性。基于元宝枫叶与花模型汇总拥有最高贡献率的两个主成分建立投影,分别得到对应散点图(图5A、图6A)、载荷图(图5B、图6B),并对各组数据进行聚类分析(图7)。如图5A 所示,基于其总体与单体酚类成分差异,元宝枫叶在不同处理之间存在较好区分。与此同时,在相同处理的不同时长上,不同处理组间同样存在区分。如蒸制处理中,由L0 到LS5 与LS10,样品点分布由第2 象限移至第3 象限,而由LS10 到LS30,样品点移动至趋近原点中心。图5B 所示载荷图中各数据点距离原点中心的距离表明各单体酚类及总酚含量对于组间差异影响程度贡献大小。其中LB15 与槲皮素-3-O-半乳糖苷、山奈酚-3-O-鼠李糖苷同属于第4 象限,显示槲皮素-3-O-半乳糖苷、山奈酚-3-O-鼠李糖苷在LB15 中含量较高并贡献于其与其他组样品的区分。而LB30 与杨梅素-3-O-鼠李糖苷及TPFC 同处于第二象限,显示杨梅素-3-O-鼠李糖苷含量变化所导致的总酚含量变化可能贡献于LB30 的区分度。

图5 不同热处理条件下元宝枫叶主成分分析得分图(A)与载荷图(B)Fig.5 Scoring (A)and loading (B)plot of principle components analysis on the variation of Acer truncatum leaves upon different thermal treatments

图6 不同热处理条件下元宝枫花主成分分析得分图(A)与载荷图(B)Fig.6 Scoring (A)and loading (B)plot principle components analysis on the variation of Acer truncatum flowers upon different thermal treatments
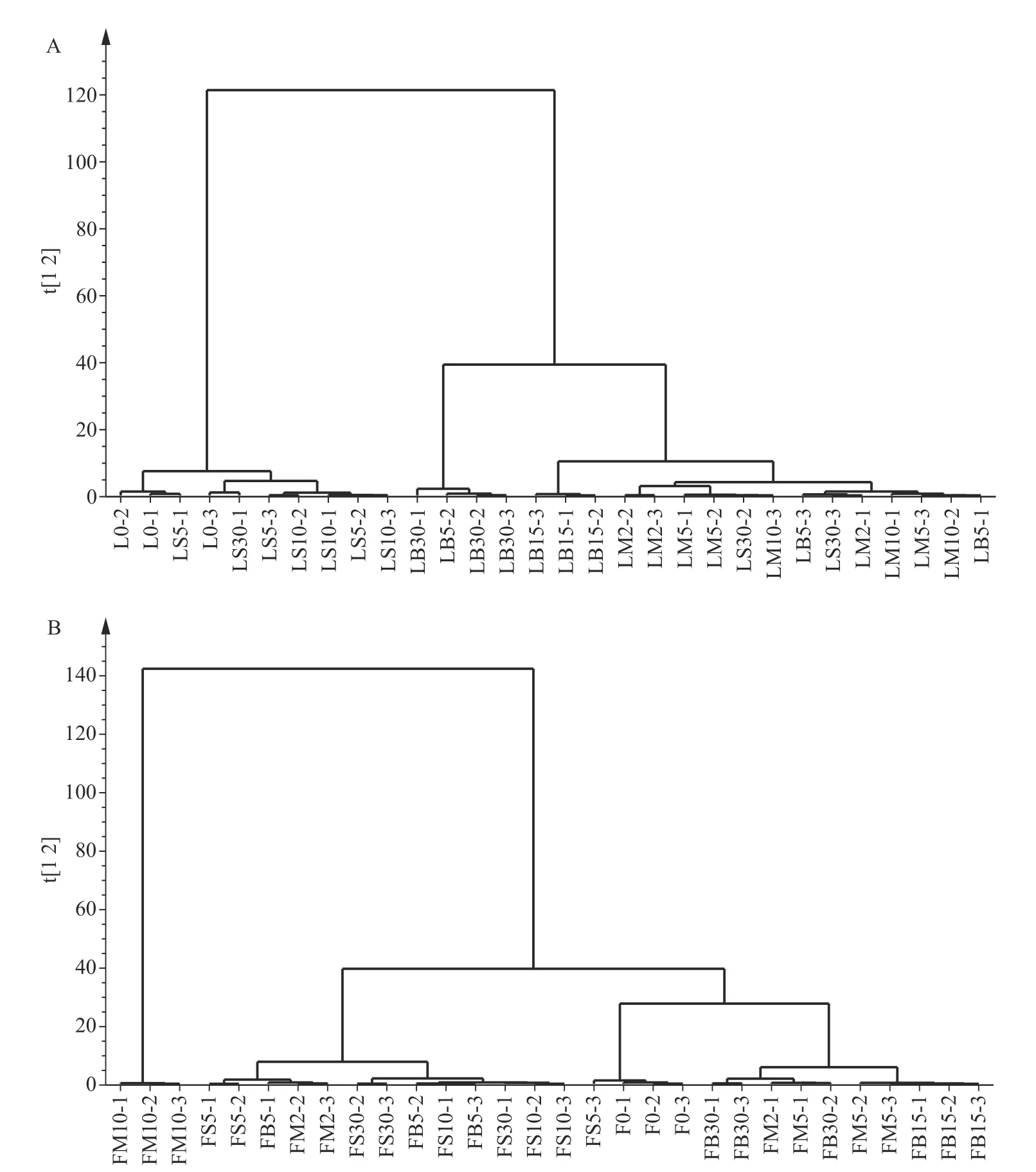
图7 不同热处理条件下元宝枫叶(A)与花(B)主成分分析的聚类分析图Fig.7 Hierarchical clustering plot of principle components analysis on the variation of Acer truncatum leaves (A)and flowers (B)upon different thermal treatments
如图6A 所示,除FM10 外,不同处理下的元宝枫花样品间存在交叉较多,这符合花中酚类成分在不同处理下含量变化较少的前期结果。如图6B 所示,FM10 与其中含量较高的没食子酸、新绿原酸、杨梅素-3-O-鼠李糖苷一同被归属于第4 象限。
样品聚类分析(HCA)结果如图7 所示,具有接近分类距离样品被归为一类。元宝枫叶聚类结果如图7A 所示,L0 与LS5、LS10 聚类为第I 大类,而剩余样品聚类为第II 大类。第II 聚类中LB30 组与其它组具有明显的分类距离从而被单独归为一小类。上述结果显示短时间蒸制处理对于元宝枫叶内酚类成分及抗氧化活性改变较小,而长时间烘烤处理造成独特的转变。如图7B 所示,FM10 单独聚为第I 大类,而剩余样品组成的第II 大类可进一步被划分为三小类。具体来说,F0 为第一小类,FB15、FB30、FM5 为第二小类,FM2、FB5 与蒸制样品为第三小类。上述结果说明长时间微波处理造成元宝枫花中酚类成分转变幅度最大。
2.5 不同热处理前后总酚、单体酚类化合物含量及抗氧化活性水平的相关性分析
对测定所得的总酚、单体酚类化合物含量,以及抗氧化活性水平在各组热处理之间的相关性进行分析。结果如图8A 所示,元宝枫叶中福林酚法测得总酚(TPFC)与没食子酸与1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖呈显著正相关(P<0.05),而液相色谱法测得总酚(TPLC)与包括没食子酸、没食子酸乙酯,以及1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖在内的没食子酸类物质呈极显著正相关(P<0.01),表明没食子酸类物质是元宝枫叶中酚类的重要组成。除此之外,槲皮素-3-O-鼠李糖苷与DPPH 值显著正相关,而槲皮素-3-O-半乳糖苷与ORAC 值显著正相关(P<0.05),说明槲皮素类物质对于抗氧化活性起主要贡献。如图8B 所示,上述含量与水平在元宝枫花中分主要为两大类。其中,新绿原酸与DPPH、ABTS 两种抗氧化水平呈显著正相关,而杨梅素-3-O-鼠李糖苷与ORAC 水平显著正相关(P<0.05),反应上述两种单体化合物在元宝枫花的抗氧化活性变化中起主导作用。而槲皮素-3-O-阿拉伯吡喃糖苷、槲皮素-3-O-半乳糖苷、1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖、以及TPLC 含量与DPPH、ABTS 两种抗氧化水平呈显著负相关(P<0.05),说明上述成分在元宝枫花的热处理过程中可能是主要的降解成分,所生成的其他物质具有更高的抗氧化能力。

图8 不同热处理条件下元宝枫叶(A)与花(B)酚类成分及抗氧化活性之间相关性热图Fig.8 Correlation heat map of phenolic constitutions and antioxidant levels of Acer truncatum leaves (A)and flowers (B)among different thermal treatments
3 讨论
本文对元宝枫花与叶进行多种短时间处理以模拟食品生产过程中的热加工手段,从而表征其对样品中酚类成分及抗氧化活性的影响。研究结果显示,元宝枫叶与花在多数热处理下总酚含量未产生显著性变化。即使总酚含量相同,后续研究发现元宝枫叶与花中酚类组成及抗氧化活性变化并不相同。Rodriguez-Mateos 等[17]探究了烹饪、发酵和烘烤对于野生蓝莓中酚类成分的影响,结果同样显示总体酚类含量不变而多种单体成分含量具有显著差异。
虽然前期工作表明元宝枫叶与花中具有相近的单体酚类组成[11],但本文发现在相同热处理中叶与花酚类含量变化呈现不同的规律,没食子酸类化合物在三组元宝枫叶热处理样品中均显著升高,而元宝枫花中酚类单体变化趋势整体相较于叶更为平缓。叶与花中抗氧化活性成分的差异化改变可能与叶与花的基质组成与结构不同有关。滕红梅等[29]通过解剖叶片发现,元宝枫叶细胞整体呈长柱形,排列紧密,且具有海绵组织及2~3 层栅栏薄壁组织,从结构层面印证了元宝枫叶对于热处理反应较不敏感的原因。
据研究报道,热处理可导致存在于食品基质中的高分子量聚合物产生降解,从而释放构成聚合物的低分子量亚基,并且这些低分子量化合物常具有较高的生物活性及吸收效率[30-31]。本研究中,元宝枫叶与花内没食子酸类化合物含量在热处理后均有较大幅度的提升。没食子酸及其衍生物作为水解单宁的基本构成单元,经不断聚合形成没食子单宁,在槭树中广泛存在[32]。由此,本文中新生成的没食子酸类化合物推测为由没食子单宁在加热环境中经水解产生,上述没食子酸水解过程在Lu 等[33]、Munteanu 等[34]和Kim 等[35]的研究中均有报道。
不同处理对于抗氧化水平造成不同影响,ORAC 水平在多数元宝枫叶与花热处理后显著提高。ORAC 法测定一段时间内抗氧化剂对于过氧自由基胁迫的实时动态保护能力,相较于DPPH 与ABTS 法单一时间点清除率的计算模式而言能够更全面与准确描述抗氧化活性[34]。Zhang 等[15]测定了紫茄在热处理过程中的酚类及抗氧化活性变化,结果显示其中没食子酸含量在多种处理中均有提升,但DPPH 与ABTS 法测定的抗氧化活性却均呈下降趋势,本研究结果与其一致。
主成分及相关性分析显示,没食子酸类衍生物含量的变化与TPFC 及TPLC 含量变化显著相关,再次说明高温导致的没食子酸单宁类物质的降解生成了以没食子酸、没食子酸乙酯,以及1,2,3,4,6-五-O-烯丙基-β-d-葡萄糖为代表的的小分子衍生物[35-36]。整体而言,在叶与花中不同酚类单体对于整体抗氧化活性具有差异化贡献。
4 结论
本研究对元宝枫花与叶进行多种短时间热处理以模拟食品热加工手段,从而表征样品中酚类成分及抗氧化活性的动态变化。结果显示,不同热处理方法造成的影响之间差异明显。此外,元宝枫叶与花的总酚含量变化不大,而其中酚类单体成分变化显著。于此同时,以ORAC 水平为代表的抗氧化能力在多数元宝枫叶与花热处理后显著提高。综上所述,热处理方式与加热时间对于元宝枫叶与花中的酚类组成及抗氧化能力具有不同影响,因此选择合适的热处理条件对于其生物活性及商品价值的提升尤为重要。作为食品资源而言,元宝枫叶在热处理过程中的酚类组成改变及抗氧化活性提成表现优于元宝枫花,本研究为元宝枫叶与花在食品领域的加工处理与深入开发提供了理论基础。

