超高压辅助酶解对汉麻分离蛋白结构和抗氧化活性的影响
刘容旭,王语聪,刘金阳,谢宜桐,谢智鑫,种正晨,李世函,刘丹怡,*,韩建春,*
(1.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028;2.东北农业大学食品学院,黑龙江哈尔滨 150030;3.中国储备粮管理集团有限公司黑龙江分公司,黑龙江哈尔滨 150006)
汉麻(Cannabis sativaL.)属荨麻目、汉麻种的一年生草本植物,又名大麻、火麻等[1]。汉麻存活能力较强,在我国各地都能种植,其中以广西巴马汉麻种植及食用历史最为悠久[2]。汉麻蛋白中含有8 种人体必需氨基酸[3],其中组氨酸和精氨酸的含量比较高,被认为是一种适合老年人和婴儿的优质蛋白[4]。汉麻蛋白质除氨基酸种类及含量丰富外还具有增强免疫力、抗氧化、抗疲劳、降血糖、维持肠道菌群平衡等作用,是一种多功效植物蛋白资源[5-6]。但汉麻蛋白质溶解度较低,功能性质较差[7],导致其难以作为原辅料应用于食品及营养保健品生产中,因此,有必要通过某些技术手段改善其功能特性以更好地开发利用汉麻蛋白,提升其市场竞争力。
利用超高压(ultra-high pressure,UHP)辅助酶解技术处理蛋白质,会使蛋白质结构以及功能性质发生改变[8-9],实现蛋白质功能性质多元化的同时,也解决了目前酶解改性技术存在的酶解过程随机、酶利用率低和酶解效率低等问题[10],提高其应用价值。研究表明压力的施加会使蛋白质构象改变,发生多肽链的伸展和立体结构的松散并且巯基含量及表面疏水性等也会发生变化[10-11],若在超高压环境下进行酶解反应,会使蛋白质结构进一步改变进而影响酶与底物之间的酶解效应,从而表现蛋白质功能性质的改善、酶解进程加快以及水解度的有效提高[12-13]。因此,利用超高压辅助酶解反应改性汉麻分离蛋白(hemp protein isolate,HPI),探究HPI 潜在功能性价值,对充分开发利用植物蛋白资源十分重要。
前期基础研究已经确认超高压辅助酶解反应的最优条件:加酶量(复合蛋白酶)5000 U/g、酶解改性pH8.0、酶解改性温度55 ℃、酶解改性时间50 min。在此基础上本研究利用超高压辅助酶解反应对HPI进行改性处理,探究改性后HPI 结构特性的变化,以及对其抗氧化活性功能的影响,对指导实际生产和充分利用HPI 资源具有重要的现实意义。
1 材料与方法
1.1 材料与仪器
汉麻分离蛋白(食品级96%)黑龙江省大庆市星火牧场;氢氧化钠、铁氰化钾 天津凯通化学试剂有限公司;磷酸氢二钠、磷酸二氢钠 天津市光复科技发展有限公司;甘氨酸 上海吉至生化科技有限公司;乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)Amesco 分子生物试剂;复合蛋白酶(试剂级)、考马斯亮蓝G-250、牛血清蛋白三羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)北京Solarbio 科技有限公司;三氯乙酸 北京京土恒盛商贸有限公司;三氯化铁 台山市粤侨试剂塑料有限公司;硫酸亚铁 国药集团化学试剂有限公司;水杨酸天津市化工三厂有限公司;过氧化氢 上海凌峰化学试剂有限公司;8-苯胺-1-萘磺酸(8-Anilino-1-naphthalenesulfonic Acid,ANS)Sigma 公司;以上试剂均为分析纯。
HHP-400 超高压设备 沈阳人和机电工程设备有限公司;FD5-3 型冷冻干燥机 美国SIM 公司;8400s 傅立叶变红外光谱仪 日本岛津公司;721 型分光光度计 日立科学仪器(北京)有限公司;HH-4 型数显恒温水浴锅、DF-1 集热式磁力搅拌器 金坛市双捷实验仪器厂;DYCZ-40D 型转印电泳仪北京六一仪器厂;721 型分光光度计 上海元析仪器有限公司;PT-3502G 型酶标仪 北京普天新桥技术有限公司;PHS-3C 型pH 计 梅特勒-托利多仪器有限公司;Sartorius BSA223S 型电子天平 赛多利斯科学仪器(北京)有限公司;GZX-9140MBE 型电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;L-8900 氨基酸分析仪 天美(中国)科学仪器有限公司。
1.2 实验方法
1.2.1 超高压辅助酶解反应条件 配制50 g/L 的汉麻蛋白溶液,用1 mol/L NaOH 溶液调节溶液pH 至最适值。随后加入蛋白酶与上述溶液混匀,将此蛋白溶液密封在聚氯乙烯袋中,放入HHP-400 超高压设备中于不同压力(0.1、100、200、300 MPa)下,在设定温度中进行酶解改性反应单因素实验,以溶解度及水解度为判定指标,筛选出最适酶解反应条件。水解物经FD5-3 型冷冻干燥机进行冻干得到蛋白样品。经前期基础研究确定,最佳酶解反应条件为:复合蛋白酶加酶量5000 U/g、改性pH8.0、改性温度55 ℃、改性时间50 min,此条件下HPI 的溶解度达到83.55%,水解度达到10.5%[14]。
1.2.2 SDS-PAGE 电泳分析 参考文献[15]方法,略有改动。分别选取分子量范围在14.4~97.4 kDa以及3.3~31 kDa 的蛋白质标准品用于原蛋白质与改性蛋白质样品电泳分析。制样:将蛋白质样品配制成浓度为2 mg/mL 的溶液,加入蛋白上样缓冲液(含β-巯基乙醇),混匀后,沸水浴5 min,上样量为10 μL。制胶:配制12%分离胶、5%浓缩胶用于原蛋白质电泳分析以及20%分离胶、10%夹层胶、4%浓缩胶用于改性蛋白质电泳分析,配制完成后,分别依次注入两板之间,插入梳子等待凝胶形成。电泳:上层胶电压80 V,时间30 min,下层胶电压120 V,时间100 min(原蛋白);30 V 跑1~2 h 后,待指示前沿到达分离胶时,调至100 V,跑5~6 h(改性蛋白样品)。染色与脱色:使用考马斯亮蓝R-250 进行染色,染色时间控制在20 min 左右,染色结束后使用脱色液(冰醋酸10%,甲醇30%)脱色至条带清晰。
1.2.3 表面疏水性的测定 参考文献[16]方法,略有改动。用0.01 mol/L 的磷酸盐缓冲液(pH7.0)将蛋白质样品稀释至0.025~0.02 mg/mL,配制8 mmol/L 8-苯胺基-1-萘磺酸(ANS)溶液作为荧光探针。分别取稀释样品5 mL 与ANS 溶液50 μL 混合均匀后避光反应20 min,使用荧光分光光度计测定其荧光强度,测试所用激发波长、发射波长分别为390 nm、470 nm,空白对照为缓冲液与ANS 混合溶液。蛋白质的表面疏水性为蛋白质浓度与荧光强度拟合回归方程的斜率。
1.2.4 汉麻分离蛋白结构分析
1.2.4.1 氨基酸含量及组成分析 取冻干蛋白质样品0.1 g 于水解管中,加入10~15 mL 6 mol/L HCl,将水解管置于冷冻剂中,充氮气保护,在鼓风干燥箱(110 ℃)中水解22 h 后,将水解液定容至50 mL,准确吸取1 mL 于试管中,待干燥完全后,用1 mL 柠檬酸钠缓冲溶液(pH2.2)复溶,过滤后上样,采用氨基酸自动分析仪进行分析[17]。
1.2.4.2 傅立叶红外光谱分析 参考文献[18]方法,略有改动。将待测样品在干燥器内用P2O5干燥两星期备用。先将溴化钾置于烘箱(105 ℃)烘干后压成薄片,将其放入载片槽中使用红外光谱仪进行分析参比。再称取20 mg 蛋白质样品与KBr 粉末(比例为1:100)混匀后放入研钵中充分研磨,压成薄片,利用傅立叶红外光谱仪进行全波段扫描(400~4000 cm-1),分辨率4 cm-1。
1.2.4.3 巯基含量的测定 参考文献[19]方法,略有改动。游离巯基的测定:将蛋白质样品配制成10 mg/mL 的溶液,取1 mL 与pH8.0 的Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L 甘氨酸、8 mol/L 尿素、0.04 mol/L EDTA)5 mL 于EP 管中,加入4 mg/mL 的DTNB 溶液0.04 mL,混合均匀后于室温下静置反应20 min,在412 nm 处测量其吸光度值记为A412。
表面巯基的测定:将蛋白质样品配制成10 mg/mL 的溶液,取1 mL 与pH8.0 的Tris-甘氨酸缓冲液(0.086 mol/L Tris、0.09 mol/L 甘氨酸、0.04 mol/L EDTA)5 mL 于EP 管中,混合均匀后于室温下静置反应20 min,在412 nm 处测量其吸光度值记为A412。计算公式如下:
式中:A412表示412 nm 处的吸光值;D 表示稀释倍数;ε表示消光系数,13600 mol-1/cm;C 表示样品浓度,mg/mL。
1.2.4.4 内源荧光光谱分析 参考文献[20]方法,略有改动。将蛋白质样品用0.01 mol/L、pH7.0 磷酸盐缓冲液配制成浓度为1 mg/mL 的溶液,取1 mL 置于四通比色皿中,利用荧光分光光度计进行内源荧光光谱扫描,设置激发波长、发射波长分别为295 nm、310~450 nm,扫描速度1200 nm/min,以磷酸盐缓冲溶液为空白对照。
1.2.5 汉麻分离蛋白抗氧化活性的测定
1.2.5.1 DPPH 自由基清除率测定 参考文献[21]方法并略作改动,称取DPPH 粉末5 mg,在避光环境下使用适量无水乙醇充分溶解,再定容至100 mL,配制成50 µg/mL 的DPPH 溶液,该溶液现用现配。按照表1 添加溶液,分别充分混合均匀后,室温避光反应30 min,于波长517 nm 处采用酶标仪测定吸光度,计算公式如式(2)。
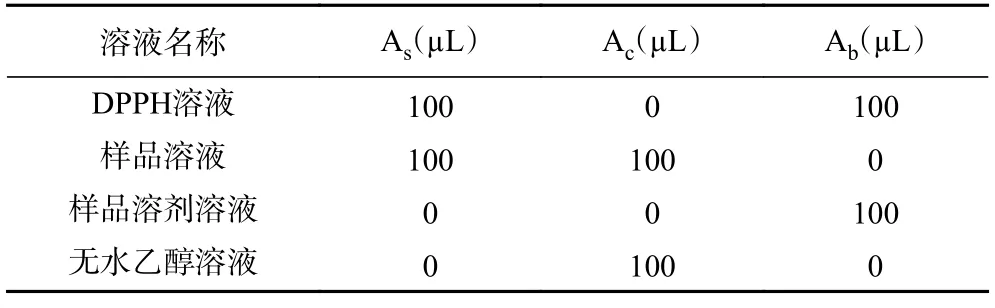
表1 DPPH 自由基清除活性测定各试剂添加量Table 1 DPPH free radical scavenging activity determination of reagent addition amount
式中:As表示样品与DPPH 混合液吸光值;Ac表示样品与无水乙醇混合液吸光值;Ab表示蒸馏水与DPPH 混合液吸光值。
1.2.5.2 ABTS+自由基清除率测定 参考文献[22]方法并略作改动,称取ABTS 200 mg,过硫酸钾34.4 mg,溶于50 mL 蒸馏水中,搅拌均匀,避光静置24 h 后,作为ABTS 母液。用95%乙醇将适量ABTS 母液稀释至吸光度值在0.7±0.02 内(OD734)待用,该溶液现用现配。按照表2 添加溶液,分别充分混合均匀后,室温避光反应5 min,在波长734 nm处采用酶标仪测定吸光度,计算公式如式(3)。
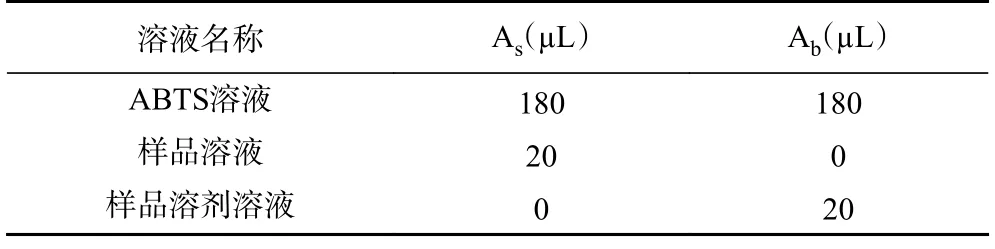
表2 ABTS+自由基清除活性测定各试剂添加量Table 2 ABTS+ free radical scavenging activity determination of reagent addition amount
式中:Ab表示蒸馏水与ABTS 混合液吸光值;As表示样品与ABTS 混合液吸光值。
1.2.5.3 还原能力测定 参考文献[23]方法并略作改动,分别配制PBS 缓冲溶液(0.2 mol/L)、铁氰化钾溶液(1%)、氯化铁溶液(0.1%)、三氯乙酸溶液(10%)。将一定浓度蛋白质样品溶液、PBS 缓冲溶液和铁氰化钾溶液按照1:1:5 比例混匀,于50 ℃水浴锅中静置20 min,然后室温下加入与样品溶液一致比例的三氯乙酸溶液,4000 r/min 离心10 min 后保留上清液。按照下表3 添加溶液,分别充分混合均匀后,于波长700 nm 处采用酶标仪测定吸光度,计算公式如式(4)。

表3 还原能力测定各试剂添加量Table 3 Reducing power determination of reagent addition amount
式中:A2表示样品与氯化铁混合液吸光值;A1表示蒸馏水与氯化铁混合液吸光值。
1.3 数据处理
采用IBM SPSS Statistics26 进行显著性分析(P<0.05);利用Statistic 8、Origin 2019 Pro 软件对数据进行分析及绘图,所有实验组均进行三次平行实验,数据采用平均值±标准差的形式表示。
2 结果与分析
2.1 超高压辅助酶解反应对HPI 电泳特性的影响
图1 为超高压辅助酶解反应前后HPI 凝胶电泳图,通过各条带对比进行汉麻分离蛋白酶解物分子量分析。由于改性后产物蛋白分子量有所降低,在标准凝胶电泳中条带呈现效果不佳,因此使用低分子量电泳对酶解产物分子量进行分析。由图1 可知,改性前后蛋白质的亚基组成发生明显改变,HPI 在电泳图中可见三条明显条带,最大分子量在34 kDa 左右,经酶解改性后,产物蛋白分子量明显降低,且压力的增加增大了HPI 的酶解程度,分子量降低更加明显,但不同压力处理下酶解产物条带的进样口附近均有聚集体存在,说明仍有一部分大分子量蛋白质未被酶解。
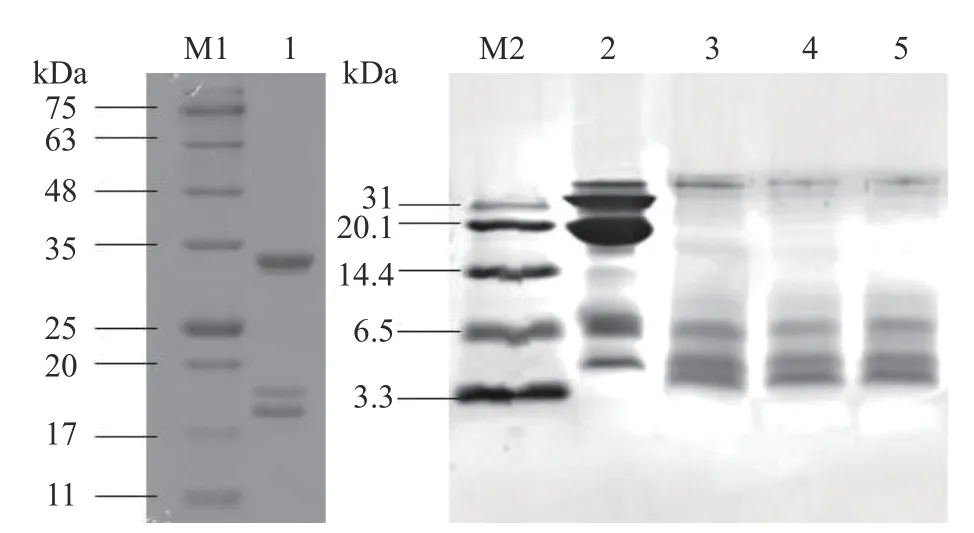
图1 不同压力下酶解产物的凝胶电泳图谱Fig.1 Gel electrophoresis patterns of enzymatic hydrolysis products under different pressures
2.2 超高压辅助酶解反应对HPI 表面疏水性的影响
表面疏水性表示蛋白质分子表面上疏水基团的数量,是判断蛋白质构象及功能性质变化的重要指标之一。当蛋白质结构发生伸展或折叠时,其表面疏水区域会随之暴露或埋藏,与乳化性、起泡性等有着紧密联系,通常蛋白质表面疏水性越强,蛋白质乳化性及起泡性越好[24]。如图2 所示为超高压辅助酶解反应对产物表面疏水性的影响,随着压力的增大,汉麻蛋白酶解产物(HPIH)的表面疏水性先升高后降低,在200 MPa 时表面疏水性最强,当压力升到300 MPa时有所下降,但仍高于未经水解HPI。这是因为蛋白质经过高压酶解后结构变得更加松散,肽链展开,使蛋白质分子疏水基团逐渐暴露,从而表面疏水性增强,然而300 MPa 压力处理时表面疏水性有所降低可能是因为在压力的作用下水解物重新聚集,使暴露于表面的疏水基团重新被隐藏于蛋白分子内部[25]。可见,超高压与酶解反应在提高HPI 表面疏水性方面存在着协同作用,表面疏水性的提高将会对酶解产物乳化性等功能性质产生有益影响。
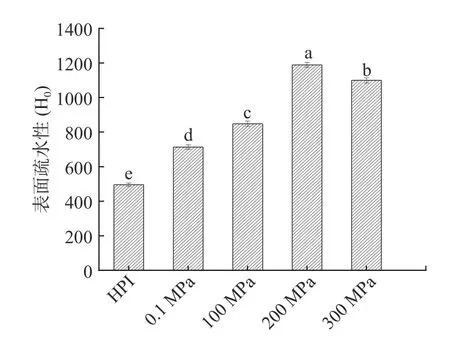
图2 超高压辅助酶解反应对HPI 表面疏水性的影响Fig.2 Effect of UHP combined enzymatic hydrolysis reaction on surface hydrophobicity
2.3 超高压辅助酶解反应对HPI 氨基酸组成及含量的影响
超高压辅助酶解改性前后HPI 氨基酸组成及含量如表4 所示。由于样品处理是使用酸水解法,色氨酸遭到破坏,故氨基酸组成与含量分析中不包括对色氨酸的分析。

表4 不同压力下酶解产物氨基酸含量Table 4 Amino acid content of enzymatic hydrolysis products under different pressures
氨基酸含量及组成决定了蛋白质的营养价值,由表4 可知,改性前后HPI 氨基酸组成不变且种类齐全,均含有17 种氨基酸,7 种必需氨基酸和10 种非必需氨基酸。而酶解产物总氨基酸含量存在不同程度下降。非必需氨基酸方面,对于食物中鲜味物质的呈现有着非常重要作用的谷氨酸和天冬氨酸含量较高[26],酶解产物的天冬氨酸含量在0.1、100、200、300 MPa 时分别降低了9.92%、11.55%、10.19%和10.73%;谷氨酸含量在0.1、100、200、300 MPa 时分别降低了10.57%、15.45%、6.50%和2.44%。另外,作为维持婴幼儿生长发育必不可少的精氨酸含量总体来说也十分丰富,虽然其含量在0.1、100、200、300 MPa 时分别降低了5.96%、1.70%、1.28%和3.09%,但仍远高于土豆蛋白、小麦蛋白与玉米蛋白等常见植物蛋白质中的精氨酸含量(2%~4%)[27]。必需氨基酸中,缬氨酸、异亮氨酸含量降低幅度较大,其中缬氨酸在0.1、100、200、300 MPa 时分别降低了7.07%、12.72%、7.77%和7.42%;异亮氨酸在0.1、100、200、300 MPa 时分别降低了7.45%、1.17%、12.16%和6.67%。由以上结果可知,虽然HPI 经超高压辅助酶解改性后各氨基酸存在不同程度损失,但整体来看酶解产物在营养价值方面仍具备一定优势,因此HPI 及HPIH 可以作为优质的植物蛋白质资源以提升其在食品加工应用中的附加值。
2.4 超高压辅助酶解反应对HPI 二级结构的影响
傅立叶红外光谱常被用于分析蛋白质中氨基酸基团变化情况,是探究蛋白质和多肽二级结构变化的重要手段。HPI 经超高压辅助酶解反应改性前后红外谱图如图3 所示,蛋白质在3288、2962、1631、1544、1447、1394、1246、1102 cm-1左右存在明显吸收峰,其中在3288 cm-1附近处的吸收峰为羟基伸缩振动,酰胺基团中的N-H 的伸缩振动;2962 cm-1附近的吸收峰为甲基、亚甲基中C-H 的对称和反对称伸缩振动;1631 cm-1附近处尖锐的吸收峰为酰胺Ⅰ带C=O 伸缩振动;1544 cm-1、1447 cm-1附近处为蛋白酰胺II 带中N-H 的弯曲振动;1394、1246 cm-1处吸收峰为酰胺Ⅲ带中C-N 伸缩振动;1102 cm-1处由C-O-C 伸缩振动引起[28]。从谱图中可以看出,与HPI 相比,不同压力下的HPIH 峰型由尖锐变得相对平缓,主要是经过酶解改性后产物中分子间氢键增多所致。酶解产物在不同波长下吸收峰的面积和峰形均存在一定差异,且随着压力的变化,峰位发生了不同程度的偏移,峰强度也发生改变,可见HPI 经超高压辅助酶解改性后结构发生了明显变化,从而影响了其理化及功能性质[29]。
2.5 超高压辅助酶解反应对HPI 三级结构的影响
巯基作为蛋白质一种重要的功能基团,属于维持蛋白质三级结构稳定的弱次级键,巯基含量变化与蛋白质结构改变及功能性质的改善密切相关。由图4 可知,与HPI 相比,酶解产物的表面巯基含量呈先上升后下降的趋势,200 MPa 以内的压力处理导致表面巯基含量升高,是由于在超高压酶解反应作用下多肽链更加伸展,使包埋在蛋白质内部的疏水基团及巯基基团暴露,因而表面巯基含量增加,当压力增加至300 MPa 时,蛋白质在高压环境下发生重折叠,使暴露于表面的巯基重新包埋于蛋白质分子内部,导致其含量降低。HPIH 游离巯基含量随着压力的增加而显著减少,是因为一些暴露到分子表面的巯基基团会发生氧化反应转化成二硫键,而且在压力及酶解作用下,新产生的游离巯基也会发生重组导致二硫键的生成,因此游离巯基含量降低,这与Zhao 等[30]在探究花生蛋白酶解改性时巯基含量变化结果类似。
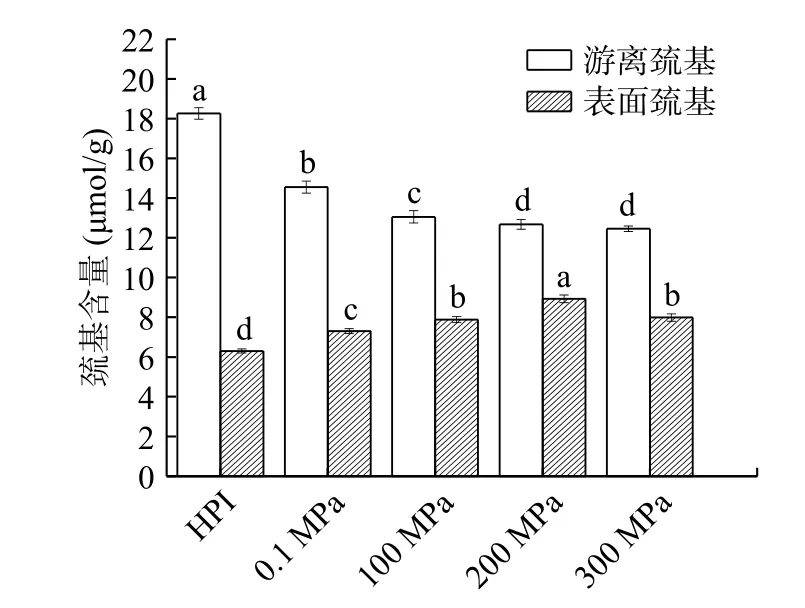
图4 超高压辅助酶解反应对产物巯基含量的影响Fig.4 Effect of UHP combined enzymatic hydrolysis reaction on sulfhydryl content
蛋白质中的色氨酸等芳香族氨基酸在特定波长下可被激发产生荧光,可通过荧光强度和最大发射波长的改变判断蛋白质三级结构的变化。超高压辅助酶解改性产物荧光光谱如图5 所示,在0.1~300 MPa压力处理下,HPIH 的荧光强度随压力增大呈现先升高后降低的趋势,当压力为200 MPa 时,荧光强度最大,压力达到300 MPa 时,荧光强度反而下降。此外,与HPI 相比,酶解产物最大发射波长均发生一定程度红移。出现以上现象可能是因为在酶解反应后,蛋白质部分结构发生了伸展,内部疏水区被破坏,芳香族疏水性基团逐渐显露,更多的色氨酸从蛋白质分子内部非极性环境中逐渐暴露于溶剂中,导致荧光强度升高[31]。但压力升高至300 MPa 时,蛋白质分子发生聚集,芳香族疏水性基团重新被包裹起来,因此荧光强度较200 MPa 处理时有所降低。以上结果表明,超高压辅助酶解反应处理破坏了HPI 分子间作用力,蛋白质三级结构发生改变,这与图2 表面疏水性结果一致。
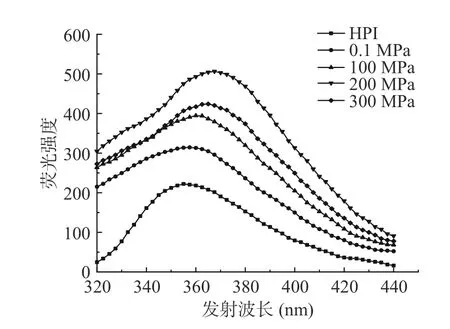
图5 不同压力下酶解产物的荧光光谱图Fig.5 Fluorescence spectra of enzymatic hydrolysis products under different pressures
2.6 超高压辅助酶解反应对HPI 抗氧化活性的影响
2.6.1 超高压辅助酶解反应对HPI 清除DPPH 自由基的影响 DPPH 自由基可在有机溶剂中稳定存在,在乙醇溶液呈紫色,吸收峰为517 nm。因具有单一电子,故能接受一个电子或氢离子。当与抗氧化剂作用时,可使体系颜色变浅或消失,吸光值下降[32]。图6 为超高压辅助酶解反应对不同浓度下酶解产物清除DPPH 自由基的影响,可以看出,HPIH 与HPI 均呈现一定的抗氧化能力,且样品浓度与其对DPPH 自由基的清除能力呈一定剂量关系,即自由基清除率随样品浓度的增大而增大。HPI 经过酶解改性后,DPPH 自由基清除能力显著提升,当压力在0.1~300 MPa 时,HPIH 自由基清除率随压力的增加先增大后减小,在200 MPa 时达到最大值。是因为在200 MPa 压力范围内,压力的增加使蛋白质构象逐渐发生改变,蛋白质结构伸展,酶解作用增强,产生大量具有抗氧化活性的小分子肽段,因此DPPH 自由基清除率增大,但压力过大(300 MPa)会导致蛋白质重新发生聚集且蛋白酶失活[33],对水解反应产生抑制作用,从而导致清除率降低。

图6 超高压辅助酶解反应对产物DPPH 自由基清除率的影响Fig.6 Effect of UHP combined enzymatic hydrolysis reaction on DPPH radical scavenging rate
2.6.2 超高压辅助酶解反应对HPI 清除ABTS+自由基的影响 ABTS 与过硫酸钾反应,可以生成绿色的ABTS+自由基,该自由基在734 nm 处有最大吸收,当体系中加入抗氧化剂时,会使其在734 nm 处的吸光度降低[34]。经计算,得到超高压辅助酶解反应产物在不同浓度下的ABTS+自由基清除率,如图7所示,在2~10 mg/mL 浓度范围内,ABTS+自由基清除能力随着样品浓度的增加而逐渐增强。总体来看,HPIH 对ABTS+自由基的清除能力从大到小依次为200、300、100、0.1 MPa,较HPI 相比,均有不同程度增强,这是因为HPI 经酶解及超高压处理后其蛋白结构发生变化,因此使得酶解产物的ABTS+自由基的清除率提高,这对于HPI 酶解产物抗氧化性的研究是一个积极的结果[35]。此前,赵贵川[36]在探究压力对米渣蛋白酶解物抗氧化能力影响的实验中发现,当压力过大时,酶解产物抗氧化能力反而降低,本实验结论与之相类似。

图7 超高压辅助酶解反应对产物ABTS+自由基清除率的影响Fig.7 Effect of UHP combined enzymatic hydrolysis reaction on ABTS+ radical scavenging rate
2.6.3 超高压辅助酶解反应对HPI 还原能力影响还原能力测定原理是抗氧化剂使铁氰化钾的Fe3+还原成Fe2+(亚铁氰化钾),亚铁氰化钾进一步与三氯化铁反应生成在700 nm 处有最大吸光度的普鲁士蓝,因此测定700 nm 处吸光度大小可以间接反映抗氧化剂还原能力的大小,吸光度越大,还原能力越强[37]。图8 为超高压辅助酶解反应对不同浓度下酶解产物还原能力的影响,HPI 经过改性后,其产物的还原能力均有所增加,且随着处理压力的提高,呈现先增后减的趋势,在不同样品浓度下,200 MPa 处理下的HPIH 均具有最大吸光度,而在300 MPa 处理下还原能力反而降低,这说明适当的压力处理可以最大程度提升酶解产物的抗氧化能力,与关海宁等[38]研究结果相符。
3 结论
本研究通过超高压辅助酶解HPI,探究超高压处理条件对HPI 结构和抗氧化活性的影响。随压力的增加蛋白质酶解反应程度增大,分子量逐渐降低。表面疏水性逐渐增加而后下降,在200 MPa 时表面疏水性达到最大。HPIH 总氨基酸含量在改性后均有不同程度下降,在非必需氨基酸中,天冬氨酸、谷氨酸、精氨酸含量下降明显,必需氨基酸中,异亮氨酸及缬氨酸含量降低幅度较大。HPI 经超高压辅助酶解反应后其二级和三级结构发生了明显变化(P<0.05)。酶解产物的DPPH、ABTS+、还原能力均在200 MPa 时达到最大值。综上所述,超高压处理能显著改变HPI 的二、三级结构,从而对抗氧化活性产生影响。本研究为超高压技术在汉麻蛋白产品中的应用提供了科学依据,有利于促进超高压技术在农产品加工领域的应用。

