体外模拟消化环境中消化酶对κ-卡拉胶/酪蛋白复合体系流变学特性及微观结构的影响
尚旭珂,朱斯亮,郑宝东,郭娟娟,*
(1.福建农林大学食品科学学院,福建福州 350000;2.泉州师范学院海洋与食品学院,福建泉州 362000)
卡拉胶(Carrageenan,CGN)是一种从红藻中提取得到的亲水线性多糖,其结构由重复的α-(1,3)-D-半乳糖和β-(1-4)-3,6-内醚-D-半乳糖交替连接组成[1-3]。根据二糖单元上硫酸盐基团的数量和位置[4],卡拉胶有三种主要类型,分别为kappa(κ)-、iota(ι)-、和lambda(λ)-卡拉胶[5-7],这些结构上的差异决定了不同类型卡拉胶具有不同的凝胶性质。卡拉胶是现代食品加工生产中广泛使用的增稠剂和胶凝剂,具有改善食品质构、结构和物理稳定性的作用,同时也能够改善和丰富食品的感官品质,除此之外,也可在食品生产中达到降低成本和增加价值的效果[8]。
随着卡拉胶在食品工业中的应用越来越广泛,其安全性和毒理学性质引起了世界各地机构的关注。近年来,虽然卡拉胶已被证明是安全的食品添加剂[9-11],但也有大量证据指出了卡拉胶的不利影响及其可能的机制[12-14]。大量实验表明,暴露于0.1%~5%的CGN 溶液可能会导致豚鼠、小鼠、兔子、雪貂、猴子产生不同程度的肠道溃疡或肠道炎症[15-17]。然而,Weiner 在2015 年的断奶仔猪模型中研究卡拉胶食用安全性时,观察到了不同的现象。实验发现,将卡拉胶添加到婴儿配方奶粉中,添加量≤0.1%对断奶前小猪的体重、肠道组织、炎症因子IL-8、IL-6、TNF-α无显著影响,也无肠道炎症效应[18-19]。卡拉胶在水溶液和蛋白溶液中致炎效应的差异性引起了研究人员的思考并展开了大量研究。后续研究发现,酪蛋白是牛乳蛋白中与κ-卡拉胶结合的关键蛋白[20-22],κ-卡拉胶含带电硫酸基团[23],它对牛乳体系的增稠稳定作用体现在κ-卡拉胶的负电荷硫酸基团与酪蛋白(尤其是κ-酪蛋白)携带的正电荷胺基以共价键或静电作用稳定结合[24-26]。除此之外,研究人员还发现摄入酪蛋白溶液或酪蛋白水解液对肠道屏障均有显著的保护作用[27-29]。
目前国内外对卡拉胶与酪蛋白相互作用的研究主要集中在卡拉胶对蛋白制品的品质改善及物理特性的研究,关于卡拉胶与酪蛋白结合后的生物活性研究尚少。κ-卡拉胶的构象转变及其与酪蛋白的相互作用可能是引起生物活性改变的重要因素,因此,研究模拟胃肠道消化过程中环境因素对κ-卡拉胶的构象以及二者相互作用的影响对卡拉胶在食品中的应用具有重要意义。本文以κ-卡拉胶为研究对象,选择牛乳中的酪蛋白为目标食品基质,研究了消化酶对κ-卡拉胶/酪蛋白复合体系(κ-Carrageenan/casein,κ-CC)流变学特性及其微观结构的影响。该工作结果不仅解析了胃肠道消化环境消化酶对κ-CC 复合体系物理化学性质的影响,还有利于进一步解析κ-卡拉胶在不同溶剂载体中的消解行为差异,为卡拉胶在食品中的安全应用提供参考。
1 材料与方法
1.1 材料与仪器
κ-卡拉胶 纯度98%(硫酸基含量为22.15%),北京索莱宝科技有限公司;酪蛋白酸钠 Sigma(上海)贸易有限公司;氯化钾、磷酸二氢钾、碳酸氢钠、氯化钠、六水合氯化镁、碳酸氢铵、氯化氢、二水氯化钙等 均为分析纯,国药集团试剂有限公司。
ME104E 电子分析天平 梅特勒-托利多仪器(上海)有限公司;HJ-2A 磁力加热搅拌器 上海富雪生物科技有限公司;HH-4 型智能数显恒温水浴锅上海富雪生物科技有限公司;T 激光纳米粒径分析仪、ADHR-2 旋转流变仪 美国TA 公司;动态光散射粒径仪 英国马尔文仪器有限公司;NovaNano-SEM 230 场发射扫描电子显微镜 美国FEI 公司;Nicolet iS5 傅里叶变换红外光谱仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 溶液制备
1.2.1.1 酪蛋白溶液的制备 称取酪蛋白酸钠加入蒸馏水中,室温下以1000 r/min 搅拌4 h,加入叠氮化钠(50 mg/L)防止细菌生长,4 ℃过夜,使其充分水和,配制成3%(w/v)酪蛋白贮存液备用。
1.2.1.2κ-卡拉胶、κ-CC 样品的制备 分别以去离子水及3%的酪蛋白溶液为溶剂,加入κ-卡拉胶粉末配制浓度为0.5%(w/v)κ-卡拉胶/酪蛋白混合体系,60 ℃水浴,磁力搅拌20 min。
1.2.1.3 不同消化酶处理κ-CC 样品的制备 取制备好的κ-CC 样品两份,每份各25 mL,依次分别加入胃蛋白酶(3200 U/mg)、胰蛋白酶(1000 U/mg)1.25 mL,使得最终消解混合物中的胃蛋白酶酶活达到2000 U/mL,胰蛋白酶酶活达到2000 U/mL。最后置于37 ℃,140 r/min 恒温摇床中,进行体外模拟消化2 h,即可得到目标样品,取出样液用于检测。
1.2.2κ-CC 复合物Zeta-电位的测定 利用激光纳米粒径分析仪测定κ-CC 的电位[30],测试温度为37 ℃,取1 mL 稀释50 倍样品于样品池中,折光指数设置为1.33,每个样品平行测定3 次。
1.2.3κ-CC 复合物硫酸基团含量的测定 通过比浊法测量消化酶中κ-CC 的硫酸根含量[31]。分别将0.4 mL 消化液与7.6 mL 三氯乙酸混合,并以8000 r/min 离心溶液10 min。向4 mL 所得上清液中,加入1 mL 氯化钡-明胶试剂,并将混合物在室温下静置15~20 min。在360 nm 处测量吸光度。采用以下公式计算κ-CGN 和κ-CC 消化液中的游离硫酸基团含量(CS)。
式中,m1:消化液中κ-卡拉胶粉末的总重量(mg);m2:暴露于消化液中的游离硫酸基团的重量(mg);V:消化液的总体积(mL);m1、m2通过标准曲线(y=2.0372x-0.0016,R2=0.9947)确定。
1.2.4κ-CC 复合物红外光谱分析 参照LI 等[32]的方法,稍作修改。使用傅里叶红外光谱仪测定消化酶中κ-CC 的复合物化学结构的变化。称取冷冻干燥后的样品(2 mg)彻底混合,置于研钵中,添加干燥的KBr,以1:100(样品:KBr)的比例混匀研磨、压片,采用傅里叶变换红外光谱仪进行测试,波长扫描范围为4000~400 cm-1。
1.2.5κ-CC 复合物微观结构的测定 参照WANG等[33]的方法,稍作修改。将1.2.1 中制备的样品置于4 ℃下过夜,经液氮处理后冷冻干燥,将冷冻干燥后的样品用导电胶固定在样品台上,经过喷金处理后,使用SEM 在电压5 kV 条件下观察样品的微观结构变化,放大100 和200 倍。
1.2.6κ-CC 复合物流变学特性的测定 参考JIAO等[34]的方法,略作修改。所有的流变学测试均使用DiscoveryDHR-2 旋转流变仪进行测试,探头型号PP-50,平行板直径40 mm,平行板间隙1 mm。取适量样品放置于平板中间,让样品充满板间,吸取多余样品。样品表面覆盖一层薄薄的硅油进行密封,防止测试过程中水分蒸发。样品测试重复三次。
1.2.6.1 应变扫描 通过大振幅振动剪切试验,在给定的应变值0.01%~1000%范围内分析样品的线性黏弹区,样品的内部结构在线性黏弹区不发生改变。在角频率6.28 rad/s,温度为4 ℃的情况下,测定并分析κ-CC 复合物线性黏弹区。
1.2.6.2 频率扫描 为了研究体外模拟消化环境中消化酶对κ-CC 复合物凝胶特性及相互作用的影响,在样品的线性黏弹区内进行角频率扫描,角频率扫描范围设置为0.01~100 s-1,温度设置为4 ℃,测定不同样品的G'和G''。
1.2.6.3 弹性活性链特征长度的计算κ-CC 复合物网络的弹性活性链特征长度可以通过Doi-Onuki 模型计算可得到[35-37],Doi-Onuki 模型的表达式如下:
其中,G0是频率为0.1 Hz 下的储存模量[38];kB是玻尔兹曼常数,1.38×10-23J/K;T 是绝对温度。
1.2.7 差示扫描量热分析(DSC)参考胡颖娜[39]的方法,稍作修改。通过DSC 测定消化酶水解对κ-卡拉胶构象转变的影响。称取1.2.1.3 中样品30~50 mg加入样品池中,以空坩埚作为参比。样品在60 ℃恒温10 min,以5 ℃/min 的速率降温至0 ℃。
1.2.8 SDS-聚丙烯酰胺凝胶电泳 通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析模拟体外胃肠道消化过程中消化酶对复合凝胶的影响[39]。将所有样品稀释至蛋白质浓度为10 mg/mL,取适量样品缓冲液与样品按1:3 混匀后煮沸5 min,将反应后的溶液以12000 r/min 的转速离心15 min,取5 µL 上清液进行SDS-PAGE 电泳。电泳条件:分离胶浓度为15%,浓缩胶浓度为4%,电压110 V。电泳结束后,采用考马斯亮蓝快速染色液染色2~3 h。染色结束后,用去离子水进行重复洗脱,直至底色基本脱除为止。最后,用凝胶成像仪扫描成像。
1.3 数据处理
所有样品至少制备两次,所有实验一式三份进行。使用SPSS 软件和OriginPro V8.5 进行绘图。进行单因素方差分析以确定显著性差异(P<0.05),结果使用平均值±标准差的形式表示。
2 结果与分析
2.1 消化酶对κ-CC 复合物Zeta-电位及硫酸基团的影响
粒子表面的电荷密度决定了彼此之间的相互作用,多糖与蛋白表面的电荷密度受到多种因素的影响[40]。林伟伟[41]的研究表明这些因素可以通过调节粒子表面的电荷密度或屏蔽作用来影响粒子间的相互缔合。图1A 展示了κ-CC 复合体系在经历胃蛋白酶以及胰蛋白酶消化前后的zeta-电位变化,由于胃蛋白酶以及胰蛋白酶在最适pH 下才能更好地发挥其生物活性,因此在消化前先将样品pH 分别调至3.0、7.0。从图1A 中可以看出,κ-CC 复合体系的zeta-电位在蛋白酶消化前后几乎没有发生变化。已有研究表明κ-卡拉胶与酪蛋白通过静电相互作用形成复合物,因此酪蛋白与κ-卡拉胶表面电荷密度的变化将直接影响二者间的相互作用[42]。在消化酶的水解过程中,κ-CC 复合体系的zeta-电位在胃蛋白酶和胰蛋白酶消化前后没有较大变化,说明消化酶对κ-卡拉胶与酪蛋白的结合影响不大。
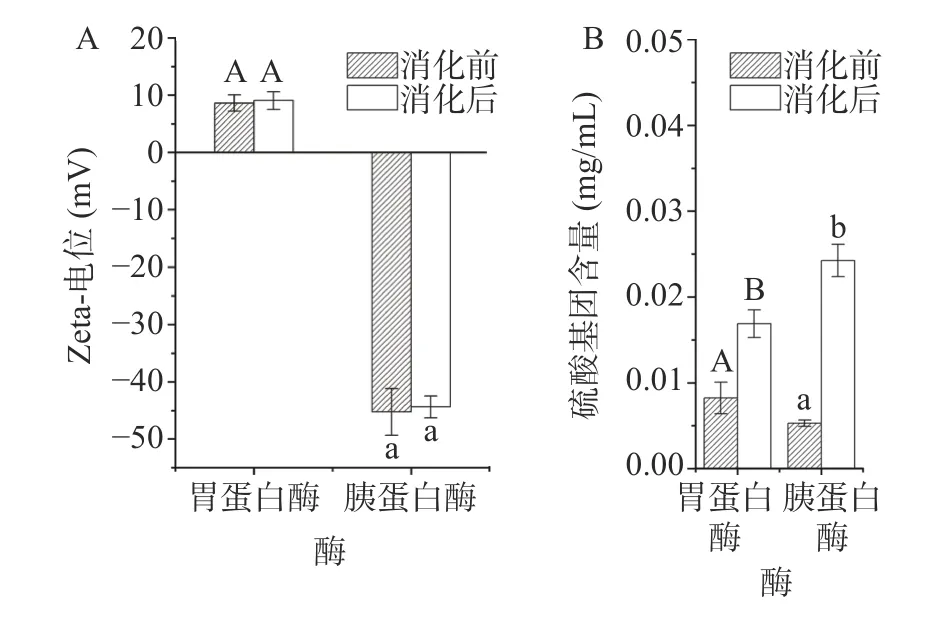
图1 模拟胃肠道中消化酶对κ-CC 复合物的zeta-电位和硫酸基团暴露量的影响Fig.1 Effect of digestive enzymes in the simulated gastrointestinal phase on the zeta-potential and free sulfate group content of κ-CC complexes
此外,本实验还采用了氯化钡-明胶比浊法测定了κ-CC 复合体系的硫酸基团暴露量。κ-卡拉胶的构象转变及其与酪蛋白的相互作用是κ-卡拉胶在乳制品中发挥稳定增稠作用的关键,而硫酸基团作为κ-卡拉胶的特征基团,影响着κ-卡拉胶的构象转变。因此,研究硫酸基团的含量对κ-卡拉胶在食品中的应用具有重要意义。图1B 是κ-CC 复合体系在消化酶水解条件下的硫酸基团暴露量。从图1B 中可以看出,经蛋白酶水解后,κ-CC 复合体系的消化液中的硫酸基团暴露量显著增加(P<0.01),其中,胰蛋白酶水解后硫酸基团暴露量的增量更加显著(P<0.01)。随着蛋白酶的水解,酪蛋白被分解为低分子量的蛋白质或肽段,κ-卡拉胶与酪蛋白间的相互作用减弱,且硫酸基团暴露量显著增加(P<0.01),而硫酸基团是κ-卡拉胶的特征基团,影响着κ-卡拉胶构象的转变,这说明蛋白酶的存在不利于κ-卡拉胶有序构象的形成[43-45]。
2.2 消化酶对κ-CC 复合物特征基团的影响
图2 是κ-CC 复合体系在模拟胃肠道蛋白酶消化条件下的红外光谱图。位于3423.51 cm-1附近的宽吸收峰为O-H 伸缩振动引起的氢键特征峰[42,46],在1234.78、929.67、846.36 cm-1附近的吸收峰分别为硫酸酯基团(O=S=O)、α-D-3,6-内醚半乳糖和β-D-4-硫酸基-半乳糖的伸缩振动[47]。从图2 中可以看出,κ-CC 复合体系的特征峰强度的变化主要发生在胰蛋白酶水解后,体系的特征峰强度显著增强。位于3398.64 cm-1的O-H 以及蛋白的酰胺Ⅰ带、酰胺Ⅱ带的伸缩振动明显增强,说明分子间氢键作用在被胰蛋白酶水解后显著增强。在图2 中可以看到,位于1235.67 cm-1处的硫酸酯基团伸缩振动明显增强,说明κ-卡拉胶的硫酸基团暴露量经胰蛋白酶水解后呈现增加的趋势,这与我们测定的硫酸基团暴露量的结果一致。蛋白酶的水解作用将蛋白质分解为小分子蛋白或肽段,减弱了酪蛋白与κ-卡拉胶之间的相互作用,从而导致κ-卡拉胶的硫酸基团暴露量增加。与胰蛋白酶相比,κ-CC 复合体系在胃蛋白酶水解后的红外光谱几乎没有发生变化,说明胃蛋白酶对酪蛋白的水解作用较弱。

图2 模拟胃肠道中消化酶水解前后κ-CC 复合物的红外光谱图Fig.2 FT-IR spectra of κ-CC complexes before and after the hydrolysis of digestive enzymes in the simulated gastrointestinal phase
2.3 消化酶对κ-CC 复合物微观结构的影响
在本研究中,SEM 被用于探究模拟胃肠道消化过程中蛋白酶的水解作用对κ-CC 复合物微观结构的影响。图3 显示了κ-CC 复合体系在胃蛋白酶和胰蛋白酶水解前后的微观结构的变化。我们分别在pH3.0 和pH7.0 条件下研究了κ-CC 复合体系在蛋白酶水解后的微观结构的变化,图3A~图3C 为κ-CC 复合体系在胃蛋白酶水解前后的微观结构。从图中可以看出,κ-CC 复合体系在胃蛋白酶消化前由于环境为酸性pH 的原因,呈现为较大的凝块结构,在经过胃蛋白酶消化2 h 后,凝块依然存在,但相比消化前,凝块的结构稍显松散,可能是消化过程中胃蛋白酶的水解作用引起的。图3a~图3c 为胰蛋白酶水解前后的微观结构图,从图中可以清楚地看到κ-CC 复合体系的网络结构在胰蛋白酶消化2 h 后局部遭到破坏,孔洞的均一程度下降,说明胰蛋白酶的水解作用使得κ-CC 复合体系的无序程度升高,网络结构的稳定性下降。凝胶网络结构的紧密程度能够侧面反映高分子聚合物相互作用的程度。在蛋白酶的消解作用下,κ-CC 复合物的构象发生变化,具体表现为水解之后网络结构孔洞大小不一,分布不均匀,很难形成有序的网络结构。

图3 模拟胃肠道中消化酶的水解对κ-CC 复合物微观结构的影响Fig.3 Effects of the hydrolysis of digestive enzymes in the simulated gastrointestinal phase on the microstructure of κ-CC complexes
2.4 消化酶对κ-CC 复合物动态流变学特性的影响
2.4.1 应变扫描分析 对于高分子流体来说,在其流动过程中会伴随着较为强烈的弹性形变,因此研究κ-卡拉胶以及κ-卡拉胶-酪蛋白体系的动态流变行为很有必要。动态测试有两个独立参数,弹性模量G'和粘性模量G'',在κ-卡拉胶以及κ-卡拉胶-酪蛋白复合物形成凝胶的过程中分别反应高分子流体的弹性性质和粘性性质。一般来说,物质在线性黏弹区内能保证自身内部结构的完整性,因此在线性黏弹区进行流变测定能够为复杂流体的微观结构提供有意义的信息。从图中可以看出κ-卡拉胶溶液以及κ-卡拉胶-酪蛋白复合体系G'和G''在较小的应变下保持稳定。当应变增加时,G'和G''在屈服前达到最大值,随后模量急剧下降,这是由于大剪切作用导致聚合物内部的网络结构和化学键被破坏,这个点即为样品线性黏弹区和非线性黏弹区的临界点,聚合物的空间结构在线性黏弹区内处于破坏与恢复的动态平衡中。模拟胃肠道中的蛋白酶水解条件下κ-CC 复合体系的应变扫描如图4 所示,从图中可得,κ-CC 复合体系的线性黏弹区应变范围为0.01%~1%,为保证在聚合物结构的相对完整,故选择0.1%应变值进行频率扫描。

图4 模拟胃肠道中消化酶对κ-CC 复合体系应变扫描的影响Fig.4 Effects of the digestive enzymes in the simulated gastrointestinal phase on the train sweeps of κ-CC complexes
2.4.2 频率扫描分析 稳态剪切粘度测量使我们对微观结构和宏观性质之间的联系了解有限,动态流变学测定可用于更好地研究κ-卡拉胶和κ-CC 复合体系的内部结构和粘弹性行为之间的关系。如图5 所示,G'和G"的值与频率呈正相关,表现出强烈的频率依赖性。两种模量的频率依赖性表明κ-卡拉胶和κ-CC 复合体系存在强大的分子间网络,主要由非共价物理交联组成。角频率扫描能反映样品不同时期的性能,低频数据表示长期性能而高频数据表示短期性能。通常储存模量(G')和耗能模量(G')分别代表样品的弹性性能和粘性性能。图5 显示了κ-CC 复合体系经胃蛋白酶和胰蛋白酶消化2 h 后粘弹性的变化。从图中可以看出,κ-CC 复合体系在蛋白酶水解前后始终保持G''>G',说明κ-CC 复合体系在这过程中保持弱凝胶的特性,在经历蛋白酶水解2 h 后,体系的弹性和粘性显著下降,说明蛋白酶的水解破坏了体系内部的网络结构,导致粘弹性降低,稳定性下降。

图5 模拟胃肠道中消化酶对κ-CC 复合体系频率扫描的影响Fig.5 Effects of the digestive enzymes in the simulated gastrointestinal phase on the frequency sweeps of κ-CC complexes
2.4.3 弹性活性特征长度计算 特征长度可以很好地反映蛋白质和多糖相互作用力的强弱,特征长度越小,相互作用力越强烈,结构越紧密。反之,相互作用力越弱,结构越松散。模拟胃肠道中消化酶水解条件下κ-卡拉胶溶液与κ-CC 复合体系的弹性活性特征长度,κ-卡拉胶初始样品的弹性活性特征长度为288.1±20.3 nm,而κ-CC 复合体系的弹性活性特征长度为31.3±0.8 nm,说明κ-卡拉胶与酪蛋白的复合大大缩短了分子链间的距离。多糖的分子链不稳定,当外界环境条件发生变化时,其弹性活性特征长度也随之变化,同时也反映了其分子链的动态变化。我们还计算了κ-CC 复合体系在胃蛋白酶和胰蛋白酶水解后的特征长度,分别为28.2±9.2 nm、96.7±16.1 nm,消化酶的水解作用使得分子链间距离增大,其中胰蛋白酶的作用更加显著。
2.5 消化酶对κ-CC 复合体系中κ-卡拉胶构象转变的影响
研究了模拟胃肠道消化体系消化酶对κ-CC 复合体系中κ-卡拉胶构象转变的影响。图6 及表1 显示了κ-卡拉胶溶液及κ-CC 复合体系中κ-卡拉胶在降温过程中的热流密度随温度的变化、构象转变温度和热焓值。

表1 κ-卡拉胶及κ-CC 在模拟胃肠道中消化酶条件下的构象转变温度(Ts-g)及焓值Table 1 Conformational transition temperature (Ts-g)and enthalpy of the κ-CGN and κ-CC complexes at the digestive enzymes in the simulated gastrointestinal phase
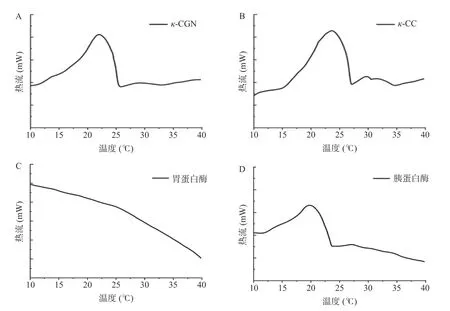
图6 降温过程中模拟胃肠道在消化酶条件下κ-CGN 溶液及κ-CC 复合体系的热流密度随温度的变化趋势Fig.6 Heat flows of κ-CGN and κ-CC complexes at digestive enzymes in the simulated gastrointestinal phase upon cooling
如图6A 所示,κ-卡拉胶溶液的DSC 曲线在降温过程中均出现放热峰,峰值位置对应溶胶-凝胶转变点,表明κ-卡拉胶溶液在降温过程中形成了凝胶网络结构。从图中可以看出,κ-卡拉胶的放热峰出现在22.08 ℃,这与ZHAO 等[48]的研究结果接近。与单独的κ-卡拉胶溶液相比,κ-CC 复合体系中κ-卡拉胶在降温过程中的放热峰的位置出现在23.63 ℃(图6B~图6D),向高温方向偏移了1.55 ℃,说明酪蛋白与κ-卡拉胶间的静电相互作用提高了κ-卡拉胶的溶胶-凝胶转变点。κ-CC 复合体系在经胰蛋白酶水解后,构象转变温度向低温方向移动,说明体系的凝胶稳定性降低。
2.6 消化酶对κ-卡拉胶与酪蛋白之间相互作用的影响
为了研究消化过程中蛋白质的水解是否会影响到κ-卡拉胶与酪蛋白之间的相互作用,本实验使用SDS-PAGE 电泳来分析酪蛋白(CA)和κ-CC 复合体系经消化酶水解不同时间后的蛋白质组成,如图7所示。

图7 酪蛋白及κ-CC 复合体系体外模拟消化不同时间的SDS-PAGE 图Fig.7 SDS-PAGE of digesta from casein and κ-CC samples in the different residence times
图7A 为经胃蛋白酶水解的消化物,从图中可以看到,未经消化的酪蛋白条带的分子量分布在25~35 kDa,随着消化时间的延长,没有观察到低分子量条带的产生,说明胃蛋白酶对酪蛋白没有消解作用,酪蛋白在模拟胃环境中酸性pH 下形成了较大的凝块,不利于蛋白质的水解[49]。图7B 展示了酪蛋白和κ-CC 复合体系经胰蛋白酶水解的消化物,从图中可以看出,随着胰蛋白酶消化时间的延长,酪蛋白的条带逐渐模糊,而低分子量段17 kDa 左右的条带颜色逐渐加深,说明酪蛋白逐渐被分解为小分子量的蛋白或肽段[45]。通过对比酪蛋白与κ-CC 复合体系的消化情况,可以看到酪蛋白在胰蛋白酶消化60 min后几乎完全水解,而κ-CC 复合体系的完全水解大约发生在消化90 min 后,由此可见,κ-卡拉胶的加入延长了蛋白质的水解时间。
3 结论
有研究指出带电多糖和蛋白质被人体摄入之后其网络结构容易受到胃肠道消化过程中酶的水解的影响。本文探讨了消化酶(包括胃蛋白酶和胰蛋白酶)对κ-CC 复合体系的影响,发现κ-CC 复合体系的zeta-电位在两种蛋白酶酶解前后并无明显变化,说明消化酶对κ-卡拉胶与酪蛋白的结合影响不大。从硫酸基团暴露量和红外光谱结果来看,胃蛋白酶对κ-CC 复合体系的水解程度较小,而胰蛋白酶水解同样时间后,体系硫酸基团暴露量由原来的0.00529±0.00037 mg/mL 显著增加到0.02425±0.00188 mg/mL(P<0.01),硫酸基团暴露量的增加不利于κ-卡拉胶的构型。此外,在电镜和流变仪的观察下发现,酶解后κ-CC 复合体系微观形貌和流变学特性上的变化主要体现为粘弹性明显下降,无序程度升高,网络结构孔洞大小不一,分布不均匀,稳定性下降,网络结构遭到破坏。根据本文研究结果,考虑在应用卡拉胶这一食品添加剂时,可以利用卡拉胶的蛋白反应性及消化酶对卡拉胶构象的作用来提高卡拉胶在食品工业应用中的安全性,为卡拉胶在机体胃肠道中的毒理学研究提供理论研究基础,对指导和拓展卡拉胶的安全应用具有重要意义。

