水仙环素通过调控PLK1/AKT 信号通路诱导三阴性乳腺癌细胞周期阻滞和凋亡
郭秋生 汤婉芬 周师师 郑志坚 吕仙梅
乳腺癌是最常见的恶性肿瘤之一,也是全球女性癌症相关死亡的主要原因[1]。三阴性乳腺癌(triple negative breast cancer,TNBC) 约占全部乳腺癌的15%~20%,侵袭和转移能力强,复发率高,预后差[2]。水仙环素(Narciclasine,Nas)是一种在水仙花和其他开花植物中发现的天然化合物,具有抗肿瘤和抗炎活性[3]。Nas 的抗肿瘤活性与调节多个信号通路有关[4]。然而,Nas 抑制TNBC 的机制仍有待深入研究。PLK1(Polo-like kinase 1)是PLK 家族的一种蛋白,在细胞有丝分裂调节、胞质分裂诱导和DNA 损伤的调节中发挥重要作用,是DNA 复制过程中维持基因组稳定性的一个重要因子[5]。AKT(又名protein kinase B,PKB)蛋白参与调节骨骼肌细胞的凋亡、增殖和代谢[6]。PLK1 是AKT 的上游激酶[7],抑制PLK1/AKT信号通路可抑制肿瘤的生长[8]。本研究拟探索Nas 通过PLK1/AKT 信号通路诱导TNBC 细胞凋亡及细胞周期阻滞的机制,现报道如下。
1 实验材料
1.1 细胞株 人TNBC 细胞株MDA-MB-231 购自上海中科院细胞库,经STR(Specialized Technology Resources)鉴定无误(目录号:SCSP-5043),使用含10%胎牛血清的RPMI-1640 完全培养基,置于温度为37 ℃、含5%CO2的细胞培养箱中培养。
1.2 主要试剂及仪器 RPMI-1640 细胞培养基(Gibco,批号8122270)、胎牛血清(BI,批号2120140)、细胞增殖-毒性检测试剂盒(CCK-8,Biosharp,批号K101816133EF5E)、双染细胞凋亡检测试剂盒(Biosharp,批号A11243)、细胞周期检测试剂盒(Biosharp,批号A10431);cle-Caspase-3(abcam,批号GR3220493-3)、PARP(cell singling,批号9542S)、cle -PARP (proteintech, 批 号 GB111503)、PLK1(abcam,批号GR3361528-4)、PI3K(affinity,批号AF6241)、p -PI3K (affinity, 批 号 AF3242)、AKT(abcam,批号GR240003-99)、p-AKT(huabio,批号ET-1607-73)、CDK1(servicebio,批号GB11398-100)、Cyclin B(epitmics,批号AF6168)、Cyclin A(servicebio,批号FNab02094)、p-21(cell singling,批号2946S)、p-27(cell singling,批号GB112176)、p-62(proteintech,批号18420-1-AP)、LC3(proteintech,批 号14600 -1 -lg)、γ -H2AX (servicebio, 批 号GB111841)、GAPDH(proteintech,批号60004-1-lg)。流式细胞仪(BD,FACSVia)、全自动凝胶图像分析系统(BIO-RAD,ChemiDocTM XRS+)为本实验室提供。
2 实验方法
2.1 CCK-8 检测细胞活力 以3000 细胞/孔的密度将MDA-MB-231 细胞接种在96 孔板中,待细胞贴壁后,按照0、0.05、0.10、0.20、0.40、0.80、1.60、3.20、6.40 μmol/L 的浓度梯度依次加入Nas,在药物处理的第24 h、48 h、72 h 加入100 μL 的CCK-8 工作液,每组设置3 个复孔,37 ℃避光孵育2 h,使用酶标仪检测各孔光密度(OD)值,检测波长设置为450 nm。运算公式如下:存活率=[1-(对照组OD 值-实验组OD 值)/(对照组OD 值-空白组OD 值)]×100%,抑制率=100%-存活率。
2.2 实验分组 根据上述CCK-8 检测结果,按照如下Nas 浓度进行实验:Control 组予完全培养基培养;低剂量(抑制率约25%)、中剂量(抑制率约35%)、高剂量(抑制率约50%)组分别用含Nas 0.5、1.0、2.0μmol/L的含药培养基进行培养。
2.3 克隆形成实验 将适当密度的MDA-MB-231细胞接种在6 孔板中,待细胞贴壁后,分别用含Nas 0.5、1.0、2.0 μmol/L 的含药培养基培养48 h,消化计数后再以500 细胞/孔的浓度接种在6 孔板中,RPMI-1640 完全培养基培养2 周,弃上清,通用型组织固定液固定,结晶紫染色后拍照记录。
2.4 Transwell 实验 将适当密度的MDA-MB-231细胞接种在6 孔板中,待细胞贴壁后,分别用含Nas 0.5、1.0、2.0 μmol/L 的含药培养基培养48 h,消化计数后按照1×105细胞/mL 的密度用无血清的RPMI-1640 培养基配制细胞悬液,每个小室上层接种200μL,而下室加入RPMI-1640 完全培养基600 μL,置于细胞培养箱培养48 h,取出小室,用通用型组织固定液固定小室底部细胞20 min,再用结晶紫溶液染色20 min,将小室置于通风橱风干2 h,用显微镜观察并拍照记录。
2.5 流式细胞分析仪检测细胞株的凋亡率 以5×105细胞/孔的密度将MDA-MB-231 细胞均匀接种于6 孔板中,待细胞贴壁后,分别用含Nas 0.5、1.0、2.0 μmol/L 的含药培养基培养48 h 及72 h,用1 mL预冷的PBS 缓冲液轻轻吹打重悬细胞并计数,4 ℃、1500 r/min 离心5 min,吸除上清,重复上述操作2遍,按照试剂商说明书要求处理细胞后上机检测。Annexin V-FITC 镜下呈现绿色荧光,PI 为呈现红色荧光。
2.6 流式细胞分析仪检测细胞株的细胞周期 以5×105细胞/孔的密度将MDA-MB-231 细胞均匀接种于6 孔板中,待细胞贴壁后,分别用含Nas 0.5、1.0、2.0 μmol/L 的含药培养基培养48 h,用1 mL 4 ℃条件下预冷的PBS 缓冲液冲洗,按照试剂商说明书要求处理细胞后上机检测。
2.7 Western blot 实验检测相关蛋白质的表达 以5×105细胞/孔的密度将MDA-MB-231 细胞均匀接种于6 孔板中,待细胞贴壁后,分别用含Nas 0.5、1.0、2.0 μmol/L 的含药培养基培养48 h,用1 mL 4 ℃条件下预冷的PBS 缓冲液冲洗,使用RIPA 裂解液提取各细胞的总蛋白,BCA 法检测各蛋白浓度,调整为浓度一致的总蛋白溶液后分别加入5×loading buffer 溶液,100 ℃金属浴10 min 完成变性。使用预制的SDS-PAGE 凝胶完成电泳,湿转法转移至PVDF 膜上后用TBST 漂洗,室温下5%脱脂牛奶封闭1 h,再次漂洗后加入一抗孵育过夜。次日再次漂洗后加入二抗室温孵育2 h,使用全自动凝胶图像分析系统显影。
2.8 统计学方法 应用Graphpad Prism 8.0 软件分析实验数据并作图,各项检测结果呈正态分布,均以均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way analysis of variance,ANOVA),两组之间的比较采用Bonferroni 校正的t 检验,P<0.05认为差别具有统计学意义。
3 结 果
3.1 Nas 对MDA-MB-231 细胞增殖的影响 使用CCK-8 方法检测Nas 对MDA-MB-231 细胞的抑制率,可知Nas 对MDA-MB-231 细胞具有明显的抑制作用,且呈现出了一定程度的时间-剂量依赖性,见表1。
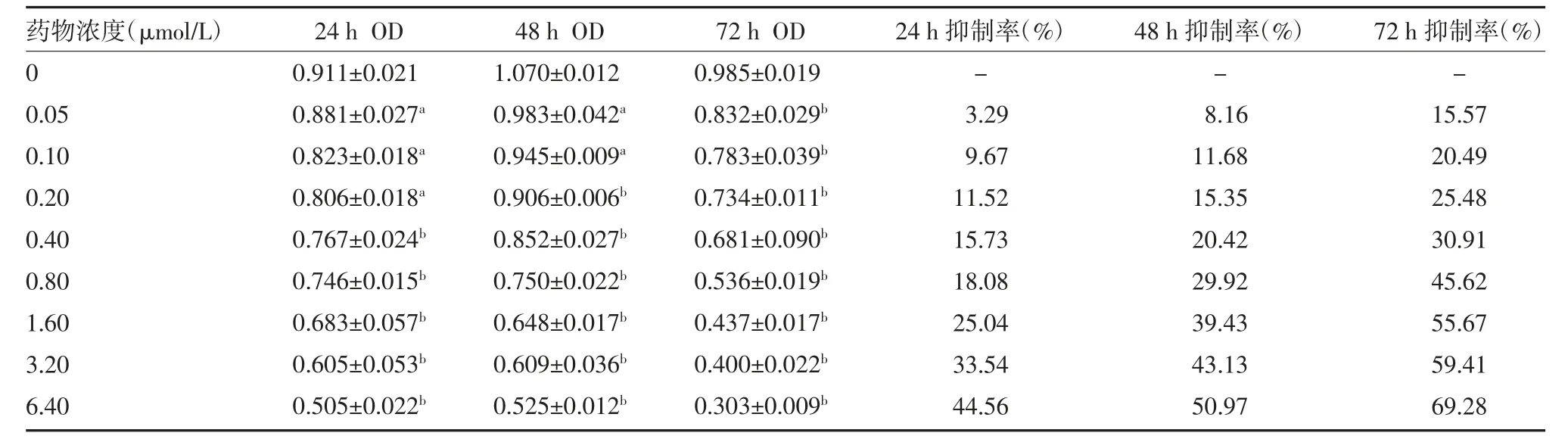
表1 Nas 对MDA-MB-231 细胞增殖的抑制作用
3.2 Nas 对MDA-MB-231 细胞克隆形成的影响通过克隆形成实验检测Nas 对MDA-MB-231 细胞克隆形成能力的影响,与Control 组比较,低剂量组的细胞克隆数量出现了15.99%的抑制;中剂量组细胞克隆抑制率为24.76%;而高剂量组的细胞克隆抑制率达到了54.17%(见图1);Nas 可明显抑制MDAMB-231 细胞的克隆形成能力。
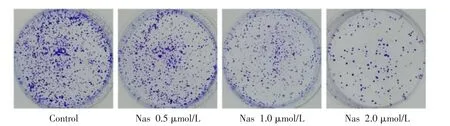
图1 Nas 对MDA-MB-231 细胞克隆形成能力的影响
3.3 Nas 对MDA-MB-231 细胞侵袭能力的影响通过Transwell 实验检测Nas 对MDA-MB-231 细胞侵袭的影响,与Control 组比较,低剂量组的细胞侵袭数量出现了0.68%的抑制;中剂量组的侵袭抑制率为23.20%;而高剂量组的细胞侵袭抑制率达到了45.27%(见图2);Nas 可明显抑制MDA-MB-231 细胞的侵袭能力。
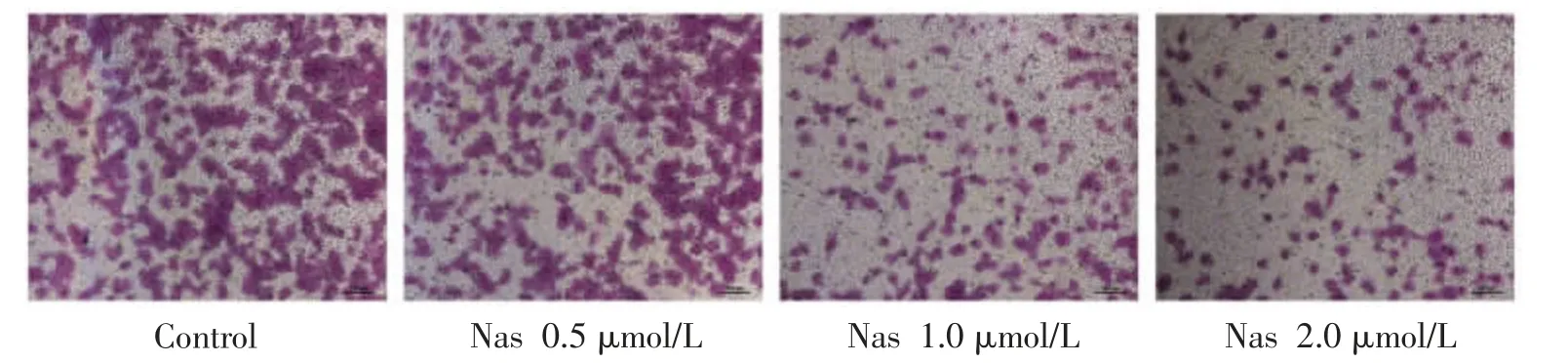
图2 Nas 对MDA-MB-231 细胞侵袭能力的影响
3.4 Nas 对MDA-MB-231 细胞凋亡的影响 使用流式细胞仪分析Nas 对MDA-MB-231 细胞凋亡的影响,Nas 处理48 h 时,Control 组的凋亡率为3.57%;低剂量组的细胞凋亡率为7.62%;中剂量组的细胞凋亡率为9.94%;而高剂量组的细胞凋亡率为17.65%(见图3A);Nas 处理72 h 时,Control 组的凋亡率为4.27%;低剂量组的细胞凋亡率为8.73%;中剂量组的细胞凋亡率为14.73%;而高剂量组的细胞凋亡率为34.57%(见图3B);Nas 可明显诱导MDAMB-231 细胞的凋亡。

图3 Nas 对MDA-MB-231 细胞凋亡的影响
3.5 流式细胞仪检测Nas 对MDA-MB-231 细胞周期的影响 使用流式细胞仪分析Nas 对MDA-MB-231 细胞凋亡的影响,Control 组的G1、G2、S 期分别为62.89%、4.98%、32.13%;低剂量组的G1、G2、S 期分别为61.00%、8.74%、30.26%;中剂量组的G1、G2、S 期分别为77.19%、11.98%、10.83%;而高剂量组的G1、G2、S 期分别为56.53%、20.72%、22.75%(见图4);Nas 可将MDA-MB-231 细胞的细胞周期阻滞在G2 期。
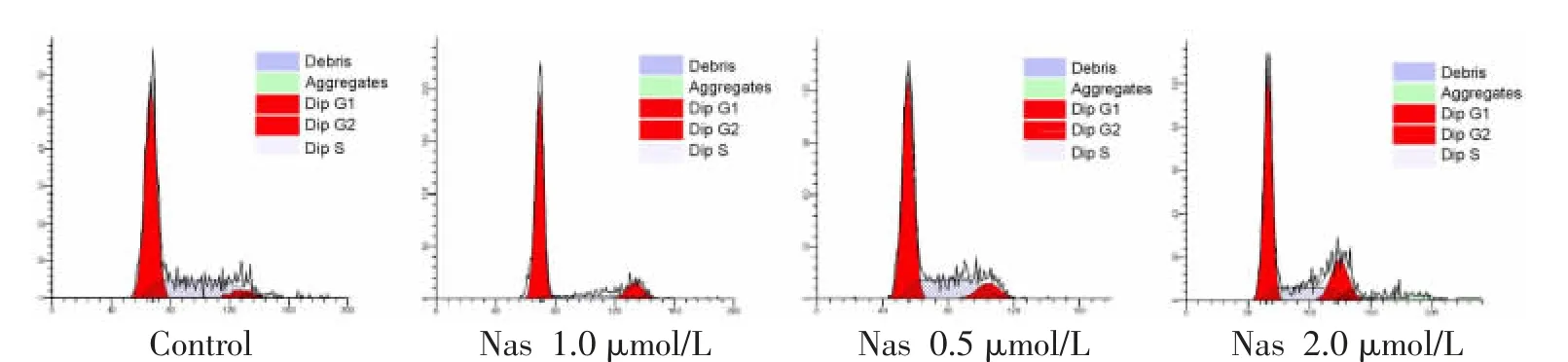
图4 Nas 对MDA-MB-231 细胞周期的影响
3.6 Nas 对MDA-MB-231 细胞相关蛋白质表达的影响 MDA-MB-231 细胞分别经不同浓度的Nas处理48 h,Western blot 实验检测cle-Caspase-3、PARP、cle-PARP、PLK1、PI3K、p-PI3K、AKT、p-AKT、CDK1、Cyclin B、Cyclin A、p-21、p-27、p-62、LC3-II/I、γ-H2AX 等蛋白质表达的影响。与Control 组比较,Nas 可以显著促进cle-Caspase-3、cle-PARP、p-21、p-27 及γ-H2AX 等蛋白质的表达,显著抑制PLK1、p-PI3K、p-AKT、CDK1、Cyclin B 等蛋白质的表达水平(P<0.05),而对p-62、LC3-Ⅱ/Ⅰ等蛋白质的表达水平影响不明显(见图5)。
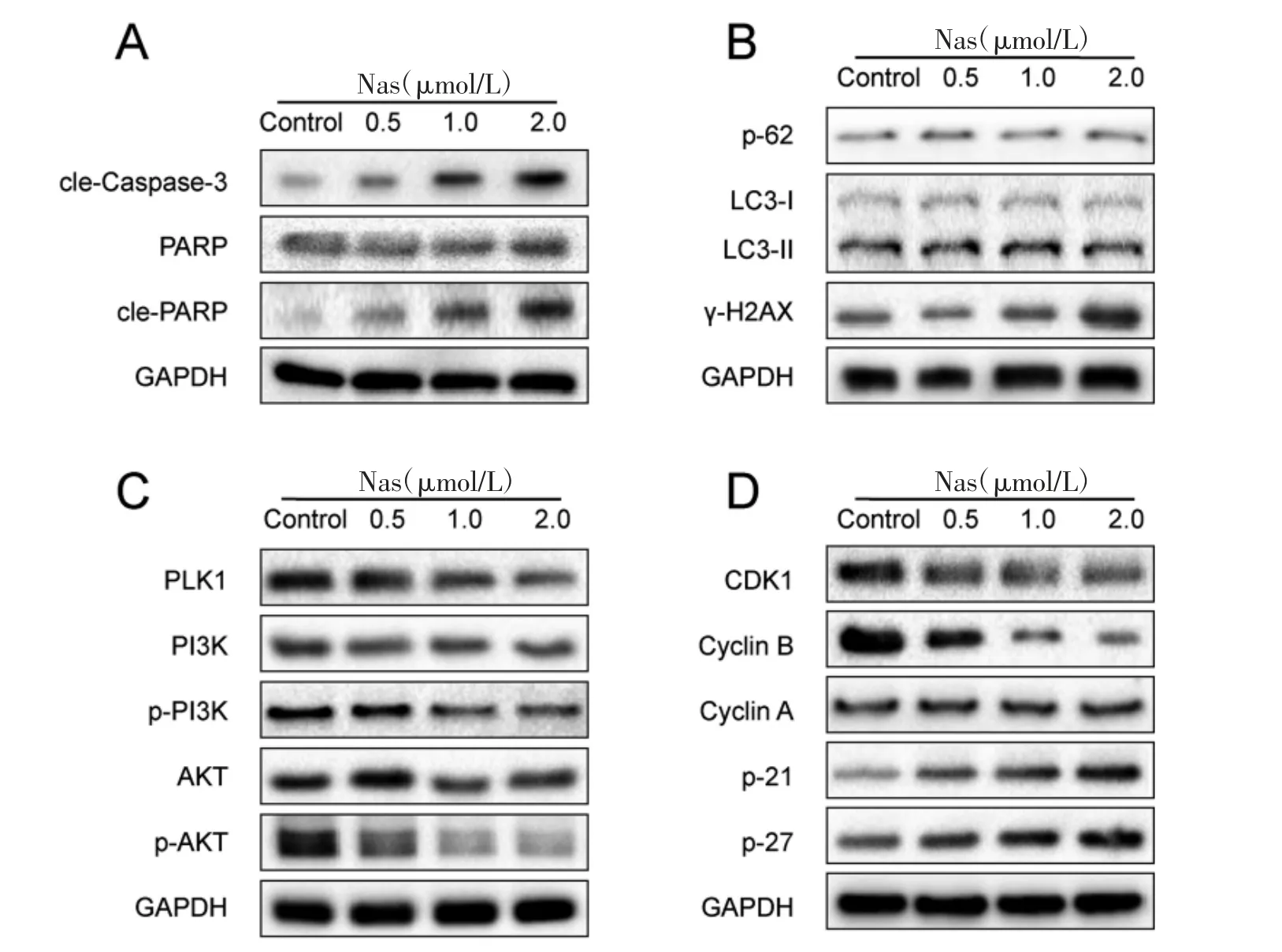
图5 Nas 对MDA-MB-231 细胞相关蛋白质表达的影响
4 讨 论
2020 年,乳腺癌已成为发病率最高的恶性肿瘤[9]。根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)表达情况,乳腺癌可分为四种不同的亚型。TNBC 约占全部乳腺癌的10%~15%,具有ER、PR、Her-2 表达缺失的特点[10]。流行病学资料显示,TNBC 多发生在40 以下的绝经前年轻女性,与其他亚型乳腺癌相比,TNBC 患者的生存时间较短,确诊后前5 年内的死亡率为40%[11]。TNBC 有高度侵袭性,大约46%的TNBC 患者会有远处转移。由于其特殊的分子表型,TNBC 对内分泌治疗或分子靶向治疗不敏感,化疗是TNBC 患者的主要治疗手段,因化疗药物有较强的毒副反应,且临床反应有限,故临床应用收到一定的限制[12]。因此,开发新的药物和治疗方法对TNBC 至关重要。
Nas 是一种在水仙花和其他开花植物中发现的天然化合物,属于石蒜科,具有抗肿瘤和抗炎活性[3,13]。Nas 在体外对多种肿瘤细胞具有抑制增殖和促凋亡的作用,在体内可缩小肿瘤体积或抑制肿瘤生长。它抑制细胞增殖、诱导细胞凋亡及自噬、抑制肿瘤血管生成、抑制肿瘤转移[14-15]。Nas 影响多个分子和信号通路,如Caspases 家族蛋白、VEGFR2 蛋白、FAK 信号通路、AKT/mTOR 信号通路、Akt/IKK/NF-κB 和JNK信号通路等[16-19]。
PLK1 属Polo 样激酶家族,是一类在真核细胞中广泛存在的丝氨酸/苏氨酸激酶,可通过其激酶活性影响多种底物,进而调节细胞有丝分裂、胞质分裂、DNA 损伤应答及发育等过程[5]。PLK1 在多种肿瘤组织中呈现高表达状态,如乳腺癌、卵巢癌、前列腺癌及神经母细胞瘤等[20],其表达水平与细胞高增殖率、高转移潜能及预后差相关[21-22]。TNBC 中PLK1 呈高表达,并且PLK1 水平升高与肿瘤淋巴结转移、临床分期晚及预后不良相关,是TNBC 不良预后的标志之一[23]。先前研究已经证明,抑制PLK1 的表达会导致G2/M 期阻滞、有丝分裂纺锤体缺陷和有丝分裂受阻,从而使细胞对凋亡信号敏感[24]。在体外实验中也证实抑制PLK1 后,乳腺癌细胞的克隆形成能力、迁移能力及侵袭能力等均受到抑制[25]。
PLK1 是AKT 的上游激酶,研究显示,PLK1 与PI3K/AKT、MAPK、Notch 等信号通路共同调节DNA损伤、转录、细胞周期、细胞凋亡等,导致恶性肿瘤的发生发展[26-27]。AKT 是一种调节细胞存活、增殖、生长、凋亡和糖原代谢的丝氨酸/苏氨酸激酶,可通过Thr308 或Ser473 位点活化并磷酸化GSK3β、Bcl-2等相关死亡启动子[28]。p-AKT 通过干扰mTOR 的正常调控机制,进而参与细胞凋亡、增殖和细胞运动。过表达p-AKT 被认为是恶性肿瘤治疗的靶点[29]。
在本研究中,我们发现Nas 可通过促进cle-Caspase-3、cle-PARP、p-21、p-27 蛋白的表达,抑制PLK1、p-PI3K、p-AKT、CDK1、Cyclin B 等蛋白的表达水平,使细胞周期阻滞于G2 期,进而抑制TNBC细胞的增殖、克隆形成、侵袭能力,促进其凋亡。从而说明,Nas 可通过PLK1/AKT 信号通路诱导MDAMB-231 细胞周期阻滞和凋亡。p-62、LC3-II/I 的表达水平未出现明显变化,说明Nas 并未诱导MDAMB-231 细胞产生自噬。γ-H2AX 的表达水平在Nas低剂量、中剂量组中未出现显著变化,而在Nas 高剂量组中出现升高,说明高剂量的Nas 可导致MDAMB-231 细胞出现DNA 损伤,从而进一步发挥抗肿瘤作用。在课题组的后续研究中,我们拟通过Rescue实验,即过表达PLK1,然后再观测Nas 对TNBC 细胞相关表型,如细胞凋亡和细胞周期,及相关蛋白质表达的影响,进一步验证Nas 通过PLK1/AKT 信号通路促进TNBC 细胞凋亡及细胞周期阻滞的作用机制,为中医药治疗恶性肿瘤提供更多的理论依据。

