基于网络药理学与实验探讨裘氏内异方治疗子宫内膜异位症的作用机制
李 慧 杨华娣 毛佩瑜 张 婷 陆申奕 叶恬恬
子宫内膜异位症(endometriosis,EMs)是妇科常见疾病,发病机制不明,主要表现为严重的盆腔疼痛、痛经和生育能力低下,20%~50%的不孕症妇女合并EMs,71%~87%的慢性盆腔疼痛妇女患有EMs,EMs 可使上皮性卵巢癌的发病风险增加50%,给女性的身体健康和家庭和谐带来严重影响[1-2]。腹腔镜或剖腹手术是EMs 的诊断“金标准”及首选疗法,虽能取得一定临床疗效,但无法完全清除深层病灶组织,特别对于深部浸润型EMs 患者,手术创伤大,术后复发率高[2]。激素疗法对EMs 的疗效相对较差[3]。EMs 在中医学根据临床特点归属于“痛经”“癥瘕”、“不孕”等病之中。首批国家级名老中医、国家突出贡献专家裘笑梅先生行医于钱塘一带,于临证治疗中审因论证,创立治疗EMs 的代表性方药——裘氏内异方,并已于临床应用数十余年,治疗病例数万例,具有确切的疗效[4-6]。但具体的作用机制尚不明确。本研究通过超高效液相色谱-飞行时间质谱联用技术(UPLC-Q/TOF-MS)联合网络药理学筛选裘氏内异方治疗EMs 的有效活性成分和有效作用靶点,预测裘氏内异方干预EMs 的可能机制,并应用动物模型实验来验证潜在靶点和作用机制,以明确裘氏内异方治疗EMs 的合理性和实用性。
1 材料与方法
1.1 试验药物 裘氏内异方(忍冬藤、红藤各15 g,白毛藤10 g,延胡索15 g,赤芍12g,山楂15 g,大麦芽30 g,半枝莲、川牛膝各15 g,白花蛇舌草10 g,紫丹参20 g,香茶菜、山海螺、威灵仙各15 g,淫羊藿12 g),由中医药大学附属第一医院中药房提供,常规方法煎煮2 次,第1 次加10 倍量水,第2 次加8 倍量水,分别提取1 h,纱布过滤,浓缩至原药材浓度为0.63、1.25、2.5 g/mL 混悬液,分装,置于-20 ℃冰箱保存备用。裘氏内异方供试品溶液制备:取原药液0.5 mL,加0.5 mL 超纯水稀释,涡旋1 min;取0.5 mL 稀释液,再加0.5 mL 甲醇,涡旋1 min,14 000 r/min 离心20 min,取上清液。孕三烯酮胶囊(北京紫竹药业公司,2.5 mg/粒,批号:H19980020)。取1 粒孕三烯酮胶囊,将内容物加50 mL 纯水溶解,配制成0.05 g/mL药液。
1.2 动 物 6~8 周龄雌性SD 大鼠60 只,体质量(180~220)g,由上海吉辉实验动物饲养有限公司提供,动物生产许可证号:SCXK(沪)2022-0009。在浙江鹰旸医药研发有限公司实验动物中心进行试验,动物实验条件合格证号:SYXK(浙)2021-0033。饲养环境:室温20~26 ℃,空气湿度50%~60%,12 h/12 h明暗交替,换风次数15~20 次/h,饲养3~5 d。本研究遵循国家制订的实验动物管理与使用指南,动物实验伦理审查批准号:ZJEY-20220630-02。
1.3 主要试剂及仪器 苏木素(sigma,批号:H3136);血管内皮生长因子A(VEGFA) 抗体(Affinity,批号:AF5131);丝氨酸/苏氨酸激酶1(AKT1) 抗体(Affinity,批号:AF0836);磷酸化AKT1(p-AKT1)(Thr308)抗体(ffinity,批号:AF0832);磷脂酰肌醇3-激酶(PI3K)p85 alpha 抗体(Affinity,批号:AF6241);磷 酸 化PI3K (p-PI3K)p85 alpha(Tyr607)抗体(Affinity,批号:AF3241);抗兔二抗IgG,HRP-linked 抗体(CST,批号:7074);抗鼠二抗IgG,HRP-linked 抗 体(CST,批 号:7076);SYBR Green qPCR 试剂盒(翌圣生物科技(上海)股份有限公司,货号:11201ES08);EZ-10 总RNA 小量提取试剂盒(生工生物工程(上海)股份有限公司,B618583-0100)。SCIEX X-500R 四级杆飞行时间质谱仪(美国AB SCIEX 公司);TurboIonSpray 离子源(美国AB SCIEX 公司);Waters ACQUITY I-Class Plus UPLC超高效液相色谱系统(美国沃特斯公司);Thermo ST40R 低温高速离心机(美国赛默飞公司);IKA 微型涡旋混合仪(德国艾卡公司);AUW220D 电子天平(日本岛津公司);低温高速离心机(Thermo,Micro17R);正置光学显微镜(日本尼康,Nikon Eclipse Ci-L);罗氏LightCycler 96 实时荧光定量PCR 仪(罗氏,LightCycler 96);mRNA 定量仪(Thermo Scientific,Nanodrop one)。
1.4 方 法
1.4.1 网络药理学分析
1.4.1.1 网络药理学分析数据库与软件 中药系统药理学分析平台(TCMSP,http://tcmspw.com/tcmsp.php,检索时间:2022 年5 月6 日);人类基因数据库(GeneCards,https://www.genecards.org/,检 索 时 间:2022 年5 月17 日);在线人类孟德尔遗传数据库(OMIM,http://www.omim.org/,检索时间:2022 年5 月12 日);蛋白质数据库(UniProt,http://www.uniprot.org/uploadlists/,检索时间:2022 年5 月17 日),Dis-GeNET 数 据 库(https://www.disgenet.org/);DRUGBANK 数据库(https://www.drugbank.ca/);Venny2.1.0数 据 库(http://bioinfogp.cnb.csic.es/tools/venny/);STRING 网站(https://string-db.org/);生物学信息注释数据库(DAVID,https://david.ncifcrf.gov/,检索时间:2022 年5 月26 日)。
1.4.1.2 裘氏内异方有效活性成分筛选 通过UPLCQ/TOF-MS 结合文献检索筛选出裘氏内异方有效活性成分。
1.4.1.3 裘氏内异方有效活性成分的靶标及EMs 相关靶点基因的获取 在TCMSP 数据中分别以裘氏内异方有效活性成分作为关键词进行检索,获取其作用靶标。利用Uniprot 数据库,限定物种为“Human(人类)”检索对应的基因靶标。以“Endometriosis”为关键词在DisGeNET、DRUGBANK、GeneCard、OMIM数据库检索EMs 相关的靶标基因。
1.4.1.4 裘氏内异方有效活性成分-EMs 共同靶标的获取 将裘氏内异方有效活性成分对应的靶标基因与EMs 相关靶标基因进行比对,筛选出共同靶标基因。
1.4.1.5 “药物活性成分-靶点网络”构建 维恩分析获得药物与疾病的共同靶点,用图形化显示网络并进行分析和编辑的软件(Cytoscape 3.8.0)绘制“药物活性成分-靶点”网络,分析网络特征。
1.4.1.6 蛋白质-蛋白质相互作用(PPI)网络的构建与核心靶点的筛选 在蛋白质相互作用数据库(STRING https://stringdb.org/)输入裘氏内异方有效活性成分与EMs 的共同靶点,构建靶点-靶点相互作用网络图,分析网络特征。
1.4.1.7 KEGG 通路富集分析 将共同靶标基因导入DAVID 中,进行KEGG 通路富集分析,得到通路富集结果。选取P<0.01 生物过程和通路,并且按照基因富集数从大到小筛选出排列前20 名的生物过程和通路。检索文献,筛选出可能的裘氏内异方治疗EMs 的通路。
1.4.2 动物实验验证
1.4.2.1 动物模型制备 依据既往课题EMs 模型大鼠造模经验[7],将雌性SD 大鼠适应性饲养3 d 后,戊酸雌二醇(0.2 mg/kg 体质量)灌胃,每日1 次,连续3 d,使各组大鼠动情期趋于一致(进行阴道涂片,可见大量无核角化细胞)。末次给戊酸雌二醇后禁食12 h,腹腔注射水合氯醛麻醉,备皮后开腹,结扎并剪取大鼠左侧子宫约0.5 cm,将子宫于无菌生理盐水中纵向剪开,以可吸收手术丝线订于腹壁上(内膜贴向腹壁),关腹。术后腹腔注射头孢呋辛钠抗感染,每日1次,连续5 d。4 周后,大鼠麻醉再次开腹,观察子宫内膜移植部位,若见到内膜生长为透明囊泡,内有液体积聚,则为造模成功。另设假手术组,仅开腹后剪去子宫周围脂肪组织,关腹。
1.4.2.2 分组给药 将假手术组(正常组)大鼠和成模的造模组(共60 只)大鼠按照随机数表法分为正常组、模型组、孕三烯酮组和裘氏内异方高(QNY-H组,2.5 g/mL 药液灌胃)、中(QNY-M 组,1.25 g/mL 药液灌胃)、低剂量组(QNY-L 组,0.63 g/mL 药液灌胃),每组10 只,正常组和模型组予生理盐水(10mL/kg)灌胃,每日1 次;孕三烯酮组予孕三烯酮药液0.26 mg/kg 灌胃,每周2 次,每次1 mL,其余时间点予生理盐水10 mL/kg 灌胃,连续4 周。测定异位内膜面积变化后用眼科剪剪取异位子宫内膜组织及正常组大鼠子宫内膜,取部分内膜组织立即放入10%中性甲醛中固定,剩余内膜组织迅速放入液氮中速冻,置于-80 ℃冰箱保存。
1.4.2.3 子宫异位内膜面积及Di Paola R 评分测定末次给药后,大鼠禁食12 h,称重。皮下注射2%戊巴比妥钠(40 mg/kg)麻醉大鼠,开腹,以游标卡尺分别测量异位内膜长径,短径;以子宫内膜异位病灶体积(mm3)=1/2×长径×短径2,比较不同组间异位内膜面积变化。根据Di Paola R 评分系统[8]计算子宫内膜异位病变的粘连评分。粘连评分:无病变,计0 分;粘连累及宫腔体积<1/3,膜性粘连,计1 分;粘连累及宫腔体积<2/3,肌性粘连,计2 分;粘连累及宫腔体积>2/3,肌性粘连,计3 分;粘连累及宫腔体积>2/3,结缔组织性粘连,计4 分。
1.4.2.4 病理形态学观察 切除异位内膜,去除周围脂肪组织,随后进行多聚甲醛固定-石蜡包埋-切片-苏木精-伊红染色处理,光镜下观察异位内膜细胞显微结构,电镜观察异位内膜细胞超微组织学结构。
1.4.2.5 PI3K、p-PI3K、AKT、p-AKT、VEGFA 蛋白表达水平测定 采用商品化定量Western blot 化学发光试剂盒和PVDF 膜检测PI3K、p-PI3K、AKT、p-Akt、VEGFA 蛋白水平,严格按照说明书操作步骤进行操作。
1.4.2.6 qRT-PCR 检测子宫异位内膜组织PI3K、AKT mRNA 的表达水平 Trizol 法提取组织总RNA,逆转录后,实时定量PCR 检测各组异位内膜中PI3K、AKT mRNA 的表达,qRT-PCR 所用引物序列信息见表1,由生工生物工程(上海)股份有限公司提供。
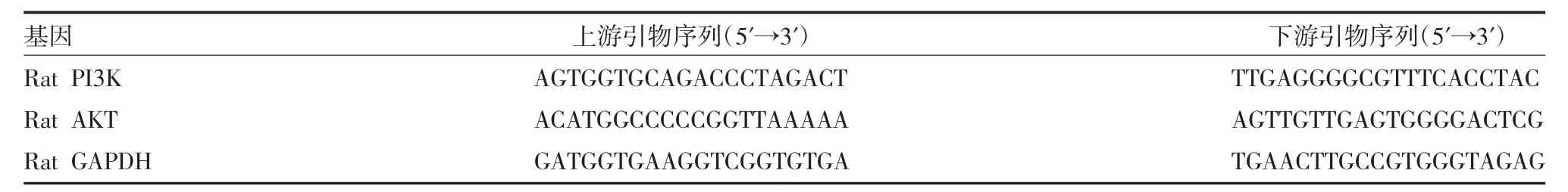
表1 引物序列
1.4.2.7 统计学方法 应用SPSS 23.0 统计软件进行数据分析,多组间计量资料若符合正态分布且符合方差齐性检验,用One-way-ANOAY 单因素方差分析,进一步组间两两比较采用Turkey 检验;若符合正态分布但方差不齐,则采用Dunnett’s T3 检验或独立样本t 检验;若不符合正态分布,则采用Kruskal-Wallis H 检验。显著性水平α=0.05。所有数据以均值±标准差(±s)表示,P<0.05 为差异有统计学意义。
2 结 果
2.1 网络药理学预测
2.1.1 裘氏内异方有效活性成分 对裘氏内异方供试品溶液进UHPLC-Q/TOF-MS 系统分析,得到复方提取液总离子流图,通过与SCIEX OS 软件自带的中药二级数据库中化合物TCM MS/MS Library 的一级精确质量数、同位素分布比和MS/MS 比较与筛选,在正离子模式下归属色谱峰64 个,在负离子模式下归属色谱峰52 个,见图1。结合文献检索获得裘氏内异方的主要活性成分共19 个,见表2。
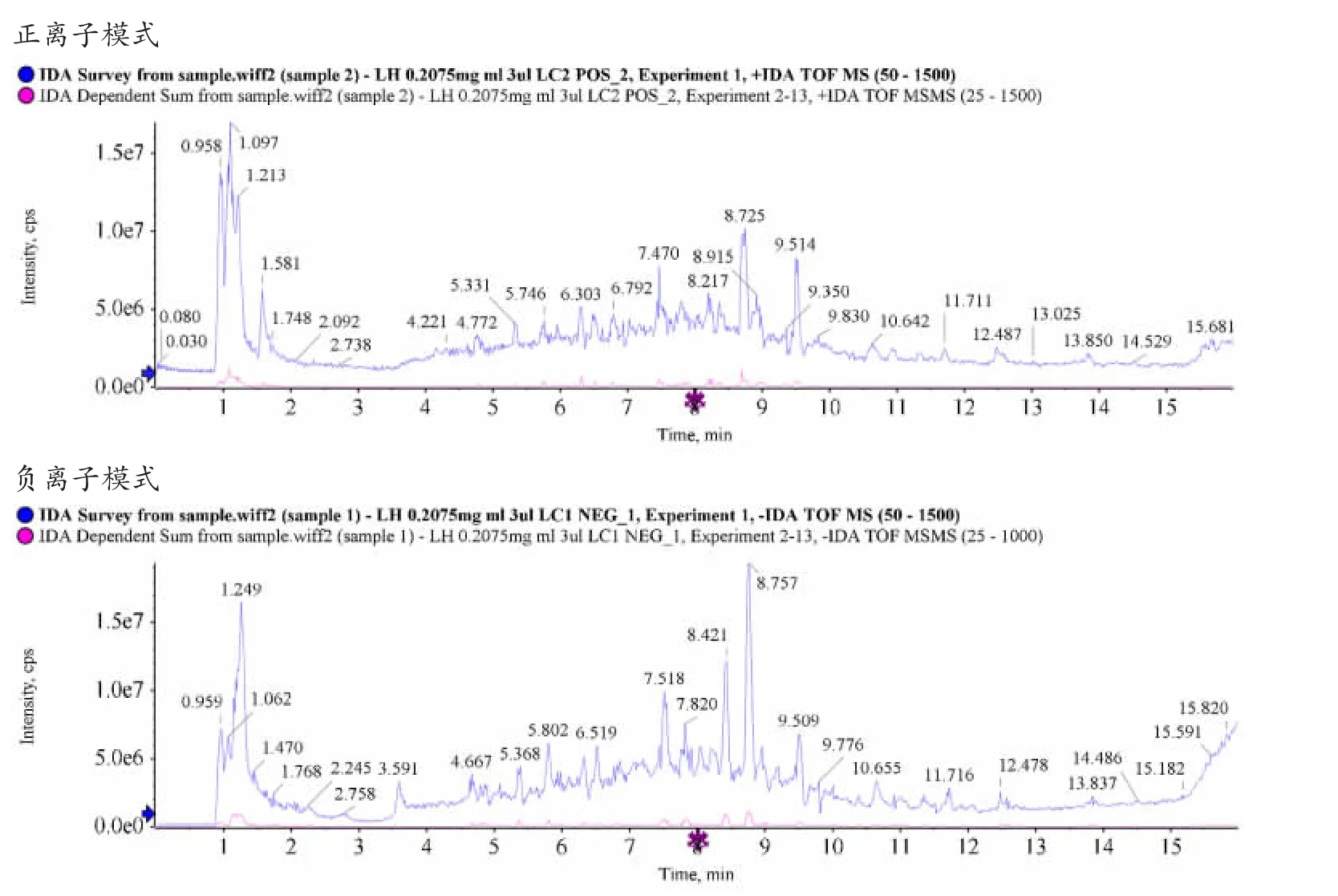
图1 超高效液相色谱-飞行时间质谱联用技术总离子流图(正负模式)

表2 裘氏内异方水煎剂可能的治疗EMs 的活性成分
2.1.2 裘氏内异方有效活性成分对应的靶标基因及EMs 靶标基因 在TCMSP 上检索筛选出的19 个裘氏内异方主要活性成分对应的靶标共240 个,通过Uniprot 数据库将靶标转换为靶标基因。从Dis-GeNET、DRUGBANK、GeneCards、OMIM 数据库获得了3816 个EMs 的相关靶标基因。
2.1.3 药物与疾病的共同靶标基因 将裘氏内异方有效活性成分对应的靶标基因与EMs 相关靶标基因进行比对,筛选出共同靶标基因132 个,通过微生信网站绘制VENN 图,见图2。
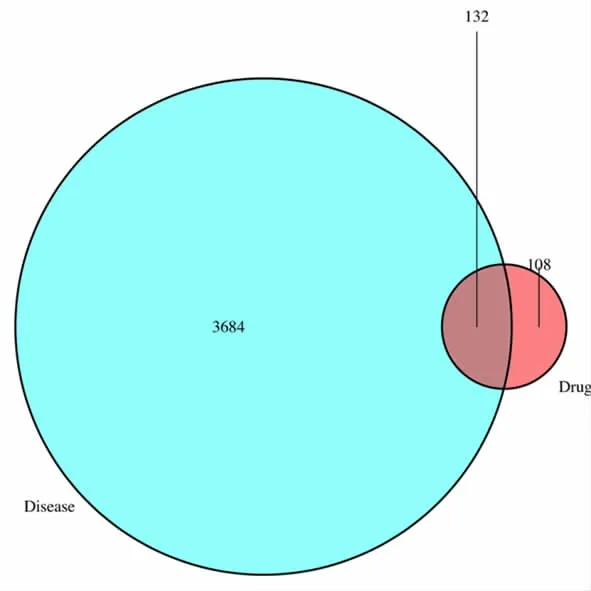
图2 药物靶点与疾病靶点VENN 图
2.1.4 “活性成分-作用靶点”可视化网络分析 将19 个活性成分及132 个交集靶点数据导入Cytoscape3.7.2 软件,构建成分-靶点网络图,并删除与网络图连接不紧密的节点,结果显示19 种活性成分协同作用于132 个调节靶点,体现了裘氏内异方的多成分、多靶点的作用特点,见图3。
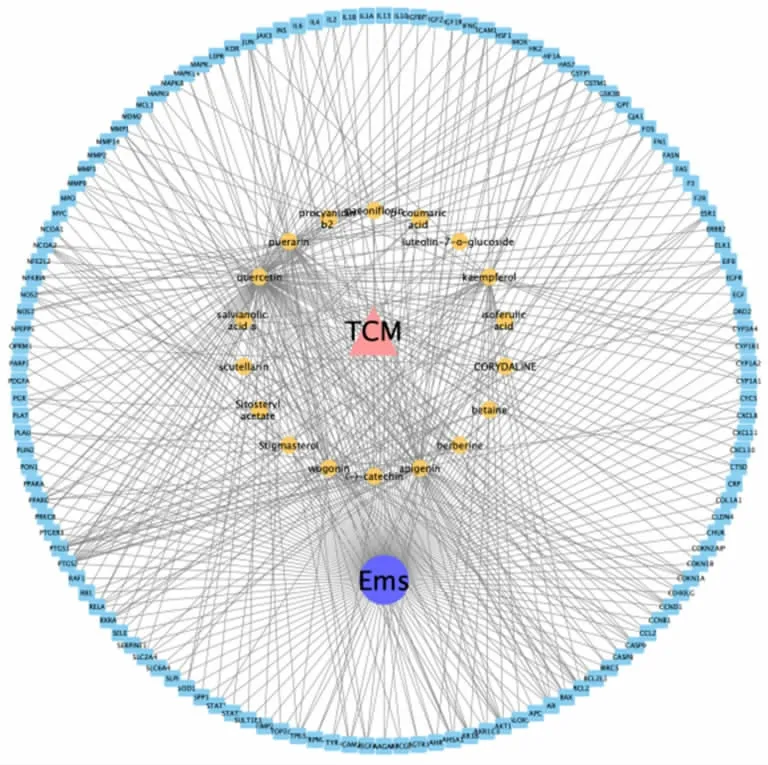
图3 活性成分-作用靶点网络
2.1.5 PPI 网络构建 将裘氏内异方可能治疗EMs的132 个作用靶标导入STRING 数据库,设置置信度得分(confidence score)为0.900,获取相互作用关系,见图4。统计其连接数,排序前20 的基因见图5。
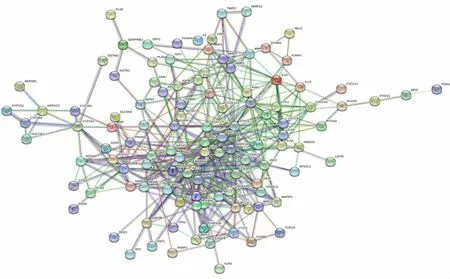
图4 裘氏内异方治疗心EMs 的核心作用靶点PPI 图
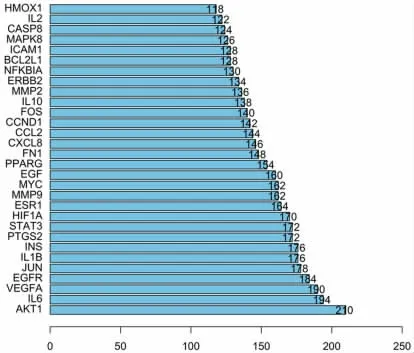
图5 PPI 中的核心基因
2.1.6 KEGG 通路富集分析 将共同靶标基因导入DAVID 中,进行KEGG 通路富集分析,得到通路富集结果。选取P<0.001 生物过程和通路,并且按照基因富集数从大到小筛选出排列前20 名的生物过程和通路,见图6。结合文献检索,发现PI3K 信号通路可能是裘氏内异方治疗EMs 主要作用机制之一。

图6 裘氏内异方有效活性成分作用靶点的KEGG 通路富集分析
2.2 动物实验验证
2.2.1 裘氏内异方对子宫异位内膜体积及Di Paola R 评分结果的影响 与正常组比较,模型组大鼠子宫异位内膜体积和Di Paola R 评分均显著上升(P<0.01);与模型组比较,孕三烯酮组和裘氏内异方高、中、低剂量组大鼠子宫异位内膜体积和Di Paola R评分均显著下降(P<0.05 或P<0.01),可见表3、图7。

图7 大鼠异位内膜面积变化情况
表3 各组大鼠异位内膜体积及Di Paola R 评分比较(±s)
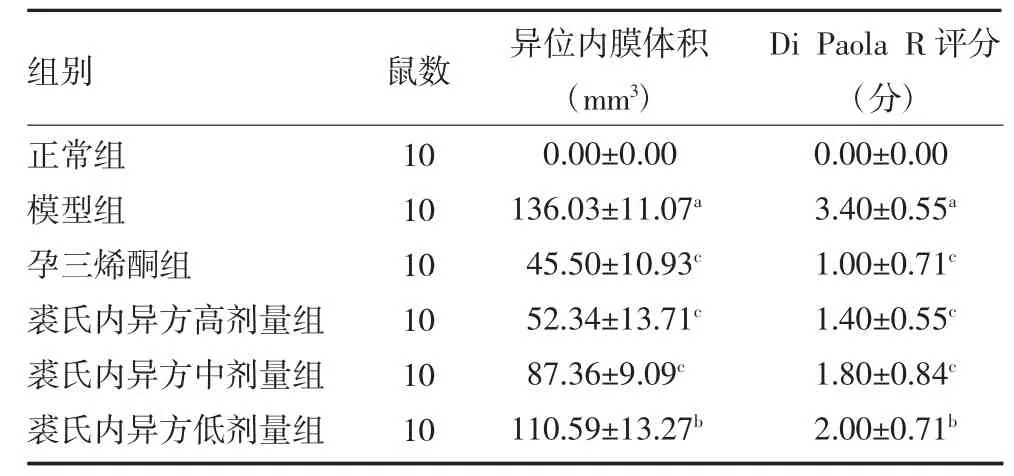
表3 各组大鼠异位内膜体积及Di Paola R 评分比较(±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别正常组模型组孕三烯酮组裘氏内异方高剂量组裘氏内异方中剂量组裘氏内异方低剂量组鼠数10 10 10 10 10 10异位内膜体积(mm3)0.00±0.00 136.03±11.07a 45.50±10.93c 52.34±13.71c 87.36±9.09c 110.59±13.27b Di Paola R 评分(分)0.00±0.00 3.40±0.55a 1.00±0.71c 1.40±0.55c 1.80±0.84c 2.00±0.71b
2.2.2 裘氏内异方对子宫异位内膜病理形态的影响HE 染色结果显示,正常组大鼠子宫结构基本正常,上皮细胞排列基本整齐、致密,模型组大鼠子宫结构遭到破坏,上皮细胞排列不规则,部分出现脱落,间质细胞结构疏松,组织间隙增大;与模型组比较,孕三烯酮组和裘氏内异方高、中、低剂量组大鼠子宫组织在损伤、间隙增大、间质细胞疏松等情况上均有显著改善,改善程度从高到低依次为:孕三烯酮组和裘氏内异方高剂量组>裘氏内异方中剂量组>裘氏内异方低剂量组,见图8;与正常组比较,模型组大鼠子宫HE 评分显著上升(P<0.01);与模型组比较,孕三烯酮组、裘氏内异方高、中、低剂量组大鼠子宫的HE 评分均显著下降(P<0.01 或P<0.05),见表4。

图8 各组大鼠子宫病理学改变(HE 染色,200 倍:100μm,400 倍:50μm)
表4 各组大鼠子宫HE 染色评分比较(分,±s)

表4 各组大鼠子宫HE 染色评分比较(分,±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别正常组模型组孕三烯酮组裘氏内异方高剂量组裘氏内异方中剂量组裘氏内异方低剂量组鼠数10 10 10 10 10 10 HE 染色评分0.33±0.58 4.00±0.00a 1.33±0.58c 1.33±0.58c 1.67±0.58c 2.33±0.58b
2.2.3 裘氏内异方对大鼠异位内膜组织PI3K、p-PI3K、AKT、p-Akt、VEGFA 蛋白表达的影响 与正常组比较,模型组内膜组织中PI3K、AKT、VEGFA 蛋白表达水平显著升高(P<0.01),p-PI3K/PI3K、p-AKT/AKT 蛋白表达水平显著性降低(P<0.01);与模型组比较,孕三烯酮组、裘氏内异方高剂量组、裘氏内异方中剂量组和裘氏内异方低剂量组内膜组织中PI3K、AKT、VEGFA 蛋白表达水平均降低(P<0.05 或P<0.01),p-PI3K/PI3K、p-AKT/AKT 蛋白表达水平均升高(P<0.05 或P<0.01),孕三烯酮组和裘氏内异方高剂量组作用更显著,见图9、表5。
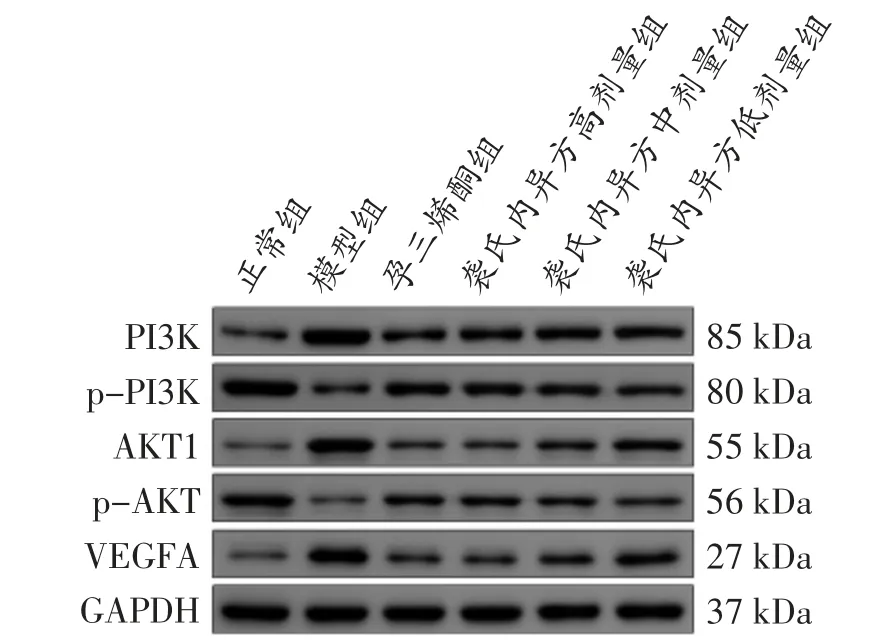
图9 内膜组织中PI3K、p-PI3K、Akt、p-Akt、VEGFA 蛋白表达条带图
表5 各组PI3K、p-PI3K、AKT、p-AKT、VEGFA 蛋白表达水平比较(±s)
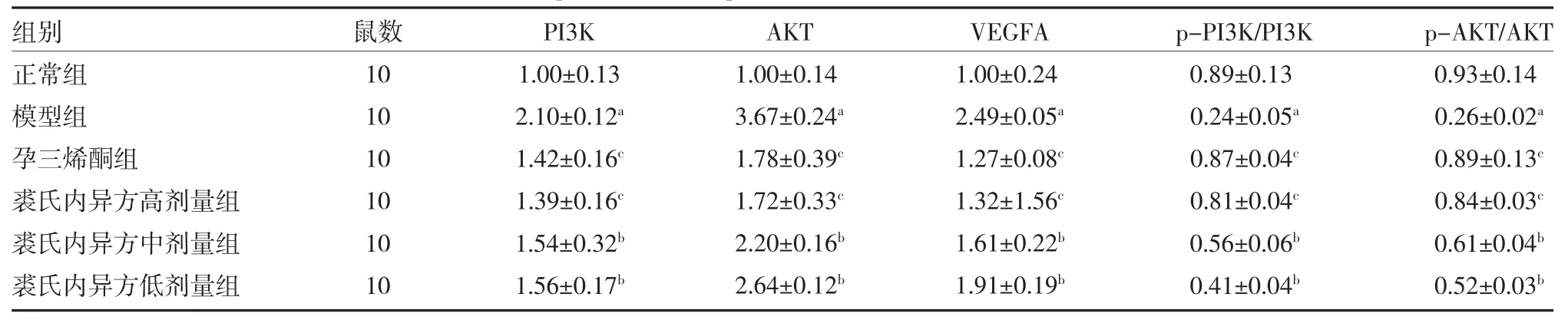
表5 各组PI3K、p-PI3K、AKT、p-AKT、VEGFA 蛋白表达水平比较(±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;PI3K 为磷脂酰肌醇3-激酶;p-PI3K 为磷酸化PI3K;AKT 为丝氨酸/苏氨酸激酶;p-AKT 为磷酸化AKT;VEGFA 为血管内皮生长因子A
组别正常组模型组孕三烯酮组裘氏内异方高剂量组裘氏内异方中剂量组裘氏内异方低剂量组鼠数10 10 10 10 10 10 PI3K 1.00±0.13 2.10±0.12a 1.42±0.16c 1.39±0.16c 1.54±0.32b 1.56±0.17b AKT 1.00±0.14 3.67±0.24a 1.78±0.39c 1.72±0.33c 2.20±0.16b 2.64±0.12b VEGFA 1.00±0.24 2.49±0.05a 1.27±0.08c 1.32±1.56c 1.61±0.22b 1.91±0.19b p-PI3K/PI3K 0.89±0.13 0.24±0.05a 0.87±0.04c 0.81±0.04c 0.56±0.06b 0.41±0.04b p-AKT/AKT 0.93±0.14 0.26±0.02a 0.89±0.13c 0.84±0.03c 0.61±0.04b 0.52±0.03b
2.2.4 裘氏内异方对大鼠异位内膜组织PI3K、Akt mRNA 表达的影响 与正常组比较,模型组异位内膜组织中PI3K、Akt mRNA 的表达水平显著升高(P<0.01);与模型组比较,孕三烯酮组、裘氏内异方高剂量组、裘氏内异方中剂量组、裘氏内异方低剂量组异位内膜组织中PI3K、Akt mRNA 的表达水平显著降低(P<0.05 或P<0.01),见表6。
表6 各组PI3K、AKT mRNA 表达水平比较(±s)

表6 各组PI3K、AKT mRNA 表达水平比较(±s)
注:PI3K 为;AKT 为;与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别正常组模型组孕三烯酮组裘氏内异方高剂量组裘氏内异方中剂量组裘氏内异方低剂量组孔数333333 PI3K/GAPDH 1.00±0.07 2.91±0.21a 1.30±0.08c 1.35±0.04c 1.597±0.16c 2.34±0.25c Akt/GAPDH 1.00±0.09 1.96±0.18a 1.16±0.12c 1.14±0.11c 1.26±0.13c 1.59±0.14b
3 讨 论
EMs 的发生与激素、免疫、炎症、基因、表观遗传学、血管新生等有关,发病机制复杂,治疗难度大,因此,在深入研究EMs 的发病机理同时,寻找有效的药物治疗靶点,具有重要的临床意义。江浙一带多雨多湿,湿郁化热致瘀热内阻,故江浙钱塘地区患者多以瘀热互结为主证,治疗多以清化瘀热为主,兼顾扶正[9]。裘氏内异方是浙派裘氏妇科治疗EMs 的代表方剂,方中忍冬藤、红藤、白毛藤,三藤合用清热解毒、活血祛瘀和通络散结之效强,为君药;延胡索、大麦芽、炒山楂、川牛膝活血散结、行滞逐瘀止痛,四者合用共助化瘀止痛之效,为臣药;赤芍、香茶菜、山海螺、白花蛇舌草、半枝莲解毒消肿,活血散瘀,紫丹参养血调经安神,活血祛瘀止痛,《妇科明理论》中有“一味丹参,功同四物”之说,共为佐药;威灵仙、淫羊藿温阳通脉、辛散能走,并能引领诸药直达病所,为使药。综观全方,寒热并用,气血两调,药专力强,共同发挥清化逐瘀的功效,从而瘀消湿祛热清,气行血畅痛止。裘氏内异方临床疗效确切,但机制未明,故本研究结合网络药理学和实验验证来研究裘氏内异方治疗EMs 的分子机制。
3.1 网络药理学分析 网络药理学是目前广泛用来预测复方中药治疗机制的方法之一。在临床实际中,复方中药主要是通过水煎剂口服的方式达到治疗作用,但复方水煎剂在煎煮过程中部分药材中的化学成分未能转移到汤剂中,或者在多种成分的协同作用下,部分化学成分的生物利用度发生改变,从而使得水煎剂的化学成分并不是简单的生药活性成分的相加[10]。而目前多数文献中中药网络药理学研究指标均以各数据库中收集的生药化学成分及其口服生物利用度为筛选条件,使得网络药理学预测结果可能存在偏差[11]。考虑到药效成分对研究结果准确性的重要影响,本研究采用UHPLC-Q/TOF-MS,结合文献检索筛选出木犀草苷、槲皮素、柚皮素、延胡索甲素、淫羊藿苷、葛根素、汉黄芩素等19 种裘氏内异方水煎剂有效活性成分,大多具有抗炎、镇痛、抗氧化应激及免疫调节等作用[12-14]。槲皮素可通过下调封闭蛋白6(CLDN6)表达,抑制整合素链接激酶(ILK)信号通路,抑制子宫异位内膜生长[15];淫羊藿苷可降低血清中的肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)与异位组织中的核因子-κB(NF-κB)与磷酸化NF-κB(p-NF-κB)的水平,使异位内膜组织中黏膜上皮变薄、腺体减少、移植萎缩异位内膜[16]。木犀草苷和山柰酚具有调节脂代谢异常、抗炎、免疫调节和抗氧化,抑制肿瘤细胞增殖、侵袭和转移等多种功效[17]。葛根素具有止痛、抗癌、抗炎的作用[18]。有研究表明葛根素可抑制细胞外调节蛋白激酶(ERK)的磷酸化,竞争性结合雌激素受,降低环氧合酶-2(COX-2)的表达,从而抑制异位内膜细胞增殖[19]。通过构建PPI 网络,发现AKT1、IL-6、VEGFA、Jun(JUN)等靶点“Degree”值最高,这些靶点在裘氏内异方治疗EMs 的生物过程中可能起到关键作用。AKT1 是编码丝氨酸/苏氨酸激酶的基因,参与细胞存活、生长、增殖等生物过程,其可通过降低细胞凋亡率促进细胞存活[20];血管内皮生长因子(VEGF)是一种强效特异性血管生成因子,可直接作用于内皮细胞而促进血管新生,加快在位子宫内膜异常转移及异位子宫内膜的增生[21];IL-6 是参与机体免疫应答、具有广泛免疫调节的促炎细胞因子,具有促进异位内膜及间质细胞的增殖、侵袭、转移及促进血管生成的作用,可导致盆腔局部组织黏连及纤维化,促使EMs 异位子宫内膜病灶的形成[22]。因此裘氏内异方可能通过抑制炎性因子、免疫调节以及抑制血管新生来治疗EMs,在后续研究中可着重关注此类生物活性物质治疗EMs 中的相关作用机制。通过KEGG 通路富集分析的结果可知,EMs 与炎症、雌激素、癌症等多条通路关系密切,其中PI3K/AKT 通路为靶点富集最多的通路,该通路可被多种细胞因子激活,发挥调节细胞转录、翻译和存活的功能。PI3K 被激活后,催化产生3,4,5-三磷酸磷脂酰肌醇(PIP3),引发AKT 磷酸化,磷酸化的AKT 可通过增加异位内膜细胞的增殖及其在纤维化微环境中的维持,从而促进内异症的发生[23];诸多研究已经证实PI3K-AKT 通路在EMs 的发生发展过程中发挥重要作用,该途径的激活可诱导血管内皮细胞生长,异位内膜细胞增殖和侵袭能力增强,加速EMs 的发展进程[24-26]。因此本研究推测裘氏内异方可能通过干预PI3K-AKT 信号通路治疗EMs。
3.2 动物试验分析 结合本实验数据显示,裘氏内异方各剂量均可缩小EMs 大鼠子宫异位内膜面积,降低Di Paola R 评分、子宫HE 评分及PI3K、AKT、VEGFA 蛋白表达水平,其中以高剂量组作用更加显著。说明抑制PI3K-AKT 通路可能是裘氏内异方的治疗机制,且效果与其剂量正相关。初步证实了网络药理学的预测结果具有一定的科学性。
综上所述,本研究对裘氏内内异方治疗EMs 的成分、靶点和作用机制进行了预测和验证。阐明了裘氏内异方多成分、多靶点、多通路治疗EMs 的作用特点,研究结果明确了裘氏内异方治疗EMs 的合理性和实用性,为裘氏内异方临床新应用、新型中药制剂研发和进一步的实验研究提供理论依据和参考,有助于裘氏内异方临床治疗EMs 的推广应用。但由于网络药理学本身所具有的局限性以及中药、疾病靶标众多等诸多元素,本研究获得的结果可能存在一定的偏差,因此课题组后期将围绕物质基础-药效学评价-机制验证等开展进一步研究。

