枯草芽孢杆菌DC⁃1产维生素K2的发酵条件优化
黄友美,曹盛,孙一斐,李诗敏,夏雪雪,袁干军*
(1.江西农业大学生物技术药物研发工程中心,江西南昌 330045;2.江西农业大学生物科学与工程学院,江西南昌 330045)
维生素K2又称为甲基萘醌(menaquinone,MK),是甲基萘醌母环和3 号位上可变侧链异戊二烯相连所产生的一系列同系物的总称,用MK⁃n(n=1~14)表示,n为侧链异戊二烯数目[1]。维生素K2是人体所必需的一类重要的脂溶性维生素,研究表明其在骨质疏松、心血管疾病、神经系统疾病、癌症等疾病的治疗方面发挥着重要作用[2⁃6]。近年来,维生素K2的安全性和可靠性已经得到各国权威机构的认证。2001年日本首先批准了维生素K2作为治疗骨质疏松的药物[7],2008年美国批准维生素K2作为食品和强化食品添加剂,2009年欧洲食品安全局允许将维生素K2添加到食品中[8],2016年我国开始允许维生素K2作为食品营养强化剂添加到儿童和孕产妇用的调制乳粉中[9]。维生素K2的来源包括从动物、植物或食品中提取,化学合成和微生物生产。由于天然来源的维生素K2含量很低,化学合成法已被用于维生素K2的工业化生产,但其存在产物活性低、易产生副产物以及污染环境等缺点[10]。相对而言,微生物发酵生产维生素K2具有发酵原料易得、成本低、反应温和以及产物半衰期更长等优势[11],因此利用微生物发酵法生产维生素K2具有广阔的应用前景。
研究发现不同菌株能产生不同类型的维生素K2。一些肠道细菌如乳酸菌能产MK⁃5~MK⁃10 的MK 同系物[12];枯草芽孢杆菌能产MK⁃4~MK⁃8 的MK 同系物,其中MK⁃7 占大多数[13];黄杆菌属主要产MK⁃4 和MK⁃6[14⁃15]。同时,一些新菌株也被发现能够合成MK系列化合物,如MK⁃8、MK⁃9、MK⁃10[16⁃18]。目前,研究发现的所有维生素K2产生菌中,芽孢杆菌由于具有较长的安全使用历史和高产MK⁃7 能力,被认为是微生物发酵生产维生素K2的潜在菌株。在MK 同系物中,MK⁃7 由于在血液中半衰期较长且生物利用度高,是目前研究最多的维生素K2形式[19]。研究发现不同类型的维生素K2同系物的生理活性和生物利用度存在差异[20],因此获得维生素K2一系列同系物并探索其药理活性和构效关系可为利用维生素K2精准治疗疾病提供理论依据。目前大多数研究集中在优化维生素K2产生菌的发酵条件以提高MK⁃7 产量。Berenjian 等[21]优化纳豆芽孢杆菌发酵条件后MK⁃7 最大浓度可达到(62.32±0.34)mg/L。汤贵祥等[22]优化解淀粉芽孢杆菌发酵条件后该菌株合成MK⁃7 的最高产量达到70 mg/L以上。目前尚无通过优化发酵条件以增加微生物产维生素K2同系物多样性相关研究。
前期建立了高效液相色谱⁃紫外(high performance liquid chromatography⁃ultraviolet,HPLC⁃UV)筛选法筛选得到一株维生素K2产生菌枯草芽孢杆菌DC⁃1 且能分析产MK 同系物种类[23⁃24]。在此基础上,本研究首先通过单因素试验考察培养基组分对枯草芽孢杆菌DC⁃1 产MK 多样性和MK⁃7 产量的影响,进行Plackett⁃Burman(PB)试验筛选显著影响因素,再以MK⁃7 产量为响应值,利用响应面试验设计确定最佳产维生素K2发酵条件,旨在为微生物发酵法合成维生素K2的工业化生产提供参考意义以及探索维生素K2同系物的生理功能和构效关系提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
枯草芽孢杆菌DC⁃1 由江西农业大学生物科学与工程学院生物技术药物研发工程中心前期分离、筛选、鉴定并保藏,GeneBank 序列ID 为MG266437.1。
1.1.2 试剂及培养基
维生素K3(MK⁃0)标准品(≥99.8%):默克化工技术(上海)有限公司;甲醇(色谱纯):西陇化工股份有限公司;异丙醇(色谱纯):德国SIMARK 公司;正己烷(分析纯):国药集团化学试剂有限公司;葡萄糖、玉米浆、葡萄糖糖蜜、黄豆粉、甘油、蛋白胨、MgSO4·7H2O、KH2PO4、K2HPO4·3H2O、NaCl(均为分析纯):北京奥博星生物技术有限公司。
种子培养基:葡萄糖15 g、蛋白胨15 g、MgSO4·7H2O 2.5 g、KH2PO41 g、K2HPO4·3H2O 2.5 g,水1 000 mL、pH7.0~7.2。
初始发酵培养基:葡萄糖15 g、黄豆粉40 g、K2HPO4·3H2O 0.5 g、KH2PO41 g、NaCl 3 g,水1 000 mL、pH7.0~7.2。
1.2 仪器与设备
高效液相色谱仪(Waters e2695)、检测器(2998e⁃PDA):美国Waters 公司;C18 高效色谱柱(250 mm×4.6 mm,5µm):大连依利特分析仪器有限公司;真空冷冻干燥机(SCIENTZ⁃10):宁波新芝生物科技股份有限公司;质谱仪(TripleToF 5600⁃1):美国AB SCIEX 公司。
1.3 方法
1.3.1 菌株活化与培养
将保藏的菌种接到种子培养基中,在37 ℃、110 r/min 条件下培养24 h 作为种子液。并以1% 的接种量接种到发酵培养基中,于pH7.0、37 ℃条件下静置培养3 d。
1.3.2 维生素K2标准曲线的绘制
参考文献[24]的方法测定,在避光的条件下,称取恒重的MK⁃0 标准品,置于10 mL 容量瓶中,用流动相甲醇∶异丙醇(4∶1,体积比)溶解、定容。试验前摇匀后,过0.45µm 滤膜,所得滤液作为标准品储备液。再用流动相将储备液稀释成浓度梯度为1、2、3、4、5、6、7 mg/L的标准曲线工作液,采用高效液相色谱仪在248 nm 波长处检测峰面积。以MK⁃0 标准品的浓度为横坐标、峰面积为纵坐标,绘制标准曲线。
1.3.3 维生素K2的提取与测定
菌株DC⁃1 的发酵培养物以4 000 r/min 的转速离心10 min,收集菌体和菌液。菌体-18 ℃冷冻过夜,然后将冷冻干燥所得菌体研磨成粉末。称取0.1 g 菌体加入萃取液A[甲醇∶异丙醇溶液(4∶1,体积比)]2 mL,涡旋振荡1 min,超声15 min,静置过夜。将萃取液B[正己烷∶异丙醇溶液(2∶1,体积比)]加入到菌液中(4∶1,体积比),静置过夜,收集上层液体(正己烷层),合并萃取液A 和萃取液B,40 ℃下减压干燥,得到黄色油状液体,于2 mL 容量瓶中用流动相定容,过0.45µm 微孔滤膜后作为样品供试液,采用HPLC⁃UV法进行含量测定,整个过程在避光条件下完成。HPLC 条件为流动相:甲醇∶异丙醇=4∶1(体积比);流速:1.0 mL/min;柱温:25 ℃;进样量:10 µL;检测波长:248 nm。采用外标法,利用样品中维生素K2的色谱峰面积计算含量。
1.3.4 维生素K2多样性分析
根据课题组前期建立的HPLC⁃UV 筛选MK 产生菌法[18]获取色谱峰的紫外吸收曲线,分析MK 类似物的种类。
1.3.5 产物液相色谱⁃质谱联用(liquid chromatograph mass spectrometer,LC⁃MS)验证
收集高效液相中分离的MK 类似物的产物,使用高分辨率质谱分析产物结构。LC⁃MS 质谱条件:碰撞能量35 V,离子源温度500 ℃,DuoSpray 离子源,阳离子模式,起始质量50 Da,最终质量1 250 Da。
1.3.6 发酵条件的优化
1.3.6.1 碳源优化
在初始发酵培养基的基础上,以添加3 g 碳源进行优化试验,分别选取甘油、葡萄糖、糖蜜、甘油+葡萄糖(1∶1,质量比)、糖蜜+甘油(1∶1,质量比)、葡萄糖+糖蜜(1∶1,质量比)、葡萄糖+糖蜜+甘油(1∶1∶1,质量比)7 组碳源进行单因素试验,其余发酵条件保持不变。使用高效液相色谱分析MK 类似物种类并按照1.3.3 所述方法测定MK⁃7 的产量。
1.3.6.2 氮源优化
在初始发酵培养基的基础上,以添加3 g 氮源进行优化试验,分别选取玉米浆、蛋白胨、黄豆粉、蛋白胨+黄豆粉(1∶1,质量比)、玉米浆+黄豆粉(1∶1,质量比)、蛋白胨+玉米浆(1∶1,质量比)、蛋白胨+玉米浆+黄豆粉(1∶1∶1,质量比)7 组氮源进行单因素试验,其余发酵条件保持不变。使用高效液相色谱分析MK 类似物种类并按照1.3.3 所述方法测定MK⁃7 的产量。
1.3.6.3 无机盐优化
在添加最优碳源和氮源条件下,对发酵培养基中KH2PO4、K2HPO4·3H2O、MgSO4·7H2O、NaCl 4 种无机盐浓度进行优化,4 种无机盐的浓度梯度均设置为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 g/100 mL,按照1.3.3 所述方法测定MK⁃7 的产量。
1.3.7 Plackett⁃Burman 试验设计
根据单因素试验结果,以MK⁃7 产量为响应值,对甘油、糖蜜、蛋白胨、黄豆粉和玉米浆添加量5 个影响因素进行评价,筛选出主效应因子,每个因素取最低(-1)和最高(1)两个水平,共12 组试验。试验因素和水平取值见表1。
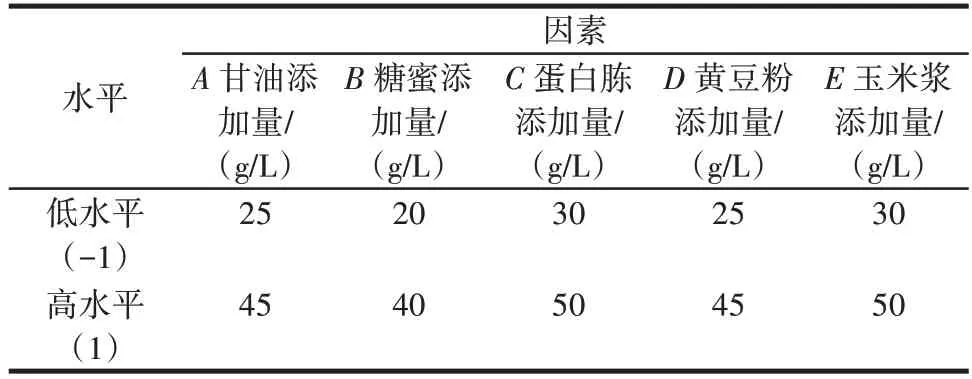
表1 Plackett⁃Burman 试验设计的因素水平Table 1 Factors and levels of Plackett⁃Burman experimental design
1.3.8 响应面试验
通过Plackett⁃Burman 设计筛选主效应因子,使用Design⁃Expert 软件进行Box⁃Behnken 中心组合设计试验,采用三因素三水平响应面法进行优化,以甘油添加量、糖蜜添加量和黄豆粉添加量为自变量,MK⁃7 产量为响应值。试验设计因素及水平见表2。

表2 Box⁃Behnken 试验设计因素和水平Table 2 Factors and levels of Box⁃Behnken experimental design
1.4 数据处理
每组试验重复3 次,数据以平均值±标准差表示,单因素试验使用Origin 8.5 软件作图,Plackett⁃Burman 试验和响应面试验采用Design⁃Expert 11 进行数据处理分析。
2 结果与分析
2.1 维生素K2 定量与定性检测
以MK⁃0 标准品的浓度为横坐标,在248 nm 波长下对应峰面积为纵坐标得到相关线性方程为y=133 066.8x+11 302.4(r=0.999 8)。依据维生素K2结构特征,以MK⁃0 标准曲线为基础,乘以校正因子即相对分子质量的比值[25],得到MK⁃7 标准曲线为y=(133 066.8x+11 302.4)×(648.490 6/172.052 4)(r=0.999 8),该线性方程可用来计算样品中MK⁃7 的浓度。
DC⁃1 菌株发酵液中初步确定为MK 类似物的色谱峰分析验证结果如图1所示。

图1 产物MK⁃7 质谱图Fig.1 Mass spectrum of product MK⁃7
由图1 可知,正离子模式下特征峰分子量为649.501 9,与正离子下MK⁃7 相对分子质量一致,可确定其为MK⁃7。
2.2 发酵条件的优化
2.2.1 碳源对枯草芽孢杆菌DC⁃1 合成MK 的影响
葡萄糖、糖蜜、甘油及混合碳源(甘油+葡萄糖、糖蜜+甘油、葡萄糖+糖蜜、葡萄糖+糖蜜+甘油)对MK⁃7产量和MK 多样性的影响如图2所示。

图2 碳源对DC⁃1 合成MK 影响Fig.2 Effect of carbon source on MK synthesis by DC⁃1
研究表明,甘油是合成MK⁃7 的最优碳源[13,26⁃27],但由图2(A)可知,使用糖蜜+甘油(1∶1,质量比)作为混合碳源时,最有利于MK⁃7 的积累。由图2(B)可知,糖蜜作为碳源时,可以增加菌株DC⁃1 产MK 类似物的种类至5 种。糖蜜作为制糖业的副产品,含有大量的可发酵糖且成分复杂,可为微生物生长提供丰富的营养成分,这可能是它作为碳源增加DC⁃1 产MK 类似物的种类的原因,且其价格便宜,是适合微生物生长的良好碳源[28]。从MK⁃7 产量、MK 多样性以及成本方面综合考虑,选用糖蜜+甘油的组合作为菌株发酵的碳源。
2.2.2 氮源对枯草芽孢杆菌DC⁃1 合成MK 的影响
蛋白胨、玉米浆、黄豆粉及混合氮源(蛋白胨+黄豆粉、玉米浆+黄豆粉、蛋白胨+玉米浆、蛋白胨+玉米浆+黄豆粉)对MK⁃7 产量和MK 多样性的影响如图3所示。

图3 氮源对DC⁃1 合成MK 影响Fig.3 Effect of nitrogen source on MK synthesis by DC⁃1
由图3(A)可知,蛋白胨作为氮源时MK⁃7 产量最高,这与Berenjian 等[21]的研究结果一致。当使用玉米浆+黄豆粉+蛋白胨(1∶1∶1,质量比)组合氮源时,MK⁃7产量略低于单独使用蛋白胨;由图3(B)可知,黄豆粉作为氮源时可以增加菌株DC⁃1 产MK 类似物的种类。玉米浆含有较为丰富的可溶性蛋白质且成本较为廉价,是适合微生物生长的良好氮源之一[29]。大豆粉不仅含有丰富的蛋白质和糖类,还含有磷、钙、镁和其他微量元素[30],这可能是它作为氮源能增加菌株DC⁃1 产MK 类似物的种类的原因。从MK⁃7 产量、MK 多样性以及成本方面综合考虑,选用玉米浆+黄豆粉+蛋白胨的组合作为氮源。
2.2.3 无机盐浓度优化
无机盐在微生物的生长和次级代谢产物的合成中起到重要作用。NaCl 能维持菌体生长的渗透压,KH2PO4、K2HPO4·3H2O 在培养基中起缓冲剂调节pH值的作用,Mg2+可能在异戊二烯侧链和萘醌母环的连接起到稳定作用,故选取KH2PO4、K2HPO4·3H2O、MgSO4·7H2O 和NaCl 4 种对菌株产MK 有较大影响的无机盐考察其对MK⁃7 合成的影响,结果如图4所示。
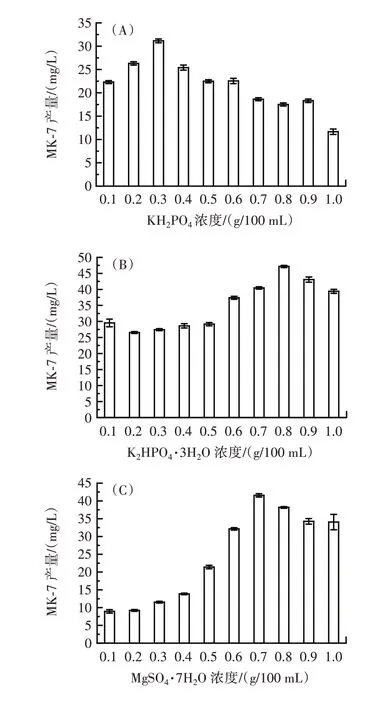

图4 无机盐添加量对MK⁃7 产量的影响Fig.4 Effect of inorganic salt addition on MK⁃7 yield
由图4 可知,4 种无机盐均对MK⁃7 的合成具有一定影响,最优添加浓度分别为KH2PO40.3 g/100 mL、K2HPO4·3H2O 0.8 g/100 mL、MgSO4·7H2O 0.7 g/100 mL、NaCl 0.5 g/100 mL。当无机盐浓度超过一定范围后,菌体产MK⁃7 能力出现下降,这与之前文献报道无机盐对微生物生长的影响一致[31⁃32]。无机盐对于微生物的生长和合成次级代谢产物具有重要影响,一般是无机盐在浓度较低时对菌体生长有促进作用,在较高浓度时会抑制菌体生长。
2.3 Plackett⁃Burman 试验设计
Plackett⁃Burman 试验设计及结果见表3,方差分析结果见表4。

表3 Plackett⁃Burman 试验设计与结果Table 3 Plackett⁃Burman experimental design and results

表4 Plackett⁃Burman 试验设计方差分析Table 4 Variance analysis of Plackett⁃Burman experimental design
由表4 可知,影响MK⁃7 产量的关键因素重要性排序依次为甘油添加量(A)>蛋白胨添加量(C)>玉米浆添加量(E)>糖蜜添加量(B)>黄豆粉添加量(D),其中甘油添加量(A)对MK⁃7 产量的影响达到极显著水平(P<0.01)。
2.4 响应面优化试验
2.4.1 响应面试验设计及结果
综合考虑PB 试验结果和单因素试验对DC⁃1 产MK 多样性的影响,选择甘油添加量(A)、糖蜜添加量(B)和黄豆粉添加量(C)3 个关键因素进行响应面优化设计和分析。Box⁃Behnken 试验设计及结果见表5。
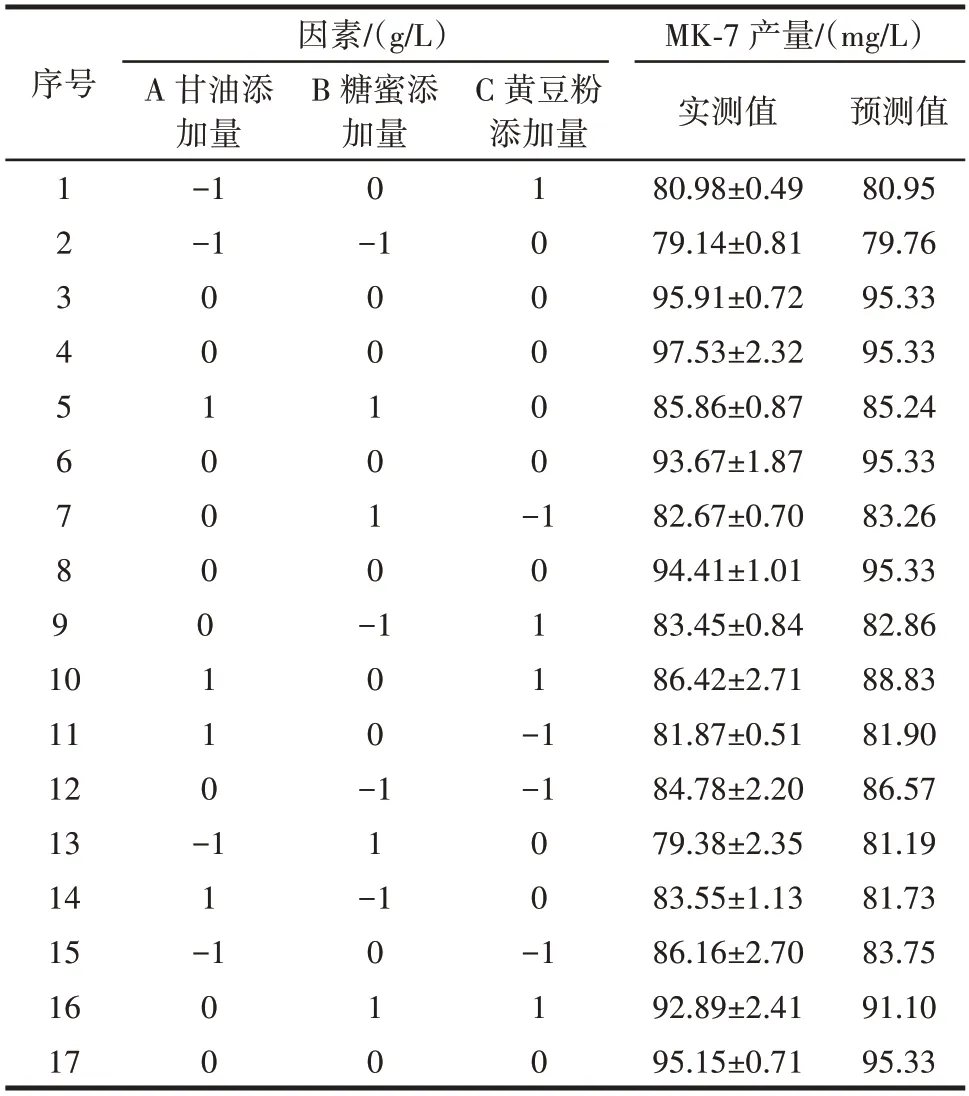
表5 Box⁃Behnken 试验设计及结果Table 5 Box⁃Behnken experimental design and results
2.4.2 结果分析
利用Design⁃Expert 软件对表5 数据进行多元回归拟合分析,得到MK⁃7 产量为响应值的回归方程:Y=95.33+1.51A+1.24B+1.03C+0.5175AB+2.43AC+2.89BC-7.72A2-5.63B2-3.76C2。对回归方程进行方差分析,结果见表6。

表6 回归方程的方差分析结果Table 6 Variance analysis results of regression equation
由表6 可知,回归模型中二次项A2、B2对MK⁃7 产量影响极显著(P<0.01),二次项C2和交互项BC对MK⁃7 产量影响显著(P<0.05),其余项不显著。对菌株DC⁃1 产MK⁃7 能力的影响大小顺序为甘油添加量>糖蜜添加量>黄豆粉添加量。该回归模型的P<0.05,方程模型显著,失拟项P=0.109 2,不显著;模型的R2=0.944 0,R2Adj=0.872 0,变异系数=2.56%,以上参数说明该模型拟合程度较好,试验误差较小,该模型可用于本次试验。
2.4.3 响应曲面分析
根据回归方程绘制甘油添加量(A)、糖蜜添加量(B)、黄豆粉添加量(C)交互作用的响应曲面如图5所示。

图5 甘油、糖蜜、黄豆粉添加量的交互作用对MK⁃7 产量影响的响应曲面Fig.5 Response surface of interaction among glycerol,molasses,and soybean flour on MK⁃7 yield
由图5 和方差分析结果可知,糖蜜添加量和黄豆粉添加量的交互作用对MK⁃7 产量的影响显著,甘油和糖蜜、甘油和黄豆粉对MK⁃7 产量的影响不显著。数学模型分析得到菌株DC⁃1 产MK⁃7 的最优发酵条件为甘油添加量36.43 g/L、糖蜜添加量31.82 g/L、黄豆粉添加量32.54 g/L,理论响应值为95.685 mg/L。结合实际操作的便利性,对上述优化结果处理后确定最优发酵条件:甘油添加量36.5 g/L、糖蜜添加量31.8 g/L、黄豆粉添加量32.5 g/L。
2.4.4 验证试验结果
在最优发酵条件下重复3 次独立试验以验证预测值,MK⁃7 产量的平均值为94.66 mg/L,与理论响应值(95.685 mg/L)相差较小,说明通过响应面优化后的发酵条件参数可靠,具有一定的实践指导价值。与优化前相比,MK⁃7 的最终产量提高了48.04%,且在该发酵条件下经HPLC⁃MS 鉴定DC⁃1 能同时产5 种维生素K2同系物。
3 结论
本研究采用单因素试验和Plackett⁃Burman 试验设计,筛选得到甘油、糖蜜和黄豆粉添加量这3 个影响菌株DC⁃1产维生素K2的关键因素。再利用Box⁃Behnken 试验设计得到最优发酵条件为甘油添加量36.5 g/L、糖蜜添加量31.8 g/L、黄豆粉添加量32.5 g/L、KH2PO4浓度0.3 g/100 mL、K2HPO4·3H2O 浓度0.8 g/100 mL、MgSO4·7H2O 浓度0.7 g/100 mL、NaCl 浓度0.5 g/100 mL,在pH7.0,温度37 ℃下静置培养。在此条件下MK⁃7 产量为94.66 mg/L,较原始发酵条件提高了48.04%,实际值与响应面预测值吻合良好。同时在该发酵条件下菌株DC⁃1产维生素K2的多样性增加,能同时产5 种维生素K2同系物,经HPLC⁃MS 鉴定为MK⁃2、MK⁃3、MK⁃4 和MK⁃7,而其中一个类似物由于极不稳定或其他原因,未能在高分辨率质谱中找到,根据保留时间推测其为MK⁃5 或MK⁃6。本研究为后续微生物发酵法合成维生素K2的工业化生产奠定基础,并为研究维生素K2一系列同系物的药理活性和构效关系提供化合物来源。

