胡萝卜、红甜椒、芹菜和紫甘蓝抗氧化相互作用
邹仕昱,彭小强,邓泽元,李红艳
(南昌大学食品学院,江西南昌 330031)
胡萝卜、红甜椒、芹菜和紫甘蓝这4 种蔬菜都是居民生活中经常食用的蔬菜,含有丰富的植物化学物质,对人体健康有着很多的益处。研究表明,蔬菜中的植物化学物,如酚类物质、类胡萝卜素等,能够降低心血管疾病、中风等慢性疾病的发病率[1]。植物化学物质按照其溶解特征可分成两类,一类为易溶于极性较强溶剂的水溶性植物化学物,如黄酮类物质、酚酸类物质等;另一类为易溶于极性较小溶剂的脂溶性植物化学物,如类胡萝卜素、植物甾醇等。
前期研究发现,不同的果蔬提取物组合会产生不同的抗氧化相互作用,相同的果蔬提取物以不同的比例组合,也会产生不同的抗氧化相互作用[2⁃4]。Engel⁃hardt 等[5]研究发现,维生素C、新绿原酸和槲皮素⁃3⁃芸香苷的抗氧化相互作用会因浓度、比例及其他抗氧化剂而发生改变。多种果蔬提取物混合后,往往会表现出抗氧化协同作用[6⁃8]。前期研究发现水溶性果蔬提取物与脂溶性果蔬提取物混合协同效果会比水溶性果蔬提取物与水溶性果蔬提取物混合协同效果好[2⁃4]。但是,目前对抗氧化相互作用的研究往往集中在相同极性的一种或两种抗氧化剂与果蔬提取物中,对3 种及3 种以上不同极性植物化学物质复配的抗氧化相互作用研究鲜见报道。
因此,本文通过超高效液相色谱⁃质谱联用技术分析4 种蔬菜(胡萝卜、红甜椒、芹菜和紫甘蓝)提取物的酚类物质,同时对单独及4 种蔬菜提取物复配时的抗氧化活性进行测定,评价其复配后的抗氧化相互作用,以期为合理搭配膳食提供科学依据,为开发功能性食品和缓解慢性疾病提供参考。
1 材料与方法
1.1 材料与试剂
胡萝卜、芹菜、红甜椒、紫甘蓝:市售;1,1⁃联苯基⁃2⁃苦基肼基(1,1⁃diphenyl⁃2⁃picrylhydrazyl,DPPH)、2,2′⁃联氮⁃双⁃3⁃乙基苯并噻唑啉⁃6⁃磺酸[2,2′⁃azino⁃bis(3⁃eth⁃ylbenzothiazoline⁃6⁃sulfonic acid),ABTS]、没食子酸、芦丁:上海阿拉丁生化科技股份有限公司;无水乙醇、无水甲醇、正己烷:上海Apel公司。以上试剂均为分析纯。
1.2 仪器与设备
EXL800全波段酶标仪:美国Thermo有限公司;DE⁃300 粉碎机:浙江红景天工贸有限公司;TDL⁃5⁃A 离心机:江苏金怡仪器科技有限公司;RE⁃2000A 旋转蒸发仪:上海亚荣生化仪器厂;CTFD⁃12PT冷冻干燥机:青岛永合创信电子科技有限公司;G6430⁃1290 超高效液相色谱仪串联三重四极杆质谱联用仪:美国Agilent公司。
1.3 方法
1.3.1 试验材料预处理
将新鲜成熟的蔬菜样品(胡萝卜、紫甘蓝、芹菜、红甜椒)洗净,晾干,切成1 cm×1 cm 小块,置于-80 ℃冰箱预冻12 h,冷冻干燥机冻干后粉碎,过60 目筛后再置于-80 ℃超低温保存。
1.3.2 样品的制备
1.3.2.1 脂溶性提取物的制备
蔬菜冻干粉与提取液(无水乙醇与正己烷体积比4∶3)按液料比50∶1(mL/g)常温浸提3 h,提取完成后,4 200 r/min离心5 min,收集上清液,并将残渣重复提取2次。合并收集的上清液,将合并后的上清液置于旋转蒸发仪中于45 ℃条件下浓缩,待有机溶剂基本挥发后,进行氮吹,所得提取物置于-20 ℃冰箱避光保存。
1.3.2.2 水溶性提取物的制备
蔬菜冻干粉与提取液(无水乙醇、蒸馏水与盐酸体积比8∶2∶1)按液料比50∶1(mL/g)常温浸提3 h,提取完成后,4 200 r/min 离心5 min,收集上清液,并将残渣重复提取2次。合并收集的上清液,将合并后的上清液置于旋转蒸发仪中于45 ℃条件下浓缩,待有机试剂挥发后,冻干提取液,所得粉末置于-20 ℃冰箱避光保存。
1.3.3 蔬菜中植物化学物含量的测定
取胡萝卜、紫甘蓝、芹菜和红甜椒水溶性提取物的干物质粉末,用无水乙醇溶液配制成所需的浓度,过0.45µm有机膜,-4 ℃冷藏待用。
1.3.3.1 总酚含量的测定
采用福林酚法测定总酚含量[9]。室温下取25µL没食子酸标准溶液或蔬菜水溶性提取物与125µL福林酚试剂在96 孔板中反应10 min,然后加入125µL 饱和碳酸钠溶液,静置30 min,在765 nm 波长下检测吸光度。总酚含量以mg没食子酸/g干重(mg GAE/g DW)表示。
1.3.3.2 花青素含量的测定
使用pH示差法测定花青素含量[10]。10µL蔬菜水溶性提取物分别与272 µL pH1.0(0.1 mmol/L HCl 和4.9 mmol/L KCl)的缓冲液和pH4.5(24.8 mmol/L 醋酸钠)的缓冲液混合,混匀30 s 后利用酶标仪测定在510 nm 和700 nm 波长下检测吸光度,吸光度A按下列公式计算。花青素含量以矢车菊素⁃3⁃O⁃葡萄糖苷(cy⁃anidin⁃3⁃O⁃glucoside C3G)毫克数等量每克干质量样品(mg C3G/g DW)表示。
A=(A510nm-A700nm)pH1.0-(A510nm-A700nm)pH4.5
式中:A510nm为缓冲液在510 nm 波长下的吸光度;A700nm为缓冲液在700 nm波长下的吸光度。
1.3.3.3 总黄酮含量的测定
室温下取110 µL 亚硝酸钠(NaNO2,0.066 mol/L)与25µL芦丁标准溶液或样品溶液在96孔板中混合反应5 min,然后加入15µL 三氯化铝溶液(0.75 mol/L)反应6 min。最后加入100µL 氢氧化钠溶液(0.5 mol/L),在510 nm 下检测吸光度[11]。总黄酮含量以芦丁当量毫克数等量每克干重样品原料(mg RT/g DW)表示。
1.3.3.4 类胡萝卜素含量的测定
类胡萝卜素的含量测定参照Li 等[12]的方法,精确称取0.5 g 蔬菜冻干粉末,加入5 mL 丙酮⁃乙醇(1∶1,体积比),混匀后于超声清洗器中提取(超声功率100 W,40 kHz,提取温度为50 ℃,提取时间30 min),4 000 r/min离心3 min,收集上清液,并将残渣重复提取,直到将残渣提取为无色。将收集的上清液合并并定容至50 mL,在470 nm 波长处检测其吸光度。类胡萝卜素含量以µg/g干重(µg/g DW)表示。
1.3.4 抗氧化活性测定
1.3.4.1 DPPH自由基清除能力试验
室温下将20 µL 不同质量浓度蔬菜样品(水溶性提取物和脂溶性提取物混合物)或空白溶剂与100µL(0.26 mmol/L)DPPH乙醇溶液于96孔板中反应30 min,在517 nm 波长处于酶标仪中测定其吸光度,所有操作均避光进行,平行测定3次。
1.3.4.2 ABTS+·清除能力试验
将88µL 2.6 mmol/L K2S2O8溶液与5 mL 7.4 mmol/L ABTS 储备液混匀静置12~16 h,稀释使其在734 nm 波长处吸光度为0.70±0.02,配制成ABTS 工作液。室温下将20 µL 不同质量浓度蔬菜样品(水溶性提取物和脂溶性提取物混合物)与0.2 mL ABTS 工作液于96 孔板中反应6 min,在734 nm 波长处测定其吸光度,所有操作均避光进行,平行测定3次。
1.3.4.3 抗氧化能力评价
用EC50mix来表示各组分实际产生的抗氧化能力的试验值。EC50mix由不同质量浓度梯度拟合的清除率曲线求得,自由基清除率(W,%)按下列公式计算。
式中:A0为不加样品,加入自由基溶液的吸光度;Ai为样品和自由基溶液的吸光度;Aj为加入样品,不加入自由基溶液的吸光度。
1.3.5 蔬菜水溶性提取物超高效液相色谱⁃电喷雾四极杆飞行时间质谱法分析
液相方法:使用Agilent Eclipse Plus C18 色谱柱(2.1 mm×100 mm,1.8µm);流动相A 为0.1%甲酸水溶液,流动相B 为乙腈溶液;洗脱梯度为0~3 min,90%~80%A;3~5 min,80%~75%A;5~10 min,75%~71%A;10~25 min,71%~69%A;25~35 min,69%~60%A;35~40 min,60%~30%A;40~43 min,30%~0%A;43~45 min,0%~90%A。进样量5µL;柱温35 ℃;流速0.3 mL/min;检测波长为280 nm。
质谱条件:电喷雾离子源;干燥气温度300 ℃;雾化气压力30 MPa;毛细管电压3.5 kV;裂解电压175 V;干燥气流速10.0 L/min;采用全扫描负离子模式扫描;质量扫描范围m/z 50~1 000。
1.3.6 抗氧化活性评价方法
用EC50add来表示各组分理论上产生的抗氧化能力的理论值。EC50add的计算根据Luszczki 等[13]的方法,在相加等效公式基础上略加改进,其计算公式如下。
式中:R为4种抗氧化剂的协同组合中单独作用时的效价比;EC50A为抗氧化剂a单独作用时的EC50mix值,mg/mL;P1为抗氧化剂a 在4 种抗氧化剂混合后在复配组中所占的比例;P2为抗氧化剂b在4种抗氧化剂混合后在复配组中所占的比例;P3为抗氧化剂c在4种抗氧化剂混合后在复配组中所占的比例;P4为抗氧化剂d在4种抗氧化剂混合后在复配组中所占的比例。
协同率的计算公式如下。
S=(EC50add-EC50mix)/EC50add
式中:S为该组合的协同率,%;EC50add为组合产生抗氧化能力的理论值,mg/mL;EC50mix为组合产生抗氧化能力的试验值,mg/mL。
1.4 数据处理
各试验独立重复3次,所有结果均以平均值±标准差表示。所有试验数据分析使用SPSS 20.0软件完成,采用单因素方差分析,P<0.05表示数据有统计学差异。
2 结果与分析
2.1 蔬菜中植物化学物含量
4种蔬菜的植物化学物含量见表1。
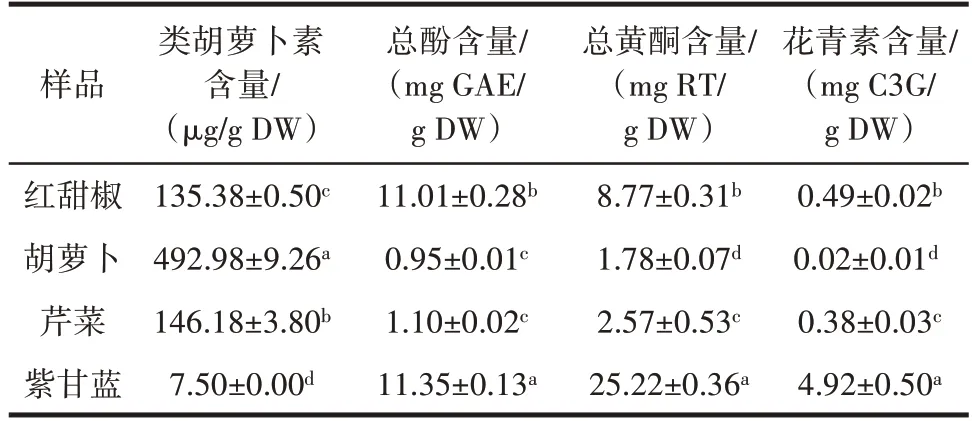
表1 4 种蔬菜中植物化学物含量Table 1 Phytochemical content in four kinds of vegetables
由表1可知,紫甘蓝的总酚、总黄酮和花青素含量最高,其次为红甜椒、芹菜和胡萝卜。4种蔬菜中胡萝卜的类胡萝卜素含量最高,其次为芹菜、红甜椒和紫甘蓝。紫甘蓝、红甜椒和芹菜水溶性植物化学物(总酚、总黄酮和花青素)含量比胡萝卜高,而胡萝卜的脂溶性植物化学物(类胡萝卜素)含量高于紫甘蓝、红甜椒和芹菜。
2.2 蔬菜提取物的酚类物质鉴定
4种蔬菜提取物的酚类物质鉴定结果见表2。

表2 4 种蔬菜提取物的酚类物质鉴定Table 2 Identification of phenolic substances in extracts of four kinds of vegetables
红甜椒、芹菜、紫甘蓝、胡萝卜提取物的超高效液相色谱图分别见图1~图4。

图1 红甜椒提取物的超高效液相色谱图Fig.1 Ultra⁃high performance liquid chromatography of red bell pepper extract
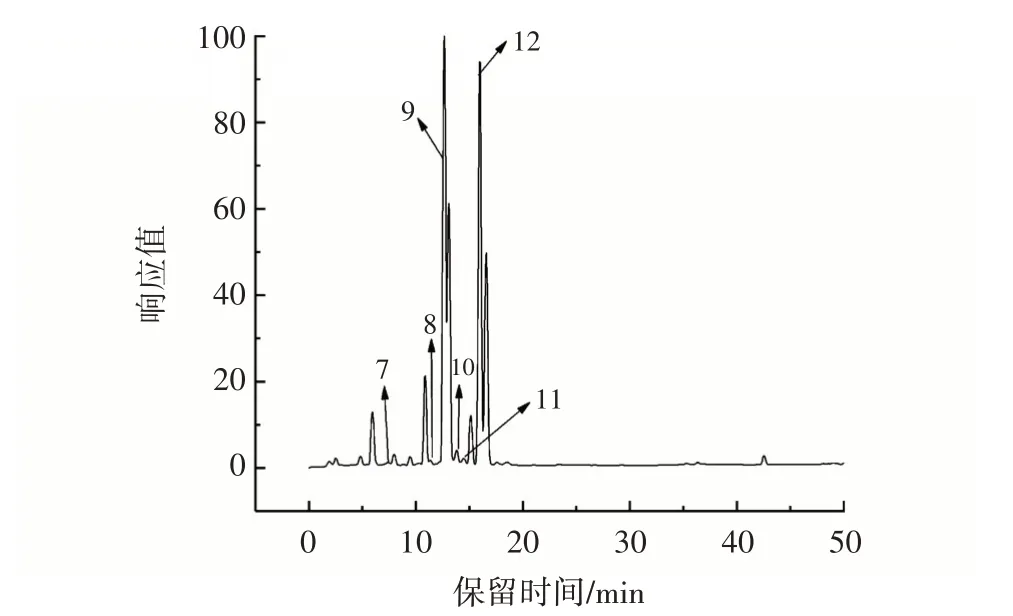
图2 芹菜提取物的超高效液相色谱图Fig.2 Ultra⁃high performance liquid phase chromatography dia⁃gram of celery extract
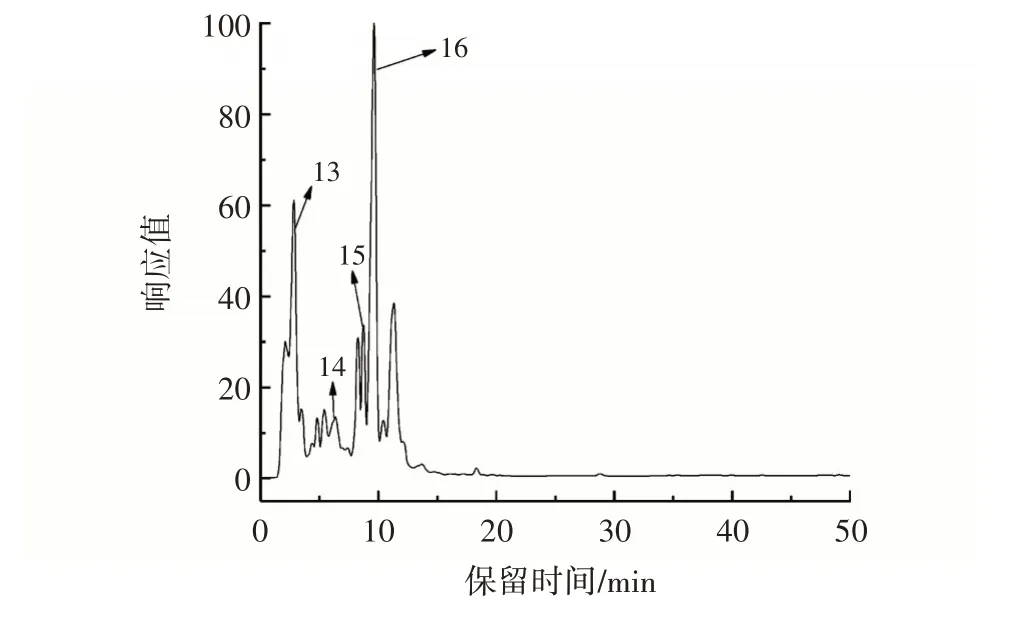
图3 紫甘蓝提取物的超高效液相色谱图Fig.3 Ultra⁃high performance liquid phase chromatography dia⁃gram of purple cabbage extract

图4 胡萝卜提取物的超高效液相色谱图Fig.4 Ultra⁃high performance liquid phase chromatography dia⁃gram of carrot extract
结合表2 和图1~图4 可知,4 种蔬菜水溶性提取物共鉴定出17 种物质,其中4 种酚酸类物质,10 种黄酮类物质[14⁃16]。峰2、3、4、7、14 和17 被鉴定为酚酸类物质,其中峰2、7 和14 是同一种物质。通过搜索人类代谢组数据库,峰3和峰4被推测为2⁃羟基肉桂酸和香豆酸衍生类化合物。与已发表文献数据对比,峰2(母离子m/z 353.088)被鉴定为绿原酸,峰17(母离子m/z 193.050)被鉴定为异阿魏酸[14]。峰1、5、6、8~13、15和16被鉴定为黄酮类物质,其中峰6 和峰8 是同一种物质。基于质谱数据库,峰1(母离子m/z 341.088)被鉴定为1⁃咖啡酰葡萄糖,峰6(母离子m/z 447.094)被鉴定为木犀草素⁃4⁃葡萄糖苷。通过标准品比对,峰5(母离子m/z 609.146)被鉴定为芦丁[14]。峰11(母离子m/z 605.151)碎片离子为m/z 563.140 和m/z 269.045,被鉴定为6⁃乙酰芹菜素。峰9、10、13 和16 被鉴定为山奈酚衍生物。峰9(母离子m/z 781.218)的碎片离子为m/z 216.927、m/z 737.229 和m/z 285.040,因此被鉴定为山奈酚⁃3⁃(2⁃鼠李糖基⁃6⁃乙酰半乳糖苷)⁃7⁃鼠李糖苷。峰10(母离子m/z 489.104)产生了碎片离子m/z 285.040 和m/z 429.082,并被鉴定为山奈酚⁃3⁃(6⁃乙酰半乳糖苷)。峰12和15鉴定为槲皮素衍生类化合物,峰12 和15 母离子分别为m/z 635.162 和m/z 625.141,它们的主要碎片离子m/z 299.056和m/z 300.027的产生来源于槲皮素的C 环3 位上失去糖苷基团,因此峰12 和15 被进一步鉴定槲皮素⁃3⁃(4⁃乙酰鼠李糖苷)⁃7⁃鼠李糖苷和槲皮素⁃7⁃葡萄糖苷。
红甜椒水溶性提取物中主要酚类物质为绿原酸、芦丁等;芹菜水溶性提取物中主要酚类物质有绿原酸、6⁃乙酰芹菜素等;紫甘蓝水溶性提取物中主要酚类物质有绿原酸、槲皮素⁃7⁃葡萄糖苷等;胡萝卜水溶性提取物中主要酚类物质有异阿魏酸。
2.3 蔬菜提取物的抗氧化活性
4种蔬菜提取物的抗氧化活性见表3。
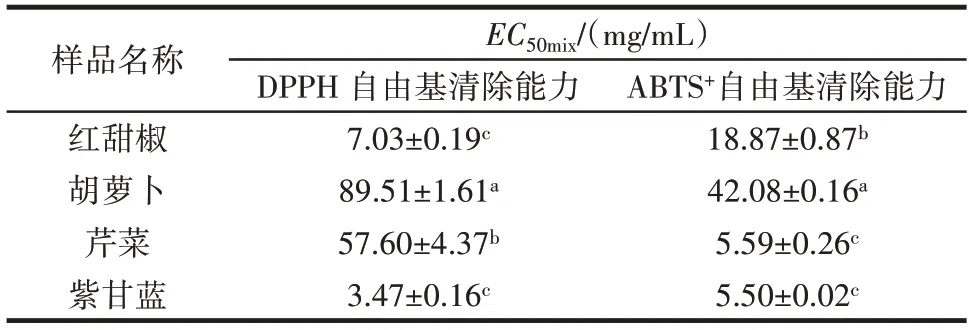
表3 4 种蔬菜的抗氧化活性Table 3 Antioxidant activity of four kinds of vegetables
由表3 可知,在DPPH 试验中,4 种蔬菜提取物抗氧化活性强弱顺序为紫甘蓝>红甜椒>芹菜>胡萝卜,在ABTS 试验中,4 种蔬菜提取物抗氧化活性强弱为紫甘蓝>芹菜>红甜椒>胡萝卜。总体来说,抗氧化活性最强的为紫甘蓝,胡萝卜最弱。
同一蔬菜在不同的评价方法下也显示出不同的抗氧化活性,芹菜提取物清除ABTS+自由基的能力是清除DPPH 自由基能力的10 倍左右,而红甜椒在两种评价方法下均表现出较强的抗氧化活性,在4 种蔬菜样品中抗氧化活性次于紫甘蓝。从表1和表3可以发现,紫甘蓝的总酚、总黄酮和花青素含量最高,其次是红甜椒、芹菜和胡萝卜,同时,紫甘蓝的DPPH 自由基清除能力最强,其次是红甜椒、芹菜和胡萝卜,蔬菜总酚、总黄酮、花青素和DPPH 抗氧化活性表现出剂量效应关系。有研究发现,农产品中总酚和花青素含量与DPPH自由基清除能力具有剂量效应关系[17],这点在本文也得到了很好的证实。
2.4 蔬菜提取物抗氧化相互作用
DPPH 试验中不同蔬菜提取物组合的理论值和试验值见表4。
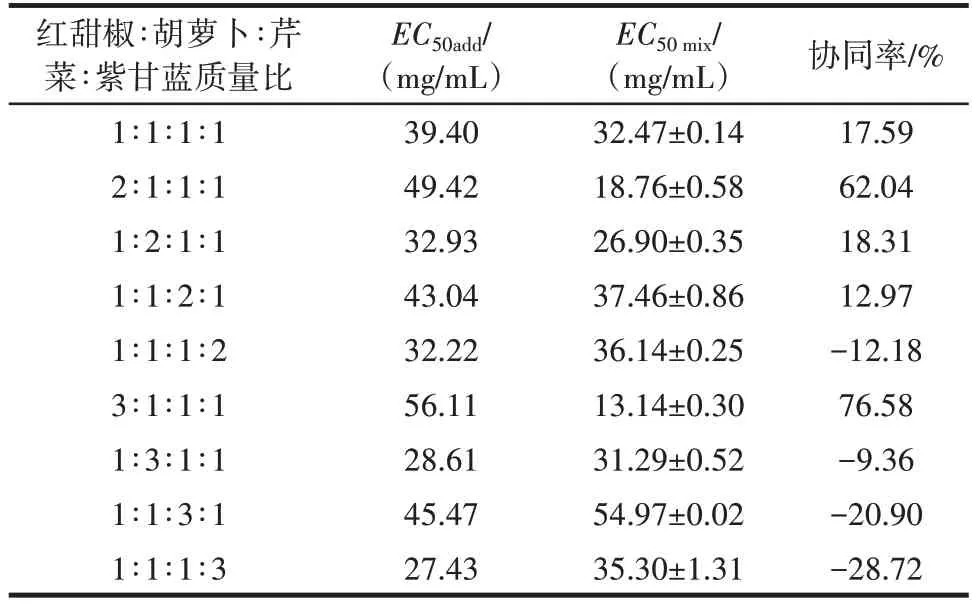
表4 DPPH 试验中不同蔬菜提取物组合的理论值和试验值Table 4 Theoretical and experimental values of different combi⁃nations of vegetable extracts in DPPH test
ABTS 试验中不同蔬菜提取物组合的理论值和试验值见表5。

表5 ABTS 试验中不同蔬菜提取物组合的理论值和试验值Table 5 Theoretical and experimental values of different combi⁃nations of vegetable extracts in ABTS test
由表4 可知,在DPPH 试验中,红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为2∶1∶1∶1 和3∶1∶1∶1 时,协同率达到62.04%和76.58%,表现出较强的协同作用。同时,有部分比例表现出协同效果,但是协同率不强,如红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为1∶1∶1∶1和1∶1∶2∶1时,协同率为17.59%和12.97%。同时,还有部分比例表现出拮抗作用,如红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为1∶1∶1∶3 和1∶1∶3∶1 时,表现出拮抗作用,协同率为-28.72%和-20.90%。
由表5 可知,在ABTS 试验中,部分比例表现出较强的协同作用,例如红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为2∶1∶1∶1和3∶1∶1∶1时,表现出较大的协同效应,协同率分别为43.26%和66.08%。同时,蔬菜组合也表现出拮抗效应,当红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为1∶1∶2∶1、1∶1∶1∶2、1∶3∶1∶1、1∶1∶3∶1、1∶1∶1∶3 时,协同率均为负值,尤其是4 种蔬菜提取物质量比为1∶1∶3∶1时,协同率达到了-129.85%。
3 讨论
在DPPH 试验和ABTS 试验中,大部分比例都呈现出相同的抗氧化作用效果,但是同样存在比例在两个试验中,表现出相反的抗氧化相互作用。导致这个现象的原因可能是两个抗氧化试验的机理不同,DPPH试验是通过单电子转移,得到氢原子还原,反应受到空间位阻的影响。而ABTS 试验不会受到空间位阻的影响,但可能会因为反应时间短,不能在给定时间和ABTS+·完全反应。水溶性植物化学物质抗氧化作用的机理主要是通过单电子转移,脂溶性植物化学物质抗氧化作用主要是氢电子转移,因此,当蔬菜组合中含有较多水溶性植物化学物质时,可能会更容易在DPPH试验中产生抗氧化协同作用。
在DPPH 试验和ABTS 试验中,当红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为2∶1∶1∶1 和3∶1∶1∶1 时,均表现出较好的协同作用,在DPPH 试验中协同率分别为62.04% 和76.58%,在ABTS 试验中协同率为43.26%和66.08%。有研究发现,抗氧化剂可以通过再生循环,达到抗氧化活性增加的效果[18]。通过蔬菜提取物的成分鉴定结果可知红甜椒中含有芦丁,在芹菜和紫甘蓝中含有绿原酸,同时研究发现芦丁对绿原酸具有抗氧化协同效果[19],红甜椒中芦丁可能与芹菜和紫甘蓝中的绿原酸形成氧化还原循环系统,从而产生较好的抗氧化协同作用。
然而,蔬菜之间同样存在着拮抗效应。在DPPH试验中,当红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为1∶1∶1∶2、1∶3∶1∶1、1∶1∶3∶1、1∶1∶1∶3 时,都表现出拮抗效应。在ABTS 试验中,当红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为1∶1∶2∶1、1∶1∶1∶2、1∶3∶1∶1、1∶1∶3∶1、1∶1∶1∶3 时,表现出拮抗效应,尤其质量比为1∶1∶3∶1 时,协同率达到了-129.85%。随着芹菜、胡萝卜摄入比例的增加,混合体系清除DPPH 自由基的能力逐渐下降,这可能与芹菜以及胡萝卜自身对DPPH自由基清除能力较差有关。随着单一抗氧化性强的紫甘蓝量的增加,混合体系的抗氧化效果呈现拮抗的效应,这可能是由于过量添加抗氧化剂反而可能有助氧化的作用[20⁃21],尤其是在红甜椒和紫甘蓝中都鉴定出了绿原酸,并且红甜椒和紫甘蓝的抗氧化活性都较强,可能随着紫甘蓝量的增加,部分绿原酸会表现出助氧化的效果。同样,也有研究报道了其它物质之间的抗氧化拮抗效果。蒋海伟[22]研究表明,番茄脂溶性提取物和胡萝卜脂溶性提取物9∶10 混合物、番茄脂溶性提取物和紫薯水溶性提取物7∶10 混合物都表现出拮抗效应。有报道表明,西兰花和大豆1∶1 混合物对于保护H2O2损伤的心肌细胞表现出拮抗效应[23]。王绍美等[24]研究表明,适当浓度茶多酚与维生素C 混合会表现较好的抗氧化协同作用,但当茶多酚浓度上升到一定程度时,混合物表现出拮抗作用。这可能是抗氧化相互作用因混合物中活性成分的比例不同或者植物化学物的抗氧化机理不同而发生变化。
4 结论
本试验通过DPPH 试验和ABTS 试验评价红甜椒、胡萝卜、芹菜和紫甘蓝的抗氧化相互作用,发现4 种蔬菜提取物以不同比例混合后都存在抗氧化协同和拮抗作用,在DPPH 试验中,红甜椒∶胡萝卜∶芹菜∶紫甘蓝提取物质量比为3∶1∶1∶1 时,协同率最大(62.04%),在ABTS 试验中,红甜椒:胡萝卜:芹菜:紫甘蓝提取物质量比为3∶1∶1∶1时,协同率最大(66.08%)。并且在4种蔬菜提取物混合时,当红甜椒所占比例较大时,抗氧化协同能力较强,可能是与其芦丁含量有关。同时,在DPPH 试验中,总酚、总黄酮和花青素的含量与抗氧化活性呈现正相关,当蔬菜提取物组合中含有较多水溶性植物化学物质时,可能会更容易在DPPH试验中产生抗氧化协同效果。总体上,两种抗氧化测定方法对不同比例抗氧化组合的抗氧化相互作用评价基本一致。

