溶剂热法合成NiFe2O4纳米颗粒及其光催化降解亚甲基蓝实验*
赵仰成,李 鑫,吴柏志,于硕硕,张 婷
(兰州理工大学 石油化工学院,甘肃 兰州 730050)
随着工业社会的不断进步,环境污染问题变得愈发严重。在传统的水污染处理领域中,有机染料是水体的主要污染物之一[1,2]。据统计,超过20%的水体污染都是由染料废水直接或间接排放造成的,其中含有大量的有机污染物,对生态环境造成了恶劣的影响。光催化技术作为一种绿色环保、经济高效的可持续发展技术,以太阳能为驱动、光催化剂为载体,在光源的刺激下,催化剂表面形成大量的电子-空穴对,产生能够分解有机污染物的氧化还原电位,从而可以对染料废水进行有效的降解[3,4]。因此,该技术的关键在于光催化剂的合成。许多类型的光催化剂比如TiO2、各种碳基材料(g-C3N4、MWCNTS、GO等)、Bi 基材料、各种尖晶石型材料(NiFe2O4、ZnFe2O4、MnFe2O4等)已经被用于光催化降解印染废水中[5-12]。其中,NiFe2O4是一种反尖晶石型铁氧体,具有较窄的带隙,对可见光具有高敏感性及稳定性,是一种理想的光催化剂载体。本工作利用溶剂热法合成了3 种不同形貌特征的NiFe2O4纳米粒子,并研究了其光催化性能及其对亚甲基蓝(MB)染料的降解机理。
1 实验部分
1.1 药品及仪器
NiCl2·6H2O、FeCl3·6H2O、对苯醌、异丙醇、乙二胺四乙酸二钠,上海麦克林生化科技有限公司;无水乙醇(广州市金华化学试剂有限公司)、乙二醇(广东光华化学厂有限公司)、30% H2O2溶液(天津市风船化学试剂科技有限公司)、NaOH(天津市恒兴化学试剂制造有限公司)、亚甲基蓝(天津市天新精细化工开发中心),以上药品均为分析纯;实验用超纯水(实验室自制)。
JB/T5374 型电子分析天平(上海梅特勒-托利多仪器有限公司);DY-101D 型集热式恒温磁力搅拌器(郑州杜甫仪器有限公司);DHG-070A 型鼓风干燥箱(上海景宏实验设备有限公司);TDL-5-A 型台式离心机(上海安亭科学仪器厂);KH3200DE 型数控超声波清洗器(昆山禾创超声仪器有限公司);VS-GCH-XE-300 型氙灯光源(无锡沃信仪器有限公司);UV-1900 型紫外-可见分光光度计(上海翱艺仪器有限公司);Bruker D8 Advance 型X 射线衍射仪(德国布鲁克公司);Zeiss Sigma 300 型扫描电子显微镜(德国蔡司公司);Talos F200X 型透射电子显微镜(美国赛默飞世尔科技公司);UV-3600i Plus型紫外-可见漫反射分析仪(日本岛津公司);CHI760E 型电化学工作站(上海辰华仪器有限公司)。
1.2 样品制备
本文采用简单的溶剂热法合成NiFe2O4纳米粒子,溶剂分别采用超纯水、乙醇和乙二醇。将10mmol NiCl2·6H2O(1.29599g) 和20mmol FeCl3·6H2O(3.24408g)加入60mL 溶剂中,并用磁力搅拌器搅拌至完全溶解。滴加1mol·L-1NaOH 溶液至pH值为11~13。将溶液加入水热反应釜在180℃下加热10h。冷却至室温后,将产物超声并离心,用无水乙醇洗涤后,在100℃下干燥2h 得到3 种棕紫色颗粒产物NF1(水)、NF2(乙醇)、NF3(乙二醇)。
1.3 表征及测试
晶胞结构 使用X 射线衍射仪测定样品的晶胞结构。
形态分析 采用扫描电子显微镜和透射电子显微镜对样品的表面及内部形态进行观测。
紫外-可见光吸收性能 使用紫外-可见漫反射分析仪对样品的紫外-可见光吸收性能进行测试。
光电性能 采用电化学工作站对样品的光电性能进行测定。
1.4 光催化性能测试
称取适量的NiFe2O4催化剂样品,加入一定质量浓度的亚甲基蓝溶液中,在黑暗条件下连续均匀搅拌30min 以达到吸附平衡。打开光源后,将溶液置于光源直射下,每20min(反应共60min)使用注射器吸取2mL 上清液用紫外-可见分光光度计记录吸光度(波长664nm),并计算其降解效率。光芬顿即在纯光催化的基础上,在打开光源的同时加入适量H2O2即可,二者的降解效率分开计算。分别考察催化剂种类(NF1、NF2、NF3)、光源种类(氙灯(自然光)、紫外光、可见光)、催化剂投加量(1~5g·L-1)、亚甲基蓝质量浓度(10~50mg·L-1)、温度(20~60℃)、pH 值(2~12)、H2O2投加量(5~25mL·L-1)对亚甲基蓝降解效率的影响。亚甲基蓝降解效率计算公式如下:
式中 C0和Ct:时间为0 和时间为t 时MB 的浓度,mg·L-1。
2 结果与讨论
2.1 表征测试结果
2.1.1 XRD 分析 XRD 图(图1)说明了制备样品的多晶性质。在18.417°、30.298°、35.689°、37.333°、43.378°、53.825°、57.382°、63.021°倾斜的衍射峰分别归属于(1 1 1)、(2 2 0)、(3 1 1)、(2 2 2)、(4 0 0)、(4 2 2)、(5 1 1)、(4 4 0)面[13-15]。观察到的峰证实了NiFe2O4的正交相。所制备的纳米粒子沿(1 1 1)面在2θ=18.417°处观察到择优取向。晶格参数由下列关系式计算:
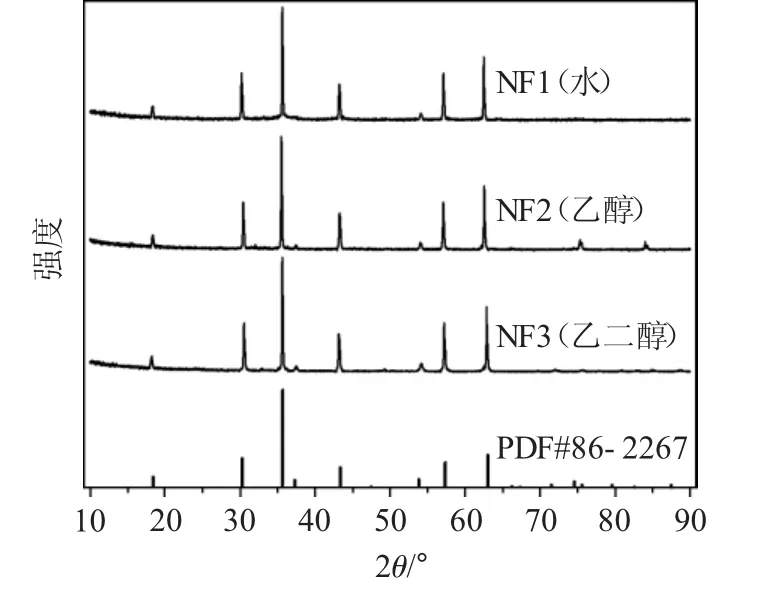
图1 3 种溶剂制备的NiFe2O4 纳米颗粒的XRD 图Fig.1 XRD patterns of NiFe2O4 nanoparticles prepared with three solvents
式中 d:平面距离,nm;h、k、l:米勒指数,常数;a,b,c:晶格参数。
制备的NiFe2O4纳米粒子的晶粒尺寸可用Scherrer 公式计算:
式中 D:晶粒尺寸,nm;λ:X 射线源波长,nm;β:衍射峰的半高峰宽,rad;θ: 衍射峰的布拉格角,°。计算的微晶尺寸和晶格参数见表1。
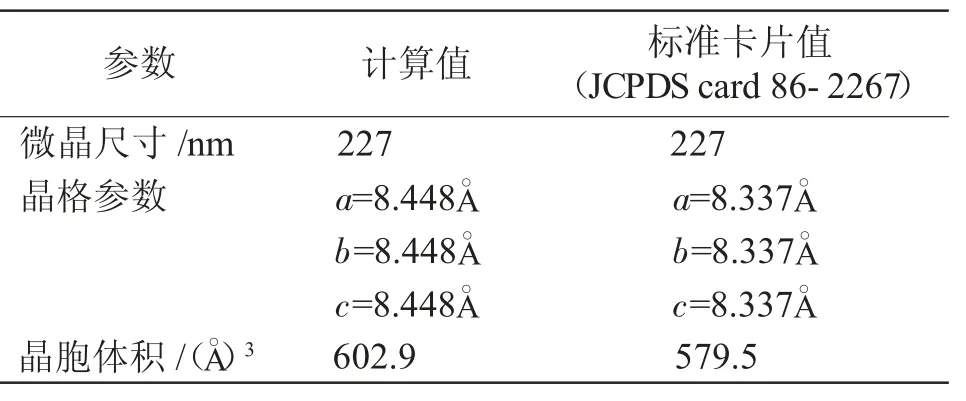
表1 制备的NiFe2O4 纳米颗粒的结晶参数Tab.1 Crystallization parameters of NiFe2O4 nanoparticles prepared
由图1 可见,制备的3 种NiFe2O4纳米粒子的主要衍射峰位置与标准卡片(PDF#86-2267)的衍射峰相对应。表1 也表明通过计算得到的NiFe2O4纳米粒子微晶尺寸和晶胞参数与标准卡片(JCPDS card 86-2267)几乎吻合,表明NiFe2O4纳米粒子的成功制备。
2.1.2 SEM 分析 使用扫描电镜对制备的3 种NiFe2O4纳米粒子的表面形貌进行了观察。
由图2 可见,使用水和乙醇制备的NiFe2O4纳米颗粒表现出了明显的颗粒性质,用乙二醇制备的NiFe2O4纳米颗粒显示出了轮廓清晰的纺锤状性质。不仅如此,它还展现出了多孔性以及高透明度,这是高反应性光催化材料检查的基本性质之一。多孔性质增强了可见光在材料内部的穿透,并导致光生载流子的高迁移率。从SEM 图像中可观察到制备的NiFe2O4纳米颗粒具有高孔隙率,这提高了光生电荷载流子的迁移率,并增加了光催化效率。

图2 3 种NiFe2O4 纳米颗粒的SEM 图Fig.2 SEM images of three types of NiFe2O4 nanoparticles
2.1.3 TEM 分析 使用透射电镜对使用乙二醇合成的NiFe2O4纳米粒子(NF3)的表面进行了研究分析,见图3。

图3 NF3 的(a)TEM 图像、(b)HRTEM 图像、(c)SAED 图和(d~g)EDS 元素映射图Fig.3 (a)TEM image,(b)HRTEM image,(c)SAED image and(d~g)EDS element mapping map of NF3
由图3(a)、(b)可以观察到,合成的NiFe2O4纳米粒子的不同方向清晰的晶格条纹以及半透明的中空结构。由图3(c)可以清楚地观察到多个衍射环。通过计算得出衍射环的晶面间距与标准卡片(PDF#86-2267) 上(111)、(220)、(311)、(222)、(400)晶面的晶面间距完全一致。图3(e~g)表明,合成的NiFe2O4中各个元素(Ni、Fe、O)分布均匀,成功地合成了NiFe2O4纳米粒子。
2.1.4 UV-Vis DRS 表征 紫外-可见光谱(UV-vis DRS)可以直接反映光催化材料的光吸收性能。
由图4 中的吸收光谱可以看出,3 种NiFe2O4纳米粒子对紫外光的吸收峰值(10~380nm)明显优于对可见光的吸收峰值(390~780nm)。而使用乙二醇制备的NiFe2O4(NF3)对紫外光的吸收峰值在3 种材料也是最高的,表明其具有优异的光催化活性。
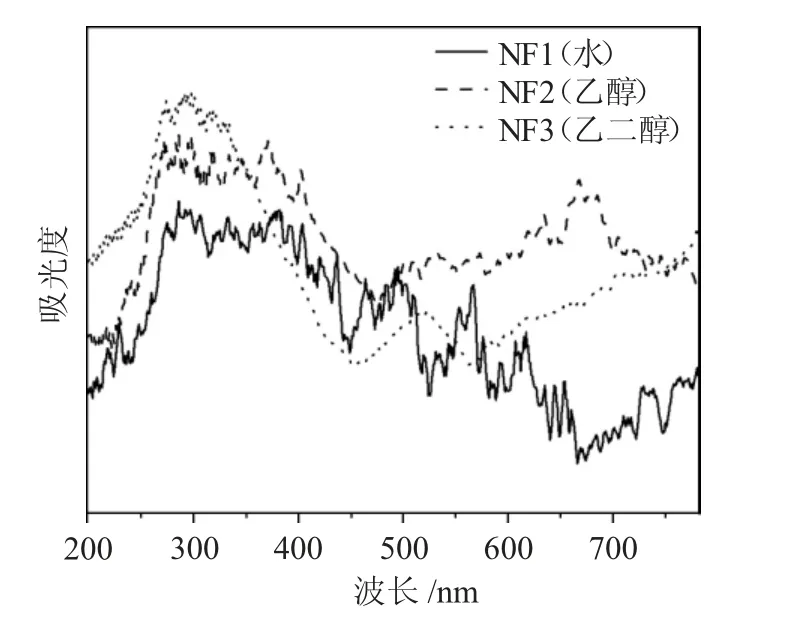
图4 3 种NiFe2O4 样品的紫外-可见光吸收光谱Fig.4 Ultraviolet visible absorption spectra of three NiFe2O4 samples
2.1.5 电化学工作站(EIS、TPC) 在电化学阻抗谱(EIS)中,位于左半部分的高频区域的半圆形半径的相对大小表明了不同材料内部的光生电荷载流子在固液两相界面的转移电阻大小。即半圆形半径越小代表较慢的电子-空穴对复合速率以及较高的导电性,即更好的光催化活性。半圆形半径越大代表电子-空穴对复合速率越快,即光催化活性越差。
由图5(a)可见,使用乙二醇合成的NiFe2O4在高频区有着最小的半圆形半径,说明其内部电荷转移电阻较低以及较高的导电率。而使用水合成的NiFe2O4圆弧半径最大,说明其电子-空穴对的复合速率最快,导致在一定时间内产生的有效活性位点不够多,即光催化活性越差。由瞬态光电流响应谱(TPC)即图5(b)可见,无论在黑暗还是有光源的情况下,使用乙二醇合成的NiFe2O4都显示出了最高的光电流密度,即更好的电子-空穴对的分离,结果与电化学阻抗谱相匹配。
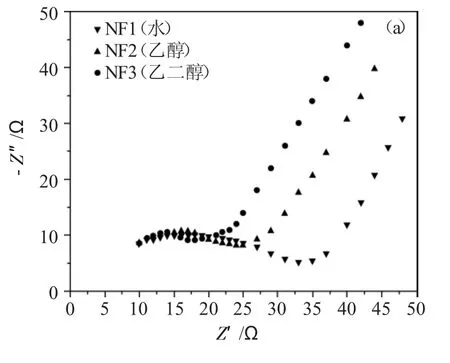
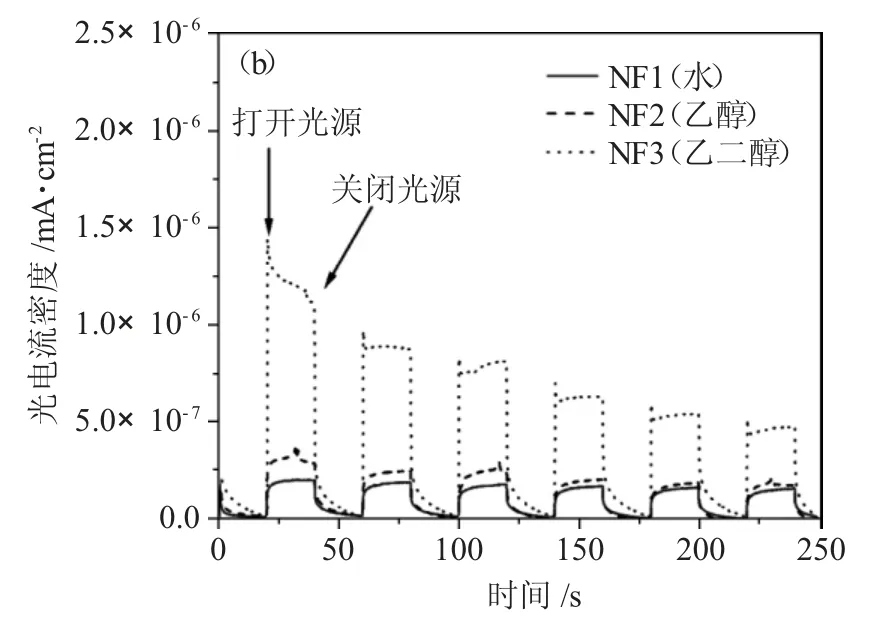
图5 3 种NiFe2O4 样品的(a)电化学阻抗谱和(b)瞬态光电流响应谱Fig.5 (a)Electrochemical impedance spectroscopy and(b)Transient photocurrent response spectroscopy of three NiFe2O4 samples
2.2 NiFe2O4 光催化降解亚甲基蓝实验
不同反应条件对NiFe2O4光催化降解亚甲基蓝的影响结果见图6。
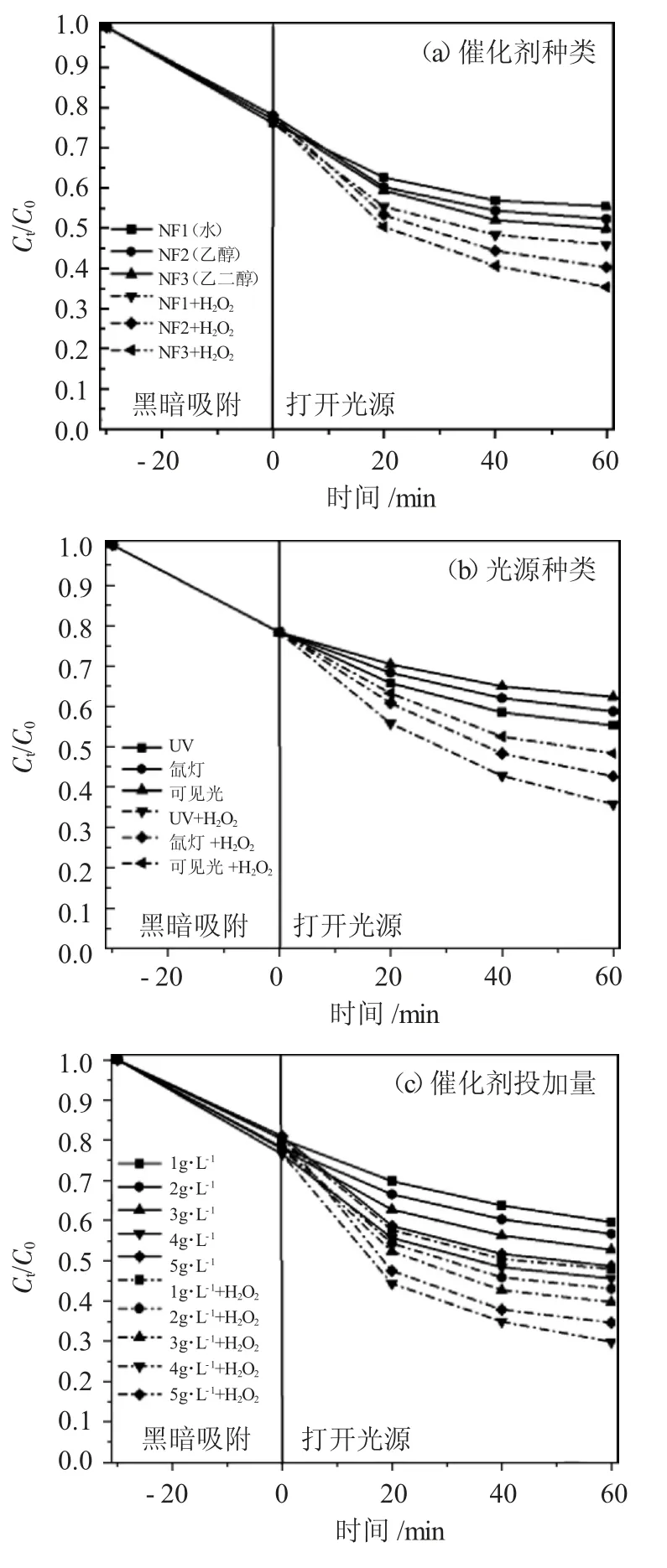
图6 不同反应条件对NiFe2O4 光催化降解亚甲基蓝的影响Fig.6 Effect of different reaction conditions on the photocatalytic degradation of methylene blue by NiFe2O4
2.2.1 不同NiFe2O4种类的影响 在使用紫外光、催化剂投加量为1g·L-1、亚甲基蓝初始浓度为50mg·L-1、温度为20℃、pH 值为7、H2O2用量5mL·L-1(仅光芬顿过程)的初始条件下,实验考察了不同NiFe2O4种类对NiFe2O4光催化降解亚甲基蓝降解效率的影响。结果如图6(a)所示,3 种催化剂均在黑暗吸附30min 时达到吸附平衡,吸附率均保持在26%左右。在光催化过程中,NF1、NF2、NF3 分别能降解约45%、47%、51%的亚甲基蓝。而在添加了H2O2的光 芬 顿 过 程 中,NF1、NF2、NF3 分 别 降 解 了 超 过54%、60%、66%的亚甲基蓝。这主要归因于NF3 的高透明度以及多孔性质,这些特点使其与大分子有机物能够充分结合,更多的结合位点激发了更多的活性位点。这些活性位点可以更快地捕获光生电荷,延缓电子-空穴对的复合,从而增加降解效率。
2.2.2 不同光源种类的影响 同种材料对不同光源的吸收效率的不同会导致降解效率的差异。实验考察了不同光源种类对NiFe2O4光催化降解亚甲基蓝降解效率的影响。催化剂在黑暗条件下达到吸附平衡后,研究了NiFe2O4分别在紫外光、LED 灯(可见光)、氙灯(太阳光)的照射下对亚甲基蓝的降解效率。结果如图6(b)所示,在紫外光、LED 灯(可见光)、氙灯(太阳光)下持续照射60min 后,亚甲基蓝的降解率分别为45%、42%、38%。在添加了H2O2之后,降解率分别达到了65%、58%、52%。这说明NiFe2O4对紫外光的吸收效率要高于可见光和太阳光。这可能是由于NiFe2O4中存在特殊区域的光缺陷带,导致复合材料可以从紫外光中获取特殊区域的光子有助于降解染料。
2.2.3 不同催化剂投加量的影响 不同催化剂的投加量会对亚甲基蓝的降解效率造成明显差异。实验考察了催化剂投加量(1~5g·L-1)对NiFe2O4光催化降解亚甲基蓝降解效率的影响。结果如图6(c)所示,随着催化剂投加量的提高,NiFe2O4的黑暗吸附效率有一定的提升。打开光源后,随着反应时间的增加,投加量为4g·L-1的NiFe2O4表现出最好的吸附效果,在60min 内降解了约55%的亚甲基蓝。在添加H2O2后,降解效率达到了71%。这可能是因为在一定范围内,提高催化剂投加量可以提供更多的活性位点,使光催化反应更充分。而在投加了过量的催化剂后,催化剂与大分子染料接触不充分,导致活性位点的减少,降低了催化效率。
2.2.4 不同初始浓度的影响 除了催化剂投加量,溶液的初始浓度也会对降解效率造成明显影响。实验考察了亚甲基蓝初始浓度对(10~50mg·L-1)NiFe2O4光催化降解亚甲基蓝降解效率的影响。结果如图6(d)所示,随着亚甲基蓝浓度的提高,其降解率也在逐渐降低。这可能是由于在固定的催化剂投放量下,不断提升的亚甲基蓝浓度导致单位质量的催化剂要和更多的大分子有机物反应,这直接导致了催化效率的降低。因此,亚甲基蓝的最佳初始浓度应控制在20mg·L-1。
2.2.5 不同初始温度的影响 根据前期研究,温度对光催化的降解效率影响较大。实验考察了初始温度(20~60℃)对NiFe2O4光催化降解亚甲基蓝降解效率的影响。结果如图6(e)所示,随着温度的提高,NiFe2O4纳米颗粒的催化效率在逐渐提高,这是因为温度的提高刺激了光催化反应的进程,导致短时间内更多的活性位点的产生。而过高的温度也会引起H2O2的无效分解,同时溶液的浓缩也会导致其浓度的提高,这些原因都直接或间接地导致了反应效率的降低。因此,反应的最佳温度应控制在50℃。
2.2.6 不同初始pH 值的影响 pH 值对光催化的反应过程起着关键作用。实验考察了pH 值对NiFe2O4光催化降解亚甲基蓝降解效率的影响。结果如图6(f)所示,其中,酸性条件下的反应效率>碱性条件下的反应效率>中性条件下的反应效率。这是因为酸性条件下的H+和碱性条件下的OH-都能够加速溶液中·OH 的生成,加速了亚甲基蓝的分解。因此,反应的最佳pH 值应控制在2~4。
2.2.7 不同H2O2用量对亚甲基蓝降解率的影响H2O2投加量会明显影响光芬顿过程的降解效率。实验最后考察了H2O2用量对于光芬顿过程的影响(5~25mL·L-1)。随着H2O2用量的提高,催化效率也在逐渐提高,当用量达到20mL·L-1时效果最好。更多的H2O2可以分解为更多的·OH,加速反应的进行。而过多的H2O2会和生成的·OH 发生二级反应,间接地消耗了·OH,导致反应效率的降低。
2.3 光催化降解机理及稳定性研究
为了验证NiFe2O4纳米粒子的作用机理,进行了光催化降解MB 染料的过程中的自由基淬灭实验。采用对苯醌(PBQ)、异丙醇(IPA)和乙二胺四乙酸二钠(Na2-EDTA)分别捕获O2-、h+和·OH。结果见图7。
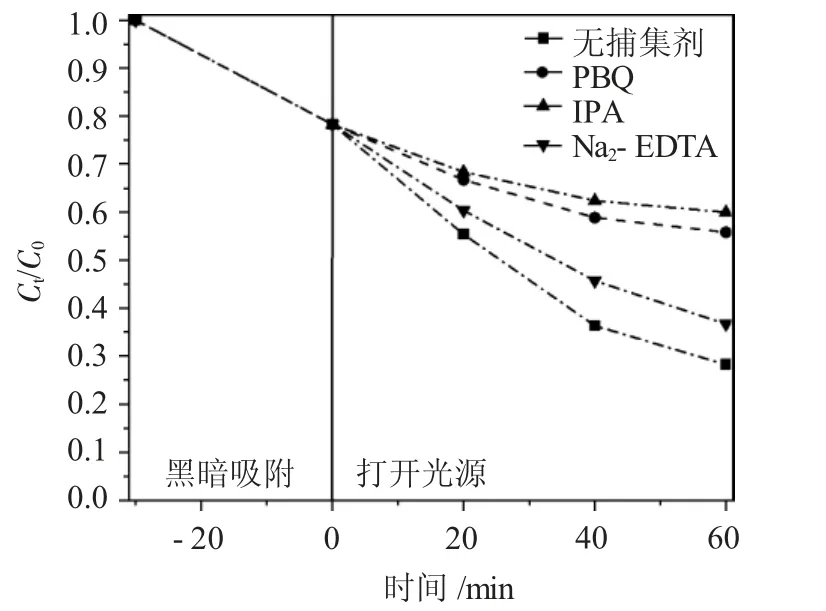
图7 不同自由基捕集剂对NiFe2O4 纳米粒子光催化效率的影响Fig.7 Effect of different free radical trapping agents on the photocatalytic efficiency of NiFe2O4 nanoparticles
由图7 可见,O2-和h+对光催化降解的贡献大于·OH。MB 的降解主要是由O2-和h+引起的[16-18]。
一般来说,多孔表面材料为有机污染物提供了更多的结合位点,从而增加了活性位点的数量。这些活性位点捕获光产生的电荷,从而增加降解效率。因此,孔隙率是决定制备的NiFe2O4颗粒催化效率的关键。此外,NiFe2O4纳米粒子光催化降解大型有机物分子的一般过程可以归结为:(1)NiFe2O4纳米粒子吸收紫外光并在导带中产生自由电子,在价带中产生自由空穴,由此形成电子-空穴对。(2)导带电子通过与溶液中存在的O2分子反应产生超氧自由基(O2-)。此外,超氧自由基通过与H+相互作用形成H2O2,这些H2O2分解成羟基自由基(·OH)。(3)这些空穴(h+)、超氧自由基(·O2-)、羟基自由基(·OH)协同降解MB 染料分子,最终生成H2O 和CO2。主要反应方程如下:
为了进一步测试NF3 的稳定性,本文对回收后的NF3 经洗涤、干燥后在得出的最佳反应条件下进行循环测试,结果见图8。
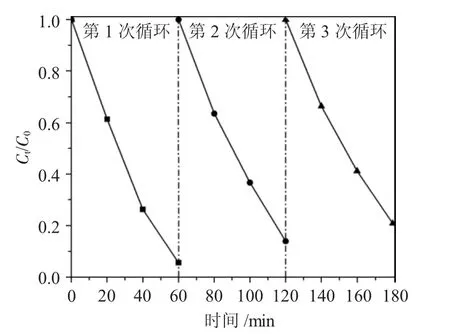
图8 NiFe2O4 纳米粒子光催化降解MB 的循环稳定性测试Fig.8 Cyclic stability test of NiFe2O4 nanoparticle photocatalytic degradation of MB
由图8 可见,在3 个循环中,NiFe2O4纳米粒子对MB 的降解率分别为95.39%、86.03%、79.13%。表明其具有较高的稳定性。
3 结论
采用溶剂热法合成了3 种不同形貌特征的NiFe2O4纳米粒子,其中使用乙二醇为溶剂合成的NiFe2O4纳米粒子表现出了最好的性能,在最优的测试条件下(紫外光源、催化剂投放量4g·L-1、亚甲基蓝初始浓度20mg·L-1、温度50℃、pH 值为2~4、H2O2投放量20mL·L-1),60min 内降解了超过95.4%的亚甲基蓝。表征测试结果表明,该纳米粒子具有多孔性、高透明度以及对紫外光的高响应度。自由基淬灭实验表明,O-2和h+在反应过程中起着主要作用,在3 次循环稳定性测试后仍然有着79.13%的降解率。该尖晶石型NiFe2O4纳米粒子制备工艺简单,性能稳定且出色,是一种理想的光催化剂材料。

