反渗透淡化水调质稳定性及健康性实验研究
武云霞,赵丹,陈莎莎,张平,杨岳平
(浙江大学 环境与资源学院,浙江 杭州310058)
随着我国经济的发展,水环境污染现象加剧,水资源短缺问题日益突出。为缓解水资源压力,海水淡化成为开发淡水资源的重要手段,目前我国超过60%淡化水采用反渗透处理海水淡化获得[1]。反渗透膜孔径小,对二价离子去除效果好,因此淡化水中CO32-含量少,缓冲能力差,pH值低,且矿物质钙、镁含量低于检测限[2]。pH值低,缓冲能力差,导致反渗透淡化水水质不稳定,在输送过程中易引起管网腐蚀,出现“黄水”现象[3]。另外,反渗透淡化水中钙镁离子含量少,无法满足人体从饮用水中获得一定量钙、镁等元素的需求[2,4]。
基于淡化水对输送管网腐蚀和对人体健康的影响,通常需对反渗透淡化水进行调质,即增加淡化水中的钙、镁含量,调节其碱度、硬度、pH值,使调质后的水质指标满足GB5749—2006《生活饮用水卫生标准》[6]和GJB1335—92《低矿化度饮用水矿化卫生标准》[7]要求,而且化学稳定性达到平衡,氧化还原电位(ORP)处于合理范围,成为满足人体安全健康要求的饮用水。常用的矿化调质方法有加药法、矿石溶出法以及其他水源掺混法。加药法操作灵活、设备占地小,是目前最为可行的方式[8],小型淡化厂、海上平台、船舶等场合均采用此方式。
描述水质化学稳定性的指标有Ryznar 稳定指数(R.S.I.)、碳酸钙沉淀势(CCPP)、拉森指数(LR)3个。R.S.I.是通过大量实验得到的半经验性公式:
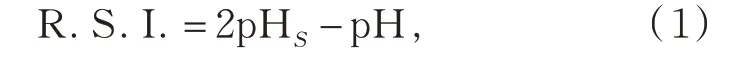
实践证明,当R.S.I.值在6~7时,水质较为稳定,R.S.I.低于6时,水体有结垢倾向,R.S.I.高于7时,水体有腐蚀倾向[9]。CCPP 指标可定量算出待测水中应该沉淀或溶解多少CaCO3才能使水体达到化学稳定,当其值在0~4时,说明CaCO3在水体中处于较为平衡的状态,低于0时,水体有腐蚀倾向,高于4时,水体有结垢倾向[10-11]。LR是将硫酸根离子和氯离子对铁管腐蚀的影响考虑在内的一个指数[12]。其值小于0.5 即可接受,LR值越低,腐蚀性越小[13]。研究表明,在其他水质参数符合饮用水标准时,氧化还原电位(ORP)小的饮用水健康性较好[14]。ORP 反映了水体的综合氧化还原能力,水体中多个氧化还原电对构成一个复杂的体系,最终在宏观上表现出一定的ORP值,ORP值越小氧化性越弱,还原性增强[15]。医学研究表明,现代人体许多疾病与体内过多活性氧有关[16]。而ORP值低的水可通过降低活性氧等氧化性物质的含量及其活性,提高抗氧化酶活性,从而提高人体的免疫能力和自然治愈能力。尹军等[17-18]研究认为,氧化还原电位(ORP)低于200 mV的水为优质饮用水。所以,将ORP 作为调质水健康的一项指标进行研究。
1 实验部分
1.1 仪器与试剂
哈希HQ40d 双路输入多参数数字化分析仪(美国哈希),电子天平(赛多利斯科学仪器(北京)有限公司),100 mL烧杯,50 mL量筒,250、100 mL锥形瓶,酸式滴定管,容量瓶。模拟海水反渗透淡化水(见表1)。NaHCO3、CaCl2、HCl、NaCl、CaCO3、甲基橙、酚酞、氨水、乙二胺四乙酸二钠、铬黑T、乙醇、硝酸银均为分析纯。

表1 实验用淡化水水质指标Table1 Raw water quality index
1.2 实验方法
将化学试剂用纯水配制成规定浓度的溶液,分别向16 组淡化水①实验中淡化水是由人工制备的模拟海水再经二级反渗透处理得到。模拟海水是按照标准海水的成分及其浓度由自来水投加一定海盐配制而成,使其TDS 达到约35 000 mg·L-1。中投加一定量的NaHCO3、CaCl2,以改变水样的硬度、碱度、pH、ORP。CaCl2投加量依次为20,30,40,50 mg·L-1,NaHCO3投加量依次为50,70,90,110 mg·L-1,进行全面实验,MgCl2投加量保持15 mg·L-1。依据GB5749—2006《生活饮用水卫生标准》[6]和GJB1335—92《低矿化度饮用水矿化卫生标准》[7]设定投加范围。每组水样取50 mL并添加CaCO3使其饱和,24 h后测定其pH值,以下称为pHs,同时测定其钙含量。室温恒定25℃。

表2 自来水的水质指标*Table2 Tap water quality index
pH值:采用美国哈希公司哈希HQ40d 双路输入、C101 型号电极进行测量。总硬度:采用GB/T5750.4—2006《生活饮用水标准检验方法感官性状和物理指标》中的乙二胺四乙酸二钠(Na2EDTA)滴定法进行测定。总碱度:参照GB8537—2018《食品安全国家标准饮用天然矿泉水》中盐酸滴定法进行测定。钙:按照GB 7476—87《水质钙的测定EDTA 滴定法》进行测定。
在计算R.S.I.时,测定水样的实际pH值;水样中加入碳酸钙至饱和,隔绝空气放置24 h,测定水样的pH值,称为饱和pH值,即pHs,根据式(1)计算得R.S.I.。
根 据CCPP=100([Ca2+]i- [Ca2+]eg)[9-10]计算CCPP,单位为mg·L-1;[Ca2+]i为待测液中原有钙离子浓度,单位为mol·L-1;[Ca2+]eg为水样加入碳酸钙平衡后钙离子浓度,单位为mol·L-1。
2 结果及讨论
2.1 碳酸氢钠、氯化钙投加量对水质指标的影响
调质后水质符合GB5749—2006、GJB1335—92标准要求。
由图1可知,调质后pH值为7.0~8.5,满足Martin Fox[19]提出的健康饮水标准,呈弱碱性(pH =7.0~8.0)。当CaCl2投加量一定,NaHCO3投加量低于70 mg·L-1时,随着NaHCO3投加量的增加,水体pH值呈上升趋势,当超过70 mg·L-1时,水体pH值波动很小,这是由于随着水体中NaHCO3投加量的增加,水体缓冲能力增强。基于水质标准、经济性考虑,可知NaHCO3适宜投加量在70 mg·L-1以 上。NaHCO3投加量一定时,随着CaCl2投加量的增加,pH值呈下降趋势,但较NaHCO3投加量影响小,建议CaCl2适宜投加量为20 mg·L-1。

图1 pH值随NaHCO3、CaCl2投加量的变化Fig.1 Variation of pH with the increase of NaHCO3 and CaCl2
由图2可知,CaCl2投加量一定,NaHCO3投加量低于90 mg·L-1时,随着NaHCO3投加量的增加,水体碱度呈上升趋势。当其投加量超过90 mg·L-1时,碱度基本不变,这是由于随着水体中NaHCO3投加量的增加,水体缓冲能力增强。CaCl2投加量对碱度几乎无影响。
由图3可知,随着CaCl2投加量的增加,水体硬度增加,NaHCO3投加量对硬度几乎无影响。
2.2 碳酸氢钠、氯化钙投加量对化学稳定性指标的影响
2.2.1 碳酸氢钠、氯化钙投加量对R.S.I.的影响
由图4可知,当CaCl2投加量不变时,随着NaHCO3投加量从50 mg·L-1增加到90 mg·L-1,R.S.I.降低(趋近于6.0~7.0),水质由严重腐蚀状态逐渐转变为轻度腐蚀状态;随着NaHCO3投加量从90 mg·L-1增加到110 mg·L-1,R.S.I.升高(偏离于6.0~7.0),水质由轻度腐蚀向重度腐蚀状态转变,由实验结果可知,NaHCO3的适宜投加量为90 mg·L-1,此时,水质稳定性较好。

图2 碱度随NaHCO3、CaCl2投加量的变化Fig.2 Variation of alkalinity with the increase of NaHCO3 and CaCl2
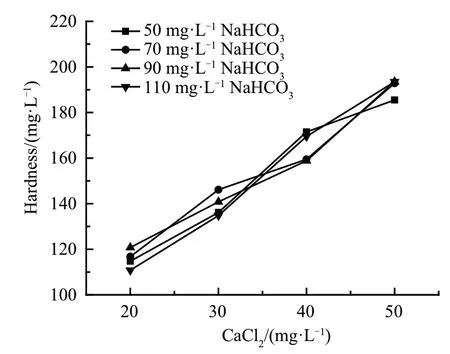
图3 硬度随NaHCO3、CaCl2投加量的变化Fig.3 Variation of hardness with the increase of NaHCO3 and CaCl2

图4 R.S.I.随NaHCO3、CaCl2投加量的变化Fig.4 Variation of R.S.I.with the increase of NaHCO3 and CaCl2
NaHCO3投加量为90 mg·L-1,CaCl2从20 mg·L-1增加到50 mg·L-1时,R.S.I.值波动幅度在0.4 以内。R.S.I.值显示水体腐蚀性变化不大。故建议CaCl2投加量为20 mg·L-1。
2.2.2 碳酸氢钠、氯化钙投加量对CCPP的影响
计算CCPP的原则:(1)CaCO3在水中溶 解或沉淀,都不影响水体酸碱性,即水中总酸度Acd 不变;(2)水体CaCO3溶解或沉淀,总碱度与钙离子浓度的差恒定,即
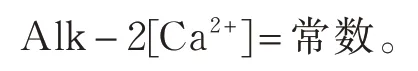
由图5知,当CaCl2投加量一定,NaHCO3的投加量从50 mg·L-1增至70 mg·L-1时,CCPP 降低,水质由较为稳定状态或轻微结垢状态转变为中度或重度腐蚀状态;NaHCO3投加量从70 mg·L-1增至110 mg·L-1时,CCPP趋于稳定。CaCl2投加量为20 mg·L-1时,水体CCPP值在-4~4,水质较其他投加剂量时稳定,且该投加剂量下使得调质水较原水(CCPP值为-20~-8)稳定。当NaHCO3投加量一定时,随着CaCl2投加量的增加,水体CCPP值整体降低,在实验条件下,CaCl2投加量的增加不利于提高水体稳定性,反而有可能加剧水体的腐蚀性。

图5 CCPP 随NaHCO3、CaCl2投加量的变化Fig.5 Variation of CCPP with the increase of NaHCO3 and CaCl2
根据CCPP 计算原则以及NaHCO3投加量和水体碱度的关系,上述现象是因为NaHCO3投加量在50 mg·L-1时,水体碱度一定,CaCl2增加,使得水体中CaCO3不平衡,水体中有过多Ca2+析出。当NaHCO3投加量从50 mg·L-1逐渐增加到70 mg·L-1时,碱度增加,当NaHCO3投加量为50~70 mg·L-1间的某一值时,水体中CaCO3趋于平衡。超过此投加量后,因CO32-多Ca2+少,水体有溶解外界离子的趋势。当NaHCO3投加量从70 mg·L-1逐渐增加时,水中碱度趋于一定,所以CaCl2投加量不变时,CCPP值趋于不变。当CaCl2投加量增加时,水体溶解与其接触的物质倾向增加,即腐蚀性增加。

图6 LR 随NaHCO3、CaCl2投加量的变化Fig.6 Variation of LR with the increase of NaHCO3 and CaCl2
2.2.3 碳酸氢钠、氯化钙投加量对LR的影响
由图6可知,当CaCl2投加量一定时,随着NaHCO3投加量的增加,LR 呈降低趋势,水体稳定性提高。当NaHCO3投加量达到90 mg·L-1时,LR变化减小,这是由于水中碱度趋于稳定。当NaHCO3投加量一定时,随着CaCl2投加量的增加,水体中Cl-增加、TDS 升高,进而水体离子活性增强、迁移速率增大、电导率增加,Cl-穿透金属管道表面的钝化膜层而与管壁发生化学反应,加速管道的腐蚀。LR值也随之增大,水体稳定性降低。由实验结果及经济性可知,NaHCO3适宜投加量为90 mg·L-1,CaCl2适宜投加量为20 mg·L-1。
2.3 碳酸氢根、钙投加量对健康指标ORP的影响
我国长白山矿泉水区是世界三大矿泉水水源地之一,区内8个泉眼的ORP值大部分在200 mV 以下,说明ORP值低对人体健康有重要作用[16]。尹军等[17]研究长白山地区天然矿泉水健康意义时,对小鼠进行抗氧化性实验,结果显示ORP 低的水在一定程度上提高了小鼠的抗氧化作用。
由图7可知,调质后的淡化水ORP值在150 以下。当CaCl2投加量一定时,随着NaHCO3投加量从50 mg·L-1增至90 mg·L-1时,水体ORP 呈降低趋势,NaHCO3投加量大于90 mg·L-1时,水体ORP 趋于平衡状态。由实验结果可知,NaHCO3的适宜投加量在90 mg·L-1左右。
在NaHCO3的投加量不变的情况下,随着CaCl2投加量的增加,水体ORP 呈略微升高趋势。CaCl2适宜投加量为20 mg·L-1。
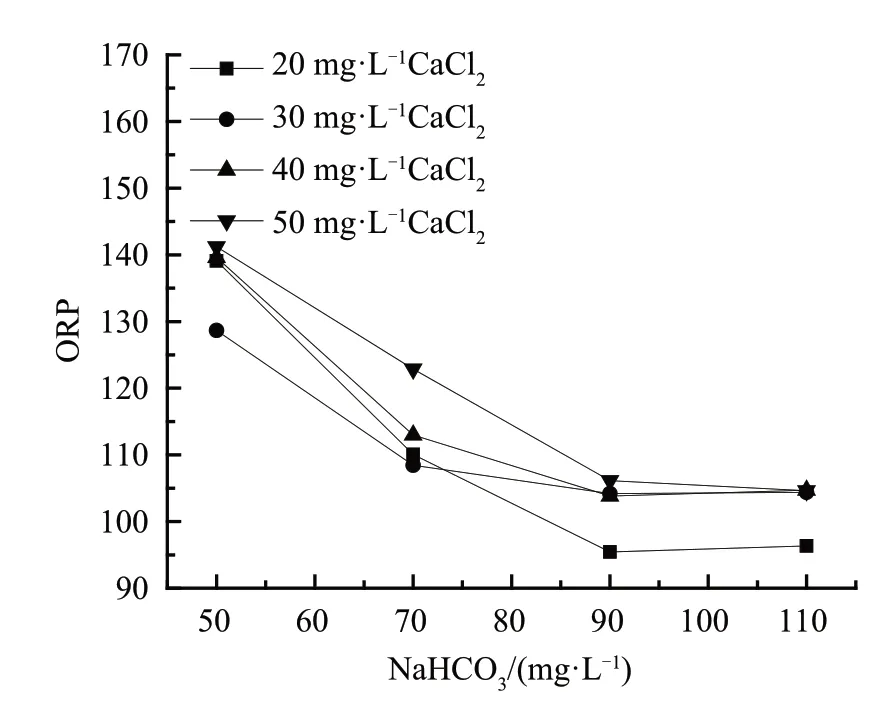
图7 ORP 随NaHCO3、CaCl2投加量的变化Fig.7 Variation of ORP with the increase of NaHCO3 and CaCl2
3 总 结
与原水比较,(1)调质后淡化水pH值由6.3~6.8 提高到7.0~8.0。(2)R.S.I值由呈极强腐蚀性的9~12 降至7.0~8.0,腐蚀性减弱。(3)调质后,水质CCPP 降低,稳定性得到改善。(4)随着NaHCO3投加量的增加,LR值减小。(5)调质后的淡化水ORP值由270~290 mV 降至200 mV 以下。投加调质剂之后,水体稳定性和健康性都得到了明显改善。在本实验条件和实验用淡化水水质条件下,NaHCO3投加量建议值为90 mg·L-1,CaCl2投加量建议值为20 mg·L-1。虽然部分稳定性指标无法达到理想值,但调质后水质得到明显改善,接近理想值。

