基于网络药理学和分子对接技术探讨归芍地黄汤加减方治疗抽动秽语综合征的作用机制
吴青业,张颖梅,王荣繁,郑志伟
广州华商学院健康医学院,广东 广州 511300
抽动秽语综合征(Tourette syndrome,TS)是一种发生在儿童时期的神经精神障碍性疾病,以不自主的运动性抽动和发声性抽动为主要特点,临床多表现为肌肉肢体的抽动及喉中发出异响或口出秽语[1]。该病在学龄儿童中的发病率为0.6%~1.0%,并有90%的TS 患者存在共病障碍[2],包括强迫症、注意力缺陷多动障碍、睡眠障碍、焦虑症、冲动控制障碍和人格障碍等[3-4],严重影响了患者正常的学习和生活,给家庭带来了沉重的心理负担。近年来,TS已成为小儿精神行为领域研究热点。
TS 类属传统医学中的“抽搐”“慢惊风”“瘛疭”“肝风”等范畴[5],多与心、肝二脏功能失调有关。归芍地黄汤加减方为课题组临床验方,主要由当归、白芍、生地、茯苓、天麻、西红花、山药等组成。本研究通过网络药理学[6]对归芍地黄汤加减方治疗抽动秽语综合征的主要活性成分、潜在作用靶点和信号通路进行综合研究,采用分子对接技术和体内动物实验进行验证,以期探讨归芍地黄汤加减方治疗TS 的作用机制。
1 材料
1.1 动物
SPF 级4 周龄雄性SD 大鼠48 只,由广东省医学实验动物中心提供,动物生产合格证号44007200112607。动物实验经广州中医药大学科技产业园有限公司实验动物使用及管理委员会批准(批准号PZ23001)。饲养环境温度(23±2)℃,相对湿度40%~70%,自由进食饮水,实验前适应性饲养1 周。
1.2 药材
归芍地黄汤加减方由白芍5 g、当归3 g、生地5 g、茯苓15 g、山药15 g、西红花1 g、天麻10 g等组成,经广州华商学院苏连杰教授分别鉴定为毛茛科植物芍药PaeonialactifloraPall.的干燥根、伞形科植物当归Angelicasinensis(Oliv.) Diels 的干燥根、玄参科植物地黄RehmanniaglutinosaLibosch.的新鲜或干燥块根、多孔菌科真菌茯苓Poriacocos(Schw.) Wolf 的干燥菌核、薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎、鸢尾科植物番红花CrocussativusL.的干燥柱头、兰科植物天麻GastrodiaelataBl.的干燥块茎经炮制加工而成。
1.3 药品与试剂
对照品阿魏酸(批号B20007)、槲皮素(批号B20527)、山柰酚(批号B21126)、异毛蕊花糖苷(批号B21535)、芍药苷(批号B21148)、对羟基苯甲醇(批号B20326)购自上海源叶生物科技有限公司,质量分数均≥98%;3,3′-亚氨基二丙腈(3,3′-iminodipropionitrile,IDPN,批号C14426981)购自麦克林试剂公司;盐酸硫必利片(批号LY220802,100 mg/片)购自江苏恩华药业股份有限公司;RIPA细胞裂解液购自美国Thermo Fisher Scientific 公司;大鼠白细胞介素-1β(interleukin-1β,IL-1β)ELISA检测试剂盒(批号PI303)、大鼠趋化因子配体2(CC motif chemokine ligand 2,CCL2)ELISA 检测试剂盒(批号PC128)购自上海碧云天生物技术有限公司;大鼠CXC 趋化因子配体8(C-X-C motif chemokine ligand 8,CXCL8)ELISA 检测试剂盒(批号ml002885)购自上海酶联生物科技有限公司;核因子-κB(nuclear factor-κB,NF-κB)p65 抗体(批号A19653)、p-NF-κB p65 抗体(批号AP0446)、kappa B 抑制蛋白激酶(inhibitor of kappa B kinase,IKK)抗体(批号A19606)、NF-κB抑制蛋白(inhibitor of NF-κB,IκB)抗体(批号A11397)、β-actin 抗体(批号AC026)均购自武汉爱博泰克生物科技有限公司;HRP 标记的羊抗兔IgG 二抗(批号HA1031)购自华安生物科技有限公司。
1.4 仪器
万分之一电子分析天平(梅特勒-托利多仪器有限公司);Sartorius 纯水机[赛多利斯(上海)贸易有限公司];R300 型旋转蒸发仪(瑞士步琦有限公司);FD-304 型箱体式真空冷冻干燥机(济南骏德仪器有限公司);Waters e2695-UV 高效液相色谱仪[沃特世科技(上海)有限公司];AB SCIEX 6500+质谱仪(上海爱博才思分析仪器贸易有限公司);Elx808 型酶标仪(美国Bio-Tek 公司);Forma370 型低温高速离心机;ChemiDocTM XRS+凝胶成像系统(美国Bio-Rad 公司);Nanodrop-2000c 型微量核酸蛋白检测仪(美国Thermo Fisher Scientific 公司)。
2 方法
2.1 网络药理学分析
2.1.1 归芍地黄汤加减方活性成分的筛选及靶点预测 分别检索TCMSP(http://tcmspw.com/tcmsp.php)和BATMAN-TCM 数据库,得到中药的有效成分及相关靶点,筛选条件为口服生物利用度(oral bioavailability,OB)≥30%、药物类药性(druglikeness,DL)≥0.18。然后采用Perl 软件(V5.30.0)将中药活性成分与相应靶点进行一一映射,并为筛选出的靶点添加基因名。
2.1.2 TS 靶点筛选 以“Tourette syndrome”为关键词,检索Gene Cards 数据库(https://genealacart.genecards.org/)、OMIM 数据库(https://www.omim.Org/)、Pharm GκB 数据库(https://www.pharmgκB.org/)、TTD 数据库(http://db.idrblab.net/ttd/)和Drug Bank 数据库(https://www.drugbank.Ca/),得到疾病相关靶点。
2.1.3 归芍地黄汤加减方防治TS 的调控网络构建利用Perl 软件将归芍地黄汤加减方活性成分靶点和TS 疾病靶点进行一一映射,得到活性成分与疾病的交集靶点,然后利用Cytoscape 软件(V3.7.1)进行网络可视化,得到活性成分-靶点网络。其中节点的类型有活性成分、靶点。
2.1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)构建及核心靶点筛选 利用STRING 在线软件将“2.1.3”项下得到的活性成分与疾病的交集靶点输入软件,筛选条件为种属选择人,隐藏不连接的节点,最小互作分数值为0.4,保存相应结果文件。利用Cytoscape 软件(V3.7.2)的插件CytoNCA 对PPI 网络进行拓扑分析,选取介度中心性(betweenness,BC)、接近中心性(closeness,CC)、度自由性(degree,DC)、特征向量中心性(eigenvector,EC)、局部边连通性(local average connectivity,LAC)、网络中心性(network,NC)6 个指标,以满足同时大于6 个指标中位数的节点作为关键靶点,以尽可能筛选出关键靶点。
2.1.5 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 将“2.1.3”项下得到的活性成分与疾病的交集靶点利用R 语言软件的Bioconductor 生物信息软件包进行处理,得到GO 功能富集分析。以P<0.05 认为统计学上具有差异。将“2.1.3”项下得到的活性成分与疾病的交集靶点利用R 语言软件的Bioconductor 生物信息软件包进行处理,得到KEGG 通路富集分析。以P<0.05 认为统计学上具有差异。
2.1.6 分子对接 对网络拓扑分析后筛选出的关键靶点IL-1β、溶质载体家族6 成员4(solute carrier family 6 member 4,SLC6A4)、单胺氧化酶 B(monoamine oxidase B,MAOB)、CXCL8、CCL2、单胺氧化酶A(monoamine oxidase A,MAOA)、骨肉瘤癌基因(FBJ osteosarcoma oncogene,FOS)与所对应的活性成分进行分子对接。从PubChem 网站下载药物有效成分2D 结构,利用ChemOffice 软件将2D 结构转换成3D 结构。从PDB 数据库获取关键靶点的3D 结构,利用PyMOL 软件对关键靶点的3D 结构删除水分子及小分子配体。利用autodock vina1.1.2 软件完成分子对接分析。
2.2 实验验证
2.2.1 归芍地黄汤加减方的制备 白芍5 g、当归3 g、生地黄5 g、茯苓15 g、山药15 g、西红花1 g、天麻10 g 等共煎煮、浓缩、冷冻干燥得干浸膏。课题组采用高效液相( high performance liquid chromatography,HPLC)建立归芍地黄汤指纹图谱,220 nm 下并标记出其中4 个峰,分别为对羟基苯甲醇、阿魏酸、芍药苷、异毛蕊花糖苷。367 nm 下标记出其中4 个峰,分别为阿魏酸、异毛蕊花糖苷、槲皮素、山柰酚。采用高效液相色谱串联高分辨质谱LC-MS/MS 法对归芍地黄汤加减方中的6 种成分进行定量分析,含芍药苷2.13 mg/g、槲皮素4.25 mg/g、β-谷甾醇6.24 mg/g、山柰酚4.78 mg/g、阿魏酸3.27 mg/g、对羟基苯甲醇1.77 mg/g。
2.2.2 TS 动物模型的制备 40 只SPF 级SD 大鼠ip IDPN(300 mg/kg)[7],给药体积为1 mL/kg,1 次/d,连续7 d 造模结束后,根据Diamond 评分标准[8]:0 分表示无刻板运动,与生理盐水的作用无差别;1 分表示出现躯体旋转行为;2 分表示头颈部的垂直上下运动过多;3 分表示头颈部的垂直刻板运动合并躯体旋转行为;4 分表示头向左右侧摆并伴有头颈部垂直上下运动过多。对造模的大鼠进行评分,其中头颈部的垂直刻板运动(上下运动过多)发作频率高、动作明显、易于分辨的,即评分结果≥2分,表明模型建立成功。
2.2.3 分组与给药 造模结束后将模型成功的大鼠分为模型组、盐酸硫必利(33 mg/kg)组和归芍地黄汤加减方高、中、低剂量(2.8、1.4、0.7 g/kg,以生药量计分别相当于临床等效剂量的4、2、1 倍)组,每组8 只,另取8 只正常大鼠作为对照组。各给药组ig 相应药物(10 mL/kg),对照组和模型组ig 等体积的纯净水,1 次/d,连续4 周。自给药第1天测定各组大鼠体质量,给药期间每7 天测量1 次。
2.2.4 行为学评分 第3 天给药后1 h 进行第1 次治疗效果评分,各组按照Diamond 评分标准和Nespoli 评分标准[9]进行评分。Nespoli 评分标准:0分表示无,没有抽动发作;1 分表示轻度,抽动出现时间少于40%,长时间停顿中出现数次抽动;2 分表示频繁,抽动在40%~70%的时间中出现,抽动和停顿交替进行;3 分表示持续,抽动几乎一直存在,只有短暂的自发中断;4 分表示强制,抽动始终存在,没有中断。随后根据Diamond 评分标准和Nespoli 评分标准每7 天对大鼠行为进行1 次评分。评分开始前先让大鼠适应环境5 min。
2.2.5 ELISA 法检测血清中IL-1β、CXCL8、CCL2水平 大鼠处死前1 d,禁食不禁水,末次给药60 min 后,ip 10%水合氯醛麻醉,取血约5 mL,静置30 min,4 ℃低温离心,取上层血清于离心管中,采用ELISA 法测定各组血清中IL-1β、CXCL8 和CCL2 水平。
2.2.6 Western blotting检测大鼠纹状体组织p-NF-κB p65、NF-κB p65、IKK 和IKB 蛋白表达 取各组大鼠脑部纹状体组织,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液,提取蛋白,BCA 法检测蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶中室温封闭1 h 后,加入一抗4 ℃孵育过夜,TBST 洗膜3 次;室温孵育二抗1 h,TBST 漂洗3 次后,采用ECL 显色法显影,使用全自动凝胶成像系统进行成像。
2.2.7 统计学分析 应用SPSS 26.0 软件统计数据,以±s表示。符合正态分布的多组资料采用单因素方差分析法(One-way ANOVA)检验,方差齐采用LSD 法检验,方差不齐组间采用Dunnett’s 检验。不符合正态分布采用Kruskal-Wallis 检验。
3 结果
3.1 归芍地黄汤加减方干预TS 靶点及通路预测
3.1.1 归芍地黄汤加减方活性成分及靶点筛选分别检索TCMSP 和BATMAN-TCM 数据库中归芍地黄汤加减方所有活性成分及相关靶点,对筛选出的靶点添加基因名。根据OB 和DL 参数对复方的活性成分进行筛选,分别得到白芍活性成分13 个、当归活性成分2 个、地黄活性成分2 个、茯苓活性成分15 个、山药活性成分16 个、西红花活性成分5 个、天麻活性成分1 个。对所有活性成分相应的靶点添加基因名后,共得到活性成分的靶点基因182 个(排除重复靶点后327 个),其中白芍靶点基因990 个、当归靶点基因69 个、地黄靶点基因34个、茯苓靶点基因30 个、山药靶点基因144 个、西红花靶点基因629 个、天麻靶点基因10 个。
3.1.2 TS 的靶点筛选结果 以“Tourette Syndrome”“coronary heart disease”和“coronary disease”为关键词,分别检索Gene Cards 数据库、OMIM 数据库、Pharm GκB 数据库、TTD 数据库和Drug Bank 数据库,取并集后得到疾病相关靶点1 358 个。
3.1.3 归芍地黄汤加减方防治TS 的调控网络构建利用Perl 软件将归芍地黄汤加减方活性成分靶点182 个和TS 疾病靶点1 358 个取交集后得到32 个交集靶点(图1)。这32 个交集靶点对应归芍地黄汤加减方中8 个活性成分见图2 和表1,图2 中圆形代表中药主要成分,长方形代表32 个交集靶点基因。红色代表白芍主要成分,绿色代表西红花主要成分,多种颜色代表多味药主要成分。
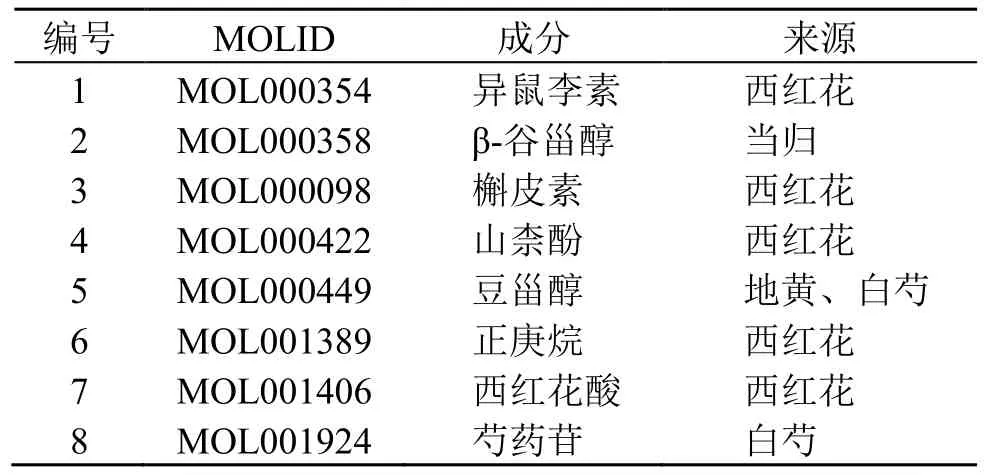
表1 归芍地黄汤加减方治疗TS 关键成分Table 1 Key compounds of modified Guishao Dihuang Decoction in treatment of TS
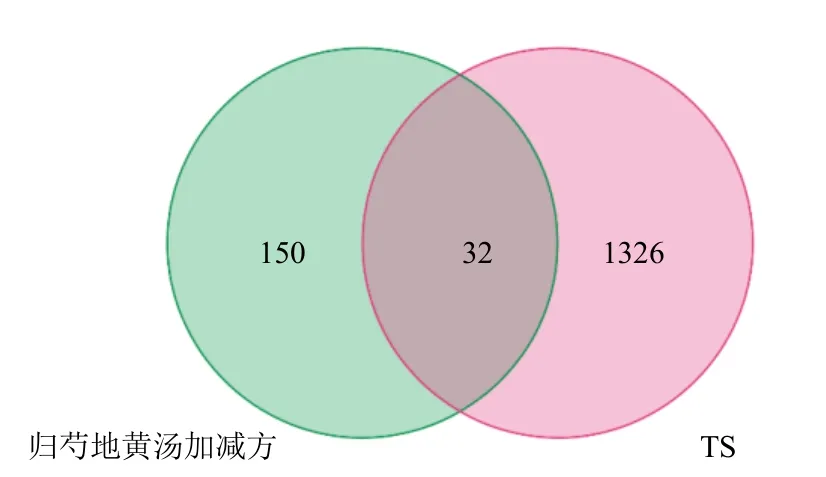
图1 归芍地黄汤加减方活性成分与TS 靶点的Venn 图Fig.1 Venn diagram of targets of active ingredients in modified Guishao Dihuang Decoction and TS
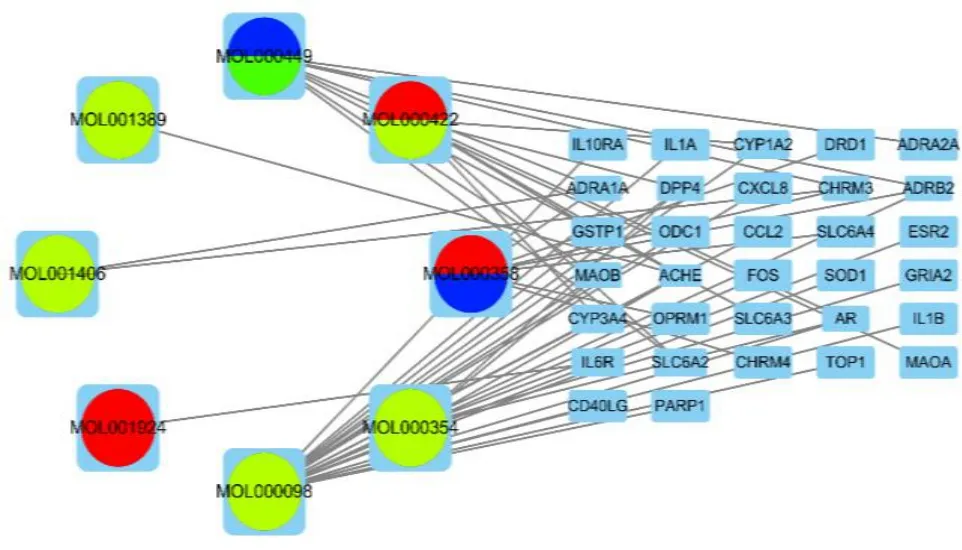
图2 活性成分-靶点网络Fig.2 Active ingredient-target network
3.1.4 PPI 网络的构建及关键靶点筛选 为了进一步筛选关键靶点,利用CytoNCA 插件进行网络拓扑分析,BC、CC、DC、EC、LAC、NC 等于1 倍中位数的关键靶点有IL-1β、SLC6A3、多巴胺受体D1(dopamine receptor D1,DRD1)、SLC6A4、MAOB、CXCL8、CCL2、MAOA、FOS(图3)。这9 个关键靶点是归芍地黄汤加减方防治TS 的核心作用靶点。
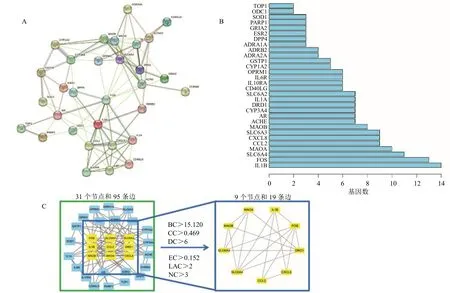
图3 归芍地黄汤加减方调控疾病网络构建及关键靶点筛选Fig.3 Construction of regulatory disease network and screening of key targets with modified Guishao Dihuang Decoction
3.1.5 GO 功能富集分析 GO 功能富集分析主要包括生物过程(biological process,BP),细胞组分(cellular component,CC)和分子功能(molecular function,MF)3 个部分。通过R 语言软件的Bioconductor 生物信息软件包进行GO 功能富集分析,如图4 所示,富集比较明显的前10 个BP 包括对脂多糖的反应、管径调节、血管大小的调节、血管直径调节、管尺寸调节、对细菌来源分子的反应、神经递质水平的调节、单胺转运、G 蛋白偶联受体信号通路、循环系统中的血管过程。富集比较明显的前10 个CC 包括突触前膜的组成部分、突触前膜固有成分、突触前膜、突触膜、突触后膜的整体成分、突触后膜、突触后膜固有成分、突触膜的组成部分、突触膜固有成分。富集比较明显的前10 个MF 包括儿茶酚胺结合、G 蛋白偶联胺受体活性、铵离子结合、钠-氯化物转运体活性、阴离子-钠转运体活性、神经递质受体活性、阳离子-氯化物转运体活性、肾上腺素能受体活性、阴离子阳离子转运体活性、细胞因子受体结合。
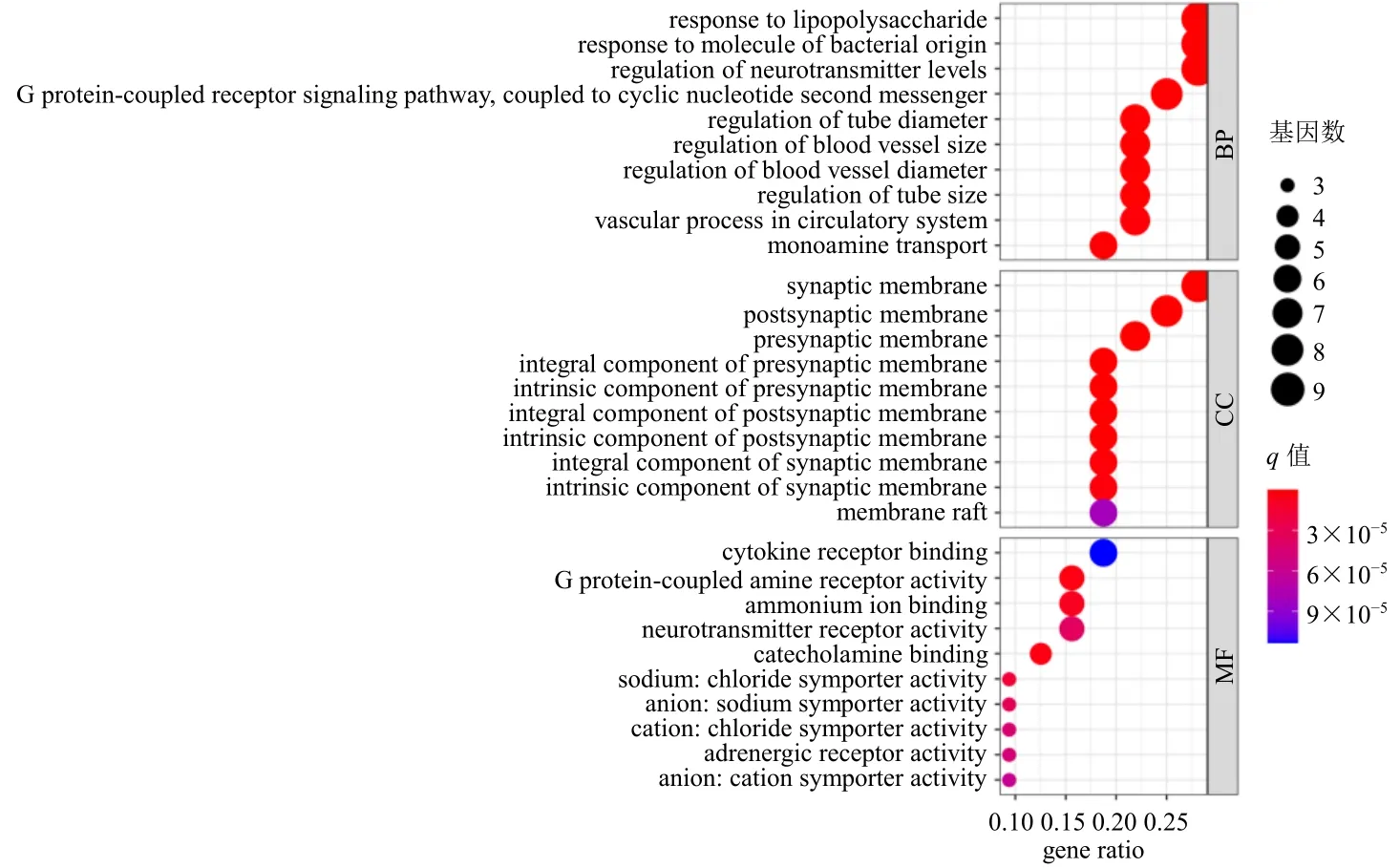
图4 GO 功能富集分析气泡图Fig.4 Bubble diagram of GO function enrichment analysis
3.1.6 KEGG 通路富集分析 通过R 语言软件的Bioconductor 生物信息软件包进行KEGG 通路富集分析,如图5 所示,富集比较明显的前20 个通路包括安非他明成瘾、可卡因上瘾、药物代谢-细胞色素P450、多巴胺能突触、类风湿性关节炎、疟疾、神经活性配体-受体相互作用、细胞因子-细胞因子-受体相互作用、化学致癌-受体活化、流体剪切应力与动脉粥样硬化、百日咳、IL-17 信号通路等。
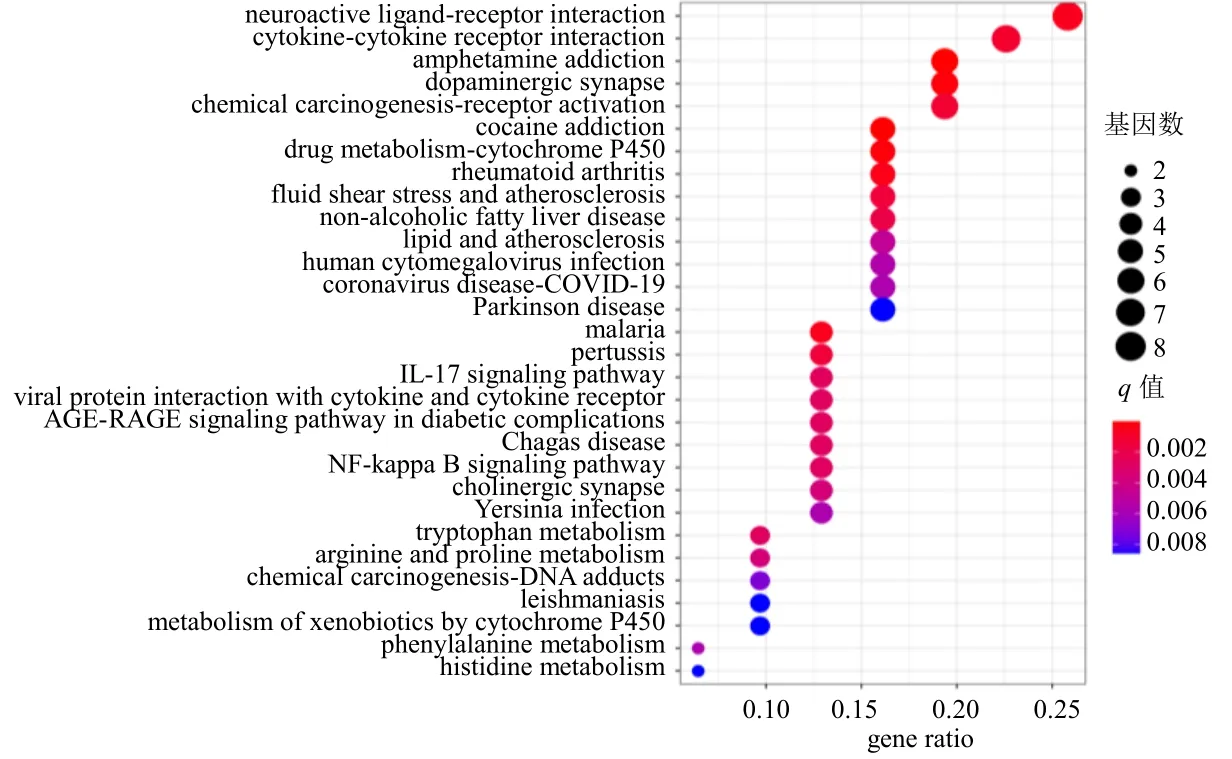
图5 KEGG 通路富集分析气泡图Fig.5 Bubble diagram of KEGG pathway enrichment analysis
3.1.7 分子对接结果 为了进一步验证网络预测能力,采用分子对接技术探讨归芍地黄汤加减方防治TS 的作用机制。将9 个关键靶点IL-1β、SLC6A4、MAOB、CXCL8、CCL2、MAOA、FOS、SLC6A3、DRD1 作为候选对接靶点;选取关键靶点所对应的活性成分槲皮素、豆甾醇、β-谷甾醇、异鼠李素作为候选对接药效成分,进行分子对接(图6)。成分与靶点的结合能及形成氢键数量是评价分子对接结果的重要依据。结合能越低,氢键数量越多,结合就越稳定,靶点与分子作用的可能性就越大。从分子对接结果(表2)可知,槲皮素、豆甾醇、β-谷甾醇、异鼠李素与IL-1β、SLC6A4、MAOB、CXCL8、CCL2、MAOA、FOS 7 个靶点的结合能均较低,且能形成氢键,这7 个靶点是归芍地黄汤加减方改善TS 的核心作用靶点。分子对接结果表明归芍地黄汤加减方可通过多成分治疗TS。
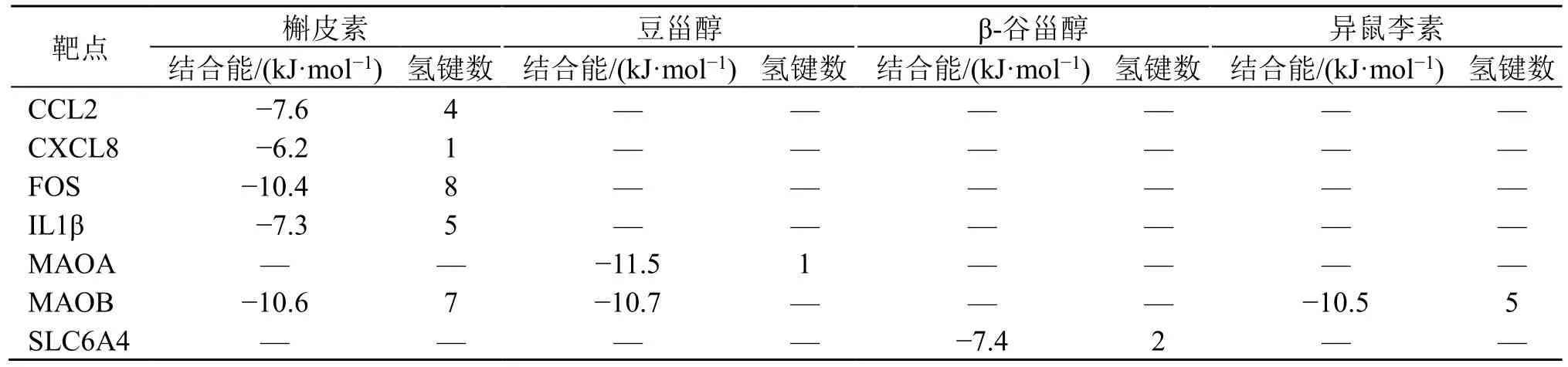
表2 归芍地黄汤加减方核心成分与靶点的结合情况Table 2 Combination of core ingredients and targets of modified Guishao Dihuang Decoction
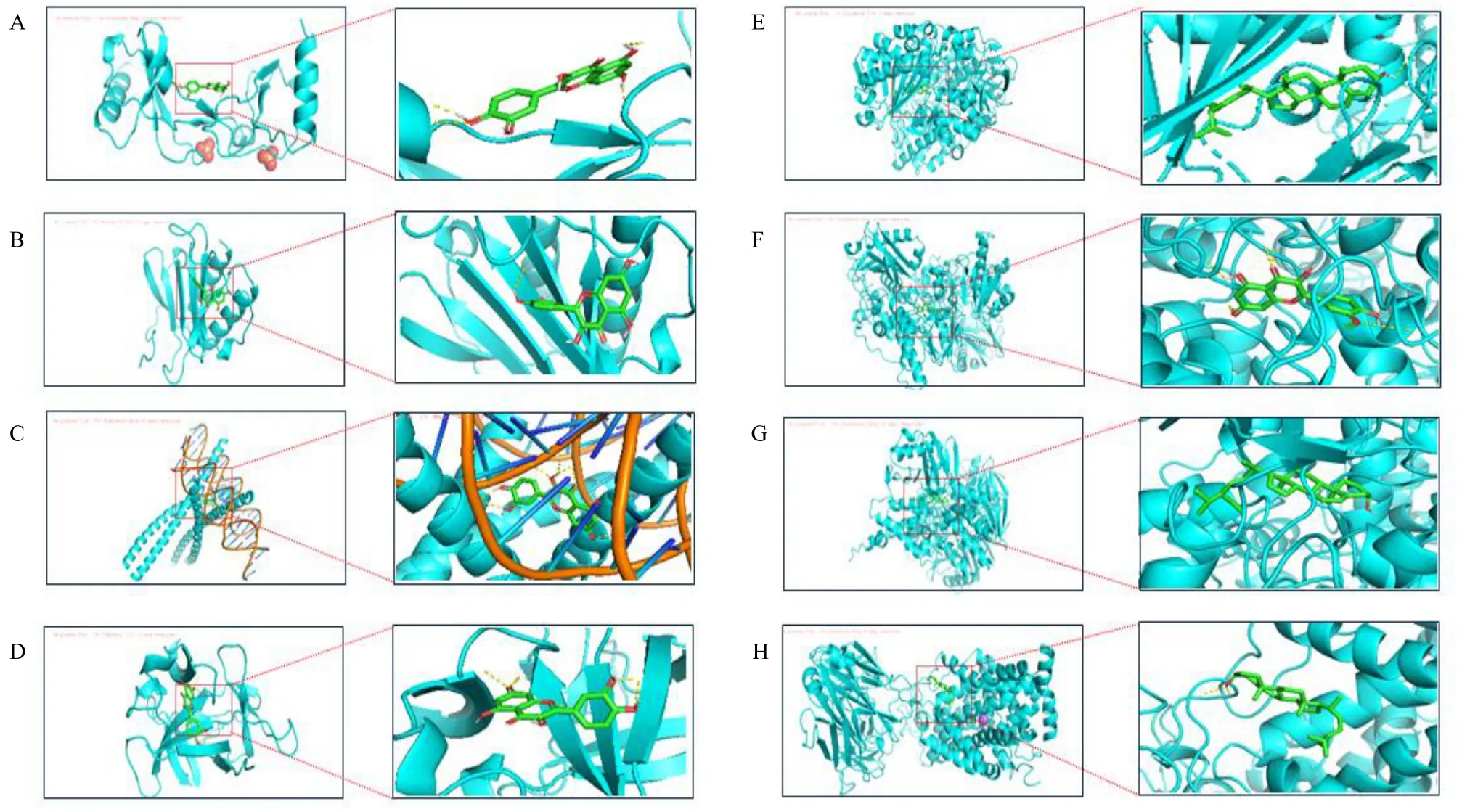
图6 归芍地黄汤加减方活性成分与关键靶点的分子对接示意图Fig.6 Molecular docking of active ingredients and key targets of modified Guishao Dihuang Decoction
3.2 归芍地黄汤加减方对TS 大鼠的保护作用
3.2.1 归芍地黄汤加减方对TS 大鼠体质量及行为学评分的影响 如图7 所示,与对照组比较,模型组大鼠体质量显著降低(P<0.05);给药干预后,大鼠体质量下降情况改善不明显。如表3 所示,与对照组比较,模型组大鼠刻板运动及抽动频率显著增加(P<0.01),TS 症状较严重;给药治疗4 周后,与模型组比较,盐酸硫必利组和归芍地黄汤加减方各剂量组大鼠刻板运动明显改善(P<0.05),归芍地黄汤加减方高、中剂量组抽动频率明显改善(P<0.05),TS 临床症状得到有效控制。
表3 归芍地黄汤加减方对TS 大鼠行为学评分的影响 (±s, n = 8)Table 3 Effect of modified Guishao Dihuang Decoction on behavior score of TS rats (±s , n = 8)
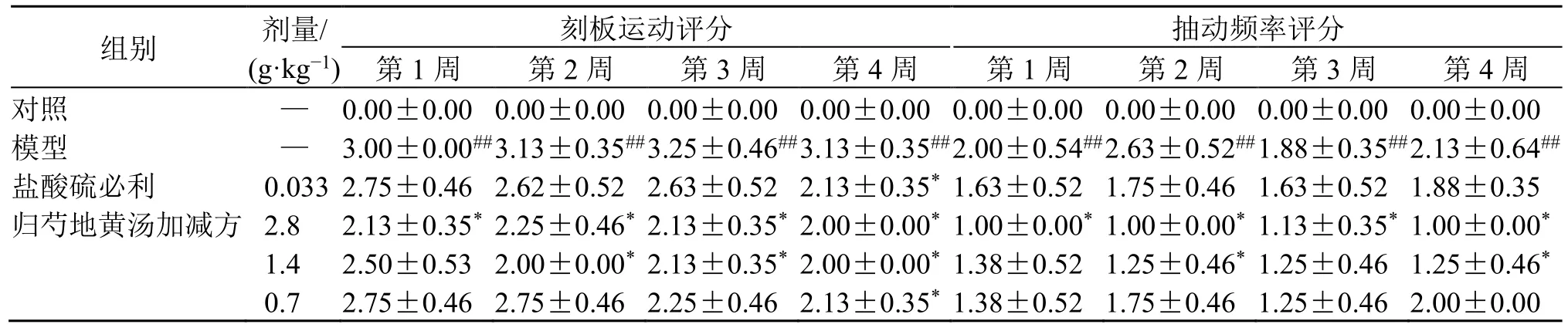
表3 归芍地黄汤加减方对TS 大鼠行为学评分的影响 (±s, n = 8)Table 3 Effect of modified Guishao Dihuang Decoction on behavior score of TS rats (±s , n = 8)
与对照组比较:##P<0.01;与模型组比较:*P<0.05。##P < 0.01 vs control group; *P < 0.05 vs model group.
组别 剂量/(g·kg−1)刻板运动评分 抽动频率评分第1 周 第2 周 第3 周 第4 周 第1 周 第2 周 第3 周 第4 周对照 — 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00模型 — 3.00±0.00## 3.13±0.35## 3.25±0.46## 3.13±0.35## 2.00±0.54## 2.63±0.52## 1.88±0.35## 2.13±0.64##盐酸硫必利 0.033 2.75±0.46 2.62±0.52 2.63±0.52 2.13±0.35* 1.63±0.52 1.75±0.46 1.63±0.52 1.88±0.35归芍地黄汤加减方 2.8 2.13±0.35* 2.25±0.46* 2.13±0.35* 2.00±0.00* 1.00±0.00* 1.00±0.00* 1.13±0.35* 1.00±0.00*1.4 2.50±0.53 2.00±0.00* 2.13±0.35* 2.00±0.00* 1.38±0.52 1.25±0.46* 1.25±0.46 1.25±0.46*0.7 2.75±0.46 2.75±0.46 2.25±0.46 2.13±0.35* 1.38±0.52 1.75±0.46 1.25±0.46 2.00±0.00
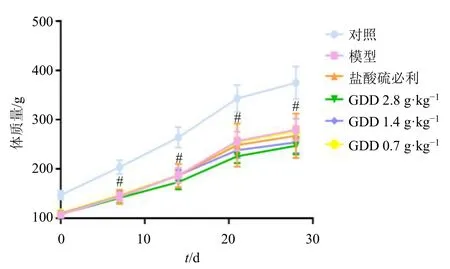
图7 归芍地黄汤加减方对TS 大鼠体质量的影响 (±s ,n = 8)Fig.7 Effect of modified Guishao Dihuang Decoction on body weight of TS rats (±s , n = 8)
3.2.2 归芍地黄汤加减方对TS 大鼠血清中IL-1β、CXCL8 和CCL2 水平的影响 如图8 所示,与对照组比较,模型组大鼠血清中IL-1β、CXCL8 和CCL2水平均显著升高(P<0.01);与模型组比较,盐酸硫必利和经归芍地黄汤加减方各剂量组IL-1β 和CXCL8 水平均显著降低(P<0.01),盐酸硫必利和经归芍地黄汤加减方高、中剂量组CCL2 水平显著降低(P<0.05、0.01)。
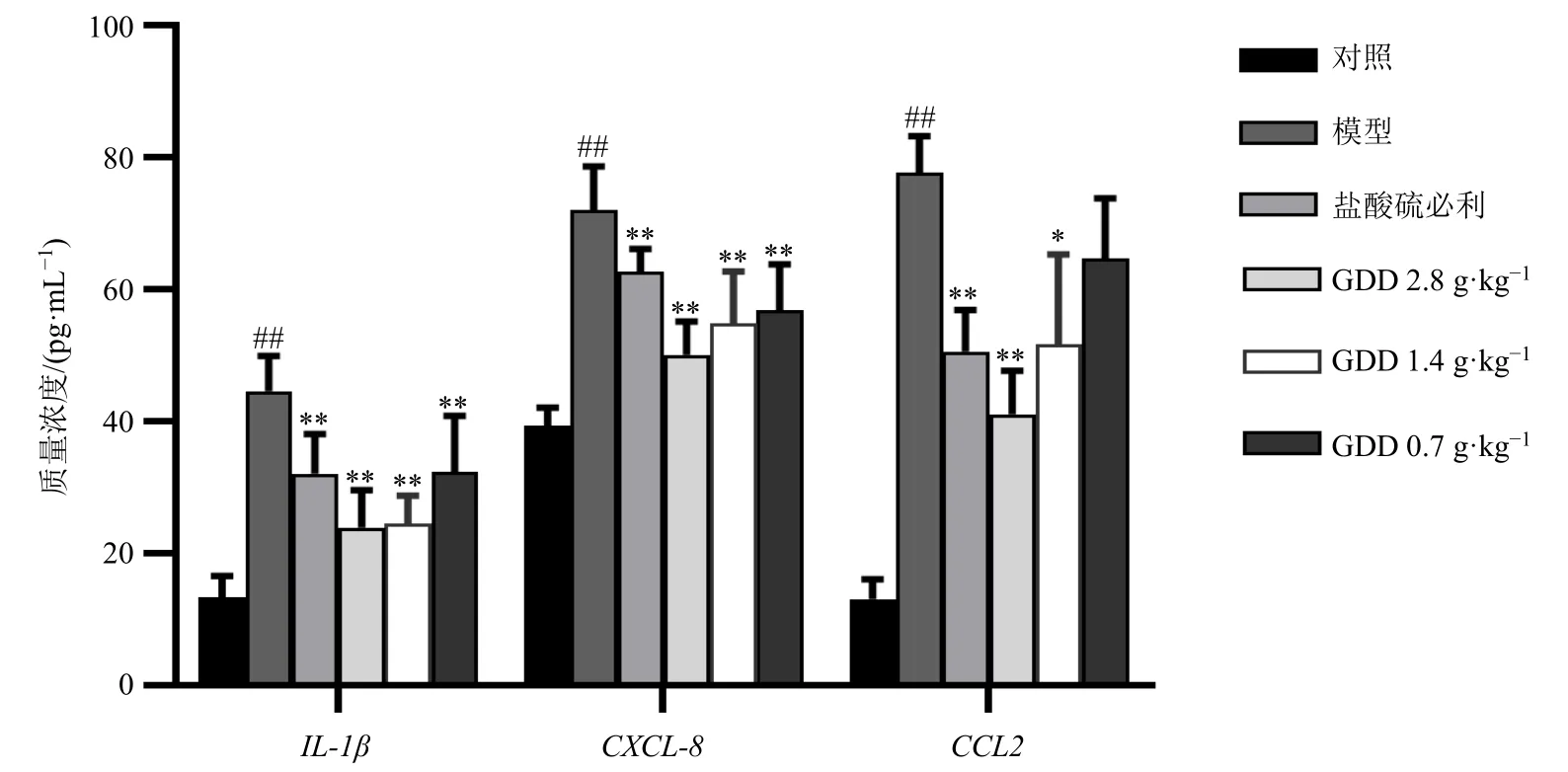
图8 归芍地黄汤加减方对TS 大鼠血清中IL-1β、CXCL-8 和CCL2 水平的影响 (±s , n = 8)Fig.8 Effect of modified Guishao Dihuang Decoction on levels of IL-1β, CXCL-8 and CCL2 in serum of TS rats(±s , n = 8)
3.2.3 归芍地黄汤加减方对TS 大鼠纹状体中NFκB 通路相关蛋白表达的影响 如图9 所示,与对照组比较,模型组大鼠纹状体中NF-κB p65、p-NF-κB p65、IKK 蛋白表达水平均显著升高(P<0.01),IκB蛋白表达水平显著降低(P<0.01);与模型组比较,归芍地黄汤加减方各剂量组NF-κB p65、p-NF-κB p65、IKK 蛋白表达水平显著降低(P<0.05、0.01),IκB 蛋白表达水平显著升高(P<0.01),表明归芍地黄汤通过调节NF-κB 信号通路相关蛋白的表达,发挥抗神经炎症的作用,从而减缓TS 大鼠症状。
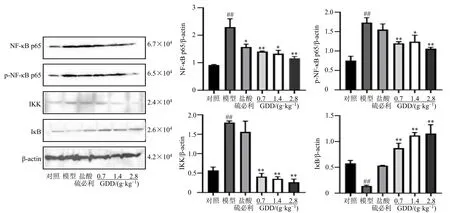
图9 归芍地黄汤加减方对TS 大鼠纹状体中NF-κB 通路相关蛋白表达的影响 (±s, n = 8)Fig.9 Effect of modified Guishao Dihuang Decoction on expressions of NF-κB pathway related protein in striatum of TS rats (±s, n = 8)
4 讨论
TS 是一种严重影响儿童身心健康的神经精神障碍性疾病,其病因极其复杂,致病机制尚不明确。《素问·至真要大论》有言:“诸暴强直,皆属于风,诸风掉眩,皆属于肝”,此病多与肝有关,并具有“阳常有余,阴常不足”的特点。传统医学认为肝气升之太过、阳动化风是其主要病因。阴血亏虚,阴液耗伤,筋脉失养,虚风内动,从而出现手足蠕动,眩晕耳鸣,五心烦热,舌红少津,阴虚内热等症。归芍地黄汤加减方依据“火宜静养,静能退火、制亢、镇潜”。凡阳升、火动、风盛、血溢等,皆以“静治”之法,以“静药”降、摄、镇、潜,清热填阴、潜阳熄风、安神等理论[10]结合临床经验制定。方中生地清热凉血、养阴生津,白芍补肝敛阴、平抑肝阳,当归养血柔肝;天麻息风止痉、平抑肝阳,茯苓健脾宁心,西红花凉血、安神,山药补脾益肾,全方共奏清热凉血、滋阴潜阳、健脾宁心之功。现代医学多认为TS 与遗传因素、社会心理因素、免疫因素、脑器质性因素及神经递质代谢障碍等有关。影像学及生理学研究发现,TS 的发展涉及皮质-纹状体-丘脑-皮质(cortico-striatal-thalamic-cortical,CSTC)回路[11],回路中富集丰富的神经递质,作为信息传递体,神经递质在躯体运动、情感行为、免疫应答中均发挥重要作用[12-13]。而构成免疫系统的细胞和分子在大脑发育和神经回路形成过程中也至关重要。研究结果显示,先天和适应性系统免疫途径及神经炎症在神经精神障碍性疾病的形成过程中发挥了重要作用[14-15]。
本研究通过网络药理学对归芍地黄汤加减方治疗TS 的作用机制进行初步研究,通过构建的活性成分-靶点网络,发现槲皮素、豆甾醇、β-谷甾醇、异鼠李素等活性成分可能是归芍地黄汤加减方发挥治疗作用的主要物质。通过GO 功能及KEGG 通路富集推测归芍地黄汤加减方可能调控神经递质受体活性配体-受体相互作用、细胞因子-细胞因子-受体相互作用、IL-17 信号通路、NF-κB 信号通路等发挥改善神经递质水平、神经炎症、抽动频率和刻板动作等作用。通过对32 个交集靶点进行PPI 分析筛选出IL-1β、CXCL8、CCL2、SLC6A4、MAOB、MAOA、FOS、SLC6A3、DRD1 9 个关键靶点,进而通过分子对接筛选出IL-1β、CXCL8、CCL2、SLC6A4、MAOB、MAOA 和FOS 7 个核心靶点。在神经精神障碍性疾病TS 的病理过程中,伴随着炎症的发生[16-17]。促炎因子(IL-1β、CXCL8 等)和趋化因子(CCL2 等)可以引起炎症过程中血清和纹状体的广泛变化。IL-1β 是典型的促炎性细胞因子,通过诱导黏附分子分泌,激活中性粒细胞,发生黏附作用和脱颗粒,参与炎症发生,与组织的水肿或组织损伤有关[18]。CXCL8 是一种由巨噬细胞和小胶质细胞等多种细胞类型产生的促炎细胞因子,在炎症反应中发挥重要作用[19]。CCL2 主要抑制星形胶质细胞炎症的消退从而促进神经炎症的进展[20]。TS 等神经发育障碍性疾病的脑组织转录组学研究结果显示,调控突触和神经元的基因表达下调,而调控炎症的基因表达上调[21],结合临床研究,低度的神经炎症可能是神经精神障碍性疾病潜在发生因素[22-23]。此外,神经递质水平的失衡被认为是TS发病机制之一[24-26]。SLC6A4 编码5-羟色胺(5-hydroxytryptamine,5-HT)转运蛋白5-羟色胺转运体(serotonin transporter,SERT),通过对SERT 的调控进而影响5-HT 水平。5-HT 是一种关键的单胺类神经递质,广泛存在于边缘系统、基底神经节、枕部和额部皮质中,参与行为管理、情绪调控、睡眠周期等多种生理功能[27]。SERT 将5-HT 从突触间隙重摄取回突触前膜,终止5-HT 的作用并以钠依赖性方式对其进行回收,作为主要机制参与调控神经元间兴奋的传递。MAOA 介导的酶解作用也参与了5-HT 的清除过程[28],SERT再摄取后,5-HT 一部分进入胞质囊泡以备再释放,另一部分在胞质中被线粒体内的MAOA 降解,代谢为最终产物5-羟吲哚乙酸。临床研究结果显示,TS 患者脑部纹状体中SERT 蛋白表达升高,5-HT水平降低[29-33]。体内实验研究发现,SERT 表达升高导致大鼠出现刻板运动、大理石掩埋、过度筑巢等类似TS 的症状,抑制SERT 的过度表达,TS 大鼠症状明显改善[33-34]。通过TS 神经炎症、神经递质的等方面的研究,对于TS 临床用药及症状改善具有重要指导意义。
KEGG 信号通路富集结果显示神经活性配体-受体相互作用、NF-κB、细胞因子-细胞因子-受体相互作用等信号通路为防治TS 核心信号通路。NF-κB是一种关键的转录因子,参与先天免疫和适应性免疫、炎症反应以及细胞分化、增殖和存活等其他过程的协调,在调节免疫细胞活化方面发挥关键作用。根据网络药理学研究结果,推测归芍地黄汤加减方可能通过抑制神经炎症反应、调节免疫功能,改善TS 症状,与目前的研究结果吻合。分子对接结果显示,槲皮素、豆甾醇、β-谷甾醇、异鼠李素与核心靶点IL-1β、CXCL8、CCL2、SLC6A4、MAOB、MAOA、FOS 结合能较低且能形成氢键,具有良好的结合效果。为进一步验证网络药理学分析结果,结合上述分析最终选取核心靶点IL1β、CXCL8、CCL2 进行体内实验验证。结果显示,归芍地黄汤加减方能够通过抑制炎症反应,降低血清中炎症因子IL-1β、CXCL-8和CCL2 水平,并下调纹状体中NF-κB p65、p-NF-κB p65、IKK 蛋白表达,上调IκB 蛋白表达,有效抑制NF-κB 通路激活,改善IDPN 诱导的TS大鼠刻板运动和抽动频率评分,有效改善TS 临床症状,初步证实了网络药理学的预测结果。
本研究通过网络药理学对归芍地黄汤加减方改善TS 的物质基础、作用靶点和作用机制进行预测,结合动物实验验证了归芍地黄汤加减方的药理作用和相关机制,初步证明归芍地黄汤加减方可能通过神经免疫网络发挥治疗作用。课题组后期将就网络药理学分析的神经活性配体-受体相互作用,兴奋性与抑制性神经递质水平等进行研究,深入研究归芍地黄汤加减方治疗TS 的作用机制。
利益冲突所有作者均声明不存在利益冲突