苹果酸脱氢酶协同纤维素酶水解纤维素:理论分析与实验
董友情,唐爱星,刘幽燕,李青云,2
(1 广西大学化学化工学院,广西 南宁 530004;2 广西生物炼制重点实验室,广西 南宁 530003)
木质纤维素是地球上最丰富的生物聚合物,广泛存在于各种形式的可再生生物质中[1]。将木质纤维素材料转化为燃料和化学品是解决人类社会能源和资源可持续发展的途径[2],其转化过程涉及预处理、水解和发酵[3]。由于纤维素结构复杂,通过水解作用使纤维素解构是实现纤维素资源化利用的关键步骤。目前研究纤维素水解方法包括物理机械法[4]、化学法[5]和酶法[6]等。采用纤维素酶水解纤维素相较于其他方法具有清洁、节能、安全等显著优势,而解决纤维素酶对纤维素的可及性对提高酶法水解效率尤为关键。
以糖苷键连接葡萄糖单体为结构特征的纤维素分子由于存在氢键的作用,使其具有较高的刚性而难以被纤维素酶接触,因此破坏纤维素分子的糖苷键、氢键网络结构,降低纤维素的结晶度是提高纤维素酶可及性的重要途径,采用添加纤维素降解辅助蛋白的策略被认为是达到这个目的的有效手段[7]。纤维素降解辅助蛋白是一类本身不具有纤维素酶活力,但是可以通过降低纤维素的结晶度、破坏纤维素链间的氢键以及提高纤维素表面的粗糙程度等方式破坏纤维素的结晶结构,从而促进纤维素酶与底物结合,显著提高纤维素酶活的蛋白[8]。目前发现碳水化合物结合模块、扩展蛋白、膨胀素、辅助活性家族等蛋白对纤维素酶都具有协同作用[9],糖苷水解酶也被发现具有协同纤维素酶水解的作用,例如糖苷水解酶家族GH7 中的TrCel7 可以通过减少纤维素酶对纤维素的非生产性吸附来提高纤维素酶的水解效率[10]。膨胀素SWO Ⅰ与糖苷水解酶家族GH10中的木聚糖酶结合后能有效避免纤维素酶的非生产性吸附,从而提高纤维素酶的水解效率[6]。而糖苷水解酶家族GH4 中的α-葡萄糖苷酶则通过破坏纤维素分子的糖苷键来促进纤维素水解[10]。Varrot 等[11]在研究糖苷水解酶家族GH4时发现,α-葡萄糖苷酶与苹果酸脱氢酶(malate dehydrogenase,MDH)的序列同源,并且二者的蛋白折叠结构极为相似[12],由此猜测MDH 可能对纤维素酶水解也具有协同作用。
基于对MDH 的功能假设,本研究以结晶度高的滤纸纤维素为研究对象,首先通过分子对接进行理论分析,然后开展MDH 协同纤维素酶水解纤维素的实验考察。MDH 是三羧酸循环过程中的关键酶,广泛存在于各类生物中[13],研究MDH 对纤维素酶水解纤维素的协同作用,不仅拓展和丰富了纤维素降解辅助蛋白的资源来源,而且为纤维素水解效率的进一步提高提供了理论指导与方法基础。
1 材料和方法
1.1 材料与仪器
苹果酸脱氢酶(MDH),来源于大肠杆菌,上海源叶生物有限公司,分子量34kDa,酶活力为670U/mg,比活力为200U/mg;纤维素酶C1184,来源于黑曲霉,Sigma公司,酶活力为0.3U/mg;结晶纤维素、纤维二糖和羧甲基纤维素,索莱宝生物有限公司;柠檬酸、柠檬酸钠,国药集团化学试剂有限公司,皆为分析纯;乙腈,上海阿拉丁生化科技股份有限公司,色谱纯;Whatman 1号滤纸,索莱宝生物有限公司,裁剪成1cm×3cm 的滤纸条,待用。
高效液相色谱仪UltiMate 3000,美国赛默飞世尔科技公司;蒸发光检测器SEDEX85,法国SEDERE公司;酶标仪BioTek,美国伯腾仪器有限公司;X 射线衍射仪(XRD)SmartLab SE,日本Rigaku 公司;傅里叶红外光谱仪(FTIR)Nicolet iS 50,美国赛默飞世尔公司;扫描电子显微镜(SEM)Sigma 300,德国Zeiss公司;水浴培养振荡器SHZ-88,金坛市器械厂。
1.2 实验方法
1.2.1 MDH与结晶纤维素的分子对接
通过PDB数据库(https://www.rcsb.org)[14]筛选同样来源于大肠杆菌、分子量为34kDa的苹果酸脱氢酶,选择PDB序号为2CMD[13]的MDH作为分子模拟的受体蛋白。分别采用Epript 3[15]和PyMOL[16]软件对MDH 与序号为1OBB 的α-葡萄糖苷酶[17]进行氨基酸序列比对和蛋白结构对比,获取MDH 蛋白结构与功能的基本信息。从PubChem[18]库中选择结晶纤维素作为小分子配体,以MDH 作为受体,使用AutoDock tools (Vina)[19]进行分子对接,理论分析MDH对结晶纤维素的作用。
1.2.2 MDH协同纤维素酶水解纤维素的实验研究
1.2.2.1 MDH协同纤维素酶的水解反应
称量(50.00±0.50)mg滤纸条,分别添加0.06FPU(滤纸纤维素酶活力)的纤维素酶C1184 和150μg MDH,用0.1mol/L 的柠檬酸缓冲液(pH=4.80)补足反应体系的总体积为2.00mL,在120r/min、50℃恒温水浴震荡条件下水解反应24h。由于纤维素酶C1184本身有还原糖,因此以未添加滤纸的样品作为空白组扣除,通过DNS法[20]测定还原糖产量,计算协同蛋白MDH 对纤维素酶的增效活性,结果以平均值表示,见式(1)。
式中,A为纤维素酶和MDH 共同作用的还原糖产量;B为纤维素酶单独作用的还原糖产量。
1.2.2.2 MDH 协同纤维素酶水解纤维素的影响因素
单因素考察MDH 添加量(0、50μg、150μg、300μg)、纤维素酶量(0、0.020FPU、0.040FPU、0.060FPU、0.10FPU、0.50FPU、1.0FPU、2.0FPU)以及酶解时间对MDH 协同纤维素酶水解纤维素的影响。每个样品做3个平行,通过测定还原糖的产量来计算MDH 对纤维素酶的平均增效活性。采用SPSS 25对MDH添加量和纤维素酶添加量的实验结果进行单因素ANOVA 分析,P<0.05(*)表示有显著差异,P<0.01(**)表示有极显著差异。
1.2.3 MDH对纤维素酶活的影响
分 别 称 量(20.00±0.20)mg 羧 甲 基 纤 维 素(carboxymethylcellulose,CMC)、(20.00±0.20)mg结晶纤维素(crystalline cellulose,MCC)以及(10.00±0.10)mg 纤维二糖[D-(+)-cellobiose]为底物,添加0.06FPU 的纤维素酶C1184 和150μg 的MDH,在上述相同条件下水解反应60min,反应结束测定还原糖产量。其中,纤维二糖的产物葡萄糖通过高效液相色谱和蒸发光检测器(HPLC-ELSD)的联合使用进行测定[21]。
1.2.4 MDH作用滤纸的表征分析
将水解反应结束后的滤纸用去离子水洗涤,除去附着在底物上的还原糖等物质,60℃烘干后分别进行SEM、XRD和FTIR的表征分析。
将滤纸样品喷金处理,在加速电压为3.0kV的条件下进行SEM 分析。XRD 的检测条件[22]为:管电压45kV,管电流40mA,扫描范围为5°~40°,扫描速度为4°/min,计算并比较MDH 作用滤纸前后的结晶度指数,见式(2)。
式中,CrI 表示结晶度指数;hcr 表示2θ=22.8°左右的主衍射峰高度;ham 表示2θ=18.0°处无定形组分的散射强度。
将滤纸和KBr以1∶100的比例进行混合,反复研磨直至均匀混合,然后制成压片进行FTIR 检测分析[22],扫描分辨为4cm-1,波数为4000~400cm-1。
2 结果与分析
2.1 MDH协同作用的理论分析
根据Varrot 等[11]和Lodge 等[17]提出α-葡萄糖苷酶与苹果酸脱氢酶MDH序列同源的结论,将MDH与α-葡萄糖苷酶进行氨基酸序列比对,两种蛋白的序列同源性为17%,该数值与文献报道的结果相一致[11]。进一步将MDH 与α-葡萄糖苷酶的蛋白结构进行对比,得到的均方根误差(RMSD) 值2.84Å(1Å=0.1nm)小于3.00Å,图1(a)显示,MDH的蛋白结构与α-葡萄糖苷酶的蛋白结构叠合良好。使用InterPro 数据库[23]进行蛋白功能注释分析,发现MDH与α-葡萄糖苷酶、6-磷酸β-葡萄糖苷酶、α-半乳糖苷酶等GH4 家族的蛋白属于同源超家族(homologous superfamily),它们同为罗斯曼折叠形式。已知α-葡萄糖苷酶可以破坏纤维素分子链的糖苷键而协同促进纤维素酶的水解,由此推测MDH 很可能对纤维素的结晶区域结构也具有破坏作用,因此采用结晶纤维素为模型底物与MDH 进行分子对接。计算所得RMSD 值为1.03Å,结合能为-8.32kcal/mol(1kcal/mol=4.18kJ/mol),处于文献报道的RMSD≤3.00Å、在结合能小于0 的范围,说明对接结果良好[24]。图1(b)所示,MDH的活性口袋附近有精氨酸(Arg)、甘氨酸(Gly)和异亮氨酸(Ile)等氨基酸残基,Arg是起保护作用的氨基酸,参与底物羧酸部分的结合,并且有研究发现该氨基酸能促进氢键的形成[11];Gly 和Ile是疏水残基,这些疏水氨基酸形成的疏水表面有利于与纤维素微纤维的疏水表面相接触[24]。MDH 通过Arg80、Gly7、Gly11、Gly13、Gly78 和Ile12 这6 个氨基酸形成的氢键作用与结晶纤维素结合,键长分别为2.10Å、3.10Å、3.20Å、2.20Å、2.10Å 和2.70Å。此外,与文献报道的其他纤维素降解辅助蛋白的结构不同,例如TlEXLX1、CxEXL22等典型扩展蛋白活性中心的N 端包含一个双-psiβ-桶状折叠(DPBB)结构域,C端包含一个β-三明治折叠结构域[25-26],而罗斯曼折叠的蛋白结构其活性中心主要位于N末端的β 折叠片层上,该片层为疏水结构[17],这也有利于MDH 与纤维素的结合。由上述理论分析可知,MDH 可能通过氢键和疏水作用与纤维素结合,由此破坏纤维素链间的氢键网络结构,降低纤维素的凝聚,使得更多纤维素暴露出来,从而提高纤维素酶的可及性[26],协同促进纤维素酶的水解。
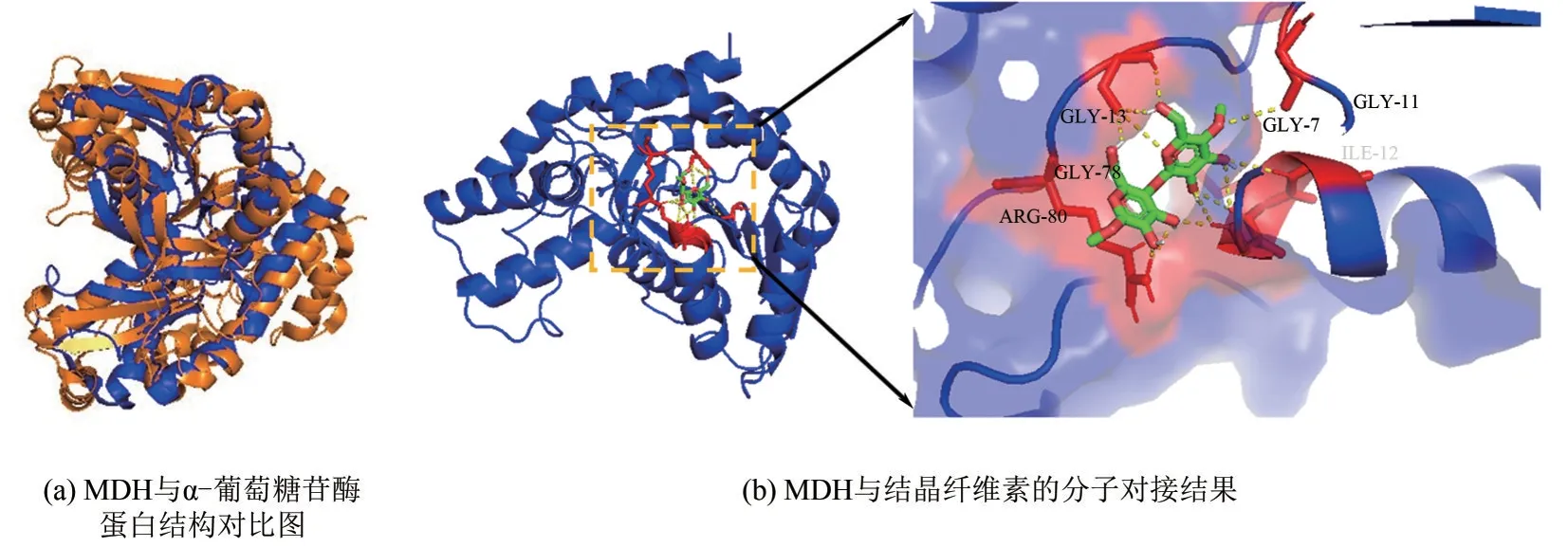
图1 MDH蛋白结构和功能的理论分析
2.2 MDH协同作用及影响因素的实验分析
基于上述MDH 的蛋白结构与功能分析,通过实验考察MDH对纤维素酶水解纤维素的协同作用。结果如图2 所示,MDH 本身对滤纸纤维素没有水解作用,0.06FPU 纤维素酶单独作用24h 的还原糖产量为(0.013±0.002)mg,当在体系中同时加入纤维素酶和150μg MDH 之后,还原糖产量增加至(0.045±0.004)mg,是纤维素酶单独作用时的(3.47±0.28)倍,表明MDH 显著促进了纤维素酶对纤维素的水解,MDH 对纤维素酶的增效活性达到247%±28%。文献报道的滤纸体系中,添加200μg扩展蛋白BsEXLX1作用24h 后,BsEXLX1 对纤维素酶的增效活性为67.7%±3.5%[27]。Qin 等[28]发现添加700μg/g(底物)的扩展蛋白POEP1作用24h,POEP1对纤维素酶的增效活性达到364%;而最近报道的来源于菌株Arthrobotryssp.CX1 的 扩 展 蛋 白CxEXL22[26],添 加5μg 水解反应48h,其对纤维素酶的增效活性达到240%;当以结晶纤维素为底物时,水解反应40h对纤维素酶的增效活性高达690%。由此可见,MDH 与扩展蛋白BsEXLX1、POEP1 和CxEXL22 的作用类似,能有效促进纤维素酶水解滤纸。
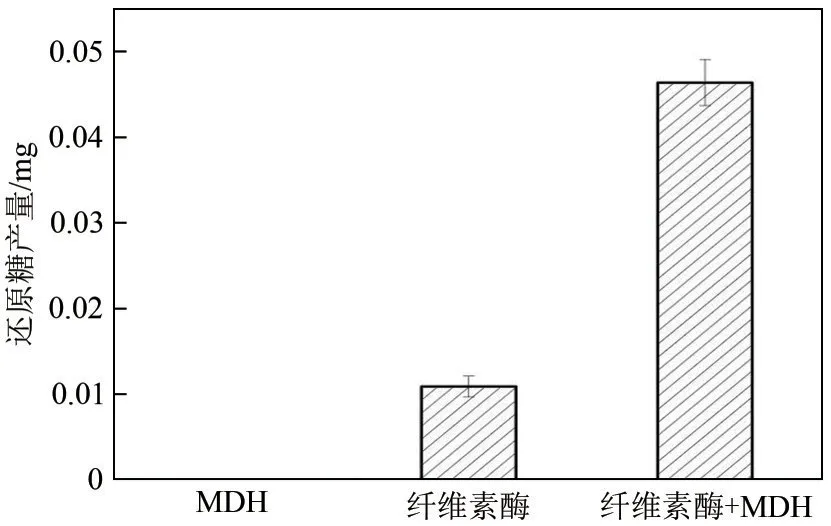
图2 添加MDH对纤维素酶的协同作用
进一步研究MDH 添加量、纤维素酶量、水解时间对滤纸纤维素水解的影响。图3(a)所示,与纤维素酶单独作用相比,添加MDH 后的还原糖产量显著增加,当MDH 添加量由50μg 增大至300μg时,还原糖的产量变化不显著,这反映一定纤维素酶量下的纤维素水解结果。MDH 对纤维素酶的增效活性在其添加量为150μg 时达到最大值232%,而在添加量为300μg 时却减小至196%,此现象可以用Kim等[27]提出的扩展蛋白与纤维素酶的协同作用存在饱和的观点进行解释。单因素方差分析结果表明,与未添加MDH的样品相比,添加MDH后对还原糖产量有极显著的影响(P<0.01),反映了MDH对纤维素酶水解纤维素具有显著的协同作用。图3(b)显示,在添加150μg MDH的情况下,体系中的还原糖产量随着纤维素酶添加量的增加而增大,但是MDH 对纤维素酶的增效活性在较低纤维素酶量情况下最为显著(在0.06FPU 时达到最高值229%),随着纤维素酶量的增加,增效活性反而降低,MDH 在较低纤维素酶量情况下所表现出的显著协同作用与文献报道的辅助蛋白Cel9A[29]、POEP1[28]等的研究结果相一致。显著性分析结果表明,当纤维素酶量在0.02~0.06FPU 范围时对还原糖产量无显著影响(P>0.05),当纤维素酶量大于0.06FPU 时有极显著影响(P<0.01),说明0.06FPU对本体系来说是纤维素酶用量的关键点。图3(c)为滤纸水解全过程的产物跟踪监测,图中所示,在0.06FPU纤维素酶、150μg MDH的体系中,还原糖产量随着时间的延长显著增加,酶解反应100h 后基本达到平衡,此时还原糖的产量达到0.199mg,而仅有纤维素酶的体系中,酶解反应12h后还原糖产量无明显增加,最终产量仅有0.0248mg,这与水解反应采用较低的纤维素酶量有关。通常纤维素酶的活性会受到水解产物葡萄糖抑制作用的影响,有研究发现当葡萄糖浓度为100g/L 时对工业纤维素酶产生高达50%的抑制作用[30],也有研究发现葡萄糖浓度为30g/L 时对纤维素酶有抑制作用[31],而Kim 等[27]和Qin 等[28]采 用 辅 助 蛋 白BsEXLX1、POEP1 协同纤维素酶水解时,纤维素酶的活性并没有因为还原糖产量的增加而降低。在本研究中也观察到相似的实验现象,这可能缘于使用较低用量的纤维素酶进行水解反应,使得产物的生成量相应也较少,因此未发生产物抑制的问题,添加MDH后还原糖产量的显著增加反映了MDH 对纤维素酶水解具有良好的协同作用。
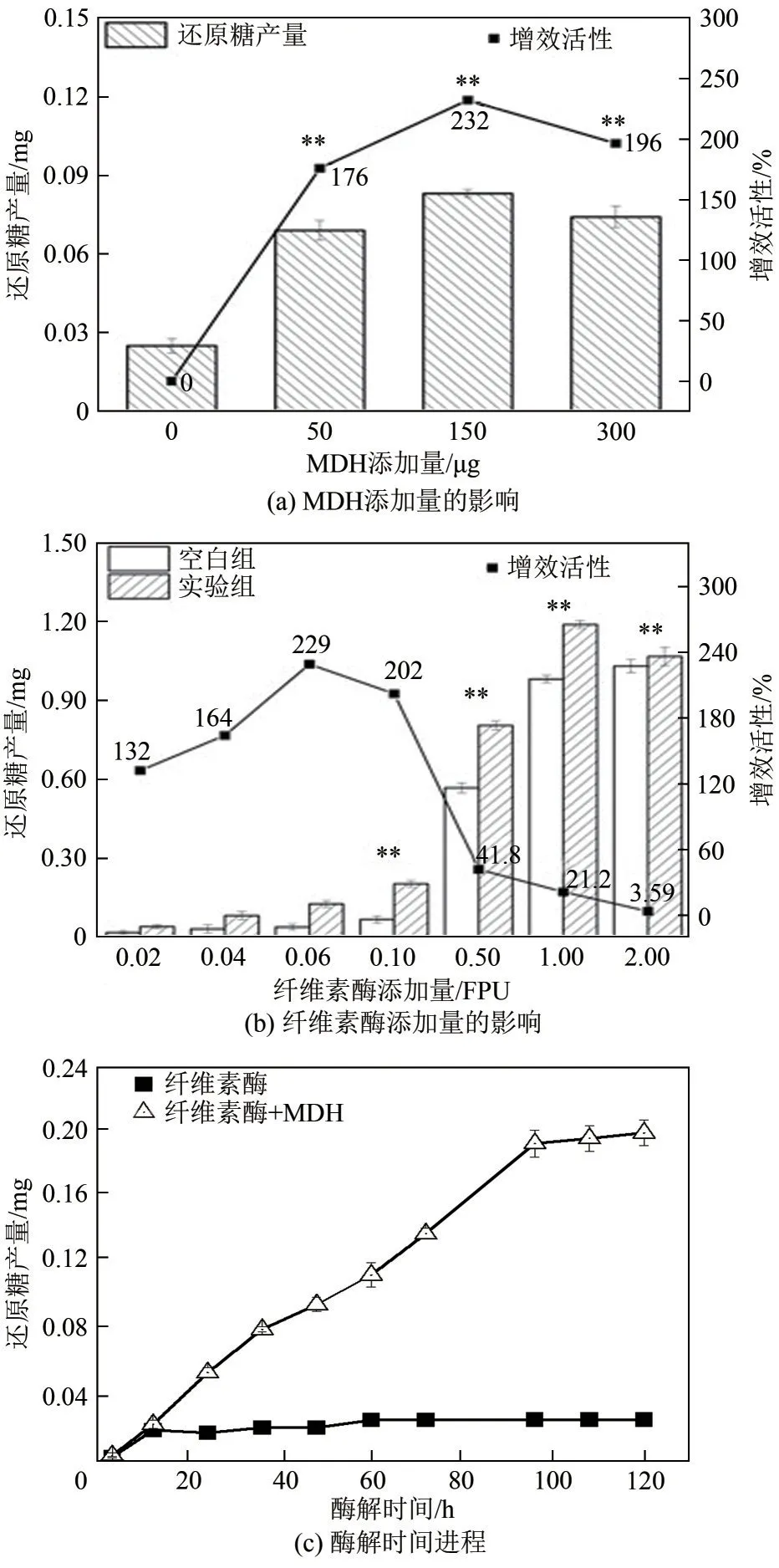
图3 MDH与纤维素酶协同作用的影响因素
2.3 MDH对纤维素酶活的影响分析
目前普遍认为纤维素的超分子结构是由结晶区和无定形区交错结合形成,结晶区域的纤维素分子链通过分子内与分子间的氢键网络有序排列,无定形区域则由分子链的无序排列构成[32]。纤维素酶对纤维素的水解包括内切葡聚糖酶(endo-1,4-β-Dglucanase,EG)、外切葡聚糖酶(exo-1,4-β-Dglucannase,CBH) 和β-葡萄糖苷酶(β-1,4-glucosidase,BG)等酶的综合协同作用。EG 主要作用于纤维素的无定形区域,将纤维素长链降解为小分子纤维素或寡糖链,CBH与EG协同作用于纤维素的结晶区域,将纤维素链剥离并水解β-1,4-糖苷键释放纤维二糖,BG 主要将EG 和CBH 作用产生的寡糖链和纤维二糖水解为葡萄糖[33]。为了考察MDH 是否提高了纤维素酶系中某种或多种关键酶的活性[34],分别测定了纤维素酶对羧甲基纤维素、结晶纤维素以及纤维二糖不同底物的水解情况。图4 显示MDH 能协同纤维素酶水解结晶纤维素和纤维二糖,使得纤维素酶的增效活性分别达到23.1%和26.2%,但是对纤维素酶水解羧甲基纤维素无明显增效,说明MDH 对纤维素的无定形区域不起作用。纤维素之所以难以水解,主要在于其结晶区域广泛的氢键网络具有高度抗化学和生物降解性[32]。相对结晶区域而言,无定形区域分子间的作用力较弱,氢键含量较少,在水解过程中更容易受到酶的攻击而使糖苷键断键[35-36],因此解决纤维素结晶区域的刚性问题是研究纤维素水解的一个重要关注点。目前文献报道的Zea h[37]、TlEXLX1[25]和CxEXL22[26]等纤维素降解辅助蛋白都是通过作用于纤维素的结晶区域,协同提高了纤维素酶的酶活。在本研究中,MDH 对纤维素的作用同样发生在结晶区域,结合前述分子对接的结果可知,MDH 对纤维素氢键网络结构的破坏有利于促进纤维素酶与纤维素的接触,使得CBH 和BG 的水解更易进行,意味着MDH 协同提高了纤维素酶系中CBH 和BG的酶活。
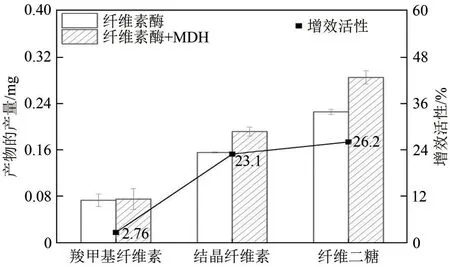
图4 MDH分别与EG、CBH、BG的协同作用
2.4 MDH作用滤纸的表征分析
基于上述实验结果与分析,对MDH作用后的滤纸分别进行SEM、XRD和FTIR表征。SEM表征结果如图5所示,与未处理滤纸的形貌相比[图5(a)中空白样品],添加纤维素酶[图5(b)]或者MDH[图5(c)]作用后的滤纸表面出现更多微小、细长的纤维结构,说明滤纸的结晶区域发生改变,滤纸结构由致密变得松散。Li等[26]分析扩展蛋白CxEXL22对纤维素酶的协同作用认为,CxEXL22 通过β-片层的疏水表面与纤维素分子链结合,破坏纤维素链中分子间和分子内的氢键,从而显著减少微原纤维的团聚,促进纤维素结晶结构的解聚。在本研究中,添加MDH 的样品中[图5(c)]发现滤纸纤维素的结构发生了断裂(圆圈处),基于上述分子对接与水解实验的数据结果,可以认为这些断裂主要缘于MDH 对纤维素的氢键网络产生了破坏。与图5(b)纤维素酶单独作用相比,图5(d)的样品显示滤纸结构变得更容易断裂(圆圈处),反映了MDH协同促进了纤维素酶对纤维素的水解。
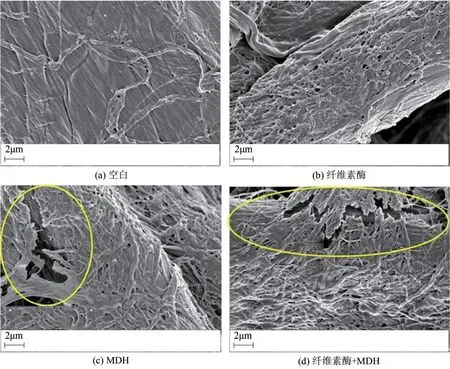
图5 不同处理后的滤纸SEM图
XRD的表征结果如图6所示,与未处理滤纸相比,MDH 处理的滤纸衍射峰强度显著降低。通过计算结晶度指数可知,MDH 处理的滤纸结晶度指数为81.64%,比未处理(85.86%)时降低了4.22%,该结果与文献报道的纤维素降解辅助蛋白CxEXL22[26](结晶度指数降低8.50%)、POEP1[28](结晶度指数降低6.70%)的作用结果类似,说明MDH能破坏滤纸的结晶区域,降低滤纸的结晶度。
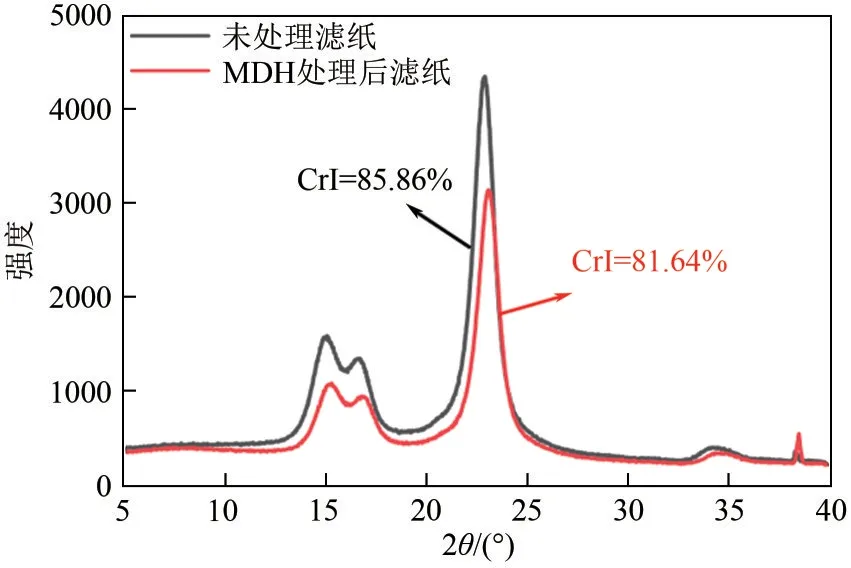
图6 不同处理后的滤纸XRD图
FTIR的分析结果如图7所示,不同处理的滤纸红外光谱具有一致的吸收曲线,没有新的吸收峰出现,说明没有新键的生成。与未处理滤纸相比,纤维素酶和MDH单独作用的样品在3300cm-1处的O—H伸缩振动有所增强,说明经过MDH 处理后的滤纸分子内和分子间的氢键发生断裂[22]。在1030cm-1处的吸收峰强度同样也增强,说明分子内的C—OH发生了骨架拉伸,表明经MDH 处理后的滤纸在水解过程中有水分子进入结晶区域,使得纤维素暴露更多氢键,促进纤维素结晶部分的断裂[36]。XRD和FTIR 的实验结果与前述分子对接的理论分析相吻合,MDH 通过氢键和疏水作用降低了纤维素的凝聚,使得纤维素链间的氢键断裂,有效降低了纤维素结晶结构的刚性,协同促进了纤维素酶的水解,这与扩展蛋白CxEXL22的作用方式相似[26]。
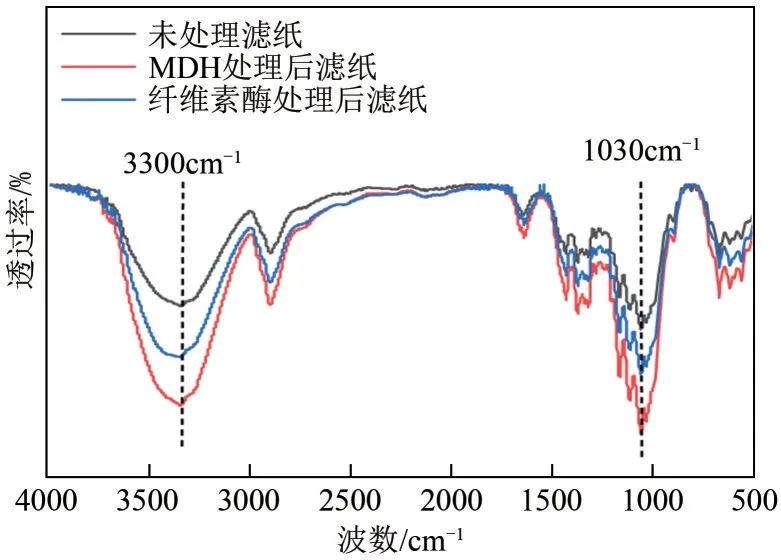
图7 不同处理后的滤纸FTIR图
3 结论
(1)利用分子对接模拟了MDH 和结晶纤维素之间的相互作用,发现MDH 可能通过氢键和疏水的作用来降低纤维素的凝聚,从而提高纤维素酶的可及性。
(2)对MDH 的协同作用进行了实验研究,MDH本身对纤维素没有水解作用,当向(50±0.50)mg滤纸体系添加0.06FPU纤维素酶、150μg MDH反应24h后,MDH的增效活性为247%±28%。通过比较纤维素酶对不同底物的水解结果,发现MDH 能协同提高纤维素酶系中外切葡聚糖酶和β-葡萄糖苷酶的酶活。
(3)利用SEM、XRD 和FTIR 进一步进行表征分析,结果表明,MDH 主要通过破坏纤维素链间的氢键网络而促进纤维素解聚,MDH 处理后的结晶度指数降低了4.22%。
(4)MDH 与其他纤维素降解辅助蛋白的功能相似,其本身不能水解纤维素,但是通过破坏纤维素的结晶区域、降低纤维素的结晶度来提高纤维素酶的可及性,协同纤维素酶水解,显著提高了纤维素酶的活力。

