关于“氮一化学”的思考与展望
于锋
(1 石河子大学化学化工学院,新疆 石河子 832003;2 新疆兵团绿色化工过程重点实验室,新疆 石河子832003)
在20 世纪70 年代,以CO、CH4等含一个碳原子的化合物为原料来合成一系列燃料和化工原料的“碳一化学”[图1(a)]引发了化学研究的热潮。随着“碳中和”目标的迫切要求,“碳一化学”的内涵也在不断更迭,包含了CO2的捕集、转化与利用等研究内容。值得一提的是,氮元素是化学元素周期表中的第7号元素,是一种非金属元素,在自然界中通常以氮气(N2)形式存在,约占大气的78%。氮元素也是化工产品的主要组成元素,近年来含有氮元素的化工产品需求量日益增加,关于含有氮元素的单质或含有一个N原子的化合物等相关的研究备受关注,特别是氮气、氨气(NH3)、一氧化氮(NO)、羟胺(NH2OH)、硝酸(HNO3)和氨基酸等。然而,迄今并未发现有“N1 Chemistry(氮一化学)”概念的提出。类似于“碳一化学”,“氮一化学”的研究对象是含有氮元素的单质或化合物[图1(b)],其研究重点在于研究这些物质之间的相互转化和制备其他化工产品,特别是在合成氨、制氢、脱硝等方面,对于促进新能源开发、控制环境污染以及实现碳中和具有重要意义。
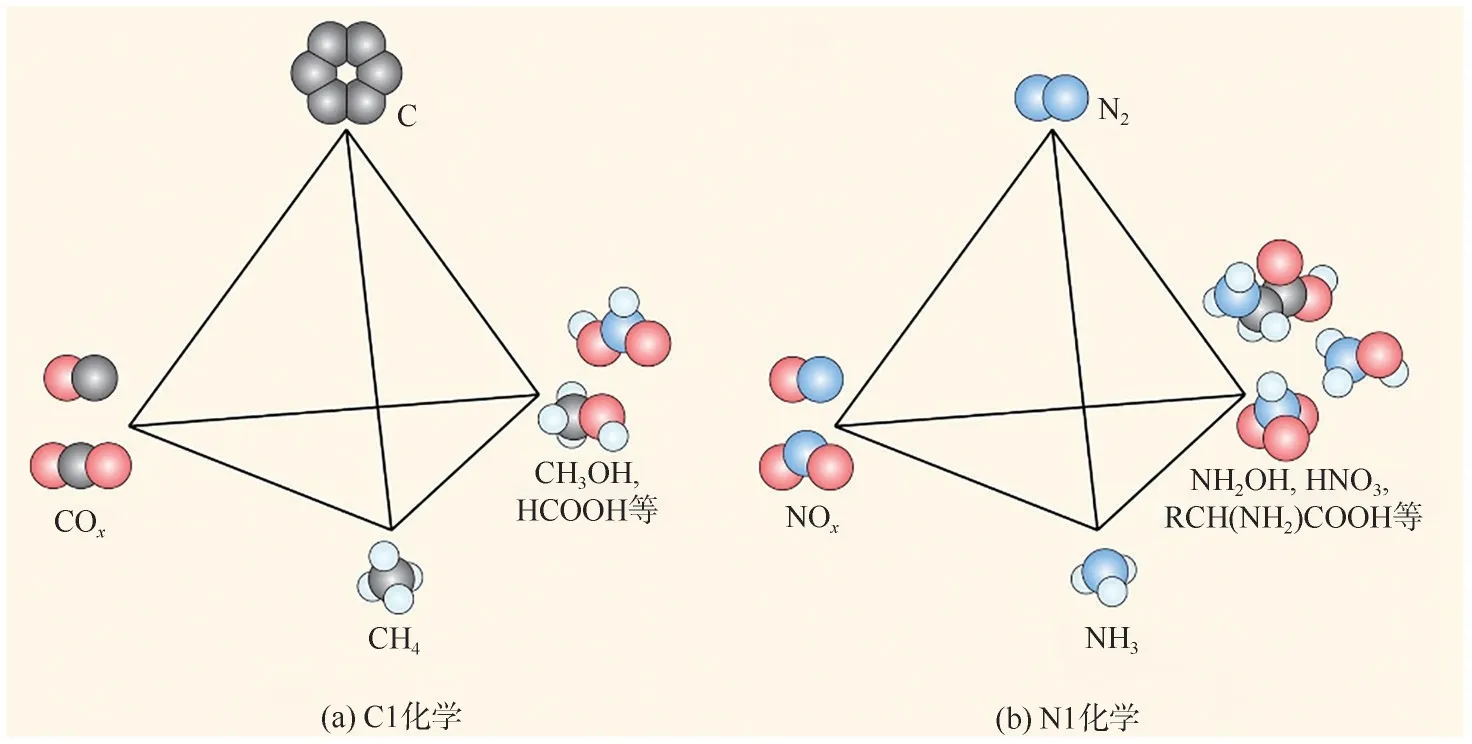
图1 碳一化学与氮一化学
1 “氮一化学”的几个典型案例
1.1 不助燃且性质稳定的氮气
氮气是大气中最为丰富的物质,每年人们都会从空气中提取上千万吨氮气应用于医疗、精密仪器和工业生产等领域。在1772 年,苏格兰化学家Rutherford[1]在他的博士论文《固定空气与浊气导论》中第一次描述了氮气的性质,认为氮气是一种“不能维持动物的生命也不支持燃烧,而且也不能被石灰水或其他碱液吸收”的气体。1774 年,法国化学家Lavoisier 正式将氮气命名为“Nitrogen”,并一直使用至今。我国清代科学家徐寿在翻译时将其译成了“淡气”,意思是冲淡了空气中的氧气,后来经不断规范,形成了“氮气”一词。
通常,工业中利用液氮和液氧沸点的差异,使用分馏液态空气的方法从空气中提取氮气。目前,分子筛空气分离法和薄膜空气分离法等新方法也被用来制取氮气。分子筛空气分离法以压缩空气为原料,利用碳分子筛等吸附剂对氧气和氮气具有不同吸附能力的性质,在吸附相中富集氧,在气相中富集氮,实现氮气的制备。薄膜空气分离法则是利用气体组分在气体分离膜中的选择性渗透和扩散特性不同进行分离。首先,空气以不同的溶解度溶解在膜的高压侧表面中,然后气体分子以不同的速度扩散到膜的低压侧,空气和氧气的渗透性比氮气的渗透性快。膜分离后,留在高压侧的气体富含氮气,而通过的气体富含氧气。
1.2 组成生命基石的氨基酸
氮循环是地球上维持生命最重要的循环之一,氮元素和其他元素一样在生物圈中处于不断循环中。其中,含氮化合物氨基酸是构成蛋白质的基本单元,是由1 个氨基、1 个羧基和1 个侧链结构组成的物质。甘氨酸是最简单的氨基酸,也是重要的生命组成部分,英国天体化学家Ioppolo等[2]在2021年发现早在宇宙天体诞生之前就已经出现了甘氨酸。迄今,人类已经发现20 种左右的氨基酸。首次实现氨基酸工业化生产的是在20 世纪40 年代初,日本味之素公司的池田菊苗(KikunaeIkeda)进行了工业化生产谷氨酸。在20 世纪60 年代,随着工业微生物发酵法的推广,已经可以生产许多种常用氨基酸品种,如谷氨酸、赖氨酸、苏氨酸、苯丙氨酸等。在氨基酸的合成方面,美国学者Miller[3]在1953年进行了著名的“米勒实验”,模拟原始大气条件(如雷鸣闪电)的实验,由无机物混合物(CH4、H2O、H2和少量NH3)得到了20 种有机化合物,其中11种氨基酸中有4种(甘氨酸、丙氨酸、天门冬氨酸和谷氨酸)是生物的蛋白质所含有的,推进了人们对生命起源的认识。
1.3 促进粮食丰产的合成氨
氨(NH3)是重要的化工产品之一,世界每年合成氨的需求量约2.0 亿吨,是氮肥、储氢、化工产品的重要原料。1905年,德国科学家Haber首次提 出 了 使 用N2合 成NH3[4]。1909 年,德 国 工 程 师Bosch采用Fe3O4作为催化剂在实验室中成功实现了氨的合成,并于1913 年在德国建立了世界第一座合成氨厂。后来,Haber 因为其从氮气合成氨的研究获得了1918年诺贝尔化学奖,Bosch则因为其改进了合成氨的方法获得了1931年的诺贝尔化学奖。目前,采用哈伯-博施法(Haber-Bosch process)合成氨依然是唯一具有工业规模的固定氮的方法,它改变了世界粮食生产的历史,该方法被称为20 世纪人类最伟大的发明之一。后来,德国化学家Ertl 在2007年因为其揭示了哈伯-博施法合成氨的作用机理获得了诺贝尔化学奖。
1.4 诱发大气污染的氮氧化物
氮氧化物(NOx)是大气污染的主要来源之一,全球NOx的排放量可达5000 万吨/年,其中95%以上来自化石燃料的燃烧过程,例如,火力发电厂排出的烟气中含NOx达1200μL/L,汽车排气中为4000μL/L。据统计,每年有约700万人的死亡是由直接或间接空气污染造成的。其中,选择性催化还原法(SCR)[5]脱硝技术是目前应用最为广泛的减少NOx排放的一项技术,主要是通过在烟气中添加或利用还原剂来催化还原NOx,使其转化为N2。该项技术最早在1959 年由美国Eegelhard 公司率先申请了发明专利,1978 年日本实现了SCR 技术的工业化。SCR 技术因其具有高效的NOx去除效率,已经广泛用于大型燃煤电厂等固定源和柴油汽车等移动源,对于减少NOx的排放具有重要的环保意义。
2 “氮一化学”的几个重要进展
2.1 合成氨
目前,合成氨主要采用哈伯-博施法[图2(a)],在Fe 基催化剂作用下由N2和H2发生催化加氢反应合成NH3。然而,该方法在高温高压下完成,每年导致3亿吨碳排放,消耗的能源高达全世界能源总消耗的2%左右,迫切需要研发低能耗的合成氨新方法。于锋等[6-7]通过研究发现使用NO作为氮源比N2作为氮源的更容易被氢还原,当采用FeCu/TiO2作为催化剂用于NO 加氢催化合成NH3时[图2(b)],在350℃和常压下NH3选择性可达97.7%。该方法采用NO 加氢催化合成NH3的反应路径,可以称之为NO 氨气化(NO ammoniation),与CO 加氢催化制备CH4的反应路径,也就是与CO 甲烷化(CO methanation)“异曲同工”。与传统的哈伯-博施法相比,这种NO氨气化的方法具有更低的能耗和更高的选择性。虽然以NO为原料的合成氨具有更低的能耗和潜在的应用前景,但是发展N2氧化制备NO技术依然存在较大的挑战。
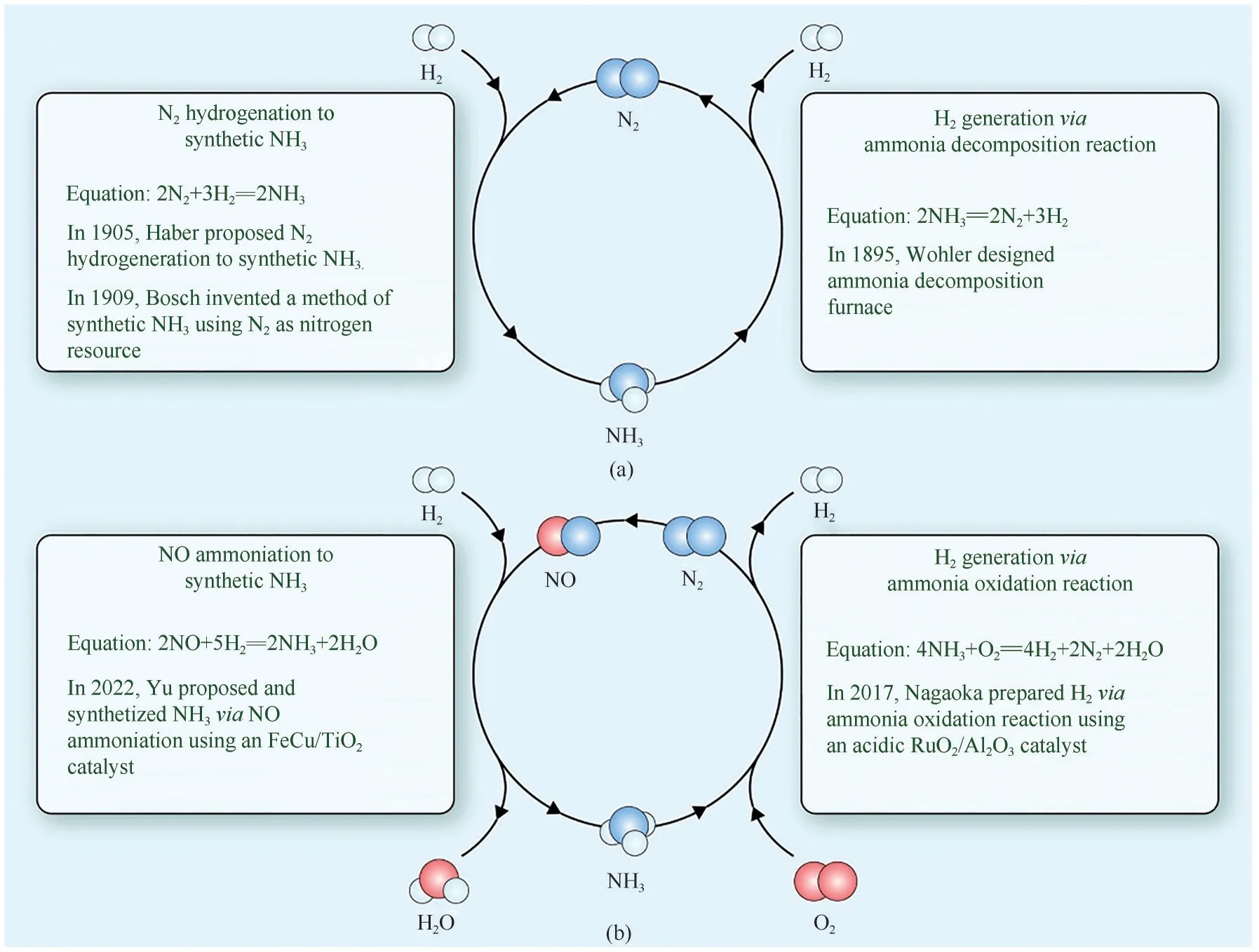
图2 以N2氮源合成氨与氨裂解制氢(a)及以NO为氮源合成氨与氨氧化制氢(b)
2.2 氨制氢
NH3是一种很有潜力的氢气载体,而且在低压(8.6bar,1bar=105Pa)和低温度(20℃)下易于液化,可以轻松克服H2储存和运输过程中的不足。采用Ru 基催化剂用于热催化氨分解反应(即氨裂解,ADR)[8]已经成为获得清洁H2的有效方法,ADR 制氢已在清洁能源中占有一席之地。但是该反应需要在高温下进行,需要大量的热量。此外,由于Ru 金属的稀缺性和高成本,阻碍了其商业规模的应用,迫切需要从高丰度的金属中探索廉价、高活性和耐用的催化剂用于ADR。日本科学家Nagaoka等[9]发现在预处理的RuO2/γ-Al2O3催化剂上可以实现常温氨氧化制氢,该反应是放热反应,可以生成大量的热量,避免了能量的消耗。
2.3 SCR脱硝
目前,固定源SCR脱硝技术常用的还原剂是液氨,依然面临着液氨的储存、氨逃逸等现象(图3)。采用CO、合成气(Syngas)等作为还原剂,利用CO-SCR 和Syngas-SCR 技术可以有效避免液氨的使用。煤制合成气的技术较为成熟,可以有效降低SCR脱硝成本。但是,面临的挑战是氧中毒现象比较严重,迫切需要开发抗氧中毒的高活性CO-SCR和Syngas-SCR 催化剂。此外,采用绿氢作为还原剂,利用H2-SCR 进行脱硝生成N2和H2O,整个过程绿色无污染。该H2-SCR 脱硝技术有望提供一条新的脱硝路径,需要注意的是要避免NH3的生成。
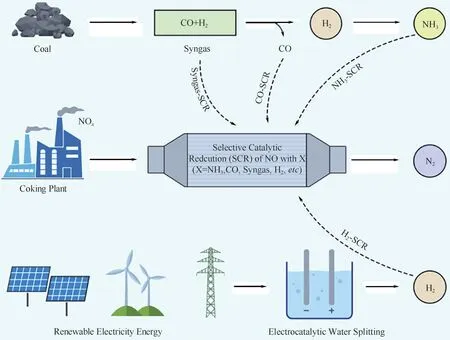
图3 NH3-SCR、CO-SCR、Syngas-SCR和H2-SCR等脱硝方式
3 “氮一化学”的机遇与挑战
随着全球对可持续发展和碳中和的需求不断增加,“氮一化学”(N1 化学)在能源、材料科学、环境保护等领域具有广阔的应用前景,也面临着诸多挑战。首先,在绿色催化技术方面。合成氨、氨制氢等技术比较成熟,但面临的主要问题是能耗等多方面的挑战,迫切需要开发在低温低压下具有优异催化活性和选择性的催化剂。其次,在化工过程耦合技术方面。例如,可以将脱硝与合成氨技术进行耦合,采用H2作为还原剂,将烟气中的NO转化为NH3,不仅可以避免NH3-SCR 过程中去除NO 中NH3的消耗,还可以有效地合成NH3,可谓是一举多得。但是需要攻克的是烟气中NO的捕集、分离与储存等技术。第三,在交叉学科方面。可以将光、电、等离子体、生物工程等引入到“N1化学”催化过程中。例如,随着等离子技术的发展,N2可以通过等离子体催化氧化为NO,可为NO 氨气化合成氨提供一条途径。此外,“N1化学”的发展还需要更加注重基础研究的开展和跨学科合作的深化,相信“N1 化学”将为人类社会的可持续发展做出更大贡献。

