纤维素水热炭化液相与玉米秸秆混合发酵有机物转化与产气特性
王浩,邸璐,王芳,张德俐,易维明,李永军,沈秀丽
(1 山东理工大学农业工程与食品科学学院,山东 淄博 255000;2 山东省清洁能源工程技术研究中心,山东淄博 255000;3 农业农村部规划设计研究院,农业农村部农业废弃物能源化利用重点实验室,北京 100125)
生物质作为零碳资源的一种,其无害化利用对于节能减排和农业循环发展具有重要的意义。然而,目前许多生物质仍存在被丢弃或直接焚烧等现象[1],既导致环境污染,又造成资源浪费,因此对生物质资源的有效利用逐渐成为人们关注的焦点。
生物质可以通过物理、热化学、生物转化等方式转化为固态、液态和气态等燃料。水热炭化技术是近年来逐渐兴起的一种生物质热化学转化方式,生物质在180~280℃的温度范围内经历一系列水解、脱水、脱羧和缩聚等化学反应[2],最终形成水热炭。水热炭化技术比较适合含水量较高的生物质[3],凭借其相对丰富的含氧官能团与良好的脱氧脱灰性能等特点,在吸附材料、储能材料、催化剂等领域具有极高的潜在应用价值[4]。然而,由于水的存在,生物质中的部分有机物会溶解到水热炭化液相中,形成小分子酸、还原糖、呋喃类和酚类化合物等可溶物质[5],通常这部分水相的化学需氧量(chemical oxygen demand,COD)和总有机碳(total organic carbon,TOC)的含量为10~40g/L和5~20g/L[6],直接将水热废液排放会对环境造成严重的影响,因此水热废液的无害化处理已经成为水热炭化技术发展中必须要解决的瓶颈问题。
厌氧发酵是一种处理废水的常用技术,已有研究证明利用厌氧发酵技术可实现水热炭化液相中有机组分的甲烷化转化,实现能量的二次回收。Aragón-Briceño 等[7]对污泥进行水热炭化处理,其中水热液相发酵的甲烷产量达到了总能量的58%。Erdogan 等[8]以橙渣为原料获得的水相产物甲烷总产气量在195~213mL/g COD,在经济上可行。Posmanik 等[9]通过对竹渣炭化水热液相和鱼加工处理废物混合发酵的研究得知,厌氧发酵技术处理水热炭化液相,有机物的去除率为58%~90%,甲烷累积产气量在136~286mL/g COD。将厌氧发酵与水热炭化技术结合,可实现生物质中有机质逐级利用,固体与气体燃料联产,具有较高的商业价值。
但是,水热炭化液相产物在单独进行厌氧消化时也存在着一些问题。由于其中含有较多的酸,可能会在厌氧消化早期出现酸抑制现象[10]。并且生物质中的纤维素、半纤维素和木质素在水热过程中会生成糠醛、羟甲基糠醛、乙酰丙酸和酚类化合物等有机物,对后续厌氧发酵具有不同程度的抑制作用[11]。近年来,随着厌氧发酵技术的发展和原料的多样化,多基质厌氧发酵得到了广泛的研究与应用。混合发酵可以稀释有毒化合物,保持营养平衡,不同原料之间的协同作用可以提高厌氧发酵系统的沼气生产效率[12]。将水热炭化液相和秸秆类原料进行混合发酵,一方面可以补充水热炭化液相中有机质含量,稀释水相中的呋喃类及酚类等抑制物,平衡水相产物的酸度,提高发酵系统稳定性;另一方面可以促进秸秆类原料水解,加速产气速率。
纤维素是木质纤维素类生物质中的重要成分之一,其在水热炭化过程中会发生水解产生糖类、酸类和呋喃衍生物等物质,是生物质水解的主要产物[13]。其中糖和酸是厌氧发酵过程中重要的代谢产物;而呋喃衍生物对产甲烷微生物代谢过程具有一定的抑制作用。因此,本研究针对纤维素水热炭化水解液与玉米秸秆混合发酵开展研究,通过分析纤维素水热炭化液相与秸秆混合发酵过程中有机物的转化和微生物菌群结构,探究二者厌氧发酵过程中相互作用及水热炭化液相产物降解机制,本研究可为水热液相和秸秆混合厌氧发酵工艺优化提供理论基础。
1 材料和方法
1.1 实验材料
用于水热炭化实验的纤维素为微晶纤维素,阿拉丁公司,其粒径为250μm。用于混合厌氧发酵的玉米秸秆,山东省淄博市,将玉米秸秆自然干燥,并粉碎至1~2cm。厌氧消化所用接种物沼渣,山东省潍坊市沼气工程,使用前将其在37℃的恒温条件下富集培养7 天,其中富集培养基包括CHNaO25g、NaAc 5g、甲醇5mL、半胱氨酸0.5g、酵母膏1g、NH4Cl 1g、KH2PO40.4g、K2HPO40.4g、水1000mL。玉米秸秆与接种物特性如表1所示。
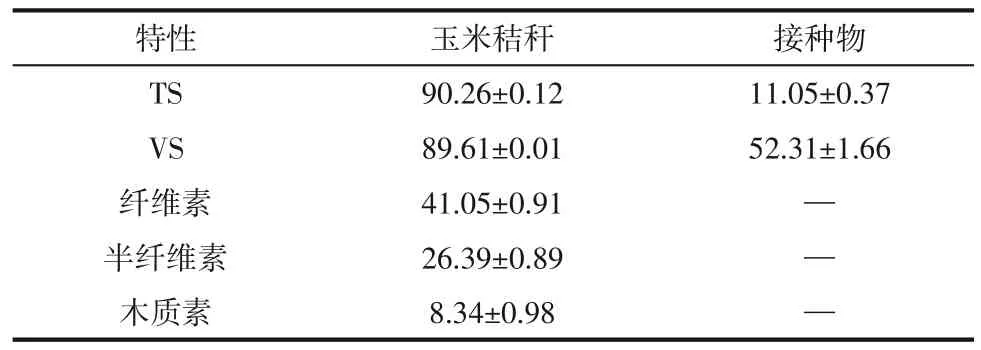
表1 秸秆与接种物特性(质量分数,%)
1.2 水热炭化实验
水热炭化实验在高压反应釜(WZEM250)中进行。将纤维素和水以质量比1∶20混合后置于反应器中,反应器温度分别设置为200℃和230℃,并在设定的温度下保持30min、60min 和120min。当反应终止时,冷却至室温,通过真空过滤器将其固液分离,然后将液相产物储存于细口瓶中密封备用。
1.3 发酵实验
混合厌氧实验发酵利用全自动甲烷测试系统(AMPTS II)进行,反应器容积为500mL。实际发酵所用容积为400mL,发酵系统的有机负荷率为65g/L VS;将水热炭化液相与玉米秸秆按质量比3∶1添加于消化器中,所加接种物占发酵系统VS 总含量的30%,发酵系统TS 总含量通过蒸馏水调节至10%。将在200℃的条件下、保温时间为30min、60min和120min的纤维素水热废液的混合发酵组分别命名为H1、H2 和H3;将在230℃的条件下、保温时间为60min的纤维素水热液相的混合发酵组命名为H4。此外,为进行对比分析,设置了玉米秸秆单发酵实验,命名为CS。在实验期间每隔1h 开启一次搅拌,搅拌转速为200r/min,搅拌时间持续60s。混合发酵在37℃水浴环境中持续60天,设置三组平行实验,分析结果取其平均值。
1.4 分析方法
TS 和VS 含量分别采用恒温干燥箱110℃烘干法和马弗炉550℃灼烧法测定;pH 测定使用数字pH 计(FE28,梅特勒-托莱多);水热炭化液相产物的TOC 由总有机炭分析仪(vario TOC select)测量;发酵液的总氨氮浓度(total nitrogen ammonia concentration,TAN)由全自动凯氏氮分析仪(K9860 Hanon)测定;COD 使用多功能水质分析仪(LY-4DA)根据重铬酸钾氧化法测定;水热液相产物和发酵液里的呋喃及其衍生物使用气相色谱-质谱联用仪(GC-MS)(GC6890/MS5973N,安捷伦)测定;挥发性脂肪酸(volatile fatty acid concentration, VFA)使用高效液相色谱仪(1260,安捷伦)定量测量。
1.5 微生物群落
通过Miseq平台测序分析第25天厌氧发酵液中细菌和古菌群落的分布。使用E.Z.N.A™Mag-Bind Soil DNA Kit 提取试剂盒从厌氧消化浆液样本中提取基因组DNA,利用Qubit3.0 DNA 检测试剂盒对基因组DNA 精确定量,以确定PCR 反应应加DNA量。对细菌和古菌进行PCR 扩增,细菌的PCR 扩增需要两轮,第一轮PCR 扩增所用的引物已经融合了测序平台的16SV3-V4引物,第二轮扩增引入Illumina 桥式PCR 兼容引物。古菌引用巢式PCR 扩增有三轮:第一轮使用GU1ST-340F、GU1ST-1000R引物扩增;第二轮使用第一轮PCR产物进行扩增,PCR 所用的引物已经融合了测序平台的V3-V4 通用引物;第三轮扩增引入Illumina桥式PCR兼容引物。PCR 扩增完成后,将得到的样品利用Illumina MiSeq平台进行测序并利用数据库进行匹配分析。
2 结果与讨论
2.1 水热炭化水相产物
如表2 所示,在200℃的条件下,随着保温时间的延长,水热液相的pH 从4.00 波动到3.68,TOC的含量从877.66mg/L上升到963.04mg/L,表明在水热过程中随着停留时间的增加,水相中总有机碳含量增加,同时酸性物质含量增加。将温度升高到230℃时,水热液相的pH降低到2.84,TOC含量上升到1994.52mg/L,表明水热温度升高加速了纤维素的解聚,使更多有机物进入到了液相之中。
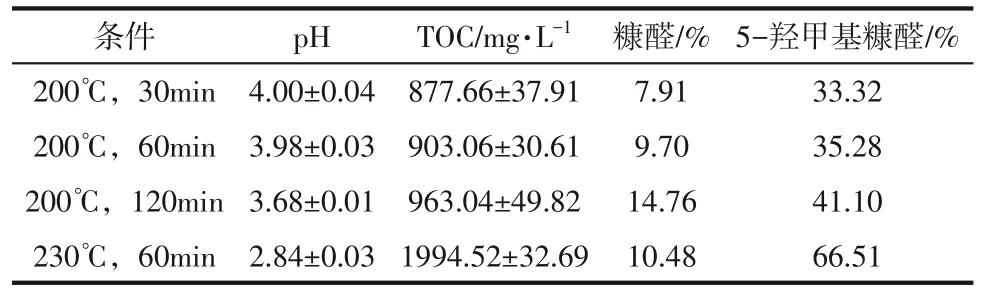
表2 纤维素水热炭化液相的特性
从表2中可以看出,随着保温时间延长,糠醛和5-羟甲基糠醛的总含量从41.23% 上升到55.86%,当温度从200℃升高到230℃,糠醛和5-羟甲基糠醛的总含量从44.98%上升到76.99%。糠醛和5-羟甲基糠醛是常见的呋喃醛,来源于戊糖和己糖在木质纤维素生物质的预处理和水解过程中脱水[14]。研究表明水热炭化液相的呋喃及其衍生物会抑制水解细菌及产甲烷细菌的生长,不利于厌氧发酵过程的进行[12]。
2.2 混合发酵产气过程
图1是水热炭化液相产物与玉米秸秆混合发酵的累计甲烷产量和日产甲烷量。由图1(a)可知,水热炭化液相与玉米秸秆混合发酵、单发酵相比,累计产气量有了明显的提升,在200℃保温30min、60min、120min的条件下产气量分别提升了7.32%、4.42%、22.08%,在230℃保温60min的条件下提升了21.76%。厌氧消化前5天,水热炭化液相和玉米秸秆混合发酵实验组的甲烷累积产气量明显高于秸秆单发酵的实验组,这表明纤维素水热炭化液相的加入提高了混合基质启动阶段的产甲烷速率[15],200℃条件下的水热炭化液相与秸秆混合发酵实验组的启动速率早于230℃水热炭化液相与秸秆混合发酵实验组,表明较高浓度的呋喃及其衍生物在发酵初期对产气产生了不利影响。厌氧发酵的第5~10天,5个实验组甲烷的产气量都较低,此阶段处于厌氧发酵的水解产酸阶段,发酵系统的环境不利于产甲烷菌的生长是产气较低的主要原因[16-17]。在厌氧消化的第10~30天,甲烷产量快速积累,其中H4 组在此阶段累积产气量最高,达到了总产气量的69.76%,CS 单发酵实验组在此阶段的甲烷累积产气量占总产气的46.05%,H1、H2、H3混合发酵实验组的甲烷产气量在此阶段超过了秸秆单发酵的实验组CS 实验组,它们在此阶段的甲烷产气量分别达到了总产气量的53.45%、54.59%、51.75%;而在厌氧消化的第15~20 天,H1、H2、H3 的甲烷产气量低于CS,表明200℃的条件下水热液在厌氧发酵前期对厌氧发酵产生了不利的影响,可能的原因是该条件下水热液中的抑制物在前期抑制了产甲烷菌的活性,但这种抑制很轻微,在第20 天左右200℃条件下的混合发酵实验组甲烷累积产气量超越了秸秆单发酵实验组,也证明了抑制不会一直存在;水热液相的加入明显加速了厌氧发酵过程的进行,使甲烷在厌氧发酵的中期获得更高的累积量。在厌氧发酵的第30~60天,CS实验组在第30~35天甲烷产量依旧有明显的上升趋势,混合发酵实验组在第30天以后产气量逐渐降低,其中H4实验组的甲烷累积量仅为总产气量的9.89%,表明水热炭化液相添加可有效缩短玉米秸秆发酵时间。最终秸秆单发酵实验组的甲烷累积产量为1136mL,混合发酵实验组H1、H2、H3、和H4 的甲烷累积产量分别达到了1218mL、1186mL、1387mL和1383mL。
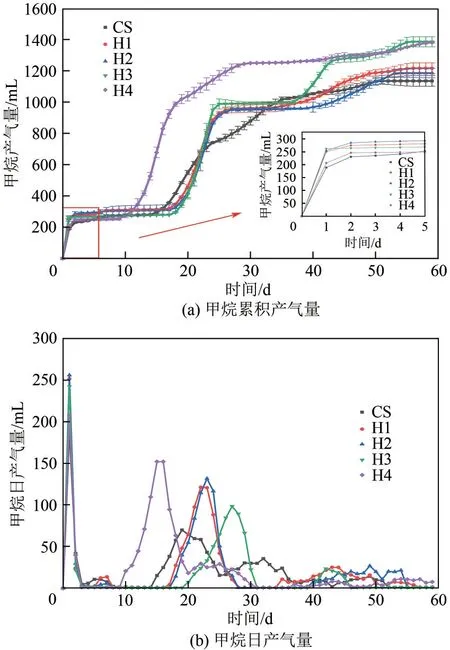
图1 甲烷产气量
由图1(b)可知,在厌氧发酵的前10天,甲烷的产气速率总体较低;在发酵第10~30 天,H4 实验组首先进入发酵过程的产气高峰且峰值最高。CS组产气高峰开始时间略早于H1、H2、H3实验组但峰值比其他实验组低,其中H4 首先进入产气高峰的原因可能为水热液相中较高的酸性物质含量促进了厌氧发酵过程中产甲烷阶段的进行。混合发酵与秸秆单发酵实验组相比,产气高峰的结束时间明显早于秸秆单发酵实验组,峰值也明显高于秸秆单发酵实验组。在厌氧发酵的第30~60天,混合发酵实验组的产气高峰已经基本结束,而秸秆单发酵实验组CS的产气高峰一直持续到第35天左右,比混合发酵实验组延长了至少5 天。H4 实验组在此阶段产气速率较低,而H1、H2、H3在此阶段依旧有小的产气高峰,H3 实验组在此阶段的产气高峰明显高于其他实验组。
由最终累计甲烷产量和日产甲烷量可知,纤维素水热炭化液相中抑制物对厌氧发酵产气的负面作用并不明显,在厌氧发酵过程中,糠醛和5-甲基糠醛二者同时存在时糠醛会被优先转化[18],5-甲基糠醛含量最高的H4 实验组的产气总量最高且产气高峰到来得最早,表明厌氧消化过程可以在早期就将发酵系统中的呋喃及其衍生物分解,解除其抑制作用并转化为甲烷。混合发酵与秸秆单发酵相比,产气效果有了明显的提升,且其甲烷产气高峰结束时间提前秸秆单发酵实验组至少5天。
2.3 混合发酵过程中发酵液
2.3.1 发酵液有机物
表3显示了第10天不同的水热炭化液相和玉米秸秆混合发酵液中主要有机成分的半定量分析。在H1、H2、H3实验组发酵液中,并没有发现呋喃类化合物,在230℃的条件下水热炭化液相与秸秆混合发酵实验组提取的发酵液中发现了3.01%呋喃衍生物1-(呋喃基)乙二醇,表明呋喃类化合物可以在厌氧消化过程中被转化为其他有机物,进而被降解。结合产气过程发现,该反应过程在厌氧发酵的前期和中期完成,呋喃类化合物对混合发酵产甲烷过程抑制并不明显。有研究显示,较高的呋喃及其衍生物浓度对发酵产生负面影响时,可能导致厌氧消化速率降低,发酵时间延长,甲烷收率降低;然而,当呋喃及其衍生物浓度较低时,厌氧发酵系统中微生物可以将其作为碳源进行转化和利用,进而促进甲烷的产生[19]。从甲烷总产气量及产气速率可知,在发酵过程中,水热炭化液相中的呋喃及其衍生物可以作为碳源被分解转化为甲烷,纤维素水热炭化产生的抑制物浓度对厌氧发酵的抑制效果并不明显,进一步表明混合厌氧发酵稀释了抑制物对厌氧发酵的影响。
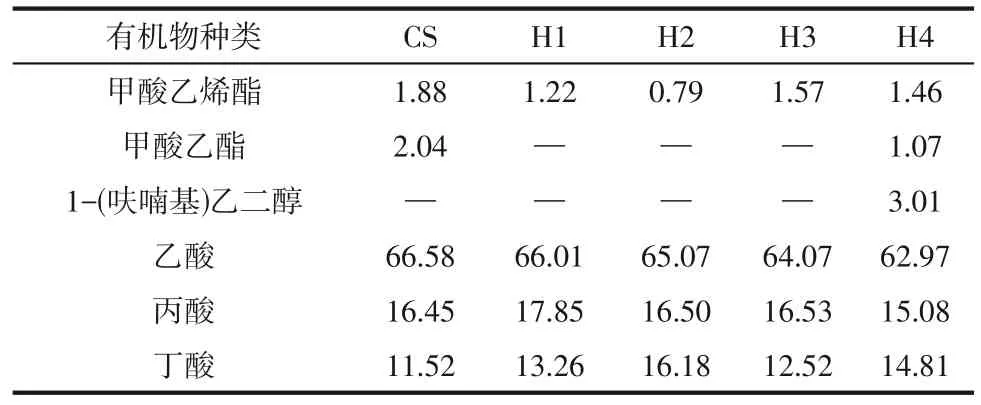
表3 第10天厌氧发酵提取液的特性(相对峰面积,%)
VFA 是厌氧发酵过程中产生的主要有机物,为探究不同条件下水热炭化液相和玉米秸秆混合发酵过程中物质变化,对发酵过程中乙酸、丙酸、丁酸三种VFA进行了进一步定量分析,如图2所示。
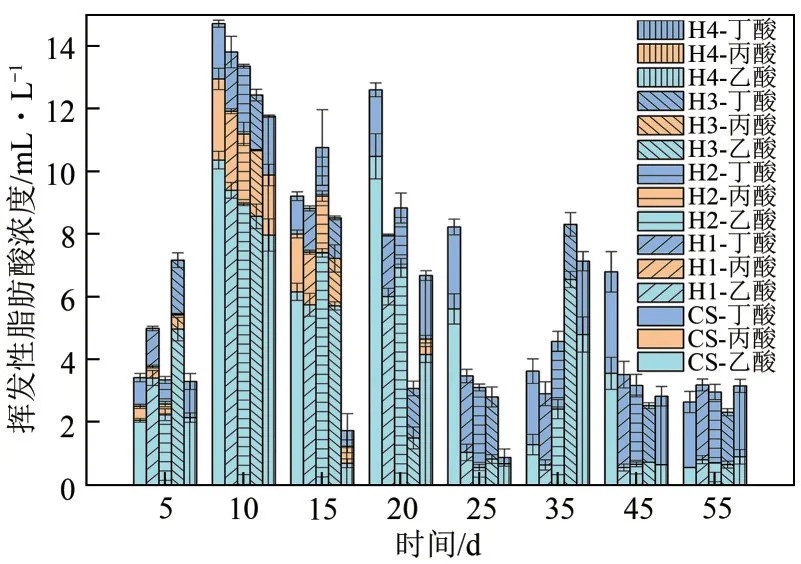
图2 挥发性脂肪酸浓度
在厌氧发酵的第5 天,H3 实验组的VFA 总量最高,其次是H1 实验组,CS、H2、H4 实验组没有较大的差别,此时乙酸的累积量明显高于丙酸和丁酸,但VFA 的总量较低,甲烷产气量也相对较低。在第10 天左右VFA 总含量达到了最高,并且CS 实验组VFA 的累积量高于混合发酵实验组,一般情况下,VFA 的积累反映了酸生产者和分解者之间的不平衡[20],其中乙酸的大量积累表明发酵系统中的产甲烷菌不够活跃,研究表明当反应器内VFA 大于10mL/L 时,会抑制产甲烷菌活性[17],这也是第5~10 天甲烷累积量较低的原因之一。在第10~25 天,大量的VFA 被消耗,其中H1、H2、H3实验组的VFA 含量持续降低,VFA 的消耗量超越积累量,表明此时的产甲烷菌分解酸产甲烷的速度超越了水解菌水解产酸的速度[21];而CS和H4实验组VFA 的含量在第10~15天下降明显,但在第15~20 天出现了回升,CS 出现这种现象的原因可能为产甲烷菌分解酸产甲烷的速度落后于水解菌水解产酸的速度。而H4 出现这种现象的原因为:在其产气高峰后,甲烷菌消耗大量乙酸导致系统中的产甲烷基质相对含量不足,产甲烷速率变缓,水解菌继续工作将底物水解,VFA 含量上升。数据显示乙酸的大量消耗时间与甲烷的产气高峰时间几乎吻合,表明发酵过程中乙酸转变为甲烷是产气的主要路径。秸秆单发酵实验组CS 的VFA 累积量在此阶段明显高于混合发酵实验组,表明混合发酵实验组在此阶段VFA 的转化效率要高于秸秆单发酵实验组,可能的原因是水热液相的加入促进了部分产甲烷菌的生长。厌氧发酵第35~60天,此时处于厌氧发酵的后期,VFA 的总含量明显降低,甲烷累积产气量相对较低,乙酸含量也处于较低的水平,表明发酵系统中的基质已经消耗殆尽;丁酸的含量在整个厌氧发酵过程中未发生大的波动,可能的原因是发酵过程中缺乏将丁酸转化的细菌。H3、H4实验组在厌氧发酵后期VFA 出现了轻微积累,对应H3 实验组在第40 天左右迎来一个小的产气高峰,H4 实验组的产气量却没有明显的增长,可能的原因是H4实验组的有机质已消耗殆尽。
2.3.2 氨氮、pH、COD
图3 为发酵系统中pH、氨氮浓度和化学需氧量在发酵过程中的变化趋势。如图3(a)所示,在厌氧发酵前期pH 总体呈下降趋势,第10 天左右pH达到最低,之后开始回升,到第20 天左右保持稳定,至发酵结束一直维持在7.7~8.2 的范围内。混合发酵实验组与秸秆单发酵实验组相比,在厌氧消化前10 天,H1、H2、H3 的pH 明显低于秸秆单发酵实验组;在厌氧发酵第20~55 天pH 保持稳定后各实验组没有出现较大的差距。如图3(b)所示,H1、H2、H3 和CS 的氨氮浓度在厌氧发酵过程中总体呈上升趋势,而H4 实验组氨氮浓度保持相对稳定。在厌氧发酵前15 天,混合发酵实验组的氨氮浓度高于秸秆单发酵实验组,其中H4 实验组氨氮浓度在前10 天明显领先于其他实验组,厌氧微生物分解有机物的同时可以将有机物中的有机氮转化为无机氮[22],H4 氨氮浓度领先于其他实验组的原因可能为230℃条件下水热液的加入对秸秆厌氧发酵前期水解速度的促进作用最好。在第20~35 天,各实验组的氨氮浓度保持相对稳定,没有较大差距;在第35~45天,H1、H2、H3和CS实验组浓度出现了提升,而H4 实验组氨氮浓度出现了小幅度的下滑,表明H4 中铵态氮转化为其他物质(可能被微生物利用转变为有机氨,在此阶段H4的VFA 和COD 含量有明显的下降趋势,表明产甲烷菌在正常工作。)。H1、H2、H3实验组的氨氮浓度的上升趋势相似,表明混合发酵过程中水热液相的保温时间对氨氮浓度影响并不明显。
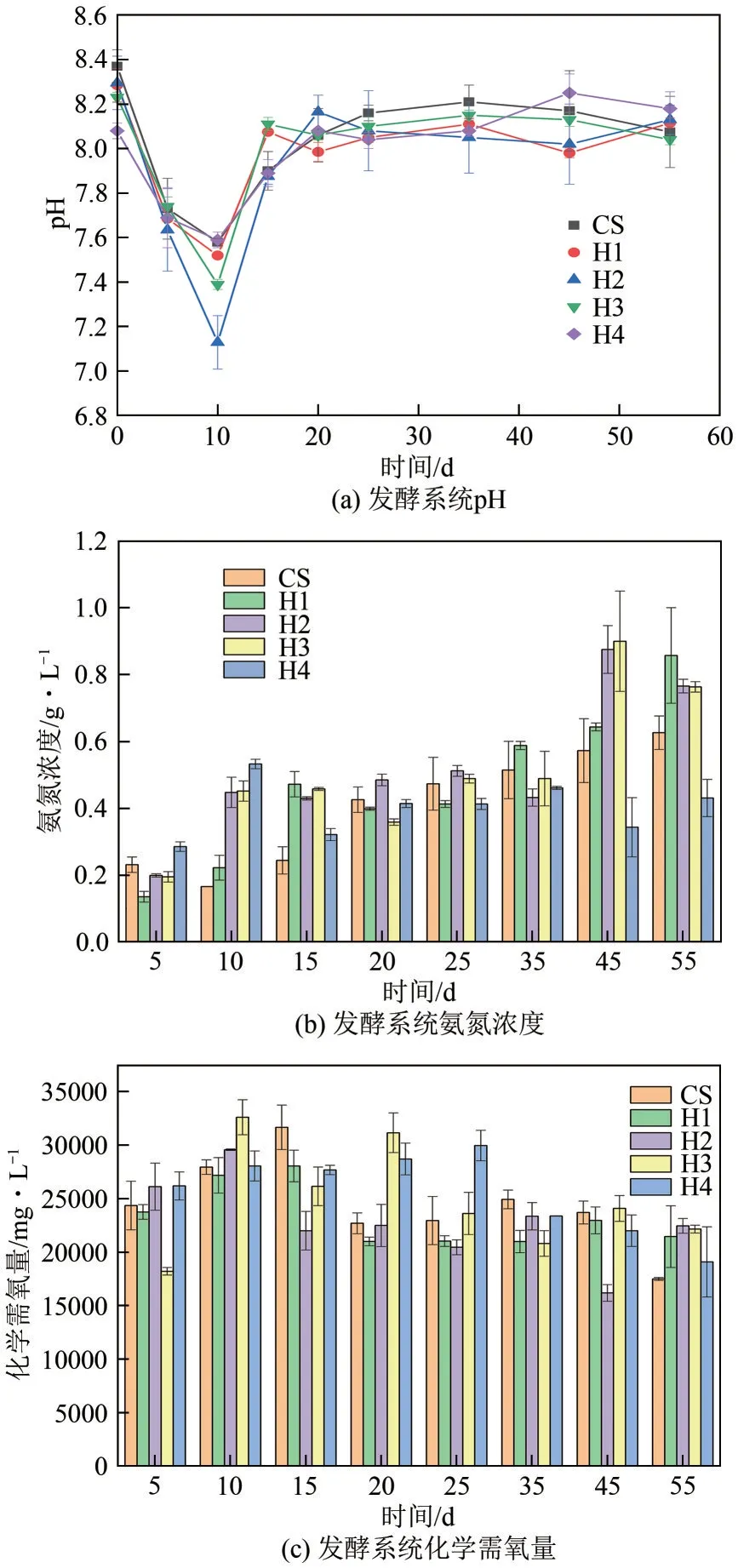
图3 pH、氨氮浓度和化学需氧量在发酵过程中的变化趋势
如图3(c)所示,COD在厌氧发酵初期主要呈上升趋势,在中后期开始呈下降趋势;其中混合发酵实验组在5天左右开始下降,而秸秆单发酵实验组在15 左右开始有明显的下降。发酵系统中主要有机物成分为碳水化合物,在厌氧发酵第5~10 天,水解产生大量VFA、还原性糖和氨基酸等小分子物质[23],VFA 快速累积是整个发酵系统pH 下降明显的主要原因,而CS 实验组在第5 天的VFA 浓度高于混合发酵实验组H1、H2、H3,pH 却低于混合发酵实验组H1、H2、H3,原因可能为CS 实验组较高的氨氮浓度缓冲了VFA 的作用;在厌氧发酵第10~25 天,pH 和氨氮浓度保持相对稳定,COD 有明显的下降趋势,COD 的下降表明产甲烷菌将发酵系统中的基质转化为甲烷;在厌氧发酵的25~55 天,pH 依旧趋于稳定,氨氮浓度在此期间有了明显的升高,仍远低于产甲烷微生物的抑制值1.7g/L[24],化学需氧量总体仍呈下降趋势,表明发酵系统中的产甲烷基质持续减少,基质中的含碳有机物被甲烷产气菌分解产气,氨氮含量开始累积,导致整个系统的C/N比失衡,这可能是厌氧发酵产气在后期停滞的原因之一。
2.4 微生物群落
图4为第25天通过对厌氧发酵提取液进行测序获得的细菌在门和属水平上的相对丰度。
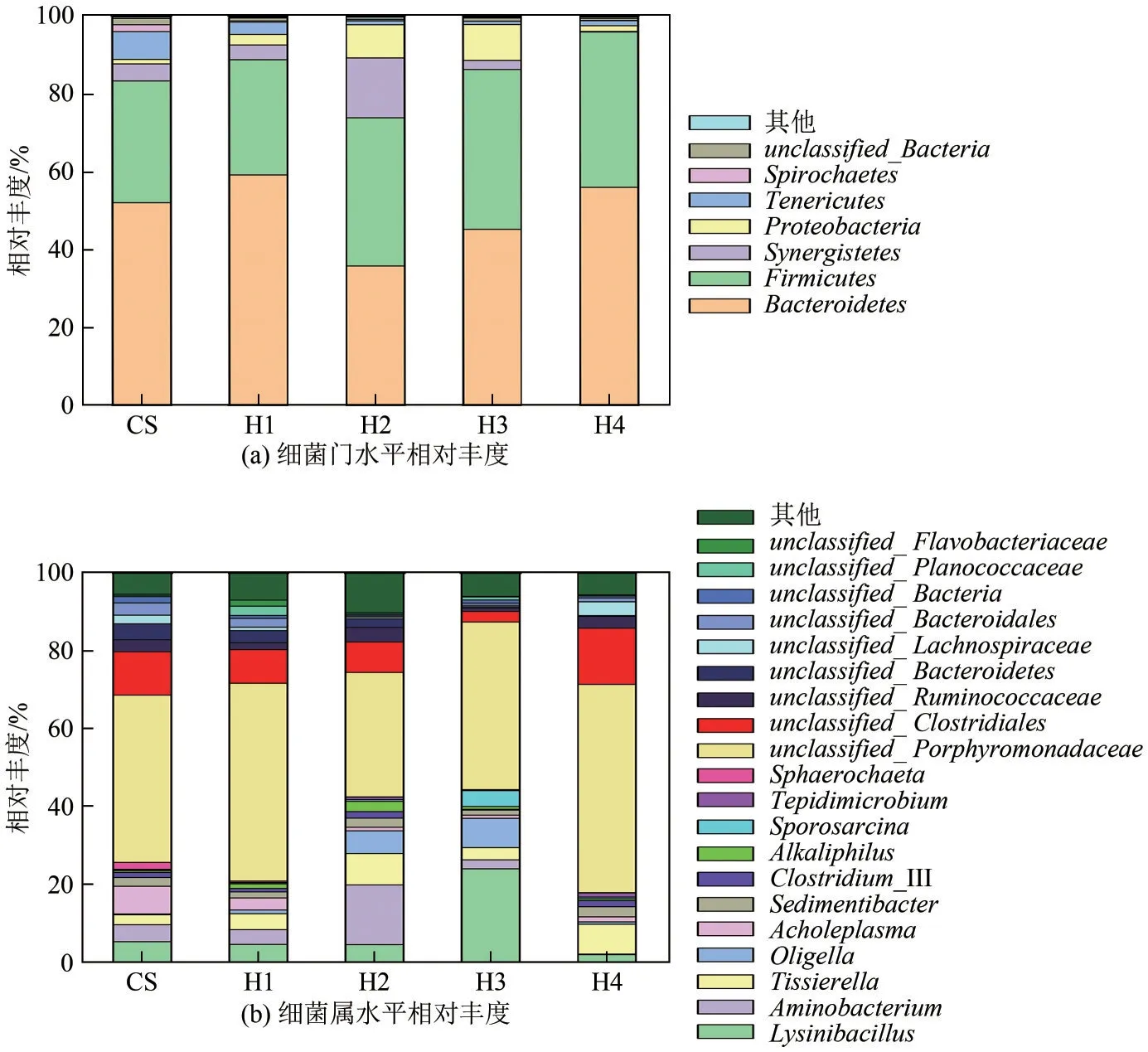
图4 细菌相对丰度
图4(a)为第25 天时细菌在门水平上的相对丰度,由图4(a)可知,厌氧发酵系统中细菌群落最主要的两个门是Bacteroidetes和Firmicutes。在秸秆单发酵实验组CS 中,Bacteroidetes和Firmicutes占整个细菌群落总量的83.58%;在秸秆与水热炭化液相混合发酵实验组中,H1、H3 和H4 实验组和CS实验组相比,Bacteroidetes和Firmicutes的相对丰度有所提升,达到89.05%、86.53%、96.18%,而H2和CS相比,Bacteroidetes和Firmicutes的相对丰度下降,为74.09%。Bacteroidetes和Firmicutes作为厌氧消化过程中最重要的两个门,它们可将有机物水解为乙酸、氢气和二氧化碳等小分子物质,从而产生甲烷[25]。H4实验组的Bacteroidetes和Firmicutes相对丰度明显高于其他实验组,也印证了230℃的条件下的纤维素水热液相可以促进水解菌的生长,解释了H4产气高峰领先于其他实验组的原因。
图4(b)为第25天时细菌在属水平上的相对丰度。玉米秸秆单发酵实验组和混合发酵实验组中细菌的种类差别较小,但其相对丰度却存在明显差别。秸秆单发酵的实验组Firmicutes在属级别的主要细菌为unclassified_Clostridiales(11.18%)、Lysinibacillus(5.18%)、unclassifiedLachospiraceae(2.25%)、Tissierella(2.56%)、Sedimentibacter(2.27%)、Clostridium_III(1.29%)。秸秆和水热液相混合发酵实验组中,Clostridium_III 在H1、H2、H3、H4的相对分度分别为0.89%、1.67%、0.21%、1.59%;由已有的研究得知,Clostridium_III 可以将糠醛和5-羟甲基糠醛转化为糠基醇和5-羟甲基糠醛醇[26],因此在H4实验组发酵液有机物分析中发现了1-(呋喃基)乙二醇,1-(呋喃基)乙二醇被进一步分解为小分子有机物并最终转化为甲烷,第10 天时在其他实验组未发现呋喃及其衍生物与呋喃醇,表明浓度较低的呋喃类有机物在前期已经被转化为甲烷。Tissierella和Sedimentibacter属于Clostridiales_Incerta e_Sedis_XI,Tissierella在加入水热炭化废液的实验组H1、H2、H3、H4相对丰度分别为4.09%、8.09%、3.17%、7.71%,除了H3实验组外,其相对丰度与CS 实验组相比都有明显的提升;Sedimentibacter可以将有机物发酵产生二氧化碳、氢和乙酸等,其在水热炭化液相与玉米秸秆混合发酵实验组H2和H4中相对丰度有所提升,分别达到了2.34% 和2.61%;H1 和H3 中此菌属的相对丰度有所下降,分别为1.55%和1.31%。水热液相的加入明显促进了Tissierella的生长,该细菌可以将基质中的糖、氨基酸、脂肪酸等有机物分解,产生乙酸、氨盐和二氧化碳,是混合基质中产乙酸的主要微生物之一[27]。
UnclassifiedLachospiraceae在加入水热炭化液相的实验组H1、H2、H3、H4中,其相对丰度分别为0.87%、0.48%、0.32%、3.57%,除H4 外其他实验组该菌属的相对丰度明显减少,表明水热炭化液相的加入抑制了该菌属的生长。Lysinibacillus属于Planocospiraceae,在混合发酵实验组H1、H2、H3、H4 相 对 丰 度 为4.48%、4.40%、23.91%、1.82%,H3实验组中,水热炭化液相的加入促进了Lysinibccillus在的生长。Lysinibacillus可以发酵糖、氨基酸、脂肪酸等基质,产生己酸[28],其厌氧消化的基质与Clostridiales_Incertae_Sedis_XI 相似,二者存在竞争机制;然而Lysinibccillus发酵产物为己酸,因此Clostridiales_Incertae_Sedis_XI 更有利于产气,H3 的产气滞后于其他实验组及丁酸含量明显高于其他实验组的原因即Lysinibccillus在竞争中处于优势地位。Bacteroidetes中的主要细菌为unclassified_Porphyromonadaceae,在秸秆单发酵实验组CS 中,unclassified_Porphyromonadaceae的相对丰度为43.02%,在水热液相与秸秆混合发酵实验组H1、H2、H3、H4 中,该菌属的比例分别为50.86%、32.02%、43.12%、53.58%,其相对丰度除H2 之外皆超过了秸秆单发酵实验组CS,表明水热液相的加入可以促进unclassified_Porphyromonadaceae的生长。该菌属可以参与复杂碳水化合物、蛋白质和多肽的厌氧降解,并在水解阶段参与挥发性脂肪酸的生成[29]。unclassified_Porphyromonadaceae作为最重要的水解细菌,在厌氧发酵过程中起着至关重要的作用。
图5为第25天通过对发酵提取液进行测序获得的古菌属水平上的相对丰度。Methanosarcina是古菌中的优势菌属,Methanosarcina属于乙酸产甲烷途径,它可以将发酵系统中的乙酸还原为甲烷[30],在秸秆单发酵实验组CS中,Methanosarcina的相对丰度为94.21%;在混合发酵实验组中,H1、H2、H3、H4 中相对丰度分别为88.01%、87.22%、76.67%、94.11%,H3 实验组Methanosarcina相对丰度低于混合发酵其他实验组的原因可能是H3 实验组中Lysinibacillus的相对丰度高于其他实验组导致丁酸含量过高,不利于Methanosarcina的生长;混合发酵H1、H2、H3 中Methanosarcina的相对丰度低于秸秆单发酵CS 实验组表明糠醛抑制了Methanosarcina的 生 长。Methanomassiliicoccus、Methanobacterium、Methanoculleus和Methanobrevibacter属于氢还原二氧化碳产甲烷途径,秸秆单发酵 中,Methanomassiliicoccus、Methanobacterium、Methanoculleus和Methanobrevibacter的 相 对 丰 度 分别为2.69%、0.42%、0.72%和0.60%;混合发酵实验组H1、H2、H3、H4 中,Methanomassiliicoccus的相对丰度为3.03%、4.47%、10.49%、1.15%,Methanobacterium的相对丰度为1.64%、1.17%、4.67%、0.90%,Methanoculleus的相对丰度为4.16%、4.27%、4.14%、1.95%,Methanobrevibacter的相对丰度为1.65%、1.38%、3.37%、0.41%。混合发酵H1、H2、H3 的Methanomassiliicoccus、Methanobacterium、Methanoculleus和Methanobrevibacter相对丰度明显高于CS和H4实验组,证明水热炭化液相可以促进氢营养型产甲烷菌生长。H4在第25天时古菌的相对丰度更接近秸秆单发酵实验组,表明此时其产气途径与秸秆单发酵相同,可能的原因是H4 实验组产气高峰领先其他实验组,在厌氧发酵前期水热液相中的基质已经消耗完毕,其厌氧发酵中期的发酵环境不利于氢还原二氧化碳产甲烷的生长。
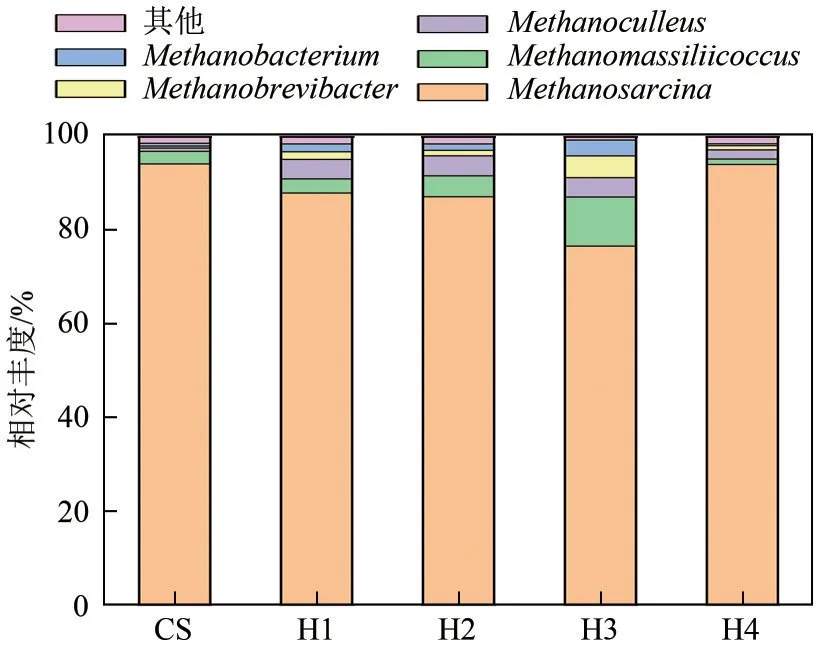
图5 古菌属水平相对丰度
由于核心微生物群中的细菌群落和产甲烷菌之间的代谢相互作用,底物特异性将厌氧发酵引向特定的产甲烷路径[31]。图6为纤维素水热炭化液相产物与玉米秸秆混合厌氧发酵过程中有机物转化甲烷路径图。
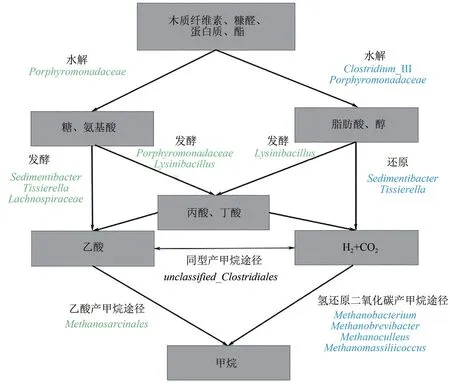
图6 纤维素水热炭化液相产物与玉米秸秆混合厌氧发酵产甲烷路径
在厌氧发酵过程中,水热炭化液相的加入促进了氢营养型产甲烷菌的生长。在发酵过程中,微生物在厌氧发酵过程中相互生存、相互依赖使得复杂有机物得以分解[32],在实验厌氧发酵过程中最主要的产甲烷途径为乙酸产甲烷途径,水解菌(Porphyromonadaceae) 将木质纤维素分解为小分子糖,小分子糖通过发酵细菌(Tissierella、Sedimentibacter、Lysinibacillus)将小分子有机物发酵分解为VFA (主要为乙酸),最终产甲烷菌(Methanobacterium)将乙酸转化为甲烷。水热液相的加入促进了氢还原二氧化碳产甲烷途径,混合基质中糠醛及其衍生物可以被Clostridium_III 转化为糠 醛 醇, 糠 醛 醇 通 过 细 菌 (Tissierella、Sedimentibacter)还原为氢气和二氧化碳,最终通过氢营养型产甲烷菌(Methanomassiliicoccus、Methanobacterium、Methanoculleus和Methanobrevibacter)将氢气和二氧化碳转化为甲烷。此过程中不同功能的微生物相互作用,相互依赖[33],共同促进产气。
3 结论
(1)纤维素水热炭化液相和秸秆混合发酵与秸秆单发酵相比,产气量有明显的提高,在200℃保温30min、60min、120min 的条件下产气分别提升了7.32%、4.42%、22.08%,在230℃保温60min 的条件下提升了21.76%;表明在一定范围内,水热炭化温度升高和保温时间延长获得的水热炭化液相对甲烷产气具有正向的促进作用。
(2)水热炭化液相中的有机物可以提高混合发酵厌氧消化潜力,纤维素水热废液中的呋喃及其衍生物在浓度较低的情况下对厌氧发酵过程并不会产生明显的抑制作用。
(3)微生物群落分析表明,纤维素水热炭化液相和秸秆厌氧共消化可以促进氢营养型产甲烷菌的生长,协同乙酸产甲烷途径,促进了甲烷生产。同时微生物群落中存在Clostridium_III,可以将糠醛和5-羟甲基糠醛转化为糠基醇类有机物,促进产气。

